Introducción
El carbono (C) de los bosques del mundo ha sido estimado en 861 Pg de (1 Pg = 1 ( 1015 g), de los cuales, 383 Pg se encuentran en el suelo (44%), 363 Pg en la biomasa aérea (42%), 73 Pg en la madera muerta (8%) y 43 Pg se encuentran en el mantillo (5%) (Pan et al., 2011). Esto sugiere que aproximadamente la mitad del C de los ecosistemas forestales se encuentra en el piso forestal y en el suelo, este valor varía con el tipo de bioma. Pan et al. (2011) estimaron que los bosques tropicales almacenan el 32% de C en el suelo, mientras que los bosques templados y boreales almacenan en el suelo alrededor del 60% del C. A nivel global los bosques templados ocupan 1 ( 107km2, lo cual representa 25% del área forestal, el 8% de la superficie continental y 13.7% de la productividad primaria neta mundial; el C almacenado en estos bosques se estima en 175 Pg en la biomasa aérea; y 262 Pg en el suelo (Haine et al., 2003). Estos inventarios de C en los bosques templados a nivel mundial indican que tanto la parte aérea (vegetación) como la parte subterránea (suelos) de los ecosistemas juegan un rol fundamental en el ciclo global del C en función de la magnitud del C capturado y almacenado. Sin embargo, los bosques templados de México han recibido poca atención en las revisiones teóricas y los modelos globales del ciclo de C y en las proyecciones de la mitigación al cambio climático a nivel regional y mundial (Richardson et al., 2007; Gómez-Díaz et al., 2011).
En la superficie terrestre, el suelo es el principal reservorio de C; el cual contiene entre 1500 y 2000 Pg (Janzen, 2004), siendo el elemento más abundante en la materia orgánica del suelo (MOS, 45-55%). Esta última se reconoce ampliamente como un componente determinante de la calidad del suelo debido a que cumple funciones críticas como fuente y almacén de nutrimentos, además de participar en la estabilización de la estructura del suelo y el almacenamiento de agua (Karlen y Andrews, 2000). La materia MOS es un compartimiento heterogéneo con características químicas muy complejas. Las actividades humanas relacionadas al uso de la tierra y cambio de uso de la tierra y silvicultura (UTCUTS) se impactan en la cantidad y calidad de fracciones lábiles (biomasa microbiana y materia orgánica particulada) y estables (bioquímica o físicamente protegida) de la MOS, pero es en las primeras que el cambio es más pronunciado y rápido (Haynes, 2005). Debido a su importancia funcional (estabilización de agregados, disponibilidad de nutrimentos) se han propuesto como indicadores potenciales de los cambios a corto plazo derivados del UTCUTS y en general como herramientas clave en el monitoreo de cambios en la calidad del suelo (Haynes, 2005). Teóricamente la MOS se ha subdividido en tres almacenes con base en la cinética de su descomposición y su tiempo de residencia en los suelos: activo (<1-10 años), intermedio o lento (10-100 años) y pasivo (>100 años) (Wander, 2004). Sollins et al. (1996) plantean que la descomposición de la MOS depende de tres factores, 1) la recalcitrancia de las moléculas; 2) las interacciones entre los componentes orgánicos e inorgánicos; y 3) la accesibilidad de los microorganismos a la MOS. Las fracciones de la MOS (biológicas, químicas y físicas) son utilizadas para caracterizar y estimar los diferentes almacenes (Figura 1) (Wander, 2004). Por ejemplo, las fracciones que permiten predecir el almacén activo de la MOS están relacionadas con la actividad biológica y con fracciones no estabilizadas ni física ni químicamente (Six et al., 2002; Wander, 2004; Figura 1), mientras que para predecir el almacén pasivo se requiere de los mecanismos de estabilización de la MOS en el suelo, lo cual es más complejo (Lützow et al., 2008).
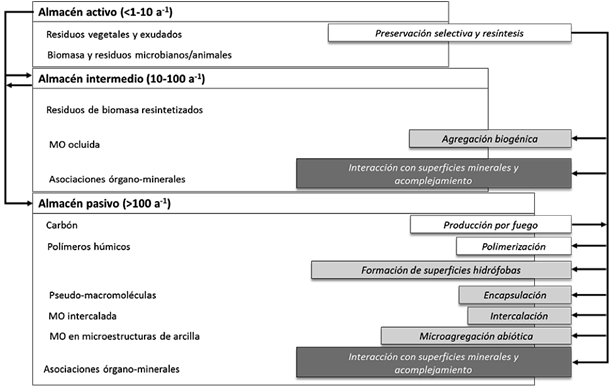
Figura 1 Modelo conceptual de estabilización de la materia orgánica del suelo. Itálicas: mecanismos; □ (sin relleno) = recalcitrancia primaria y secundaria, ■ = inaccesibilidad espacial, ■ = interacciones órgano-minerales. Modificado de Lützow et al. (2008).
En el contexto del cambio climático global, el carbono orgánico del suelo (COS) ha recibido particular atención debido a que puede actuar como fuente de CO2 o sumidero de C. El almacenamiento del COS depende de la interacción entre diversos factores (bióticos, abióticos y antrópicos). Se ha sugerido que en escalas de décadas a siglos, el UTCUTS es el principal factor que determina el almacenamiento del COS (Scott et al., 2002). Actualmente se plantea que el UTCUTS es la segunda causa del incremento de CO2 atmosférico luego de la quema de los combustibles fósiles, siendo responsable de alrededor del 25% de las emisiones de CO2 a la atmósfera (Lal et al., 2004). A escalas globales se ha estimado que las pérdidas anuales de COS derivadas del UTCUTS alcanzan 2 Pg (Janzen, 2004). Sin embargo, el almacenamiento de C y las emisiones de CO2 a la atmósfera dependen del tipo de suelo y ecosistema, entre otros factores; los cuales son heterogéneos en los bosques templados de México y han sido estudiados escasamente.
En México, el potencial de captura de C en la vegetación y los suelos de los bosques templados fue estimado en 200 y 327 Mg ha-1 respectivamente (Monreal et al., 2005), sin embargo, no existen estudios sobre el papel de los diferentes tipos de suelos como reservorio terrestre de carbono bajo los bosques templados mexicanos. Estos bosques albergan una alta diversidad biológica debido a la presencia de diferentes tipos de vegetación: (a) bosques de pino, (b) bosques de encino, (3) bosques mixtos de pino y encino y (d) bosque de Abies (Challenger, 1998; Rzedowski 1978). En México, los bosques de pino y encino son los ecosistemas más diversos; poseen aproximadamente 7000 especies, y representan aproximadamente el 25% de la flora fanerogámica del país (Challenger, 1998, Rzedowski, 1991). Estos bosques contienen alrededor de 46 especies de pinos, las cuales representan el 50% del total a nivel mundial; así como 161 especies de encinos, que también representan más del 50% del total a escala mundial (CONABIO, 2001).
Los bosques templados tienen el potencial de cubrir alrededor del 20% del territorio nacional (Challenger, 1998; Rzedowski, 1991); del cual alrededor del 5% estaría ocupado por bosques de encinos, 14% por bosques de pino-encino y 1% por otras coníferas (Figura 2) (Rzedowski, 1991). Históricamente, los bosques de pino y encino han sufrido una intensa disminución en su extensión y número de especies (Rzedowski, 1978; Challenger, 1998). La superficie cubierta por bosques de encinos, bosques mixtos y bosques de pino en el país alcanza alrededor del 17% del territorio (Palacio et al., 2000), y tiene una tasa de deforestación anual promedio mayor al 0.5% (Masera et al., 1997). Recientemente, se ha documentado que entre 1976 y 2011 se han perdido 940 267 ha de bosques templados, con una mayor tasa de cambio en los periodos 1976-1993 y 1993-2002 (SEMARNAT, 2014). Las estimaciones más recientes en el sector forestal indican que las emisiones nacionales de gases de efecto invernadero (GEI) con base en el CO2 son de 87(106 (± 34.4) Mg año-1, de las cuales el 74.2 % se emitieron por pérdida de biomasa, 5.6 % por el aprovechamiento de los bosques, 34.8% por pérdidas de C en suelos minerales, y una compensación de -14.8% correspondiente a captura de C en terrenos abandonados (de Jong et al., 2010). En términos generales, alrededor del 10% de las emisiones de GEI son atribuibles a la deforestación provocada para abrir nuevas tierras al cultivo y por los aprovechamientos maderables. Debido a lo anterior, los bosques que sufren procesos de degradación o deforestación son considerados emisores netos de CO2 a la atmósfera. De continuar el aumento de la concentración de los GEI en la atmósfera a las tasas actuales, se prevén serias alteraciones en los ecosistemas que pueden desencadenar grandes cambios sociales y económicos en el planeta.

Figura 2 Distribución espacial de los bosques templados en México, por tipo de vegetación (Elaboración propia con base en datos vectoriales de uso del suelo y vegetación escala 1:250 000, SERIE V (INEGI, 2013).
El objetivo de la presente revisión fue evaluar el papel del suelo de los bosques templados en México como reservorio de carbono. Analizamos como la variación del grupo de referencia de suelo, el tipo de vegetación dominante y el manejo influyen en el almacenamiento de C edáfico, y sintetizamos la información existente sobre los flujos de C para comprender el papel de los bosques templados mexicanos en el ciclo de C a nivel regional y mundial. Al final del trabajo se presenta una reflexión sobre cuáles son las necesidades de información para determinar el efecto del cambio de uso del suelo sobre los almacenes en el suelo y los flujos de C en los bosques templados de México.
Materiales y Métodos
Revisión de literatura
La síntesis de los tipos de suelos, el almacenamiento de COS y los flujos de C en los bosques templados México a nivel nacional se realizó a través del análisis de diversas fuentes de datos: publicaciones revisadas por pares, incluyendo revistas, libros y memorias de congresos, todo ello a nivel nacional o internacional. En esta extensa búsqueda de literatura se utilizaron bases de datos que son referenciales académicos, incluyendo Science Direct, Web of Knowledge y Scopus, al igual que las directrices para las revisiones sistemáticas propuestas por Pullin y Stewart (2006) y Davies y Pullin (2007). Una vez que todas las búsquedas se recopilaron, se sintetizó la información en forma de texto, cuadros y figuras sobre el ciclo de C en los bosques templados mexicanos.
Identificación de los suelos bajo cobertura de bosques templados
La cobertura vegetal de bosques templados a nivel nacional, se obtuvo del conjunto de datos vectoriales de uso del suelo y vegetación escala 1:250 000, Serie V (INEGI, 2013). Se consideraron los siguientes tipos de vegetación: bosque de encino, bosque de encino-pino, bosque de oyamel, bosque de pino y, bosque de pino encino. Una vez obtenida esta base cartográfica se realizó la sobre-posición con el tipo de suelo para cada polígono de vegetación; la base fue el conjunto de datos vectorial edafológico, Escala 1:250 000 Serie II (INEGI, 2007). Una vez realizada la sobre-posición se calcularon las áreas de cada uno de los polígonos resultantes. Con la información para cada uno de los polígonos del tipo de suelo asociado a cada uno de los tipos de vegetación considerados se realizó su sobre-posición con el conjunto de datos vectoriales geológicos Continuo Nacional. Escala 1:1 000 000 (INEGI, 2002); obtenidos los polígonos se calcularon las áreas de cada uno de ellos. Los procesos se realizaron en el programa ArcGis 10.2.2.
Resultados
Tipos de suelo en los bosques templados
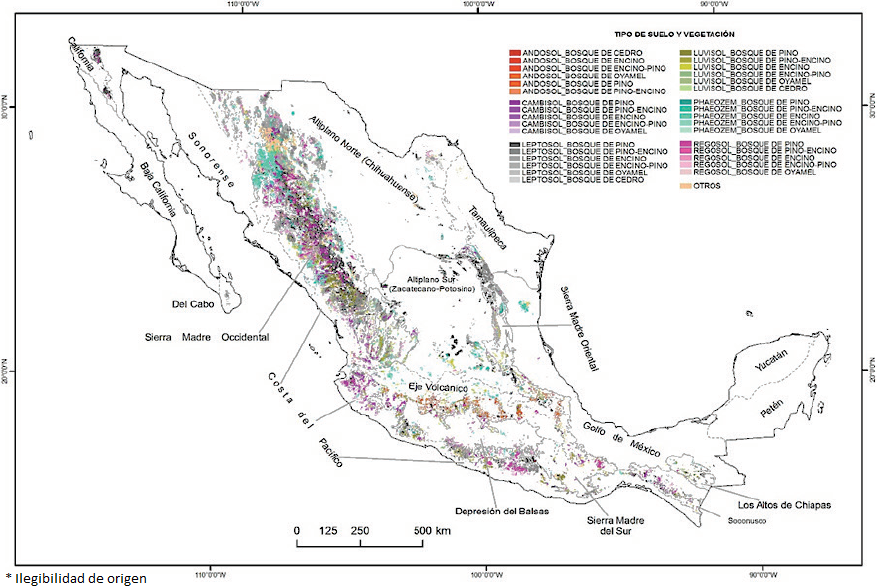
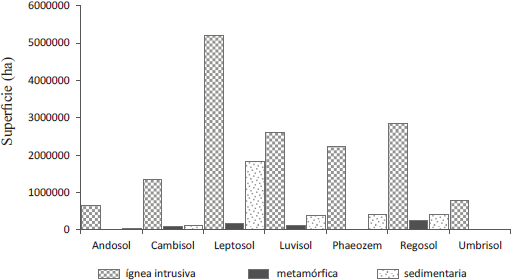
Los bosques templados se distribuyen principalmente en siete grupos de referencia de la base referencial mundial del recurso suelo (WRB por sus siglas en inglés) (Figura 3): Leptosoles (7 208 049 ha), Regosoles (3 513 729 ha), Luvisoles (3 120 785 ha), Phaeozems (2 719 839 ha), Cambisoles (1 560 716 ha), Umbrisoles (824 327 ha) y Andosoles (695 281 ha), y en menor proporción en otros grupos de referencia (Figura 4). Los suelos dominantes que sustentan a los bosques templados se caracterizan por ser someros, con un incipiente desarrollo, como son los Leptosoles y Regosoles, los cuales sostienen en forma conjunta al 58.6% del bosque templado (Figura 3). La diversidad de los suelos que soportan los bosques templados mexicanos contrasta con la reducida distribución de los suelos que soportan estos mismos bosques a nivel mundial, ya que 95% de los Molisoles y 76% de los Aridisoles soportan bosques templados de Norteamérica, Europa y Eurasia (Palm et al., 2007). La Sierra Madre Occidental es la región que tiene la mayor diversidad de tipos de suelos, predominando los Cambisoles, Phaozems y Regosoles, esto debido a su compleja historia geológica y biogeográfica, su topografía montañosa y su variedad de climas y microclimas. La conjunción particular de estos factores formadores da lugar a una alta diversidad de suelos en esta provincia fisiográfica (Cotler, 2007, Figura 3). En la Faja Volcánica Transmexicana dominan los Andosoles y los Luvisoles, en la Sierra Madre el Sur y los Altos de Chiapas se distribuyen los Cambisoles y Luvisoles; mientas que en la Sierra Madre Oriental dominan los Leptosoles y en menos proporción los Phaeozems, a excepción de los bosques de oyamel que se distribuyen principalmente sobre Andosoles (Figura 3). Por otro lado, los suelos se desarrollan en diferentes tipos de sustrato, lo que les da diferentes características minerales (Figura 5). Por ejemplo, los siete grupos de referencia dominantes en bosque templados se forman mayoritariamente a partir de rocas ígneas y en menor proporción sobre rocas sedimentarias y metamórficas (Figura 5). Cruz et al. (1998) sugieren que el modelo fisiográfico es más preciso para relacionar el origen de los suelos frente a otros modelos como el de ecorregiones y las cuencas hidrográficas, indicando que la geología, la geomorfología y el relieve explican la gran diversidad de suelos en los bosques templados mexicanos.

Figura 4 Tipos de suelo (de acuerdo a los grupos de referencia de la base referencial mundial del recurso suelo (WRB)) en bosques templados de México. a) Bosque de encino; b) Bosque encino-pino; c) Bosque de oyamel; d) Bosque de pino; e) Bosque de pino-encino; f) tipos de suelos en bosques templados.
La revisión de la literatura sugiere que la información sobre el almacenamiento de COS en los bosques templados está dominada por el estudio del almacenamiento en la biomasa aérea (52 artículos) en relación a la información del almacenamiento en el suelo (20). Lo anterior se debe probablemente a la demanda de estudios bajo la temática de la deforestación evitada en el contexto de REDD y a su mayor facilidad de monitoreo. El número de artículos científicos en revistas internacionales sobre el almacenamiento de COS en suelos de bosques templados mexicanos es reducido (20 artículos). Lo anterior también sugiere, que existen pocos estudios sobre los procesos biogeoquímicos de estos bosques, es decir que sólo domina la información sobre la caracterización y clasificación de suelos sin entender los procesos ni la dinámica de formación de la materia orgánica del suelo. La información sobre el potencial de secuestro de carbono de suelos está inversamente relacionada con su área de distribución; los Andosoles que ocupan una superficie pequeña están mejor caracterizados que los Leptosoles, Regosoles, Luvisoles y Phaeozems. A continuación describiremos la información relacionada con el almacenamiento de COS que sustentan los bosques templados con mayor área de distribución.
Principales tipos de suelo cubiertos por bosques templados y sus procesos de fijación de carbono
Leptosoles (Litosoles y Rendzinas según la clasificación FAO-UNESCO 1970 utilizada por INEGI hasta el año 2000). Son suelos muy someros sobre roca continua y muy pedregosos (<10% volumen de tierra fina <2 mm), particularmente comunes en regiones montañosas con pendientes altas y por lo mismo son muy propensos a la erosión y a la pérdida de MOS con el UTCUTS. Es un grupo de suelos muy variado, porque sus propiedades dependen en gran medida del tipo de roca a partir del cual se forman. El potencial de los Leptosoles para almacenar COS es limitado, debido a su escasa profundidad. No obstante muchos Leptosoles tienen concentraciones de COS altas (4-8 %) debido por un lado a que la biomasa muerta se incorpora y mezcla en un volumen de suelo relativamente pequeño, y por otro lado a los eficaces mecanismos de estabilización que operan en suelos ricos en calcio (los desarrollados a partir de calizas), o en minerales de bajo orden estructural (los desarrollados a partir de rocas volcánicas (Siebe et al., 2003).
Regosoles. Son suelos minerales escasamente desarrollados en materiales no consolidados, por lo mismo tienen bajos contenidos de arcilla, baja capacidad de retención de humedad, baja capacidad de intercambio catiónico y también bajos contenidos de MOS en bosques de pinos (Siebe et al., 2003). Algunos se han desarrollado a partir de cenizas volcánicas recientes (<4000 años), como las emitidas por el Popocatépetl (Miehlich, 1990) y el Pico de Orizaba en sus últimas fases eruptivas (<4000 años), y por el Paricutín entre 1943 y 1945 (Luhr y Simkin, 1993). La capa de ceniza es de textura gruesa (arena franca a arena), el excesivo drenaje limita el desarrollo radical, por lo que estos suelos se consideran de profundidad fisiológica moderada. Están bien drenados y aireados, pero tienen moderada capacidad de retención de agua disponible. El horizonte A es de desarrollo incipiente con un espesor de 4 a 11 cm, bajo contenido de materia orgánica (<1%) y también de nitrógeno total (0.06-0.07%). Los contenidos de fósforo disponible son bajos (9-12 mg kg) en términos absolutos, sin embargo, estos suelos están entre los de mayor contenido de fósforo disponible. Esto se explica debido a que las cenizas recientes suelen contener una pequeña cantidad de fósforo fácilmente soluble en extractos ácidos (Shoji et al., 1993), y a que aún no se han formado minerales secundarios que fijen el fósforo; la capacidad de retención de fósforo determinada en estos suelos es menor a 10%. Los valores pH son moderadamente ácidos (5.0-5.6) y la capacidad de intercambio catiónico efectiva es muy baja (<1 cmolc kg-1). Los contenidos de potasio intercambiable son bajos también.
Luvisoles. Son suelos en los cuales han ocurrido procesos de formación de minerales secundarios e iluviación de arcillas con la consecuente formación de un horizonte Bt característico (Spaargaren, 2008). En México, los bosques templados desarrollados sobre Luvisoles, al menos los que han sido estudiados, están asociados a ambientes volcánicos, por lo cual se relacionan a la evolución a partir de los Andosoles por efecto de la rápida cristalización de los minerales amorfos a minerales 1:1 (p. ej.: haloisita) como consecuencia de periodos de desecación (Sedov et al., 2003). Ambientalmente, los Luvisoles están condicionados a regiones con una marcada estacionalidad (Driessen et al., 2001), lo cual sugiere que éste podría ser el tipo de suelo en el cual dominan los bosques templados representados por especies latifoliadas de fenología caducifolia del género Quercus (Hernández et al., 2013; Chávez et al., 2015); ya que en estos bosques deciduos el desfronde está asociado al estrés hídrico por el efecto estacional (Borchert et al., 2005). Sin embargo, en la revisión de trabajos encontramos que existen bosques de pino y bosques mixtos sobre este grupo de suelos (Cuadro 1), lo cual sugiere que puede existir una elevada heterogeneidad en la composición química de los residuos vegetales que se incorporan a estos suelos.
Cuadro 1 Estudios de almacenes y dinámica del Carbono en diferentes tipos de suelos y bosques templados. Observe las diferentes profundidades a las que han llevado a cabo estos estudios.
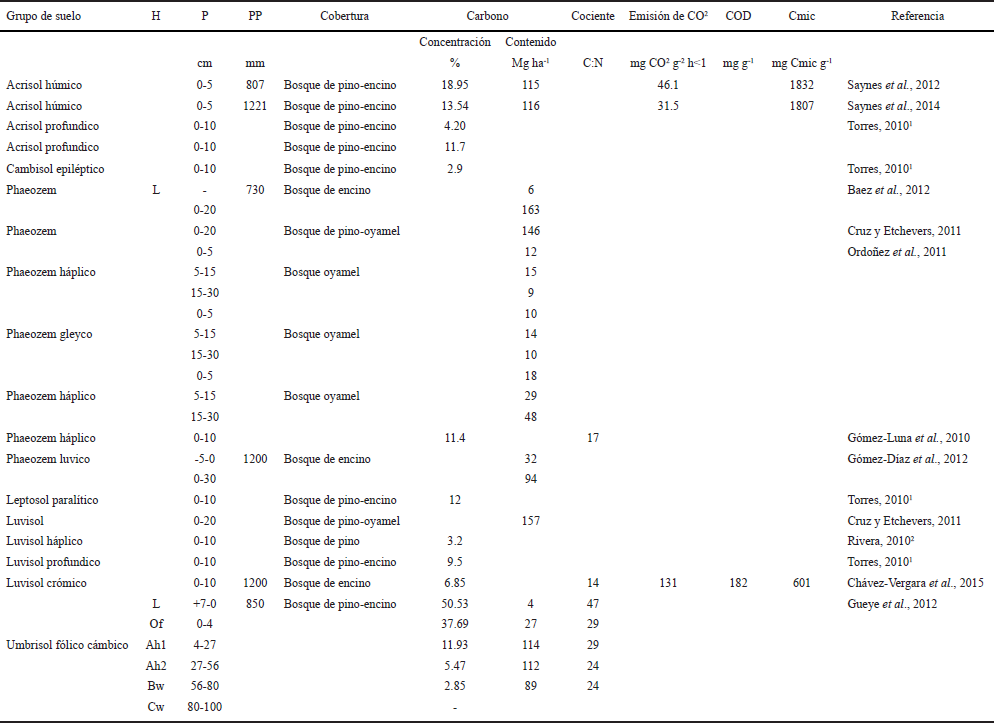
H = horizonte; P = profundidad; PP = precipitación pluvial.
Con base en los trabajos desarrollados en Luvisoles se sugiere que no existe un efecto del tipo de cobertura vegetal sobre la concentración de C del suelo, pero se observa que el Luvisol que soporta el bosque de pino es donde existe la menor concentración de C en el suelo superficial. Lo anterior podría estar asociado a la menor incorporación de compuestos orgánicos provenientes del mantillo y la menor lixiviación de formas solubles de C, debido a la mayor proporción de compuestos hidrófobos en las especies aciculares (Almendros et al., 2000), sin embargo, no existe amplia evidencia de ello. En el caso de los Luvisoles desarrollados a partir de Andosoles, se ha observado que existe la pérdida de complejos órgano-Al o des-humificación en el horizonte superficial. Lo anterior, derivado de la cristalización de los compuestos amorfos (Sedov et al., 2003). Esto sugiere que la materia orgánica puede estabilizarse en horizontes superficiales por efecto de agregación biogénica (Lützow et al., 2008), mientras que en los horizontes sub-superficiales la estabilización ocurre a través de la interacción con arcillas, lo cual es una ruta diferente a la dominante en los Andosoles (Shoji et al., 1993). Desafortunadamente, en bosques templados de México no existen trabajos que permitan reforzar esta hipótesis ya que, aunque se han realizado trabajos en Luvisoles de origen volcánico, la profundidad media de muestreo en estas investigaciones es de 15 cm (Cuadro 1). En uno de los pocos trabajos reportados para este grupo de suelo Chávez et al. (2014, 2015) encuentran que la concentración de formas lábiles de materia orgánica en el mantillo está relacionada con las características fisiológicas de las especies vegetales, y esto determina la disponibilidad de C, N y P en los suelos. Asimismo, las especies influyen en la actividad microbiana y en los suelos que presentan mayor disponibilidad de C se promueve la formación de materia orgánica más estable derivado de la resíntesis microbiana (Chávez-Vergara, 2015). Con base en lo anterior, se puede plantear que al interior de este grupo de suelo la dinámica del C puede modificarse por la cobertura vegetal, lo cual puede ser aplicable para otros grupos de suelo.
Acrisoles. Son suelos que han pasado por un intenso proceso de intemperismo, lo cual deriva en la destrucción de los aluminosilicatos (Macías, 2008). En el caso de los bosques templados en México, los Acrisoles estudiados son derivados de materiales volcánicos en condiciones cálidas y con elevada precipitación. Estos suelos presentan un horizonte Bt (árgico) bien definido, dominado por arcillas 1:1 tipo caolinitas con cantidades variables de sesquióxidos de Fe (principalmente hematita o goetita) y Al. Asimismo, presentan baja capacidad de intercambio catiónico, y los sitios de intercambio están dominados por cationes ácidos lo cual favorece pH alrededor de 4.5-5.5 (Macías, 2008). En los Acrisoles se ha determinado que la abundante presencia de óxidos de Fe favorece la estabilización del carbono orgánico, el cual llega a representar entre el 50% y el 70% del carbono orgánico disuelto estabilizado (Jardine et al., 1998). Además, pueden formar complejos órgano-Fe muy estables a través de la interacción con la caolinita (Wiseman y Pütmann, 2006), los cuales incrementan su reactividad debido al bajo pH (Lützow et al., 2006).
Existen pocos trabajos en Acrisoles en los bosques templados de México, cuya vegetación está asociada a bosques mixtos de pino-encino, en los cuales se ha determinado la concentración de C (Cuadro 1). Comparativamente con otros grupos de suelos, los Acrisoles presentan los valores más elevados en concentración y contenido de C en los primeros 10 cm de profundidad (Cuadro 1). De acuerdo a los datos de respiración basal se puede sugerir que la materia orgánica puede estar en formas estables, debido a que la tasa de producción de CO2 es de las más bajas reportadas en los estudios de suelos de bosques templados (Cuadro 1). Los Acrisoles de bosques templados son intensamente deforestados para cambio de uso de forestal a agrícola, los cuales son rápidamente abandonados y debido a sus caracterizas morfológicas son muy susceptibles a la erosión intensa si la cubierta vegetal es removida (Gómez-Romero et al., 2012), con lo cual el riesgo de pérdida de C de estos suelos es alto.
Phaeozems. Son suelos con un marcado horizonte superficial rico en C orgánico y se caracterizan por tener una alta saturación de bases en todo el perfil, presentan pH en el rango de 5-7, por lo cual el perfil característico es AhC o bien AhBC (Spaargaren, 2008b). Estos suelos se desarrollan en condiciones húmedas y subhúmedas, con marcada estacionalidad de la lluvia, las cuales favorecen la acumulación de sustancias húmicas en el horizonte superficial (Krasilnikov et al., 2013), como respuesta a la elevada incorporación de residuos vegetales y la elevada actividad microbiana en época de lluvias, pero a su disminución en época seca. De acuerdo a los estudios revisados en el presente trabajo, existe una gran variedad de coberturas vegetales sobre estos suelos, las cuales incluyen: bosques de mixtos de pino-encino, bosques de pino-oyamel y bosques de oyamel y bosques de encinos (Cuadro 1).
Aunque estos suelos presentan una elevada acumulación de materia orgánica, los valores de contenido de C orgánico reportados son muy variables, y aunque no son concluyentes debido a la reducida disponibilidad de datos, esto puede estar asociado al tipo de cobertura vegetal. Lo que pudimos observar es que los suelos cubiertos por especies latifoliadas (encinos) presenta el mayor contenido de C orgánico, seguido por los bosques mixtos y los bosques de oyamel con los valores más bajos (Cuadro 1). Lo anterior puede estar asociado con las diferencias en las tasas de descomposición e incorporación de compuestos orgánicos a través de la percolación desde el mantillo (Lützow et al., 2006). En bosques de Quercus rugosa de Michoacán desarrollados sobre Phaeozems, se ha reportado una concentración de C del suelo de 114 g k‑1 en una profundidad de 0-15 cm (Gómez-Luna et al., 2009). Sin embargo, no hay información sobre el almacenamiento de COS.
De acuerdo a las características edáficas de los Phaeozems, los procesos que pueden favorecer la permanencia del C orgánico son la preservación selectiva de compuestos aromáticos y alifáticos, la re-síntesis microbiana de compuestos orgánicos, y la formación de compuestos órgano-minerales asociados a cationes polivalentes (p. ej.: Ca2+) y en interacción con arcillas en los horizontes sub-superficiales. Como en otros grupos de suelos en bosques templados de México no existen estudios que evalúen la importancia de los procesos que favorecen la permanencia del C orgánico, lo cual es un campo de oportunidad para el estudio del ciclo del C en ecosistemas templados.
Andosoles. Entre los factores formadores del suelo, el material parental y el clima son los principales determinantes de las características químicas y físicas de los Andosoles (Shoji et al., 1993). La ceniza volcánica, material parental que da origen a estos suelos, está predominantemente constituida por vidrio volcánico, el cual se intemperiza muy fácilmente dando lugar a la formación de minerales secundarios no cristalinos o de bajo orden estructural. Varias de las propiedades de los Andosoles están relacionadas con la presencia de estos componentes de bajo orden estructural como el alofano, la imogolita, la ferrihidríta y los complejos Al/Fe-humus (Shoji et al., 1993). Particularmente, se ha observado que en suelos volcánicos las variables mineralógicas permiten explicar el comportamiento del COS bajo diferentes usos y coberturas, debido a que es estabilizado mediante la formación de complejos Al-humus y la adsorción de MOS al alofano (Nanzyo et al., 1993, Johnson-Maynard, 2002).
Se ha descrito una relación entre el régimen de humedad del suelo y los contenidos de C (Shoji et al., 1993). Estudios de secuencias bioclimáticas evidencian menores contenidos de C bajo condiciones xéricas (Cuadro 2). Por ejemplo, Broquen et al. (2005) registraron una diferencia del 66% en el COS en Andosoles xéricos con respecto a los desarrollados bajo regímenes údicos. Asimismo, diferencias en las relaciones C/N del suelo sugieren que la tasa de mineralización del COS es superior en condiciones xéricas (Broquen et al., 2005). Bajo el mismo tipo de cobertura (p. ej.: cultivo), Campos et al. (2001) registraron concentraciones de C muy superiores en condiciones údicas en comparación con las encontradas en regímenes xéricos (Cuadro 2).
Cuadro 2 Estudios de secuencias bioclimáticas y estudios comparativos entre Andosoles alofánicos y no alofánicos.

† Tipo de suelo: A=alofánico (Alp/Alo < 0.5); NA=no alofánico (Alp/Alo > 0.5; Shoji et al., 1993).
En el caso de Rodríguez et al. (2006) no se siguió el criterio anterior, se mantuvo la clasificación de los autores.
En ambientes húmedos y fríos, se plantea que la MOS puede jugar un papel antialofánico (Shoji et al., 1993). La complejización con la MOS limita la disponibilidad de Al restringiendo la formación de alofano e imogolita (Shoji et al., 1993). Se ha señalado que los Andosoles no alofánicos, donde el Al y el Fe forman complejos con el humus, acumulan más C que los alofánicos, aquellos donde las formas activas del Al y el Fe son el alofano, la imogolita y la ferrihidrita (Nanzyo et al., 1993; Aran et al., 2001; Nishiyama et al., 2001). Sin embargo, también se ha observado la tendencia opuesta, en la cual los Andosoles alofánicos presentan almacenes mayores de C en comparación con los no alofánicos (Cuadro 2).
Además de la protección química mencionada, particularmente en los Andosoles, la protección física juega un papel importante en la acumulación de la MOS. En general, la relación entre la MOS y la agregación es recíproca, ya que la formación y estabilización de agregados está mediada en gran parte por la MOS y a su vez, dicha incorporación de la MOS a los agregados del suelo, la protege de la descomposición (Six et al., 2002). La presencia de altos contenidos de MOS y minerales de bajo orden estructural en los Andosoles da lugar a una fuerte agregación del suelo (Ulery, 2002). Evidencia de esta protección física de la MOS es el incremento en las tasas de mineralización potencial luego del rompimiento de agregados (Gijman y Sanz, 1998) y la correlación negativa entre la tasa de mineralización constante (tasa de mineralización: C total) y la estabilidad de agregados (Huygens et al., 2005). Es claro que la relación entre variables mineralógicas y el clima determina los almacenes de C en Andosoles, sin embargo, es necesario entender la interacción de estos dos factores con otros controladores de la dinámica de C en estos suelos como la productividad tanto aérea y subterránea del sistema y la actividad microbiana.
Almacenes de carbono en suelos de bosques templados
Los Andosoles presentan una importante acumulación de COS (310 Mg ha-1; Cuadro 3), la cual se ha explicado por la estabilización de la MOS con la formación de complejos órgano-metálicos y órgano-minerales (Nanzyo et al., 1993; Johnson-Maynard, 2002). Esta estabilización de la MOS la hace altamente resistente a la descomposición, de forma que el tiempo medio de residencia de C es muy alto y la tasa de circulación muy baja. Los Andosoles presentan, después de los Histosoles, las mayores concentraciones de C (Cuadro 3), por lo cual tienen un alto potencial para secuestrar C. Por otro lado, el efecto del UTCUTS es menor sobre el CO almacenado en Andosoles, por lo cual también se plantea que pueden ser aprovechados de una forma sostenible desde el punto de vista de conservación de COS (Parfitt et al., 1997).
Cuadro 3 Concentración y almacenes de carbono (C) en los suelos del mundo.

† Clasificación según la US Soil Taxonomy. Fuente: Eswaran et al., 1993.
En suelos de origen volcánico, la edad de la superficie es un factor determinante de la capacidad de almacenamiento de C (Peña-Ramírez et al., 2009). En bosques de pino y oyamel localizados en el campo volcánico de la Sierra del Chichinuatzin estos autores encontraron, bajo un régimen ústico, que los Andosoles de edades entre 8000 y 10 000 años antes del presente (A.P.) tenían una acumulación de C orgánico total en el solum de entre 370 y 540 Mg ha‑1, respectivamente. A lo largo de la cronosecuencia, con Leptosoles, Regosoles y Andosoles de entre 1835 hasta 10 000 años de edad, estimaron una tasa de incremento de carbono de 40 Mg ha-1 cada 1000 años, sugiriendo que alrededor del 61% de la variabilidad del C se relaciona con la edad del suelo (Peña-Ramírez et al., 2009) (Figura 6). Además encontraron una relación positiva entre la concentración de C y la concentración de aluminio extractable con pirofosfato (Alp), el cual corresponde al aluminio asociado a los complejos humus-aluminio (Figura 7). De hecho, se estimó una tasa de incremento de 14% de C por cada unidad porcentual de Alp. El modelo explica el 49% de la variabilidad de la concentración de C teniendo al Alp como estimador. Por otra parte, en los horizontes A superficiales la concentración de C muestra una tendencia a relacionarse inversamente con el Al asociado al alofano (Alo-Alp), mientras que en los horizontes B sub-superficiales existe una relación lineal positiva entre la concentración de C y el alofano, estimado tanto a través de la diferencia Alo-Alp, como a través de las concentraciones de sílice extractable con oxalato (Sio) (Figura 7).
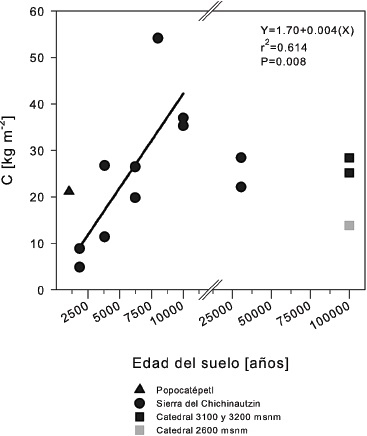
Figura 6 Acumulación total de C orgánico en suelos de la Faja Volcánica Transmexicana, analizados en función del tiempo y agrupando los suelos según su origen (Popocatépetl, Sierra Chichinautzin y La Catedral). Los datos de la Sierra del Chichinautzin de 1835 a 10 000 años fueron ajustados a un modelo lineal. Fuente: Peña-Ramírez et al., 2009.
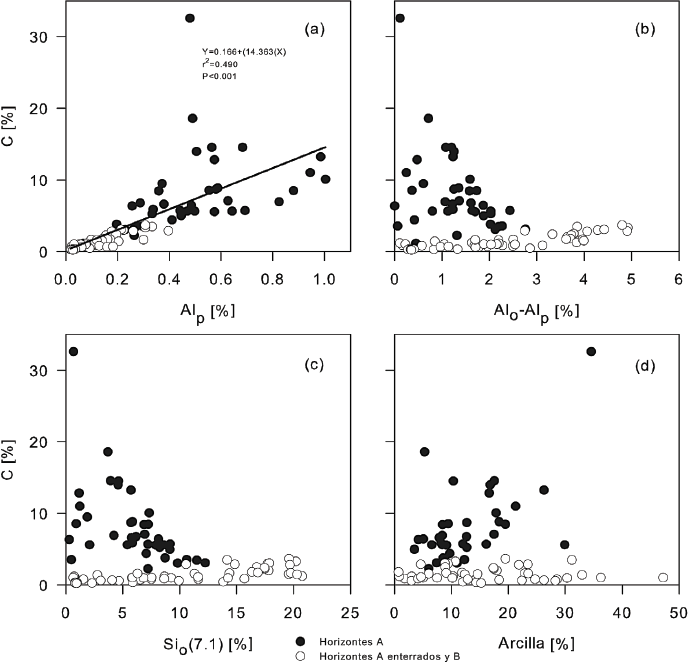
Figura 7 Comportamiento del C en función del Alp (a), Alo-Alp (b), Sio (7.1) (c) y arcilla (d). Fuente Peña-Ramírez et al., 2009.
De forma similar, el C de los horizontes A superficiales muestra una relación positiva, aunque débil, con la concentración de arcilla (Peña-Ramírez et al., 2009) (Figura 7). A lo largo de la cronosecuencia el C aumenta, y es particularmente abundante en los Andosoles con propiedades ándicas, llegando a su máximo en el sitio Cuauhtzin (8000 años A.P., 540 Mg ha-1). La cantidad de C en este sitio es similar a la reportada por Torn et al. (1997)) en el archipiélago de Hawaii, 600 Mg ha-1 (150 000 años A.P.). Sin embargo, el tiempo en el que se alcanza la máxima acumulación de C en Hawaii es mucho menor. Probablemente el clima más seco de los alrededores de la Cuenca de México acelere la mineralización de una parte de la materia orgánica, disminuyendo la permanencia de los horizontes orgánicos (Peña-Ramírez et al., 2009). A diferencia del trabajo de Torn et al. (1997), en los suelos de la cronosecuencia de la Sierra Chichinautzin la estabilización de la materia orgánica se debe principalmente a la acumulación de complejos de substancias húmicas con aluminio, como lo demuestra la relación positiva entre la acumulación de C y el Alp. En el centro de la Faja Volcánica Transmexicana la relación entre el C y los minerales de bajo orden estructural y las arcillas cristalinas, no resultó estadísticamente significativa (Figura 7) (Peña-Ramírez et al., 2009).
En la región del Cofre de Perote, Gamboa y Galicia (2011, 2012) reportan que a escala de paisaje la variabilidad de la concentración del C en los horizontes A está relacionada con propiedades físico-químicas, como el radio binomio (Alp/Alo), la concentración Al-humus (Alp), la densidad aparente y el pH. La formación de complejos Al-humus es el principal controlador de la estabilización de C en horizontes superficiales y su importancia disminuye con el decremento de C con la profundidad. En los horizontes B la concentración de minerales de bajo orden estructural como el alofano es el principal controlador de la estabilización de C. Estos dos controladores principales interactúan con la densidad aparente y el pH en todos los horizontes, de tal forma que mayores densidades aparentes, así como condiciones menos ácidas determinan menores concentraciones de C.
Cruz-Flores et al. (1998)) reportan que el promedio de C acumulado en los Andosoles de México es similar a lo reportado para Andosoles a nivel mundial (306 Mg ha-1 a 100 cm de profundidad) (Eswaran et al., 1993). Sin embargo, suelos de 8000 años entre 2000 y 2600 m en la comunidad indígena de San Juan Nuevo en el estado de Michoacán, contienen 50% menos C (entre 110 y 150 Mg ha-1) que los suelos de edad similar de la Sierra del Chichinautzin localizados a 3100 m (Peña-Ramírez et al., 2009). Miehlich (1980) reporta una menor acumulación de C en los suelos de la Sierra Nevada desarrollados sobre depósitos de ceniza y pómez con edades entre 5000 y 10 000 años y altitudes entre 2750 y 3100.
En el Cofre de Perote, Campos (2002)3 ha reportado que la concentración de COS decrece con la altitud. En los bosques de coníferas localizados en las partes altas (2500 msnm) la concentración es de 26 g kg‑1, mientras que en las partes bajas (1650 msnm) con cultivo de papas aumenta a 60 g kg-1. En esta altitud se ha estimado que el potencial de almacenamiento de C es de 426 Mg ha‑1 a una profundidad de 1 m en Andosoles. En la reserva de la Mariposa Monarca, Pérez-Ramírez et al. (2014) reporta que el promedio en el contenido de COS en suelos de los rodales de Abies conservado tienen en promedio 153 Mg C·ha-1, mientras que los rodales aprovechados y perturbados tienen 95 y 125 Mg C·ha-1, respectivamente, pero con una alta variación espacial. Asimismo, reporta que el promedio de COS en bosques conservados de pino-encino es de 103 Mg C·ha-1, mientras que los rodales aprovechados y perturbados tienen 39 y 13 Mg C·ha‑1, respectivamente. Sin embargo, cabe señalar que los bosques conservados almacenan entre 40-80% del COS en los horizontes A del suelo.
Cruz-Flores y Etchevers, (2011a) reportan que en las reservas de la biosfera El Cielo y Sierra de Manantlán, los suelos forestales con Pinus rudis y Abies vejarii y formados sobre rocas sedimentarias y metamórf icas tuvieron mayores contenidos de COS (147 Mg ha-1), comparados con los Andosoles y Leptosoles derivados de rocas ígneas en diversas áreas naturales protegidas del centro del país (83.5 Mg C ha-1). En suelos derivados de roca sedimentaria y complejos metamórficos, la mayor acumulación de carbono orgánico puede ser consecuencia del CaCO3 presente en rocas. El contenido promedio general de CO de suelos cubiertos por especies del género Pinus fue menor al encontrado en suelos cubiertos por Abies debido a que el sotobosque de estos últimos está conformado por estratos herbáceos y arbustivos que son poco frecuentes bajo la cobertura arbórea de los bosques de pino, lo cual pude contribuir a una mayor entrada de materia orgánica. El efecto que los géneros o especies tuvieron sobre el COS fue el siguiente: en el género Abies: A. vejarii tuvo mayor COS (131 Mg ha-1) que A. religiosa (92 Mg ha-1). Los bosques de pinos presentaron una alta variabilidad en el COS: P. ayacahuite var. oaxacana (21 Mg ha-1) y P. montezumae (71 Mg ha-1) en relación al suelo bajo P. rudis (180 Mg ha-1), sugiriendo que las especies juegan un papel central en el COS, sin embargo, no se conocen los procesos que determinan la acumulación de C en el suelo (Cruz y Etchevers, 2011b).
Vela et al. (2012), reportan el COS para los bosques de coníferas y encinos del área de conservación de la Ciudad de México, el cual tiene una alta variación espacial dependiendo del tipo de suelo y el relieve. Por ejemplo, en los Phaoezems y zonas planas con coberturas de Quercus spp., el COS es de 150 Mg C ha‑1; o en suelos Regosol éutrico, Leptosol lítico y con cobertura de P. montezumae, P. patula, P. ayacahuite, el COS oscila entre 50-100 Mg C ha-1. Finalmente, en suelos Phaeozems háplicos y Leptosoles, que se encuentran en las planicies aluviales intermontanas de los volcanes Tulmiac y Cuautzin los valores de COS < 50 Mg ha‑1. En cuanto al tipo de vegetación, el bosque de A. religiosa presentó el nivel más alto de COS con 145.6 Mg ha-1, el bosque de Quercus spp., con 121.3 Mg ha-1 y el bosque de Pinus spp., con 119.4 Mg ha-1.
Acevedo-Sandoval et al. (2014) en un estudio en Alisoles del municipio de Acaxochitlán, Hidalgo, México establece que la concentración de materia orgánica del suelo (MOS) bajo bosques de P. patula fue de 13.2%, mientras que bajo P. teocote fue de 16.3%, y de 3.2% bajo Quercus spp. Asimismo, el porcentaje de MOS decrece con la profundidad del suelo hasta llegar a valores considerados como muy pobres (0.15%).
Saynes (2012) 4 reporta diferentes almacenes de COS para los bosques templados bajo diferentes tipos de suelos, por ejemplo para Acrisoles en Ixtlán de Juárez, Oaxaca (116-153 Mg ha-1); Luvisoles en Oaxaca (133 Mg ha‑1), Andosoles en Nuevo San Juan, Michoacán (42‑189 Mg ha‑1), Andosoles en Hidalgo, México (66‑85 Mg ha-1), en Regosol/Phaeozem en la Sierra de Manantlán en Jalisco (146 Mg C ha-1) en Andosoles en Perote, Veracruz (52-76 Mg ha-1), las concentraciones cambiaron no sólo en función del tipo de suelo, también influyeron los patrones de precipitación y temperatura y el estado sucesional. La mayor parte de la masa del suelo se distribuyó en las fracciones: mineral pesada (31-40%) y fracción fina (65-83%), mientras que la materia orgánica particulada (MOP) representó del 2 al 8%. Estos resultados son similares a otros reportados en bosques templados con una contribución de la MOP del 2 al 6% (Balesdent et al., 1998) y del 97% en las fracciones minerales (Sarkhot et al., 2008). Aunque la MOP representó una parte minoritaria de la masa del suelo, su concentración de C fue más alta (370‑490 mg g-1 suelo) que la de las fracciones mineral pesada y ligera (61-120 mg g-1 de suelo); éste también ha sido un patrón consistente en varias investigaciones.
Los contenidos de COS del suelo de bosques templados mexicanos oscilan ampliamente entre los tipos de suelo (Leptosoles 60 Mg ha-1 contra Andosoles 559 Mg ha‑1; Cuadro 4); la identidad de la especie vegetal dominante (Abies 160 Mg ha-1 contra P. montezumae 280 Mg ha-1; (Cuadro 4) el estadio sucesional y la edad del suelo (Cuadro 4), entre otros factores. Sin embargo, la heterogeneidad de los almacenes (suelo mineral total, en diferentes profundidades y fracciones, etc.) y a la poca disponibilidad de datos que caracterizan a los suelos y los respectivos sitios (altitud, clima, material parental, edad de la superficie, etc.), impide analizar los factores determinantes de la capacidad de captura de carbono. Urge una estrategia nacional para estandarizar la información puntual. También es claro que los Andosoles son los suelos mejor caracterizados en cuanto el potencial de almacenamiento de COS y los procesos de estabilización de la materia orgánica en relación a los otros seis tipos de suelos dominantes bajo las coberturas de bosques templados.
Cuadro 4 Almacenes de carbono en diferentes tipos de suelos cubiertos por bosques de pino y oyamel en el centro de la Faja Volcánica Transmexicana. El clima que prevalece en estos sitios es Cw con abundantes lluvias en verano (precipitación 1000-1200 mm; temperatura 10-14°C), régimen ústico e isomésico, excepto el sitio Catedral Ph, ubicado en un clima más cálido y seco (Peña-Ramírez et al., 2015).

Ped = pedregosidad; DA = densidad aparente.
Efecto del cambio de uso sobre el COS en suelos de bosques templados
Los cambios en el COS y los flujos de C son el resultado de cambios locales, los cuales son generados por las actividades humanas como el uso y manejo del suelo, los incendios, la regeneración, la sustitución de especies, entre otros (Cuadros 5 y 6). El cambio de uso del suelo es uno de principales emisores de CO2 por deforestación (Detwiller y Hall, 1988), siendo ésta la segunda causa de emisión de CO2 a la atmósfera (12.9 y 54.1 Mg C año-1 por deforestación de bosques templados y tropicales, respectivamente) (Masera et al., 1997). Recientemente, de Jong et al. (2010) estimaron que las emisiones netas de C del suelo en los bosques son de 23.7 Mg C año-1 para el período 1993-2002, sin embargo, los mayores flujos de emisiones UTCUTS se han producido sobre todo en el sur de México. Por otro lado, es bien conocido que las actividades antrópicas (cambios de cobertura, cambios de uso de suelo y tipos de manejo) generan gradientes ambientales y espaciales complejos, lo cual dificulta realizar estimaciones regionales precisas de acumulación de C (Powers y Veldkamp, 2005).
Cuadro 5 Almacenes de Carbono (Mg ha-1) y cambios derivados del UTCUTS en Andosoles.

PP = precipitación.
Los efectos de la conversión de bosques a otros usos/coberturas sobre el COS han sido revisados por varios autores (Guo y Gifford, 2002; Murty et al., 2002). Los análisis de las tasas de deforestación de dichos ecosistemas no han sido constantes ni homogéneos en el espacio ni en el tiempo, como consecuencia existe una marcada heterogeneidad espacial en los almacenes de C en el suelo y sus flujos a escala regional y paisajística, aspectos que han sido evaluados aisladamente. En general, la conversión a la agricultura causa disminución de los almacenes de COS (promedio de cambio: -22%; Murty et al., 2002). Esto se ha explicado por el incremento en la tasa de descomposición de la MOS, la modificación de la cantidad y calidad de los residuos, cambios en la estructura del suelo, la fragmentación y redistribución de residuos, así como el aumento de procesos erosivos (Guo y Gifford, 2002; Murty et al., 2002; Lal, 2004).
Específicamente en Andosoles, este tipo de cambio de uso del suelo ha sido poco estudiado, registrándose únicamente tres casos en la presente revisión (Kawahigashi et al., 2003; Lemenih et al., 2005; Campos, 2006). En conjunto, las respuestas del COS no evidencian una tendencia como se ha observado en otros suelos (Guo y Gifford, 2002). Mientras Kawahigashi et al. (2003) no observaron cambios en el C orgánico en el suelo superficial luego de la conversión de bosques deciduos, Campos (2006) registró una disminución del COS asociada a un incremento significativo de los flujos de CO2. Lemenih et al. (2005), quienes estudiaron una cronosecuencia de uso agrícola, registraron una disminución de los almacenes de COS en los primeros 10 cm de profundidad luego de 10 años de uso. Aunque los resultados de Kawahigashi et al. (2003) y Lemenih et al. (2005) muestran tendencias diferentes, sugieren que el efecto del uso agrícola depende de la profundidad del perfil del suelo (Cuadro 4). Lemenih et al. 2005 registró incrementos importantes de 10-20 cm de profundidad, los cuales compensaron en gran medida las pérdidas superficiales de C orgánico. Contrariamente y a pesar de no registrar cambios en el suelo superficial, Kawahigashi et al. (2003) observaron en horizontes más profundos una disminución importante del almacén de C orgánico, lo cual condujo a una pérdida significativa en el almacén total (Cuadro 5).
En el Cofre de Perote, Veracruz, se reporta que en los Andosoles silándicos la pérdida de C luego de la conversión de áreas forestales a la agricultura fue menor en comparación con los Andosoles vítricos del piedemonte noroccidental. Evidencia de esta menor vulnerabilidad a la transformación a la agricultura son la menor pérdida de COS superficial (0-10 cm) en los Andosoles silándicos en relación con el CT de referencia; en contraste con una disminución en Perote y la falta de cambios en la concentración de C en los horizontes subsuperficiales y profundos de los Andosoles silándicos de Los Pescados y El Conejo. Esta menor susceptibilidad del CT de Andosoles silándicos se relaciona con una mayor estabilización de la MOS debido a las altas concentraciones de complejos Alhumus y órgano minerales, en comparación con los Andosoles vítricos del piedemonte (Gamboa y Galicia, 2011).
En Michoacán, los bosques de Q. rugosa utilizados para la elaboración de carbón, disminuyen la concentración y la tasa de mineralización de C orgánico en los primeros centímetros, pasando de 114 a 55 g kg-1 (Gómez-Luna et al., 2009). En la temporada seca la actividad microbiana es inhibida, por lo que se acumula la MOS y no hay ningún flujo de mineralización de C. Por otra parte, las quemas redujeron la cantidad de CO2 después de 28 días debido a que reduce la cantidad de materia orgánica del suelo y el sustrato de C para los microorganismos del suelo (Gómez-Luna et al., 2009).
En Atécuaro Michoacán en suelos de tipo Cambisol y Andosol, el cambio de bosques de encinos (130 g C kg) a pastizales (48 g C kg) reduce el COS en un 63%. El cambio de uso de suelo tuvo un impacto negativo y significativo en el COS asociado a las fracciones arcillosa y limosa (Covaleda et al., 2011). La MOP fue la fracción más sensible al cambio de uso del suelo, seguida por las fracciones de limos y arcillas que tenían menos C después de la conversión de bosques en tierras de cultivo y pastizales. La pérdida de cubierta forestal podría ser la razón de la disminución de la materia orgánica particulada (Covaleda et al., 2011). Esto significa no sólo la pérdida del COS, sino de sus mecanismos de protección física.
En el suelo de conservación del Distrito Federal, México, el cambio de uso de suelo reduce el COS, por ejemplo los suelos bajo los bosques de A. religiosa contienen más COS (145 Mg ha-1), que los que se han convertido a agricultura (46 Mg ha-1) y pastizales (90 Mg ha-1). En relación a la agricultura, los cultivos que se siembran en surcos como el maíz generalmente retienen menos de la mitad de COS (39 Mg ha-1), en comparación con los cultivos de cobertera, como la avena forrajera (49 Mg ha-1), debido al manejo de residuos (Vela et al., 2012). Esto significa que no sólo el cambio de uso de suelo, sino también el tipo de cultivo y las prácticas de manejo influyen en la pérdida de COS.
Otra de las trayectorias en la conversión de bosques es su transformación a pastizales y el posterior establecimiento de plantaciones forestales. Murty et al. (2002) reportan cambios en los almacenes de COS de -50% a + 160% por la conversión de zonas forestales a pastizales (Cuadro 5). Por su parte, Guo y Gifford (2002) concluyen que la conversión de bosque a pastizal causa un incremento del 8 % en los almacenes de C. En Andosoles se han observado tanto incrementos como reducciones en los contenidos de COS (Parfitt et al., 2003; Huygens et al., 2005; Campos, 2006) como respuesta a la conversión de bosques a pastizales (Ross et al., 1999; Kawahigashi et al., 2003) (Cuadro 4), mientras que la respuesta del COS ante la conversión de pastizales a plantaciones forestales disminuye en forma consistente (Ross et al., 1999; Parfitt et al., 2003; Huygens et al., 2005). Esto último podría ser atribuido parcialmente a la degradación de la estructura del suelo y la consecuente pérdida de protección física de la MOS implicada en el establecimiento de las plantaciones. También se ha planteado que la implementación de un monocultivo forestal implica una disminución de los ingresos de C (Guo y Gifford, 2002). Por su parte, los pastizales mantienen una cobertura constante del suelo y tienen altas tasas de recambio y productividad, particularmente subterránea; como resultado de esto tiene lugar una intensa formación de MOS estable (Brown y Lugo, 1990; Huygens et al., 2005).
Efecto del cambio de uso sobre la fracción biológicamente activa en suelos de bosques templados
Los cambios de uso del suelo pueden influir negativamente en la concentración de las fracciones orgánicas lábiles (p. ej.: materia orgánica disuelta, materia orgánica particulada, biomasa microbiana) y en la formación de moléculas estables (p. ej.: interacciones órgano-minerales, productos de resíntesis microbiana), las cuales influyen positivamente en el secuestro de carbono. Rees et al. (2005), sugieren que el tipo de suelo y la forma en cómo es manejado determina en gran medida las entradas de MO y con ello también la acumulación de humus en el suelo. Joliviet et al. (1995) encontraron que la transformación de bosques templados a cultivos de maíz reduce a la mitad el C orgánico del suelo (COS) en tres décadas; mientras que el manejo forestal sólo reduce alrededor del 10% del COS en ese mismo período. El cambio de uso/cobertura del suelo puede afectar diferencialmente las fracciones de COS. Particularmente, los cambios en una fracción lábil como la biomasa microbiana son de gran importancia debido a que la mayoría de los procesos en el suelo ocurren a través de reacciones mediadas por microorganismos, siendo la actividad microbiana responsable de la circulación de carbono y nutrientes en el suelo (Nannipieri y Badalucco, 2003).
Particularmente, en los Andosoles, la respuesta del COS en pastizales depende del tipo de manejo (Fearnside y Barbosa, 1998). Huygens et al. (2005), quienes registraron un incremento del 31% en el CO luego de la conversión de bosques a pastizales, observaron en estos últimos, tasas de mineralización potencial de C menores, así como una mayor tasa de mineralización de residuos de depositación reciente asociada a un menor porcentaje de C en esta misma fracción lábil (Cuadro 6). Esta respuesta puede explicarse por la disminución del pH del suelo derivada de las prácticas de manejo, lo cual facilita la formación de complejos del tipo metal-humus-arcillas, mejora la protección física del COS y consecuentemente, disminuye la actividad microbiana (Huygens et al., 2005). En respuesta a este incremento en la protección de parte de la MOS, los microorganismos pueden utilizar otras fracciones lábiles no protegidas como la materia orgánica particulada ligera, conduciendo cambios en esta fracción del COS.
Parfitt et al. (2003) también observaron efectos del manejo de pastizales sobre COS y explicaron los mayores contenidos de COS, tasas de mineralización potencial y C en biomasa microbiana en pastizales manejados, debido a las bajas concentraciones de lignina y los altos contenidos de C lábil. Mayores cantidades de C lábil, en forma de MOS de mejor calidad que los residuos forestales, podrían haber sido incorporadas al suelo por los pastos, leguminosas y el ganado, los cuales son luego procesados por los microorganismos (Parfitt et al., 2003). Campos (2006) registró resultados similares que relacionan las altas tasas de mineralización potencial de pastizales con una alta producción primaria de estos sistemas y con cambios en las comunidades bióticas derivadas del UTCUTS (Cuadro 6). En general, estos resultados asocian el incremento de los almacenes de C con un aumento en fracciones lábiles y en la actividad microbiana. Por el contrario, Ross et al. (1999) observaron una disminución de los almacenes de C en pastizales asociada a una mayor tasa de mineralización potencial y a un mayor valor de qCO2 (respiración: Cmicrobiano) en comparación con zonas forestales. Argumentando también diferencias cualitativas entre los sustratos de coberturas herbáceas vs. forestales, Ross et al. (1999) relacionan la disminución de los almacenes de C con un consecuente enriquecimiento en formas lábiles de C en pastizales derivado de raíces y mantillo, con lo cual explican la mayor actividad microbiana y la disminución de los almacenes derivada de esta intensa actividad (Cuadro 6).
En México, Saynes et al. (2012), Gamboa y Galicia (2011; 2012) analizaron el efecto del manejo forestal y el cambio de uso de suelo sobre los flujos de CO2 y la actividad microbiana del suelo. En Ixtlán de Juárez se evaluaron los flujos de CO2 en Luvisoles y Cambisoles sujetos a diferentes lapsos de tiempo de extracción forestal y bajo dos condiciones de precipitación (Saynes, 20124). En la localidad con mayor precipitación la producción de CO2 luego de uno (2.7 ± 0.14 mg g-1) y 20 años de aprovechamiento forestal (1.8 ± 0.23 mg g-1), no fue diferente de la registrada en el suelo del bosque de referencia (2 ± 0.29 mg g-1). Sin embargo, el tiempo de abandono tuvo un efecto significativo sobre las emisiones acumuladas de CO2, las cuales fueron significativamente mayores en el bosque con un año de aprovechamiento que en el de 20 años. El COS siguió el patrón descrito anteriormente (bosque de 1 año > bosque de referencia > bosque de 20 años). En la localidad con menor precipitación, el flujo CO2 fue estadísticamente similar entre el bosque de referencia (2.7 ± 0.39 mg g-1), el bosque de 1 año (2.7 ± 0.25 mg g-1) y el bosque de 20 años después del aprovechamiento (1.9 ± 0.27 mg g-1). El aprovechamiento forestal disminuyó 16 y 29% la concentración de COS después de 1 y 20 años, en comparación con el bosque de referencia. La tasa de mineralización (k) sugiere un incremento de la disponibilidad de sustratos lábiles luego de un año del aprovechamiento, la cual disminuye transcurridos 20 años desde la extracción (Saynes et al., 2009, 2012). Estos resultados en la cantidad total de C y en la tasa de mineralización sugieren una mayor disponibilidad de materia orgánica lábil en el bosque de un año, lo que pudo favorecer un mayor contenido de materia orgánica potencialmente mineralizable y emisiones acumuladas de CO2 del suelo en este bosque. Estos efectos combinados con la alta precipitación media en este sitio probablemente favorecen la mineralización de la MOS, incrementando la emisión de CO2 (Saynes et al., 2009, 2012).
En el Cofre de Perote se utilizó un mosaico de coberturas de uso de suelo, que representa diferentes trayectorias de uso de suelo (deforestación-uso agrícola-regeneración) para evaluar los flujos de CO2) (Gamboa, 2012 5). En la localidad de Perote las unidades correspondieron a una plantación forestal de 30 años (cobertura de referencia), un área cultivada con maíz desde hace aproximadamente 50 años y que estuvo previamente cubierta con bosque de Pinus sp. y una zona que fue reforestada hace 15 años. Este sitio se localiza a una altitud de 2550 m, tiene una temperatura media anual de 11 °C y una precipitación total anual de 650 mm. En Los Pescados, las unidades correspondieron a un bosque de referencia (P. montezumae y Abies religiosa), un cultivo (papa) y una reforestación de 12 años (P. montezumae y A. religiosa). Este sitio se localiza a una altitud de 3550 m, tiene una temperatura media anual de 8.7 °C y una precipitación total anual de 1078 mm. En la localidad Los Pescados el cambio de uso del suelo modificó la producción acumulada de CO2: el suelo del bosque de referencia presentó mayor producción de CO2 (3.9 ± 0.28 y 1.10 ± 0.97 mg g-1) que el uso agrícola (1.1 ± 0.10 mg g-1) y la regeneración (1.9 ± 0.28 mg g-1). No obstante que las emisiones acumuladas de CO2 de regeneración fueron mayores que las de las áreas agrícolas, esta diferencia no fue estadísticamente significativa (Campos, 2004, 2006). La concentración de C orgánico disminuyó con la trasformación de aéreas forestales a la agricultura y se observó una recuperación relacionada con la regeneración. La mayor tasa de descomposición (k) se observó en el cultivo, indicando un incremento de la disponibilidad de sustratos orgánicos lábiles o menos estabilizados debido al establecimiento de áreas agrícolas. El C orgánico correspondió a 61, 14 y 23 mg CO g-1 C en el bosque de referencia, el área agrícola y la reforestación, respectivamente, lo que significa un agotamiento en los sistemas de cultivo y regeneración. Los suelos agrícolas estudiados registraron una tasa mayor de mineralización, indicando un incremento del C orgánico, lo cual supone una disminución de las reservas de COS. Este aumento de la mineralización lábil del COS se debe a la modificación tanto de la calidad de los residuos orgánicos como de los mecanismos de protección debido a la deforestación y las estrategias de manejo agrícola (Guo y Gifford, 2002; Six et al., 2002). La recuperación de la cubierta forestal luego del uso agrícola a través de la reforestación, incrementó las emisiones potenciales de CO2 y el C de la materia orgánica potencialmente mineralizable. Aunque no se recuperaron los niveles de referencia, el C en la materia orgánica potencialmente mineralizable fue 5.6 veces mayor en la reforestación en comparación con los suelos agrícolas. Probablemente la recuperación de los niveles de C de esta fracción está relacionada con el incremento de la biomasa aérea, y por ello a un mayor ingreso de residuos orgánicos. En Perote el porcentaje del COS fue superior en la reforestación comparado con el correspondiente al suelo forestal de referencia, lo cual podría estar relacionado con la disponibilidad de la materia orgánica lábil debido a la escasa mineralización (k = 0.008). En este sentido, la tasa de mineralización indica que bajo la cobertura de reforestación la materia orgánica potencialmente mineralizable es menos lábil que la observada en las demás coberturas, favoreciendo procesos de acumulación de C en el suelo (Saynes et al., 2009). Asimismo, la respiración del suelo disminuyó con el aumento de la temperatura y disminución de la disponibilidad de agua del suelo en la época seca, mientras que aumentó, con condiciones no limitantes de agua en el suelo en el verano. Estos resultados revelaron que la respiración del suelo es menos sensible a la humedad a temperaturas más bajas, pero se vuelve más sensible a altas temperaturas cuando el agua no es un factor limitante.
Los flujos de carbono y los procesos de estabilización de la MOS son escasamente estudiados en los bosques templados; nuevamente domina la literatura sobre los Andosoles en relación a los otros tipos de suelos. Por otra parte, la modificación del COS está más estudiada bajo diferentes trayectorias de usos de suelo, particularmente su transformación a la ganadería, que otros factores de perturbación como los incendios y la sustitución de especies. Es necesario señalar también que existen más estudios en los bosques de pinos que en los de encinos, por lo cual es necesario ampliar los estudios en estos últimos. Finalmente, los flujos de CO2 están regulados por las actividades antrópicas y las variables de temperatura y precipitación debido a la estacionalidad de la precipitación y temperatura en estos ecosistemas.
Algunas consideraciones futuras
En este trabajo los autores coinciden con las conclusiones que Paz et al. (2014) han sugerido en el sentido de que a la fecha de esta revisión no existe una explicación satisfactoria de los mecanismos implicados en el aumento o disminución de los sumideros de carbono terrestres, por lo que es necesario continuar las observaciones de laboratorio y de corto plazo e incrementar las de mediano y largo plazo en el campo. Asimismo, es importante generar información sobre los mecanismos de retroalimentación positivos y negativos que afecten la respuesta de las plantas y el suelo bajo diferentes tipos de suelos, y en los suelos con mayor distribución en México.
Existen algunos estudios sobre dinámica del C asociados principalmente a los reservorios de la biomasa aérea realizados en el país, pero poco se conoce sobre la dinámica de acumulación del COS. A pesar de la importancia del almacenamiento de COS que suponen los bosques templados, los suelos que les dan soporte no han sido suficientemente analizados desde una aproximación multifactorial (edad de la superficie, clima, geología, geomorfología y tipos de vegetación) que es como éstos se desarrollan. Esto es relevante ya que la interacción con los factores antes mencionados y aunado al uso y manejo del suelo, tanto actual cómo histórico, han influenciado la dinámica de C en las diferentes fracciones de la MOS. Es imperativo señalar que los suelos bajo los bosques templados mexicanos difieren en diversidad y composición de los bosques templados de latitudes medias, lo que probablemente genera diferentes procesos biogeoquímicos que merecen ser integrados en los modelos regionales y mundiales de los bosques templados para robustecer con datos de sistemas altamente heterogéneos la posible respuesta a escenarios de cambio global.
Las respuestas del COS de Andosoles a la conversión de bosques no presentan una tendencia clara en cuanto a su dirección o magnitud. Los cambios en diversas direcciones sugieren una fuerte dependencia de la respuesta del COS al escenario ambiental y de manejo, debido a una interacción entre la historia de uso y manejo y los factores determinantes de la formación del suelo. El material parental y el clima son los determinantes de las principales características en estos suelos, siendo el primero el determinante en los mecanismos de estabilización del COS a través de las interacciones órgano-minerales, mientras que el clima es el principal conductor de la productividad del sistema. Además de estos dos factores, la posición en el paisaje es también un factor central en la dinámica natural de C y asimismo, se ha sugerido como un controlador de la respuesta del COS al UTCUTS en Andosoles. Sin embargo, es crucial que se analice el impacto de las diferentes trayectorias de uso de suelo y la gran diversidad de suelos sobre la dinámica y almacenamiento de COS en los bosques templados mexicanos. A continuación se delinean algunas consideraciones futuras para entender el COS de los suelos en estos ecosistemas.
Análisis de efectos del cambio de uso del suelo y procesos de estabilización del COS
Además de estudiar los efectos del UTCUTS sobre los almacenes totales es fundamental integrar fracciones que permitan caracterizar almacenes de diferente labilidad y entender la respuesta de los procesos de protección de la MOS al UTCUTS, ya que ésta puede ser diferente para cada una de las fracciones. Es importante identificar las fracciones de MOS más sensibles al cambio de uso, las cuales servirán como indicadoras de corto plazo así como herramientas de verificación y monitoreo de cambios. Entender el cambio en almacenes totales es importante para establecer líneas de base en programas de manejo, sin embargo, es necesario entender simultáneamente la respuesta de los procesos implicados en la protección y dinámica de la MOS para realizar predicciones en términos de magnitud y dirección. Sin embargo, aún no existe evidencia clara de que sea en sentido negativo.
Análisis de efectos en todos los horizontes del suelo
Es importante analizar el efecto sobre el COS en todos los horizontes del suelo y no restringir el estudio a los superficiales o a profundidades sugeridas como las más susceptibles a los efectos del UTCUTS (p. ej.: 0-20 cm, capa arable). Realizar análisis únicamente de horizontes superficiales y no tomar en cuenta la variación ocurrida sobre fracciones menos dinámicas (fracciones bioquímicamente estables) puede llevar a conclusiones sesgadas debido a sobre o subestimaciones de los almacenes de C.
Analizar efectos del manejo y establecer historias de uso
El manejo del suelo modifica sus propiedades químicas, físicas y biológicas, lo cual puede influenciar fuertemente la dinámica de C y ser determinante en sus cambios tanto en magnitud como en dirección (Parfitt et al., 2003; Huygens et al., 2005; Campo, 2006). La falta de tendencias claras en la respuesta del COS al UTCUTS podría encontrar su explicación en los efectos diferenciales asociados al manejo de estos ecosistemas, por lo cual es necesario analizar claramente la historia de uso y manejo del sitio para establecer propuestas y alternativas de manejo.
Análisis regionales y de largo plazo
Sin restar relevancia a la información derivada de estudios locales y de corto plazo o de cronosecuencias, es necesario implementar análisis a escalas regionales, así como establecer estudios de largo plazo que permitan entender la dinámica del C en escalas adecuadas para sustentar el planteamiento de estrategias de manejo de C. Estudios de este tipo permitirían establecer relaciones predictivas, como las planteadas por de Koning et al. (2005), aplicables no sólo a condiciones específicas si no extrapolables a otras regiones. Estudios comparativos con suelos formados a partir de rocas sedimentarias, han mostrado que este tipo de relaciones predictivas son mucho más fuertes en suelos volcánicos (de Koning et al., 2003), lo cual es una ventaja al momento de establecer modelos de distribución espacial o dinámica temporal del CO.
La dinámica del COS depende de diversos factores que operan en distintas escalas espaciales y temporales. El clima, el material parental y la posición en el paisaje interactúan con el uso y manejo actuales e históricos del sistema determinando, la productividad, características edáficas y la dinámica de procesos erosivos y en consecuencia el COS. La mayoría de los estudios que analizan el efecto del UTCUTS se han conducido a escalas locales y bajo esquemas de sustitución de tiempo por espacio (cronosecuencias), dando resultados que en conjunto no apuntan hacia una tendencia clara en la dinámica de los almacenes de C bajo escenarios de UTCUTS. Aunque es evidente la potencialidad de los suelos para la conservación y secuestro de C, aún se desconocen muchos de los mecanismos que regulan la dinámica y almacenamiento de C, tanto bajo condiciones naturales como de UTCUTS.











 nueva página del texto (beta)
nueva página del texto (beta)