Introducción
La agregación es el proceso donde las partículas primarias del suelo interaccionan con las sustancias húmicas y otros cementantes orgánicos, formando agregados. Este es el primer paso en el desarrollo de la estructura del suelo. Los agregados del suelo influyen en la estructura del mismo generando condiciones favorables de estabilidad contra la erosión, reduciendo la perdida de nutrientes, mejorando la fertilidad y la infiltración de agua en suelos con problemas de drenaje, el flujo de aire, la mejora de los procesos de descomposición, formación y secuestro de carbono orgánico en el suelo (COS), además de promover un ambiente idóneo para el desarrollo de los microorganismos del suelo que favorecen a su vez la estructuración del mismo generando agregados más estables a fuerzas endógenas y exógenas (Dexter, 2004).
Los cementantes orgánicos son polisacáridos de origen microbiológico, mucílagos producidos por raíces de plantas y algunas hifas fúngicas que se encuentran libres u ocluidas (Huang, 2004). Los polisacáridos juegan un papel importante como agentes cementantes temporales (Chenu, 2000). Éstos en su mayoría son productos intermedios de la biodegradación y productos residuales del metabolismo microbiano, y actúan estabilizando puntos de contacto entre las partículas elementales del suelo, aunque este efecto no es permanente, por la continua degradación microbiana (Tiessen y Stewart, 1988).
El mucílago de nopal (Opuntia spp.), tiene polisacáridos estructurales como; L-arabinosa, D-galactosa, ácido D-galacturónico, L-ramnosa y D-xilosa (Sáenz, 2002; Sáenz etal., 2004; Medina et al. , 2000; Snyman et al., 2006; Duru y Turker, 2005; Matsuhiro et al., 2006 y Sepúlveda et al., 2007) por lo que se puede utilizar como un aditivo natural para mejorar la agregación del suelo, porque incrementaría la cantidad de cementantes temporales. Además el mucílago de nopal puede cambiar la población microbiana del suelo, y generar mayor producción de enzimas extracelulares. Las cuales pueden quedar unidas a arcillas y materiales húmicos por medio de interacciones iónicas, enlaces covalentes, y puentes de hidrógeno (Bakshi y Varma, 2011). Las enzimas del suelo son fácilmente medibles y responden rápido a las alteraciones físicas, químicas y biológicas, son importantes por ser indicadores de calidad del suelo (Calderón et al., 2000; Drijber et al., 2000; Nannipieri et al., 2002). Imprescindibles en la catalización de varias reacciones importantes, necesarias para los procesos de vida de los microorganismos en el suelo y la estabilización de la estructura del suelo, den descomposición de desechos orgánicos, y el ciclo de nutrientes (Dick et al., 2000). El objetivo del trabajo fue evaluar el efecto de tres dosis de mucílago de nopal (Opuntia spp.) y un testigo sin mucílago, sobre la actividad de las enzimas del ciclo del carbono; amilasa, celulasa, lipasa e invertasa, en dos suelos con textura arenosa y arcillosa, para ver si la textura influye en el efecto del mucilago de nopal en el suelo.
Materiales y métodos
El experimento se realizó, en el laboratorio de Microbiología del Postgrado de Edafología, en las instalaciones del Colegio de Postgraduados, Campus Montecillo. Se utilizaron dos tipos de suelo (arenoso y arcilloso). El suelo arcilloso se colectó en el Campo Experimental Bajío (CEBAJ), del INIFAP, en Celaya, Guanajuato, a los 20° 36' 34" N y 100° 49' 20" O. El suelo arenoso se obtuvo en el Colegio de Postgraduados-Campus Montecillo, a los 19° 22' y 19° 37' N y 98° 54' O. El suelo se secó a temperatura ambiente y se homogenizó con un tamiz del número 10 (apertura de 2 mm de diámetro).
Las pencas de nopal se seleccionaron de una especie criolla con tres meses de edad de una huerta ubicada a 19° 32' 18.7" N y 98° 53' 59.4" O. La extracción del mucílago se realizó con un extractor casero marca Oster. Las pencas se trozaron en tiras de aproximadamente un centímetro de ancho para facilitar la extracción del mucílago.
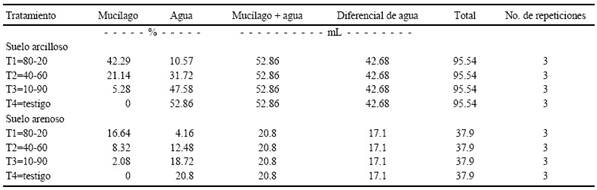
Se utilizó un diseño experimental completamente al azar con tres repeticiones, con los siguientes tratamientos aplicados a cada tipo de suelo; Testigo (solo agua), T10-90 (10% de mucílago-90% de agua), T40-60 (40% de mucílago-60% de agua) y T80-20 (80% de mucílago-20% de agua). Las unidades experimentales fueron cajas magenta de policarbonato y polipropileno (66x99x58 mm) con capacidad para 400 mL, a las que se agregó 200 g de suelo. Se determinaron las constantes de humedad; capacidad de campo (CC) y punto de marchitamiento permanente (PMP), y se obtuvo la humedad aprovechable (CC menos PMP) y las cantidades de mucílago para los tratamientos (Cuadro 1). Las unidades experimentales se colocaron en una cámara de ambiente controlado Marca Sherer, modelo Cel 3714, a una temperatura de 25 °C y humedad relativa de 40% en el Postgrado de Botánica del Colegio de Postgraduados-Campus Montecillo.
Se evaluó la actividad de las enzimas que participan en el ciclo de carbono (Cuadro 2) a los 7, 14 y 21 días después de establecido el experimento. Para la amilasa, se colocaron 10 g de suelo seco en un matraz de 250 mL, se agregaron 2.5 mL de tolueno y se agitó durante 15 min, posteriormente se añadieron 20 mL de amortiguador de fosfatos a un pH de 5.5 y 20 mL de una solución recién preparada de almidón. Después de 24 horas de incubación, se filtró en papel Whatman no. 12, se tomó una alícuota del filtrado y se determinaron azúcares por la técnica de Somogyi-Nelson (Ross, 1966). Para la celulasa el método se basó en la determinación de los azúcares reducidos que resultan después de incubar las muestras con carboximetilcelulosa (CMC) por 24 h a 50 °C (Schinner y von Mersi. 1990). Para la lipasa, la determinación se basa en la medición del producto fluorescente 4-metil-umbeliferona (4-MU) liberado después de incubar las muestras con 4-metil-umbeliferonaheptanoato (4-MUH) como sustrato durante 10 min a 30 °C (Schinner et al., 1991). Y la invertasa se basó en la determinación de los azúcares reductores que resultan después de la incubación de las muestras con sacarosa por 3 h a 50 °C ó 24 h a 37 °C (Schinner y von Mersi, 1990).
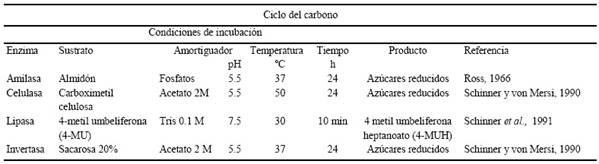
Cuadro 2 Metodologías empleadas en la cinética enzimática de las enzimas participantes en el ciclo del carbono empleando diferentes dosis de mucílago de nopal y aplicadas a los suelos arcilloso y arenoso.
Con los datos obtenidos se realizó un análisis de varianza y la comparación de medidas con DMS (α = 0.05) utilizando el Sistema de Análisis Estadístico SAS, (versión 1998) de acuerdo a Rebolledo (2002).
Resultados y discusión
La actividad enzimática en el suelo arenoso mostró una tendencia mayor en los tratamientos T40-60 y T80-20, en amilasa (Cuadro 3, Figura 1A), celulasa (Cuadro 3, Figura 1B), lipasa (Cuadro 3, Figura 1C) e invertasa (Cuadro 3, Figura 1D). Este comportamiento siguió una tendencia similar en el suelo arcilloso donde el T80-20 tuvo la mayor actividad a los 21 días en las enzimas amilasa (Cuadro 3, Figura 2A), lipasa (Cuadro 3, Figura 2C) e invertasa (Cuadro 3, Figura 2D), y el tratamiento T40-60 presentó la mayor actividad en la enzima celulasa (Cuadro 3, Figura 2B).
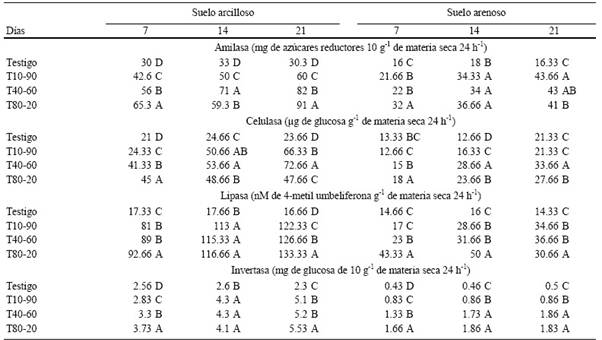
Tratamiento con diferente literal, son estadísticamente significativos DMS (α = 0.05).
Cuadro 3 Actividad de las enzimas amilasa, celulasa, lipasa e invertasa, a los 7, 14 y 21 días después de la aplicación de mucílago de nopal en suelo arenoso y suelo arcilloso. (T = tratamiento, primera cifra = % de mucílago y segunda cifra = % agua).
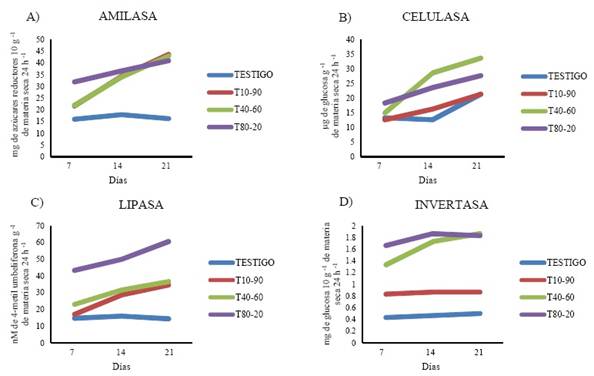
Figura 1 Actividad de las enzimas amilasa (A), celulasa (B), lipasa (C) e invertasa (D) en el suelo arenoso después de la aplicación de las diferentes dosis de mucílago de nopal (T = tratamiento; primera cifra = % de mucílago; segunda cifra = % agua).
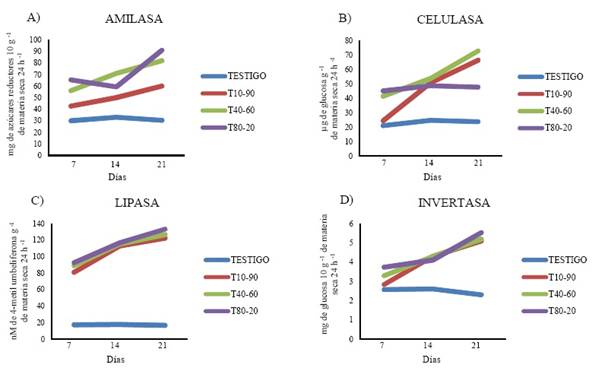
Figura 2 Actividad de las enzimas amilasa (A), celulasa (B), lipasa (C), invertasa (D) en el suelo arcilloso después de la aplicación de las diferentes dosis de mucílago de nopal (T = tratamiento, primera cifra = % de mucílago y segunda cifra = % agua).
Los resultados mostraron que los tratamientos T80-20 y T40-60 tuvieron diferencias significativas (a=0.05) con respecto al testigo sin mucílago de nopal y el tratamiento T10-90, estos resultados pueden ser influenciados por la actividad microbiana ya que al haber mayor cantidad de alimento fácilmente disponible, en este caso los polisacáridos del mucílago, la población de microorganismos puede incrementarse más fácilmente a diferencia del testigo y el tratamiento T10-90 que casi no tiene mucílago. Sin embargo, las enzimas libres pueden persistir de diversas formas en el suelo, se pueden encontrar adsorbidas a minerales, arcillas principalmente, coloides húmicos, además de quedar ocluidas dentro de microagregados, y existe la posibilidad de que las enzimas adsorbidas y atrapadas en el suelo (Quiquampoix et al., 2002; Nannipieri et al., 2003) se estabilicen y persistan durante largos períodos, incluso cuando han sido alejadas de su fuente de producción y no se ven afectadas por los factores que inhiben su actividad, como son la temperatura y el pH (Zimmerman y Ahn, 2011). Gianfreda y Bollag (1996) han concluido que una fracción importante de las enzimas en el suelo está constituida por enzimas unidas a partículas minerales o inmovilizadas naturalmente por la agregación y la materia orgánica del suelo.
La existencia de mecanismos para proteger las enzimas en los suelos (Paulson y Kurtz, 1969; Ramírez-Martínez y McLaren, 1966), muestran que la actividad enzimática del suelo es independiente de la población microbiana. Los componentes arcillosos y complejos orgánicos, se ligan a las proteínas confiriéndoles menor posibilidad de ser degradadas, tanto a causa de microorganismos, como por acción directa de proteinasas (Verma et al. , 1975), lo que se puede ver reflejado en los resultados obtenidos en el suelo arenoso, donde los tratamientos T40-60 y T80-20 tuvieron mayor actividad en las cuatro enzimas analizadas, pero con 50% menos que la actividad enzimática en el suelo arcilloso, donde el porcentaje de arcillas es mayor.
La estabilidad de las enzimas en el suelo, ha sido ampliamente demostrada por varios autores, pero no ha sido comprendida por completo si es debida a la formación de complejos entre enzimas y arcilla, o entre enzimas y polímeros orgánicos (Zimmerman y Ahn, 2011).
Cárdenas et al. (1998) probaron la adición de mucílago de nopal (extraído de pencas hervidas) a la cal (Ca (OH)2) en proporciones diferentes (0.65, 1.0 y 1.95%); la resistencia de las pastas secas fue evaluada por una prueba de penetración-ruptura con un texturómetro, a medida que la cantidad de mucílago de nopal aumentaba se produjo una reducción drástica del estrés máximo y de la tasa de deformación, comparado con un testigo (sin mucílago de nopal); en cambio, la cal control mostró una estructura mecánica más homogénea en la muestra con la dosis más baja de jugo de nopal (0.65%). Esto demuestra que las dosis altas de mucílago de nopal tuvieron mayor influencia, de la misma forma que lo encontrado en este trabajo, donde los tratamientos T80-20 y T40-60, generaron mayor actividad enzimática, en los dos tipos de textura (arenosa y arcillosa).
Hernández et al. (2007), hicieron un estudio sobre la adición de mucílago de nopal liofilizado a morteros usados en la construcción, y observaron que la adición de mucílago liofilizado mejoraba las características mecánicas de la mezcla, con una mejor resistencia a la compresión que el tratamiento de control sin mucílago. Gardiner et al. (1999), investigaron la acción de un extracto de nopal para mejorar la infiltración del agua en el suelo. Los autores compararon poliacrilamidas (PAM) con un extracto de nopal sin diluir y diluido, concluyendo que la aplicación del extracto aumenta la infiltración de agua en el suelo, en una magnitud similar al de las poliacrilamidas. Al ser un polisacárido, el mucílago de nopal puede afectar los agregados del suelo al proveer una fuente de material cementante, que funciona como un agente de unión temporal, mejorando la estructura del suelo y confiriendo protección a las enzimas extracelulares, que a su vez, serían menos propensas a los factores que inhiben su actividad. También es una fuente de alimento para los microorganismos del suelo, con lo que la población microbiana aumentaría más que en el testigo donde no se aplicó mucílago, haciendo que las enzimas extracelulares se fueran incrementando con el paso del tiempo. Por lo que se pueden usar las pencas de nopal que se tiran en las huertas y que generan problemas fitosanitarios. Este trabajo es de los primeros que se hacen para medir la actividad enzimática de la amilasa, celulasa, lipasa e invertasa, que juegan un papel importante en el ciclo del carbono, a pesar de que el periodo de muestreo fue muy corto y no se logró observar descenso de la actividad en los tratamientos con mucílago, y que no se analizó la actividad de los microorganismos para comparar con la actividad enzimática puede ser de suma importancia para realizar un estudio más profundo del uso del mucílago de nopal como mejorador del suelo.
Conclusiones
La aplicación de mucílago de nopal (Opuntia spp.) influyó en un incrementó de la actividad de las enzimas: amilasa, celulasa, lipasa e invertasa, tanto en el suelo arenoso como en el suelo arcilloso. Este incremento fue más notorio en los tratamientos con una dosis de mucílago mayor, por lo que se observa una clara influencia de los polisacáridos que aporta el mucílago de nopal, en el incremento de la actividad enzimática en el suelo, que puede influir en una mayor degradación de la materia orgánica del suelo.











 nova página do texto(beta)
nova página do texto(beta)