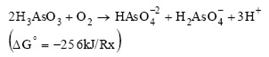Introducción
El arsénico (As) ocupa el lugar 20 en abundancia de los elementos en la corteza terrestre y se distribuye de manera no uniforme por todo el mundo, dependiendo de la región geográfica, características geoquímicas del suelo y actividad industrial (Mandal y Suzuki, 2002; Santini y vanden Hoven, 2004; Heinrich-Salmeron et al., 2011).
Alrededor de un tercio del arsénico presente en la atmósfera proviene de fuentes naturales como reacciones ambientales, actividad biológica, emisiones volcánicas, y el resto proviene de un amplio rango de actividades antropogénicas (Campos et al., 2007; Alam et al., 2014).
El As se clasifica como uno de los elementos químicos más tóxicos y carcinogénicos, representando un serio problema ambiental en varias regiones de México y el mundo (Iliná et al., 2009; Yamamura y Amachi, 2014).
La Comarca Lagunera se localiza en la parte noreste de México y desde 1963 se reportan elevadas concentraciones de arsénico en el suelo, agua y agua subterránea (Rosas et al., 1999).
La toxicidad del arsénico en el agua es eliminada con un proceso oxidativo para la transformación de la forma más tóxica de As (III) a la forma menos tóxica de As (V) (Dastidar y Wang, 2009; Yamamura y Amachi, 2014; Cha et al., 2015). El As puede oxidarse mediante procesos químicos o biológicos. La oxidación química del arsénico es lenta y los compuestos químicos utilizados, tales como cloro, hipoclorito de calcio, permanganato de potasio, pueden derivar en elevados costos, generar una contaminación secundaria y ser ineficientes a bajas concentraciones de arsénico (Santini et al., 2000; Simeonova et al., 2004; Tsai et al., 2009), por lo que se prefiere el proceso biológico.
Desde hace algunos años se han realizado estudios sobre bacterias que presentan la capacidad de oxidar el As (III), buscando comprender el sistema que involucra este paso en el metabolismo de estas bacterias, con el fin de utilizarlas como una tecnología para el tratamiento de agua y suelos contaminados con arsénico. El presente artículo de revisión cubre diferentes aspectos del arsénico, desde su presencia e impacto en el medio ambiente, hasta los distintos mecanismos de trasformación del arsénico en los microorganismos, enfocándose principalmente en la oxidación del arsenito.
Aspectos Generales del Arsénico
El As se encuentra presente en la atmósfera, suelo, rocas, cuerpos de agua, minerales y organismos de formas inorgánica, orgánica y metilada (Tsai et al., 2009; Valenzuela et al., 2009; Basu et al., 2014). La problemática del arsénico es el resultado de su fácil movilización bajo condiciones naturales. Sin embargo, el hombre ha tenido un importante impacto en la generación de formas tóxicas del As a través de la actividad minera, uso de combustibles fósiles, de pesticidas orgánicos, herbicidas y desecantes agrícolas, así como el uso del arsénico como un aditivo de alimentos para ganado y aves de corral (Campos et al., 2007; Garelick et al., 2008; Valenzuela et al., 2009; Shankar et al., 2014).
El arsénico se puede encontrar en diferentes estados de oxidación: arseniato As (V), arsenito As (III), As elemental (0) y arseniuro As (-III) (Tsai et al., 2009); encontrándose más frecuentemente como arsenito o arseniato. El arsenito es 70 veces más tóxico que las especies metiladas y 10 veces más tóxico que el arseniato, el cual es poco soluble en agua y, por tanto, menos biodisponible (Kumaresan y Riyazuddin, 2001; Valenzuela et al., 2009).
Cuando el arsénico se encuentra en formas insolubles, como un mineral en combinación con sulfuro y hierro: oropimente (por ejemplo: trisulfuro de arsénico As2S3) y rejalgar (por ejemplo: Arsenopirita FeAsS), no se considera tóxico. En cambio, cuando se encuentra en formas solubles, como As (III) y As (V), es tóxico para los organismos vivos (Santini et al., 2000).
La presencia de As (V) y As (III) depende de factores físicos, químicos y biológicos, en este último, los microorganismos juegan un papel fundamental, ya que muchas bacterias son capaces de transformar As (III) a As (V) y viceversa, como un mecanismo de defensa de algunas especies bacterianas (Macur et al., 2004; Stolz et al., 2010).
El estado de oxidación del As y su movilidad se controlan fundamentalmente por las condiciones redox (potencial redox Eh) y el pH (Figura 1). En sistemas acuosos, el As se encuentra, en general, como especie disuelta, formando oxianiones.
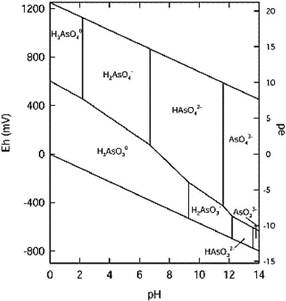
Figura 1 Eh (potencial redox) y pH de las especies acuosas de arsénico en un sistema As-O2-H2O a 25 °C y 1 bar de presión total (Smedley y Kinniburgh, 2002).
El As (III) se encuentra como H3AsO3 y sus correspondientes productos de disociación (H4AsO3+, H2AsO-3, HAsO3-2 y AsO3-3), los cuales, en condiciones oxidantes, son dominantes a pH alcalinos. Sin embargo, la forma sin carga del As (III) [As(OH)3] es dominante en ambientes reducidos y anóxicos, siendo así el más tóxico y difícil de eliminar. Por su parte el As (V) está presente en la forma H3AsO4 y sus correspondientes productos de disociación (H2AsO4-, HAsO4-2 y AsO4-3), siendo dominante bajo condiciones oxidantes a pH ácidos en ambientes acuosos y aeróbicos (Oremland y Stolz, 2003; Campos et al., 2007; Tsai et al., 2009; Bowell et al., 2014) (Figura 2).

Figura 2 Especiación de a) arsenito y b) arseniato en función del pH. Las condiciones redox se han elegido de tal manera que el estado de oxidación indicado domina la especiación en ambos casos (Smedley y Kinniburgh, 2002).
La comprensión del comportamiento geoquímico del arsénico y su movilización es importante para el desarrollo de estrategias que ayuden en la descontaminación de agua y suelo afectados por la contaminación de arsénico (Sarkar et al., 2013).
Toxicidad de las Especies de Arsénico
El arsénico (As) es considerado dentro de las toxinas esenciales porque se requiere en pequeñas cantidades para el crecimiento y el metabolismo, pero es tóxico en altas concentraciones (Krumova et al., 2008). La toxicidad para los humanos de un compuesto con arsénico depende en gran medida de su forma química, diferenciándose dos grupos de compuestos: inorgánicos y orgánicos. Los compuestos inorgánicos del arsénico son los más tóxicos y aparecen, sobre todo, en aguas, donde se encuentran principalmente en forma de pentóxido de arsénico (As2O5) o trióxido de arsénico (As2O3). La toxicidad de estos compuestos depende del estado de oxidación, estado físico, solución o tamaño de las partículas de polvo, la velocidad de absorción en las células, la velocidad de eliminación y la solubilidad en el medio biológico. Además, la exposición a compuestos de arsénico inorgánico se ha asociado a diversos tipos de cánceres como de hígado, pulmones y piel, así como a diabetes (Basu et al., 2014).
Por otra parte, los compuestos orgánicos de arsénico se encuentran frecuentemente en alimentos y suponen la vía principal de exposición de la población al arsénico (Aragonés, 2001; Ferrer, 2003).
La escala de toxicidad de los compuestos de arsénico decrece en el siguiente orden: arsina (H3As) > arsenito (As III) > arseniato (As V) > compuestos arsenicales > arsénico elemental. El arsénico elemental no es común y las arsinas orgánicas solo se encuentran en ambientes muy reducidos (Mandal y Suzuki, 2002; Tsai et al., 2009; Calvaca et al., 2013).
De todos los compuestos de arsénico, el gas arsina se considera la forma más tóxica, seguida del arsenito, arseniatos y los compuestos orgánicos del arsénico. La arsina es un gas incoloro más denso que el aire, el cual se forma al contacto del hidrógeno con el arsénico. El gas ingresa al organismo por vía respiratoria y pasa directo a la circulación, donde actúa enzimáticamente sobre la glucosa-6-fosfato deshidrogenasa de los eritrocitos, oxidando la hemoglobina y formando metahemoglobinuria, reduciendo en forma drástica el contenido de glutación de los glóbulos rojos, lo que la convierte en uno de los agentes hemolíticos más potentes (Bucio, 2004).
El As (III) entra en las células a un pH neutro por acuagliceroporinas (proteínas de transporte de glicerol) en bacterias, levaduras y mamíferos, y su toxicidad reside en su capacidad para unirse a los grupos sulfhidrilo de los residuos de cisteína en las proteínas, lo que las inactiva y lo hace altamente tóxico. También actúa como disruptor endócrino mediante la unión a receptores hormonales e interfiere con la señalización de las células (Santini y vanden Hoven, 2004; Krumova et al., 2008; Tsai et al., 2009).
Por su parte, la toxicidad del As (V) se debe principalmente a que puede sustituir al fosfato, pues posee una estructura análoga y, por consiguiente, puede inhibir la fosforilación oxidativa y entrar a las células a través del sistema de transporte del fosfato (Santini y vanden Hoven, 2004; Tsai et al., 2009; Rosen et al., 2011).
El Arsénico en el Medio Ambiente
El arsénico puede penetrar en el aire, el agua y el suelo a través de tormentas de polvo y aguas de escorrentía, por lo que la contaminación por arsénico está muy extendida debido a su fácil dispersión (Emsley, 2001; Gillispie et al., 2015). Cuando hay mayor presencia geológica natural de arsénico, se pueden encontrar altos niveles en aguas subterráneas (Figura 3), como es el caso de Bangladesh, India, China, Taiwán, Mongolia, Chile, Argentina, México y numerosos lugares de Estados Unidos de Norteamérica (Anawar et al., 2003; Mondal et al., 2006; Campos et al., 2007).
Las principales fuentes de contaminación de arsénico por causa humana son la quema de carbón y la fundición de metales industriales y, más recientemente, la industria de semiconductores y la liberación de minerales ricos en arsénico durante la extracción minera de otros compuestos (Mukhopadhyay et al., 2002).
La contaminación de aguas subterráneas por arsénico es una grave amenaza para la humanidad, ya que el arsénico puede incorporarse fácilmente en la cadena alimenticia y favorecer su distribución de amplia difusión en todo el reino animal y vegetal (Mandal y Suzuki, 2002; Rakib y Bhuiyan, 2014).
Dependiendo de las condiciones físico-químicas del medio ambiente, algunos compuestos de arsénico se pueden solibilizar fácilmente en agua y, de ahí, ser tomados por los microorganismos, dando lugar a altos niveles de biodisponibilidad (Tsai et al., 2009).
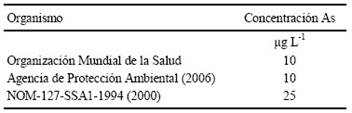
Debido a su toxicidad, la Organización Mundial de la Salud (OMS) considera perjudicial para el ser humano el consumo de agua con una concentración de arsénico superior a 10 mg L-1. Este metaloide también ocupa el primer lugar en la lista de productos contaminantes de agua de la Agencia de Protección Ambiental (EPA), por lo que en 2006 se redujo en Estados Unidos la concentración de arsénico en agua potable de 50 mg L-1 a 10 mg L-1 (WHO, 2003; EPA, 2006).
En México es en la Norma Oficial Mexicana 127 (NOM-127-SSA1-1994) donde se establecen los límites permisibles de calidad del agua para uso y consumo humano que deben cumplir los sistemas de abastecimiento públicos y privados, siendo 25 mg L-1 la concentración límite de arsénico en el agua potable según Norma Mexicana modificada en 2000 (NOM- 127-SSA1-1994) (Cuadro 1). Por otra parte, en la Norma Oficial Mexicana 147 (NOM-147-SEMARNAT/S SA1 -2004) se establece la concentración límite de arsénico para suelo de uso agrícola/residencial/comercial, siendo ésta de 22 mg kg-1.
La Problemática del Arsénico en la Comarca Lagunera
México posee una compleja geología, con rocas ígneas, sedimentarias y un ambiente tectónico activo, factores que predisponen a la contaminación del medio ambiente natural de las aguas subterráneas, siendo el arsénico una de las principales causas de efectos adversos en la salud por la ingestión de aguas subterráneas contaminadas con este metaloide (Armienta y Segovia, 2008; Jasso-Pineda et al., 2015).
La problemática de contaminación por arsénico se localiza principalmente en los estados de Chihuahua, Coahuila, Durango, Hidalgo, Nuevo León, Puebla, Sonora y San Luis Potosí. El área afectada es de aproximadamente 3200 km2, siendo la Comarca Lagunera, en los estados de Coahuila y Durango, la región donde se reportan las mayores concentraciones. La primera intoxicación crónica por arsénico en esta región se reportó en 1958, y desde entonces se habla de casos por contaminación endémica (Cebrián et al., 1994; Del Razo et al., 1994; Ramírez, 2008; Rosas-Castor et al., 2014).
La Comarca Lagunera es una de las áreas más importantes de la agricultura y ganadería; además, es la principal cuenca lechera en el país. Por lo tanto, la explotación del agua subterránea es un componente importante de su crecimiento económico. Sin embargo, esto ha causado una continua elevación de la concentración de arsénico en el agua del subsuelo, la cual se utiliza para consumo animal, humano y riego agrícola. A su vez, el uso de esta agua para riego puede producir altos niveles de arsénico en el pasto y contribuir a que aumenten los niveles de arsénico en el ganado y sus productos derivados (Rosas et al., 1999; Armienta y Segovia, 2008; Ramírez, 2008).
En esta región existe el problema de hidroarsenicismo crónico regional endémico (HACRE) que es una enfermedad causada por el consumo de agua contaminada con arsénico. El arsénico se acumula en el organismo, en la orina, piel, uñas de los dedos y cabello por exposición crónica, y a ciertas concentraciones ocasiona afecciones severas (Iliná et al., 2009; Basu et al., 2014).
Las altas concentraciones de As en la Comarca Lagunera se deben principalmente a las características geológicas del área. La movilización del As, así como su presencia en el agua subterránea, son producto de las reacciones de disolución de óxidos de Fe y desorción debido a los valores altos de pH (Mejía-González et al., 2014).
Una investigación fue realizada por Rosas et al. (1999) en las explotaciones lecheras de la zona para determinar la distribución de arsénico en el ambiente agrícola. El contenido de arsénico en pozos agrícolas varió de 7 a 740 mg L-1 (Cuadro 2). En el suelo, las concentraciones de arsénico llegaron a 30 mg g-1 y éste se encontró retenido principalmente en las fracciones del limo y arcilla. El suelo de la Comarca Lagunera está constituido principalmente por arcilla con bajo contenido de materia orgánica y un pH alcalino (> 8). El arsénico en los suelos normalmente se limita a la fracción de arcilla que contiene aluminio amorfo y oxihidróxidos de hierro.
Procesos de Remoción de Arsénico
Los residuos generados de las actividades antropogénicas que involucran el uso del arsénico han ocasionado la contaminación de numerosos sitios, por lo que es importante tomar medidas para la eliminación de este elemento de aguas y suelo con presencia de arsénico.
Existen diversos tratamientos para la remoción de arsénico del agua, los cuales se basan en métodos químicos; generalmente se realiza un paso previo de oxidación que transforma el As (III) a As (V), ya que el As (III) tiene una carga eléctrica neutra a pH de 4 a 10 mientras que el As (V) presenta una carga eléctrica negativa que hace más eficiente su remoción. Posteriormente, el As se remueve del agua por técnicas convencionales, basadas en fenómenos de interacciones físico-químicas a nivel superficial en las que se incluyen: precipitación-coprecipitación, coagulación y filtración, ósmosis inversa, adsorción, intercambio iónico y sedimentación (Katsoyiannis et al., 2004; Vaclavikova et al., 2008). Para la elección de uno de estos tratamientos se debe tener en cuenta su eficiencia, costos, tamaño de población a la que sirve, condiciones de mercado, entre otros (Simeonova et al., 2004; Dastidar y Wang, 2009; Kim et al., 2010; Carro y Francisca, 2013; Basu et al., 2014).
El paso de oxidación de As (III) se lleva a cabo generalmente utilizando oxígeno, ozono, hipoclorito, cloro, permanganato, peróxido de hidrógeno y radiación UV; sin embargo, estos procesos químicos pueden dar lugar a la formación de subproductos perjudiciales o difíciles de eliminar del agua. Por lo tanto, esta etapa se puede sustituir por una oxidación biológica mediante la utilización de microorganismos debido a la alta resistencia y tolerancia que tienen hacia las formas inorgánicas del arsénico y a la capacidad que pueden presentar para transformarlo (Wang y Zhao, 2009). Así, la oxidación microbiana representa una estrategia alternativa que puede ayudar en la preservación del medio ambiente por la eliminación de contaminación secundaria (Ahmed, 2001; Ghurye y Clifford, 2001; Simeonova et al., 2004; Dastidar y Wang, 2009; Ito et al., 2012; Bahar et al., 2013; Huang, 2014).
Diversos estudios que involucran el tratamiento biológico de agua contaminada con arsénico se han realizado en los últimos años con el fin de optimizar el inóculo, el diseño del biorreactor así como de los parámetros cinéticos y fisicoquímicos para obtener mayores eficiencias de remoción.
Mondal et al. (2008) utilizaron un reactor de biocolumna, la cual contenía a la bacteria Ralstonia eutropha MTCC 2487 inmovilizada en carbón activado granular. Esta bacteria pertenece al grupo de las bacterias reductoras de As (V), por lo que el mecanismo de dicho reactor consistió en acumular el As (III) producido en el tratamiento de agua residual que contenía concentraciones proporcionales tanto de As (V) como de As (III). Después de tres días de operación, 99% del arsénico fue removido del agua por bio-adsorción. A pesar de la excelente eficiencia demostrada por este sistema, los autores resaltan ciertos problemas importantes que surgen al tratar de emplear esta estrategia. El primero involucra la regeneración de la columna con una solución de lavado, y el segundo, la disposición de dicha solución que ahora se encontrará saturada con arsénico.
Como ya se ha indicado, la oxidación de As (III) es preferida, ya que el producto As (V) es más fácil de remover, por lo tanto la búsqueda y el empleo de microorganismos capaces de oxidar As (III) se ha vuelto fundamental a la hora de implementar sistemas de tratamiento de aguas. Así, Le et al. (2012) aislaron y caracterizaron un consorcio quimiolitoautótrofo de bacterias con capacidad de oxidar As (III), el cual enriquecieron con el propósito de emplearlo en un futuro como inóculo para un biorreactor.
La bacteria Rhodococcus equi, aislada de agua contaminada con arsénico, fue inmovilizada en una cama de celulosa para el tratamiento tanto de agua sintética como de agua naturalmente contaminada en un reactor escala laboratorio. Utilizando diversas concentraciones de arsénico (en la forma As2O3) que variaron entre las 50 a 100 ppb, se obtuvo una eficiencia máxima de 95% de remoción de arsénico (Bag et al., 2010). En otro estudio a escala laboratorio, se probó la eficiencia de gránulos de porcelana cubiertos con Azetobacter y cemento (Gauri et al. , 2011). En este caso, se comparó la eficiencia de remoción de arsénico en reactores tipo batch entre lo gránulos que contenían tanto la bacteria como el cemento con aquellos que solo contenían la bacteria. Los resultados de los investigadores demostraron que se obtenía un mayor rendimiento de remoción (96%) con los gránulos que contenían cemento en lugar de utilizar solo biomasa (65%). En este caso, el cemento actuó como un agente adsorbente.
En 2012, Dastidar y Wang reportaron el uso de Thiomonas arsenivorans str. b6 en un biorreactor de lecho empacado. Se mantuvo un influente de As (III) de 500-4000 mg L-1, y un tiempo de residencia hidráulica (TRH) de 0.2-1 día durante 137 días. Posterior a este tiempo se obtuvo una eficiencia de oxidación de arsenito de 48.2 a 99.3%. En ese mismo año, Ito et al., aislaron bacterias de la especie Ensifer adhaerens, las cuales fueron utilizadas para tratar agua residual sintética. En este caso se obtuvo una eficiencia máxima de oxidación de As de 92%, manteniendo un influente de 1 mg L-1 de As (III) con un tiempo de retención de 1 h.
Estudios a escala piloto también se han realizado. Michon et al. (2010) utilizaron un consorcio bacteriano CAs01 aislado de una mina de oro como inóculo de un reactor piloto de dos camas biológicas, el cual trató agua sintética, obteniendo una eficiencia de oxidación de más de 90%. Los autores sugirieron que la remoción total de arsénico podía lograrse por medio de un soporte sólido como hidróxido de hierro o hierro elemental con arena y, por consecuencia, en un estudio posterior, investigaron tanto la oxidación de As (III) así como la remoción de éste y As (V) en dos reactores diferentes, utilizando la bacteria Thiomonas arsenivorans como inóculo (Wan et al. , 2010). En ambos reactores se añadió una cama de arena; sin embargo, a uno de ellos se le agregó hierro elemental y al otro no. El funcionamiento de los dos reactores se monitoreó por 33 días, encontrándose que la adición de hierro favoreció la remoción química de As (III), así como de As (V), teniendo una influencia sobre la actividad y diversidad de la bacteria.
La búsqueda y la optimización de sistemas para el tratamiento de agua y suelos contaminados que engloben tanto tratamientos biológicos como fisicoquímicos aún continúan, pero se espera que en un futuro puedan implementarse a gran escala.
Mecanismos de Transformación de Arsénico por Bacterias
Las bacterias poseen una gran diversidad metabólica, debido a su capacidad de obtener energía empleando diferentes reacciones de óxido-reducción; por lo tanto, un número importante de microorganismos son capaces de utilizar arsénico, ya sea en su forma oxidada de arseniato o en la forma reducida de arsenito, para su metabolismo (Cuadro 3). Las bacterias pueden superar los efectos tóxicos del arsénico por medio de un decremento en las concentraciones de sus iones o modificándolo químicamente a especies relativamente menos tóxicas (Anderson et al., 1992; Mukhopadhyay et al., 2002; Mandal et al., 2007).
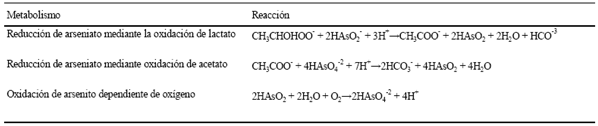
Cuadro 3 Reacciones que catalizan microorganismos que metabolizan arsénico (As) (Stolz y Oremland, 1999).
En la naturaleza, existen diversas especies de microorganismos que responden al arsénico a través de diferentes mecanismos; éstos incluyen reacciones de óxido-reducción mediadas por enzimas, metilación, quelación, exclusión e inmovilización. Es por esto que comprender el nivel molecular y genético del metabolismo del arsénico será una base de conocimientos importante para el desarrollo de enfoques eficientes en la biorremediación de arsénico, lo que representará una forma amigable con el ambiente para la eliminación de metales pesados (Krumova et al., 2008; Tsai et al., 2009; Slyemi y Bonnefoy, 2012).
Los microorganismos que transforman el As (V) y As (III) son diversos en su filogenia y fisiología (Cavalca et al., 2013). Para la transformación del arsénico existen tres principales sistemas enzimáticos: arsenito oxidasa, arseniato reductasa y arseniato reductasa citoplasmática (Figura 4). Un gran número de bacterias Gram negativas y Gram positivas emplean un mecanismo común de resistencia a arsénico basado en el operón ars RDABC que codifica cinco genes, el cual corresponde al sistema de desintoxicación de arsénico más estudiado e implicado en la reducción del arseniato a arsenito mediante la enzima arseniato reductasa que expulsa el arsenito fuera de la célula usando una bomba de expulsión de arsénico (Croal et al., 2004; Silver y Phung, 2005; Tsai et al., 2009; Kruger et al., 2013).
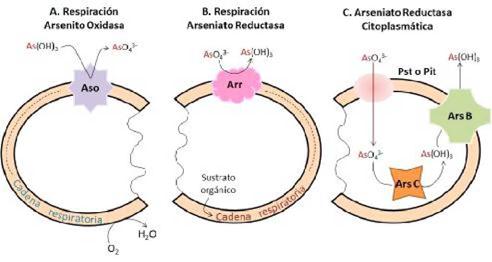
Figura 4 Ubicación y funciones de los sistemas respiratorios arsenito oxidasa y arseniato reductasa, así como del sistema arseniato reductasa citoplasmática (Silver y Phung, 2005).
En este ámbito, Ghosh et al. (2015) concluyeron que un ciclo de oxidación-reducción entre As (III) y As (V) es necesario para garantizar la supervivencia de las bacterias que habitan nichos contaminados por arsénico. En su estudio, probaron la resistencia de 6 cepas bacterianas aisladas de la rizósfera de la planta hiperacumuladora Pteris vittata al arsenito o arseniato y la relación que existe entre ésta, el transporte de fósforo y la producción de sideróforos. Aunque la mayoría de las cepas aisladas reducían As (V), la existencia de bacterias capaces de oxidar As (III) eran necesarias para establecer un equilibrio entre las concentraciones de ambas especies de arsénico y, de esta forma, evitar la acumulación de arsénico dentro de la célula.
Por lo tanto, es preciso reconocer que debe existir una cooperación entre los diferentes sistemas y mecanismos para transformar el arsénico que se encuentra en los microorganismos con el fin de aprovechar dicha relación para optimizar las técnicas de biorremediación, sobre todo aquellas que se aplican in situ.
La Enzima Arsenito Oxidasa
Green (1918) describió por primera vez la oxidación del arsenito por bacterias en Bacillus arsenoxydans; y a la fecha se han reportado un gran número de bacterias oxidantes de arsenito, las cuales en su mayoría se tratan de organismos heterótrofos. Algunas procariotas heterótrofas pueden oxidar el As (III) a As (V) bajo condiciones aerobias o anaerobias. Entre este grupo se encuentran miembros de la clase b-Proteobacteria (Muller et al., 2003) y especies de los géneros Alcaligenes (Anderson et al., 1992), Thermus (Gihring et al., 2001), Hydrogenophaga (van den Hoven y Santini, 2004), Arthrobacter (Prasad et al., 2009), Ralstonia (Lieutaud et al., 2010) y Pseudomonas (Rehman et al., 2010). Algunas bacterias quimiolitoautótrofas también pueden utilizar el As (III) como un donador de electrones y obtener energía de la oxidación de éste, las cuales incluyen microorganismos de las clases a-g-Proteobacterias, y de los géneros Rhizobium/Agrobacterium (Santini et al., 2000) y Thiomona (Battaglia-Brunet et al., 2002).
La oxidación de arsenito por microorganismos con metabolismo quimiolitoautótrofo es usualmente preferida a la de los microorganismos con metabolismo heterótrofo, ya que tienen requisitos nutricionales más bajos y poseen un potencial menor para la producción de metabolitos orgánicos nocivos. Sin embargo, existen pocos estudios sobre bacterias con metabolismo quimiolitoautótrofo capaces de oxidar arsenito (Santini et al., 2000; Dastidar y Wang, 2009; Bahar et al., 2013; Rangel- Montoya y Balagurusamy, 2015). Ilialetdinov y Abdrashitova (1981) reportaron la primera bacteria quimiolitoautotrófica con capacidad de oxidar el arsenito de un cultivo de Pseudomonas arsenitoxidans, sin embargo este microorganismo se ha perdido.
En las bacterias heterótrofas, la oxidación se considera más un mecanismo de desintoxicación que uno que pueda apoyar en el crecimiento de la bacteria (Ecuación 1), aun cuando la oxidación de arsenito a arseniato de acuerdo con la siguiente reacción es exergónica (Santini et al., 2000).
La secuencia de la reacción anterior se completa cuando los electrones o equivalentes reductores generados en el curso de la reacción pasan a un aceptor de electrones fisiológico, el cual puede ser un tipo de citocromo c o azurina (Ellis et al., 2001; Heath et al., 2012).
La oxidación del arsenito permite a los microorganismos tolerar niveles más altos de arsénico y, aunque el arsenito también puede metilarse, éste primero se oxida directamente a arseniato, el cual es menos tóxico, antes de la metilación. Anteriormente, se había pensado que este último mecanismo era utilizado como un paso de desintoxicación, pero estudios recientes sugieren que no todos los productos metilados de arsénico son menos tóxicos que el arseniato (Anderson et al.,1992; Mukhopadhyay et al., 2002; Tsai et al., 2009; Slyemi y Bonnefoy, 2012).
Por otro lado, la oxidación microbiana del arsenito es un eslabón crítico en el ciclo biogeoquímico del arsénico, ya que la conversión de arsenito a especies menos móviles y tóxicas afecta la movilidad y distribución de las especies de arsénico. Además, este proceso favorece la colonización de otras especies bacterianas no tolerantes a arsénico, importantes en los demás ciclos biogeoquímicos. (Campos et al., 2007; Mandal et al., 2007; Huang, 2014).
El mecanismo de oxidación del arsenito involucra a los genes aio A y aio B que codifican para la subunidad grande catalítica molibdopterina y la subunidad pequeña tipo Rieske de la enzima arsenito oxidasa AioAB (van Lis et al., 2012). Anteriormente, estos genes se denominaban de diferente manera en organismos: aox, en aquellos identificados en un cultivo de la b-proteobacteria ULPAs 1; aro o aso, en la cepa NT-26, una bacteria quimiolitoautótrofa que oxida As (III), y en A. faecalis (Weeger et al., 1999; Santini et al., 2000). Sin embargo, el uso de diferentes denominaciones causaba confusiones, especialmente para anotaciones del genoma y también porque cada nombre generaba un conflicto con otras nomenclaturas. Por lo tanto, para tener más coherencia en la designación de los genes involucrados en la oxidación del arsenito, Lett et al. (2012) propusieron esta nueva nomenclatura unificando así los nombres de los genes involucrados en la oxidación aeróbica procariota del arsenito.
La enzima arsenito oxidasa consiste en dos subunidades heterólogas (a1b1), las cuales están asociadas íntimamente, y juntas presentan una masa molecular aproximadamente de 100 kDa. La subunidad grande catalítica (825 residuos) tiene un centro de molibdeno y un cluster [3Fe-4S] y un peso aproximado de 85 kDa; por su parte, la subunidad pequeña (133 residuos) contiene un cluster tipo Rieske [2Fe-2S] y una masa molecular aproximada de 14 kDa (Figura 5 y 6). Esta enzima es miembro de la familia dimetil sulfóxido (DMSO) reductasas de las enzimas que contienen molibdeno. Aunque la subunidad grande de la arsenito oxidasa tiene relativamente poca homología de secuencia en comparación con los otros cinco miembros de la DMSO reductasas para las que se han determinado estructuras, la topología general es similar tanto respecto de la división en cuatro dominios como para el pliegue de los dominios individuales. La diferencia más significativa entre la arsenito oxidasa y las otras enzimas es la ausencia de cualquier enlace covalente entre la proteína y el átomo de molibdeno (Anderson et al., 1992; Ellis et al., 2001; Santini y vanden Hoven, 2004; Heinrich-Salmeron et al., 2011). Esta enzima se encuentra generalmente unida a la superficie externa de la membrana interna, como se ha observado en Alcaligenes faecalis (Anderson et al., 1992), Herminiimonas arsenicoxydans str. ULPAs1 (Muller et al., 2006), Thiomonas sp. str. 3As (Duquesne et al., 2008), y Artrhobacter sp. (Prassad et al., 2009); o puede estar presente en el espacio periplasmático como en Rhizobium sp. str. NT-26 (Santini et al., 2000) e Hydrogenophaga sp. str. NT-14 (vanden Hoven y Santini, 2004). La arsenito oxidasa se expresa en la fase estacionaria de los microorganismos; sin embargo, cuando el medio es enriquecido con extracto de levadura, la enzima aparece al final de la fase exponencial (Philips y Taylor, 1976).
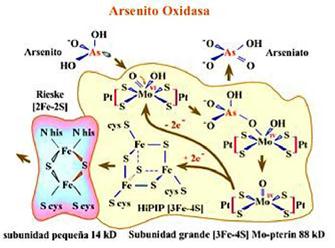
Figura 5 Modelo de la Arsenito Oxidasa, con el sitio activo en forma de embudo representado en la parte superior, el cofactor Mo-pterin, y aminoácidos que la enlazan (Mukhopadhyay et al., 2002).
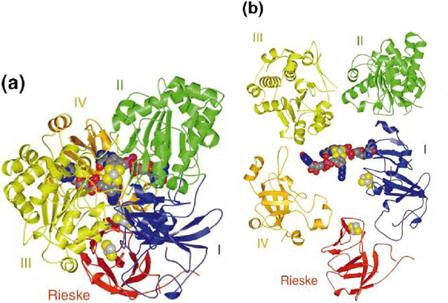
Figura 6 Diagrama de la arsenito oxidasa. (a) Dominios I-IV de la subunidad grande están representados en azul, verde, amarillo y naranja, respectivamente. (b) Vista ordenada de la arsenito oxidasa que muestra los dominios individuales (Ellis et al., 2001). La subunidad Rieske está representada en rojo. También se muestran el cofactor molibdeno y los cluster [3Fe-4S] y [2Fe-2S].
Anderson et al. (1992) purificaron y caracterizaron la arsenito oxidasa (Cuadro 4) de Alcaligenes faecalis, reportando una actividad enzimática específica de 0.023 mmol min-1 mg-1 en el extracto crudo y de hasta 2.88 mmol min-1 mg-1 en la enzima purificada, observando la mayor actividad enzimática a pH 6.
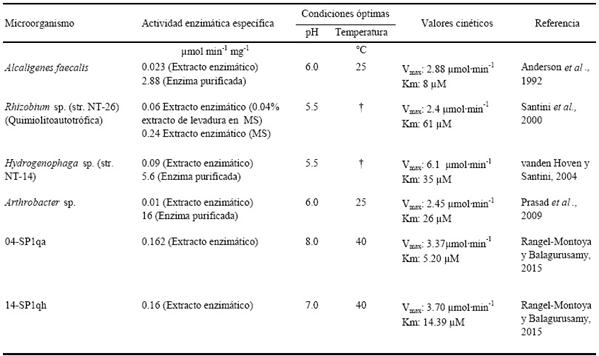
†No reportaron temperatura óptima.
Cuadro 4. Actividades específicas reportadas de arsenito oxidasa.
Santini et al. (2000) reportaron la actividad enzimática de una cepa quimiolitoautótrofa NT-26 identificada después como una especie de Agrobacterium/Rhizobium. Al cultivarse esta cepa con 0.04% de extracto de levadura, al igual que Anderson et al. (1992), se alcanzó una actividad específica enzimática de 0.06 mmol min-1 mg-1 en el extracto crudo, la cual fue tres veces mayor que la obtenida en el extracto de A. faecalis, y 10 veces mayor cuando la cepa se creció en medio mínimo de arsenito sin extracto de levadura alcanzando una actividad enzimática específica de 0.24 mmol min-1 mg-1 de proteína en el extracto celular.
Por su parte, Prasad et al. (2009) llevaron a cabo la purificación de esta enzima de Arthrobacter sp. y reportaron una actividad en el extracto crudo de 0.01 mmol min-1 mg-1 y de hasta 16 mmol min-1 mg-1 en la enzima purificada, exhibiendo la máxima actividad a pH 6 y a una temperatura de 25 °C.
En 2010, Lieutaud et al. caracterizaron la enzima arsenito oxidasa de Ralstonia sp. str. 22. aislada de muestras de suelo de la mina Salsigne al sur de Francia. Mediante un análisis filogenético encontraron que el grupo de genes que codifican para la arsenito oxidasa fue resultado de una transferencia horizontal de genes de una especie relacionada estrechamente con Achromobacter sp. str. SY8. Además, reportaron como inhibidores de la arsenito oxidasa sustratos de sulfito y sulfuro, con lo que resaltan la relación del metabolismo del arsénico y el azufre. Recientemente, Rangel-Montoya y Balagurusamy (2015) aislaron 25 cepas bacterianas oxidantes de arsenito de suelos contaminados con arsénico de la Comarca Lagunera con el fin de caracterizar sus parámetros cinéticos y evaluar su potencial como agentes para la remediación de suelos contaminados en esta región. Las temperaturas óptimas reportadas por los autores llegaron a los 40 °C, demostrando que la enzima arsenito oxidasa de estas cepas está adaptada al clima árido de la Comarca Lagunera.
Mecanismo de Reacción y Regulación de la Arsenito Oxidasa
El arsenito, al encontrarse en una forma sin carga, entra a la célula mediante el transportador de acuaporina (Huang, 2014). Posteriormente, la arsenito oxidasa cataliza la oxidación de arsenito de acuerdo con el siguiente mecanismo: el acceso al centro de molibdeno es proporcionado por un canal hidrofílico; cerca de la base de dicho canal está un conjunto de residuos de aminoácidos, que incluyen His195, Glu203, Arg419, y His423, los cuales representan el sitio de unión de la enzima con el sustrato. La forma oxidada del centro de molibdeno posee un grupo terminal Mo=O; el sitio de unión del arsenito, que se transporta por acuagliceroporinas. Los residuos indicados posicionan al par de electrones del arsénico adecuadamente para el ataque nucleofílico sobre el grupo Mo=O del centro de molibdeno oxidado. Esta reacción produce molibdeno reducido mediante la unión coordinada del producto (arseniato) con el metal (Figura 7). La reacción reductora del ciclo catalítico se completa por la disociación de los productos de la esfera de coordinación de molibdeno para generar la enzima reducida en la estructura cristalina. Finalmente, el ciclo catalítico se completa con la reacción oxidativa, que implica la reoxidación, con la adición y la desprotonación de agua para regenerar el grupo oxo (Mo=O), que devuelve la enzima al estado oxidado (Ellis et al., 2001; Dastidar y Wang, 2009).
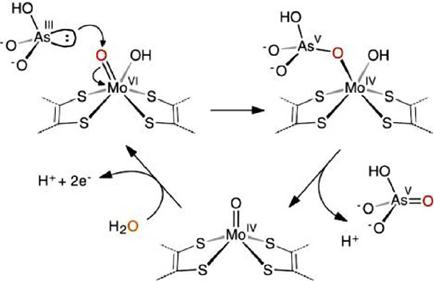
Figura 7 Representación esquemática del mecanismo de reacción de la oxidación de arsenito por la enzima arsenito oxidasa. El átomo de oxígeno que es transferido desde el agua al arsenito durante el ciclo catalítico es resaltado con rojo (Ellis et al., 2001).
La regulación de los genes que codifican para este enzima también ha sido investigada. Un estudio realizado por Slyemi et al. (2013) sobre la organización y regulación del operón de la arsenito oxidasa en Thiomonas arsenitoxydans reveló la presencia de un cluster de genes diferente al cluster de aio AB que codifica las subunidades de AioAB. Este segundo cluster está compuesto por dos genes que codifican un citocromo c y un metalorregulador perteneciente a la familia ArsR/SmtB. Estos genes se co-transcribren con aio AB, por lo que sugieren que el citocromo c está involucrado en la oxidación del arsenito y que este operón se encuentra regulado por el metalorregulador. Un estudio posterior por el mismo grupo reveló la presencia de otro metalorregulador adicional dentro del misma familia ArsR/SmtB, AioF, que solo se encuentra en T. arsenitoxydans, lo que parece indicar que la regulación del operón de la arsenito oxidasa difiere entre las bacterias que lo contienen (Moinier et al. , 2014).
Pseudomonas xanthomarina str. S11 (Koechler et al., 2015), aislada de una mina de oro antigua contaminada con arsénico en Salsigne, Francia, presentó una alta capacidad para oxidar arsenito a arseniato en presencia de hasta 42.72 mM de arsenito. Además, Koechler et al. (2015) realizaron estudios sobre la expresión de la arsenito oxidasa encontrando la presencia de tres clusters ars. Uno de éstos se encuentra en un plásmido organizado como una isla de arsénico el cual contiene el operón aio AB y los genes involucrados en el metabolismo del fósforo. Esta "isla de arsénico" se encuentra conservada en un gran número de bacterias con capacidad de oxidar arsénico y se sugiere que su evolución y presencia en distintos grupos de bacterias es resultado tanto de transferencia vertical como horizontal (Li et al. , 2013). Además, los autores sugieren que la presencia en la isla de los genes pho, pst y phn, involucrados en el metabolismo de fosfato en condiciones de estrés, puede estar relacionada con el transporte y utilización de este elemento para funciones vitales, aun en presencia de grandes concentraciones de arsénico.
El genoma de Rhizobium sp. NT-26, una bacteria autótrofa aislada de una mina de oro en Australia (Santini et al. , 2000), sugirió que la expresión de los genes de la "isla de arsénico", localizada en un mega plásmido, está relacionada con la expresión de genes relacionados con la movilidad flagelar o formación de bio-películas, que se encuentran codificados en el cromosoma (Andres et al., 2013). De esta manera, el metabolismo del arsénico parece ejercer una influencia en la exploración y colonización de nuevos nichos por parte de este microorganismo.
Aunque la capacidad de transformar arsénico se ha demostrado en un gran número de microorganismos, no cabe duda que aún se requieren estudios que ayuden a comprender la regulación y producción de las enzimas involucradas en este proceso con el fin de optimizar nuevos métodos que pueden aplicarse al tratamiento de aguas y suelos contaminados por arsénico. Estudios que involucran la modificación genética y el hallazgo de microorganismos capaces de transformar arsénico bajo condiciones extremas han aparecido en años recientes con el objetivo de optimizar la actividad de los organismos capaces de transformar arsénico para su aplicación en la remediación de agua y suelos contaminados de una manera más eficiente y ecológica (Kostal et al., 2004; Ferrer et al., 2005; Liu et al., 2011; Chen et al., 2013; Osborne et al., 2013; Dangayach et al., 2014; Rahman et al., 2014).
Conclusiones
La presencia de grandes concentraciones de arsénico en el medio ambiente es un problema en el ámbito mundial que tiene un impacto negativo en la salud humana y se incrementa más cada día debido a diferentes actividades antropogénicas. Es por esto que el estudio de microorganismos que exhiben la capacidad de transformar el arsénico, y en particular oxidar arsenito, es de particular interés para la descontaminación de suelos y aguas residuales y subterráneas con presencia de arsénico. La comprensión de las vías metabólicas involucradas en la transformación del arsénico molecular y genético representa un paso importante hacia el desarrollo de nuevos mecanismos y tecnologías de biorremediación que ayuden a la preservación del medio ambiente a través del empleo de microorganismos para la oxidación biológica del arsenito ya que ésta no conduce a una contaminación secundaria.











 nueva página del texto (beta)
nueva página del texto (beta)