Introducción
El cambio de uso de suelo es uno de los principales factores de la degradación de los ecosistemas naturales, su impacto ha sido reportado a nivel global (MEA, 2005). Esta degradación reduce la productividad actual e inclusive puede afectar a la producción potencial de los ecosistemas, debido principalmente a que disminuye la disponibilidad del agua y nutrientes del suelo (Dregne, 1983; UNCCD, 1994). A pesar de que los procesos relacionados con la disponibilidad del agua y los nutrientes se afectan a nivel de parcela, la suma de estos efectos en diferentes parcelas repercute a escalas de paisaje y regionales (Peters y Havstad, 2006).
Las zonas áridas y semiáridas a nivel mundial son muy extensas y se caracterizan por tener una baja disponibilidad de recursos, lo cual ha restringido las actividades agrícolas, por lo que su principal uso han sido las actividades ganaderas (Asner et al., 2004). Dicho pastoreo puede actuar como fuerza selectiva en las comunidades vegetales, modificando su diversidad funcional y la dinámica de los recursos (Díaz et al., 2007). Dado que esta actividad se ha desarrollado de manera extensiva por siglos en el Desierto Sonorense esto ha afectado la productividad y funcionamiento de los ecosistemas (Bryant et al., 1990; Camou, 1990 y 1998; Castellanos et al., 2010).
En las zonas áridas es conocida la importancia de las especies arbóreas como formadoras de islas de fertilidad, en particular las de la familia de las leguminosas (García-Moya y McKell, 1970; Perroni-Ventura et al., 2010) y de recursos (Reynolds et al., 1999) o sirviendo como plantas nodrizas para otras especies vegetales (McAuliffe, 1984; Valiente-Banuet y Ezcurra, 1991; Suzán et al., 1996). Por ejemplo, bajo el dosel de estas especies se ha encontrado que se reducen las condiciones climáticas extremas características de los ecosistemas desérticos, así como se incrementa la concentración de los nutrientes del suelo, principalmente el nitrógeno (García-Moya y McKell, 1970; Schlesinger et al., 1996; Vitousek et al., 1997; Whitford, 2002; Stubbs y Pyke, 2005; Celaya y Castellanos, 2011). En cambio, las condiciones microclimáticas y la disponibilidad de nutrientes parecen ser menos benignas en las áreas sin vegetación (interespacios), las cuales son comunes en este tipo de ecosistemas (Baldocchi y Kiang, 2004; Celaya y Castellanos, 2011).
La introducción directa (por desmontes y siembra) e indirecta (por invasión) de especies de rápido crecimiento se ha incrementado en algunas regiones áridas y semiáridas de Norteamérica (Asner et al., 2004). Especies de rápido crecimiento como algunos pastos exóticos (Williams y Baruch, 2000), modifican el funcionamiento del ecosistema, a través de cambios en la productividad, la entrada de materia orgánica, o cambios en los reservorios de recursos como agua y nutrientes (Ehrenfeld et al., 2005).
A pesar de que la disponibilidad del agua es el principal controlador del funcionamiento de los ecosistemas áridos (Noy-Meir, 1973), existen pocos trabajos que han estudiado aspectos ecohidrológicos y en particular de su dinámica en el perfil del suelo (Loik et al., 2004; Wilcox y Thurow, 2006) de manera comparativa, para tratar de entender los cambios debidos a la transformación de los matorrales a sabanas. En algunos casos de modificaciones de matorrales a pastizales o de pastizales nativos a exóticos en zonas áridas de Norteamérica, como la invasión del pasto africano Eragrostis lehmanniana Nees, se han estudiado sus cambios ecohidrologicos superficiales (Scott et al., 2010), sin embargo para otros no menos importantes como Pennisetum ciliare (L.) Link (zacate buffel) (AngelL y McClaran, 2001; Castellanos et al., 2002; Castellanos et al. , 2010; Abella et al., 2012), poco se conoce aún. En el caso de los estudios sobre buffel se han enfocado más en su impacto sobre la biodiversidad y regeneración de grupos particulares de plantas (Saucedo-Monarque et al., 1997; Morales-Romero et al., 2012) y escasamente a las modificaciones que pudieran existir en los almacenes de recursos como el agua y nitrógeno en el suelo (Castellanos et al. , 2010). Dado el vacío de información que existe sobre los ecosistemas áridos modificados de matorrales a sabanas exóticas, algunos autores manifiestan la necesidad imperiosa de estudios empíricos al respecto (Wilcox et al. , 2012).
El presente estudio es una primera aproximación que documenta cómo la transformación de matorrales semiáridos a sabanas de zacate buffel, afecta la cantidad y disponibilidad de agua y nitrógeno en el suelo. Este estudio compara las dinámicas y los cambios en los almacenes y flujos de agua y nitrógeno en el suelo de diferentes tipos de parcelas entre la vegetación natural y una sabana de buffel adyacente, establecida hace 25 años, ambas sujetas a pastoreo moderado por ganado vacuno.
Materiales y metodos
Área de estudio
El área de estudio se ubica en el municipio de La Colorada, en el límite sureste del Desierto Sonorense, dentro de la Región Central de Sonora (RCS) y se localiza en las coordenadas 28 44' 45" N y 110 30' 33" O. El clima es seco cálido, la temperatura media anual es 20.6 °C, las temperaturas máximas se registran en junio (45 ºC) y las mínimas en febrero (2 ºC). La precipitación media anual es de 340 mm, con lluvias principalmente durante el monzón de verano (entre julio y agosto) y con una evapotranspiración potencial anual de 2360 mm; por lo que existe un déficit de agua durante la mayor parte del año ( CONAGUA, 2005).
Los suelos en el sitio se clasifican como Regosol calcárico y Feozem háplicos (INEGI, 1995). La vegetación natural predominante es matorral subtropical (INEGI, 1988), transformada en algunos sitios a sabanas con buffel (Pennisetum ciliare (L.) Link). Aunque el pastoreo sobre la vegetación natural se ha realizado durante varios siglos en la región (Camou, 1998), la transformación a sabanas es más reciente y obedece a modelos productivos de exportación (Camou, 1998, Bravo et al. , 2010). La sabana de buffel bajo estudio fue establecida hace 25 años, mediante un desmonte selectivo con maquinaria y manteniendo algunos árboles de leguminosas dominantes en pie. Tanto la vegetación natural, como la sabana de buffel se encuentran separadas en potreros, lo que ha permitido un pastoreo rotacional por bovinos, con períodos de utilización y de descanso de la vegetación, evitando la sobrecarga y sobrepastoreo en ambas. Para el presente trabajo se seleccionaron dos sitios, uno con matorral subtropical natural y otro transformado a sabana de buffel, los cuales tienen una superficie de al menos 400 ha cada uno. El muestreo se realizó a un kilómetro de distancia entre los sitios, por lo cual comparten el mismo clima, substrato geológico y tipo de suelo.
Caracterización de la Vegetación
La cobertura de la vegetación se caracterizó para establecer la proporción de parcelas dominadas por árboles, arbustos, buffel e inter-espacios, para lo cual se utilizó el método de intercepción por línea de Canfield (1941). En cada uno de los sitios, se realizaron 20 líneas al azar, de 50 m de longitud cada una. En cada una de las líneas se identificó cada individuo y se midió la distancia que interceptaba sobre la línea, así como la proporción de espacios abiertos. Las especies vegetales encontradas fueron agrupadas según su tipo funcional sensu Díaz y Cabido (1997), como árboles, arbustos, efímeras, diferenciándose al buffel como forma única. La cobertura por cada tipo funcional se obtuvo como porcentaje utilizando la siguiente ecuación:
Parcelas de la Vegetación
Olneya tesota A. Gray, es la especie más comúnmente conservada intacta durante los desmontes para establecer las sabanas de buffel. Además de ser una especie con amplia distribución en el Desierto Sonorense, forma islas de fertilidad y de recursos, generalmente asociada con otras especies de arbustos y herbáceas, formando un solo dosel (Suzán et al., 1996). En cada uno de los sitios, se seleccionaron dos tipos de parcelas similares: islas de recursos establecidas bajo el dosel de árboles de Olneya tesota (A) e inter-espacios abiertos sin cobertura vegetal aparente (I). El objetivo de escoger dos diferentes tipos de parcelas fue tener una mejor representación de la heterogeneidad espacial que se ha reportado en zonas áridas (García-Moya y McKell, 1970; Schlesinger et al., 1996; Kieft et al., 1998; Ewing et al., 2007; Wang et al., 2009; Celaya y Castellanos, 2011).
Para el estudio se seleccionaron parcelas de islas de recursos bajo árboles adultos similares en altura (3.5 m) y cobertura (3.5-4.5 m diámetro) tanto en el sitio natural (en adelante NA), como en el transformado a sabana de buffel (SA). Los espacios abiertos se encontraban rodeados por árboles y arbustos en el matorral natural (NI) y por buffel en la sabana (SI). Se establecieron cinco repeticiones para cada tipo de parcelas: NA y NI en la vegetación natural y SA, SI en la sabana, además de otra bajo la cubierta del pasto Buffel (SB). Cada repetición representó un bloque, pues en cada una se eligió una isla de recursos bajo un árbol de O. tesota (A) con base en su cobertura y altura, y se buscó un inter-espacio (I), de tal manera que ambas parcelas se encontraran lo más cercanas posible, esto con el fin de entender mejor cómo se complementan e integran ambas para el funcionamiento de la cubierta vegetal en las zonas áridas. Se ha propuesto que los interespacios desnudos en las zonas áridas son resultado de la utilización del agua por las raíces de los árboles vecinos, formando así una unidad funcional (Ferrante, 2014). El mismo procedimiento se utilizó para establecer las parcelas a muestrear en la sabana de buffel, utilizando árboles de características similares a los de la vegetación natural. Además de establecer ambas parcelas en la sabana, se buscó el conjunto de individuos de buffel (B) más cercanos al mismo árbol, de tal forma que los tres tipos de parcelas estuvieron a menos de 2 metros del perímetro del dosel. Las repeticiones para cada árbol y el conjunto de parcelas asociadas, se efectuó en individuos lejanos entre sí, asegurando su independencia entre ellos. Los muestreos fueron efectuados en la parte media de la cubierta del dosel (árboles y buffel) y de la porción desnuda en el inter-espacio. La instrumentación y mediciones se efectuaron en la porción sur-este del dosel, mientras que para la obtención de muestras de suelo para análisis en el laboratorio se utilizaron submuestras provenientes de los diferentes puntos cardinales bajo el dosel.
Caracterización del Suelo
Para la caracterización física y química del suelo, se tomaron muestras de los primeros diez centímetros de profundidad con un nucleador de cinco centímetros de diámetro (AMS Inc., Idaho, USA) retirando previamente el mantillo del suelo. Se utilizó una muestra compuesta de cinco puntos de muestreo para cada una de las parcelas mencionadas. A las muestras del suelo se le realizaron análisis de textura por el método del hidrómetro de Bouyoucos, porcentaje de saturación de agua del suelo y pH activo, para lo cual sé utilizó una solución 1:5 p/v de suelo en agua deionizada (suelo previamente tamizado en malla menor a 2 mm) y se leyó con un potenciómetro calibrado con buffer pH 7 y 4 (Hanna Instruments, modelo pH 209). Las mismas muestras se analizaron para conductividad eléctrica (Orion modelo 162), materia orgánica con el método de Walkley y Black (1934) y fósforo disponible con el método Bray P-1 (Bray y Kurtz, 1945).
La densidad aparente del suelo se determinó con nucleadores metálicos de 7 cm de diámetro y recuperando la muestra sin perturbar. La muestra fue secada en un horno ventilado a 80 °C durante 48 h, equilibradas en un desecador y posteriormente pesada. La densidad aparente fue calculada con base en la siguiente ecuación:
donde el volumen se calculó con base en sus dimensiones (πr2*h).
La humedad volumétrica a capacidad de campo se midió a 0.3 atmósferas, utilizando el método de platos de presión (Richards, 1948, 1961).
Nitrógeno en el Suelo
En cada punto de muestreo, se obtuvo una muestra única de suelo de los primeros 10 cm de profundidad para la determinación de nitrógeno total y disponible en el suelo, retirando previamente el mantillo y utilizando un nucleador de 5 cm de diámetro. Para cada una de las parcelas, se establecieron cinco repeticiones, dando un total de diez puntos de muestreo en la vegetación natural (NA y NI) y quince en la sabana (SA, SI, SB). Las muestras de suelo se obtuvieron mensualmente de junio de 2009 a marzo de 2010. Las muestras fueron tamizadas con una malla de 2 mm y se almacenaron a 4 °C y en obscuridad previo a los análisis del laboratorio. Para expresar la concentración de los nutrientes en relación al peso seco del suelo, a una alícuota de la muestra se le determinó el porcentaje de humedad gravimétrica en el laboratorio.
Se cuantificó el nitrógeno disponible tanto en forma de amonio (NH4+), como de nitrato (NO3-) de muestras frescas del suelo. Para ello, se realizó una extracción con KCl 2N, los extractos fueron filtrados en papel Whatman # 1 y leídos por colorimetría utilizando el método de fenol-hipoclorito (Robertson et al., 1999) en un Auto-Analizador Bran-Luebbe III (Norderstedt, Alemania) en el Laboratorio de Biogeoquímica de Suelos del Centro de Investigaciones en Ecosistemas de la UNAM.
El nitrógeno total del suelo se analizó solo para la muestras del mes de agosto. Las muestras fueron digeridas con H2SO4 y una mezcla digestora con K2SO4 y CuSO4 a 160 °C por una hora y a 290 °C por tres horas. Posteriormente, se analizaron con el método micro-Kjeldahl con un Analizador Rápido de Fluídos (Alpkem, RFA-300) a 640 nm (Alpkem, 1990, 1994). Estos análisis fueron realizados en el Laboratorio de Ecofisiología Vegetal del DICTUS, Universidad de Sonora. Con el fin de comparar los datos con estudios similares que presentan los datos en contenidos (kg por hectárea; Dalal et al., 2005a y b), la concentración de N en el suelo se multiplicó por la cantidad de suelo por superficie, utilizando la densidad aparente del suelo de NA para todos los casos, bajo el concepto de masa de suelo equivalente (Ellert y Bettany, 1995).
Perfil Vertical de la Humedad Volumétrica del Suelo
El contenido de humedad volumétrica en el suelo se midió a diferentes profundidades, para lo cual se instalaron 10 tubos de acceso permanente (dos para cada una de las parcelas estudiadas), que fueron monitorizados con una periodicidad mensual. La humedad del suelo se midió con un sensor TRIME-FM y una sonda IMKO-T3 (IMKO, Ettlingen, Germany). La sonda efectúa la medición de la constante dieléctrica aparente del suelo, a frecuencias de 0.5 a 1 GHz, que es cuando el campo electromagnético emitido por la sonda detecta el mayor número de dipolos del agua alineados y constantes, al tiempo que la porción imaginaria de la constante dieléctrica es mínima (Topp et al., 1980; Jones et al., 2002). En cada muestreo se midió el contenido volumétrico de agua para cada 0.10 m hasta una profundidad máxima de 2 m. Posteriormente, las lecturas se transformaron a litros por metro cuadrado multiplicando la relación en volumen por el espesor de la capa de suelo (0.1 m) para pasar de una relación volumétrica (m3 m-3), a volumen de agua por unidad de superficie (m3 m-2). Finalmente, el volumen registrado se expresó en litros para obtener litros m-2, lo cual equivale a milímetros de agua (mm), y se acumuló el contenido de agua para los primeros 0.20, 0.40 y 0.80 m de profundidad.
Análisis Estadísticos
La información entre sitios (natural o sabana de buffel), parcelas (NA, NI, SA, SI y SB) de las variables obtenidas en los muestreos, se contrastaron mediante análisis de varianzas. Para analizar los cambios en el tiempo y entre sitios se realizó un Análisis de Varianza de Medidas Repetidas, donde se considera a las parcelas, a las estaciones del año y su interacción. Para el análisis estacional, las variables se agruparon trimestralmente en invierno (enero, febrero y marzo), primavera (abril, mayo y junio), verano (julio, agosto y septiembre) y otoño (octubre, noviembre y diciembre). Previo al análisis, los datos fueron sometidos a una prueba de Cochran de homogeneidad de varianza y en caso de que no se ajustaran se transformaron a logaritmo natural, pero los valores se reportan sin esta transformación. La prueba a posteriori utilizada fue Tukey y solo en el caso de nitrógeno inorgánico (amonio y nitrato) se utilizó Fisher cuando las diferencias eran poco significativas. En todos los casos se estableció una significancia estadística menor o igual al 5%. Los análisis estadísticos se llevaron a cabo con los programas JMP versión 10 (SAS Institute, 2000) y Statistica 7.0 (Statsoft, 2000).
Resultados y discusión
Efectos de la transformación en la estructura de la vegetación
En el sitio natural sin transformar 42% de la cobertura del matorral estuvo ocupada por árboles y arbustos y 58% restante correspondió a los espacios abiertos sin vegetación aparente y sólo ocasionalmente con algunas hierbas (Figura 1). En la sabana predominó la cubierta de buffel con 55%, mientras que 43% fueron espacios abiertos y solo 2% se encontró cubierto por árboles y arbustos. En la sabana, los árboles son remanentes, como resultado de que se dejaron en pié al desmontarse el sitio y solo algunos arbustos se han establecido posteriormente. La disminución en la proporción de ciertos tipos funcionales con el cambio de uso de suelo, como el de las especies arbóreas con capacidad de fijación de nitrógeno, como es el caso de algunas especies de leguminosas, contribuye al cambio en algunas características del suelo (Cuadro 1), y reduce la presencia de islas de fertilidad y de recursos.

Figura 1 Porcentaje de cobertura por tipo de parcelas de estudio de vegetación natural y sabana de buffel en la región central de Sonora.

C.E. = conductividad eléctrica; M.O. = materia otgánica; P = fósforo.
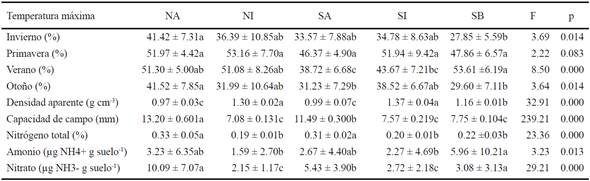
Cuadro 1 Características del suelo (0-10 cm) bajo parcelas de estudio de vegetación natural (NA: árbol, NI: inter-espacio) y sabana de buffel (SA: árbol, SI: inter-espacio y SB: buffel) en la región central de Sonora.
A pesar de que la superficie vegetal fue transformada hace más de 25 años y, dado que se asumen características de gran invasibilidad del buffel, sería de esperarse una superficie cubierta casi en su totalidad por buffel; sin embargo, esta fue de solo 55%. Es posible que incluso la cobertura de buffel vaya disminuyendo y, aunque no se conocen en definitiva las causas de dicha disminución, puede ser una combinación de presencia de enfermedades (PATROCIPES, 1995), deficiencia en la germinación y establecimiento durante la siembra (Castellanos et al., 2002), mortalidad de plantas adultas o escaso o nulo reclutamiento de nuevos individuos (Ibarra-Flores et al., 2004).
Efectos de la Transformación sobre las Características del Suelo
En el Cuadro 1 se presentan las principales características de los suelos superficiales (10 cm). Los suelos bajo los árboles (NA y SA) tuvieron las mayores concentraciones de materia orgánica, seguidos por el suelo del buffel (SB); mientras que los valores más bajos se registraron en los suelos de los espacios abiertos (NI y SI; Cuadro 1). Igualmente, los suelos bajo árboles mostraron mayor capacidad de retención de agua que aquéllos bajo buffel y espacios abiertos (Cuadro 2). En contraste, los suelos debajo de los árboles tuvieron la menor densidad aparente, siendo mayor en los espacios abiertos (P ≤ 0.0001; Cuadro 2).
Valores seguidos horizontalmente por letras diferentes indican que las medias son significativamente diferentes con la prueba de Tukey (P < 0.05).
Cuadro 2 Medias ± desviación estándar de algunas propiedades físicas y químicas del suelo (0-10 cm) en parcelas de vegatación natural (NA: árbol, NI: inter-espacio) y sabana de buffel (SA: árbol, SI: inter-espacio, SB: buffel) en la región central de Sonora.
El cambio de cubierta vegetal y su manejo ganadero parecen influenciar aspectos microclimáticos como la temperatura máxima del suelo, la cual fue mayor en NA que en SB en otoño, y que SA en verano, otoño e invierno (Cuadro 2), coincidiendo con las estaciones de mayor crecimiento y acumulación de biomasa del zacate buffel; no obstante, en la etapa de primavera no hubo diferencias estadísticas, que es cuando el pastoreo ya logró remover la biomasa acumulada en las parcelas.
Tal vez una determinante de la baja cobertura en la sabana de buffel esté relacionada con la densidad aparente del suelo (∂), debido a su compactación por el ganado (Lull, 1959). Una menor densidad aparente facilita la circulación de agua y aire en el suelo (Packer, 1953; Rauzi y Hanson, 1966). En los sitios de estudio, la mayor compactación ocurrió en los inter-espacios (Cuadro 2), probablemente relacionada con el pisoteo del ganado y la disminución del contenido de materia orgánica del suelo (Cuadro 1), ambos factores fuertemente relacionados entre sí (Lull, 1959). En sabanas de buffel de Australia, Dalal et al. (2005a), registraron mayor compactación en los primeros 20 cm del suelo en comparación con el matorral natural adyacente. En este estudio, el suelo con buffel (SB) presentó densidades aparentes (∂) intermedias respecto a las del suelo del inter-espacio (SI) y bajo el dosel del árbol (SA).
Con el cambio en la estructura de la vegetación natural a sabana de buffel (Figura 1), hay un incremento del 98% en la superficie del suelo susceptible al pisoteo por el ganado (Figura 1), lo que aunado a una mayor ∂ y menor contenido de materia orgánica, resultaría en mayores pérdidas de los reservorios orgánicos del suelo.
Cambios del Nitrógeno en el Suelo
El suelo bajo los árboles en ambos sitios presentaron mayores concentraciones de nitrógeno total que los suelos en los espacios abiertos y debajo del pasto buffel (Cuadro 2). En el caso de la concentración de amonio las parcelas fueron diferentes entre ellas, siendo mayor en el suelo bajo buffel y árboles que ambos espacios abiertos (Cuadro 2), y se encontraron diferencias entre estaciones (Figura 2a). Las muestras de primavera tuvieron mayor concentración que las muestras de las otras estaciones (Figura 2a). En contraste, la interacción entre la parcela y la estación fue significativa en la concentración de nitrato. En invierno, la mayor concentración de nitrato ocurrió en NA del matorral subtropical, mientras que en primavera, NA y SA de ambos sitios presentaron mayor concentración que las otras parcelas, mientras que las diferencias entre todas ellas se perdieron en las otras dos estaciones (verano y otoño; Figura 2b). Por otro lado, solo NA y SB presentaron diferencias estacionales en la concentración de nitratos. En el suelo de NA, los valores más altos y más bajos fueron para el invierno y el verano, respectivamente; mientras que la menor concentración en SB fue durante la primavera (Figura 2b).

Figura 2 Concentración estacional de amonio (a) y nitrato (b) en parcelas del suelo de vegetación natural (NA: árbol, NI: inter-espacio) y sabana (SA: árbol, SI: inter-espacio y SB: buffel). Letras mayúsculas diferentes horizontalmente (A, B y C) indican diferencia significativa para cada parcela; letras minúsculas (a, b, c) indican diferencia entre parches con la prueba de Fisher (P < 0.05; NH4 + estación * habitat: F: 4.17, p = 0.002; NO3 - estación: F: 181; P < 0.0001).
Los mayores almacenes de nitrógeno total se registraron en el suelo de islas de recursos (NA y SA), de buffel y de espacios abiertos, respectivamente (Cuadro 2). La mayor concentración de nitrógeno bajo el dosel de arbóreas de zonas áridas resulta en islas de fertilidad (García-Moya y McKell, 1970; Perroni-Ventura et al., 2010), como fue el caso en la parcela bajo O. tesota en este estudio. Dada la presencia de los mayores almacenes de nitrógeno total en las islas de fertilidad, su eliminación o reemplazo en la sabana de buffel, podría representar una disminución importante en el reservorio de este nutriente y estar ligada a procesos de pérdida del potencial productivo y degradación en la sabana. Utilizando el contenido de nitrógeno total por parcela en las islas de recursos y la proporción de su cobertura (Cuadro 2, Figura 1), se estimó que su reservorio en los primeros 10 cm del suelo de la vegetación natural es de 2420 kg de N ha-1 contra 2108 de la sabana, con una diferencia de 312 kg N ha-1 o pérdida anual de 12.5 kg N ha-1 debido a la transformación de la vegetación. También Dalal et al. (2005b) reportaron una disminución de 10 kg N ha-1 año-1 con la transformación de matorrales australianos dominados por leguminosas a sabanas de buffel. Otros estudios reportan pérdidas de entre 9 y 40 kg N ha-1 debido a la pérdida de especies con fijación de N (Geesing et al., 2000; Hughes et al., 2006).
Tal reducción en los reservorios de nitrógeno indica un proceso de degradación del suelo (Gallardo y Schlesinger, 1992; Anser et al. , 2004) que puede estar afectando el nitrógeno disponible. Igualmente pueden existir otras pérdidas adicionales aún no cuantificadas en la transformación de la vegetación, debido al incremento de emisiones de óxidos de nitrógeno en excretas y orina por el pastoreo de rumiantes (Bouwman et al., 1997; Yamulki et al., 1998), lo que al sumarse pueden contribuir al empobrecimiento de nitrógeno y la baja fertilidad del suelo en las sabanas de buffel (Castellanos et al., 2002).
Durante la primavera, en gran medida la época más seca en el área de estudio, la acumulación de amonio estaría indicando precisamente una baja demanda por parte de las plantas, mientras que la actividad microbiana heterotrófica en el suelo continúa. En otros ecosistemas áridos y semiáridos, Austin et al. (2004) asumen dinámicas similares dada la presencia de pulsos de precipitación como controladores principales de la humedad, y cuando las temperaturas son más favorables para la actividad biológica.
Los reservorios de nitrato fueron menores en parcelas con cubierta vegetal en la sabana y en particular bajo los individuos de buffel, lo que pudiera estar relacionado con una menor velocidad de nitrificación, mayor pérdida de nitrato o su mayor utilización en la sabana posiblemente influido por la presencia de buffel. Un incremento en la cobertura de buffel bajo el dosel de especies formadoras de islas de fertilidad como el mezquite (Prosopis velutina Woot) y palo fierro (O. tesota ) es común en parcelas en que el buffel aumenta su presencia. Lo anterior se podría relacionarse con los resultados este estudio, en el que los árboles en el sitio natural presentan mayor enriquecimiento del suelo en MOS, N total, amonio y nitrato; por lo que al convertir estos sitios a sabana conlleva a largo plazo a la pérdida de los reservorios de nitrógeno. La reducción de MOS, N total y N disponible entre NA y SB, representan cambios importantes en los ciclos biogeoquímicos al transformarse los ecosistemas áridos a sabanas de buffel.
Cambios en la Cantidad de Agua en el Suelo
La cantidad de agua en el perfil del suelo, integrada a tres diferentes profundidades (20, 40, 80 cm), presenta valores más altos en los suelos de los inter-espacios (SI y NI; Cuadro 3). En los primeros 40 cm del suelo, el SI tuvo mayor contenido de agua que el SA (P < 0.05). En el perfil de 80 cm de profundidad, los espacios abiertos en el sitio natural (NI) presentaron mayor contenido de agua en primavera y verano (P < 0.05) que el mismo tipo de parcelas en la sabana (SI). El contenido de agua bajo el buffel (SB) y el dosel de árboles en la sabana (SA) fueron aún menores a esa profundidad en la primavera, sugiriendo una mayor extracción de agua a esas profundidades bajo las cubiertas vegetales de la sabana.

Valores seguidos horizontalmente por letras diferentes indican que las medias son significativamente diferentes con la prueba de Tukey (P < 0.05).
Cuadro 3 Medias ± desviación estándar de la cantidad de agua en el suelo en parcelas de vegetación natural (NA: árbol, NI: interespacio) y sabana de buffel (SA: árbol, SI: inter-espacio, SB: buffel) en la región.
Los datos de los contenidos de agua en el suelo a diferentes profundidades durante los cuatro años de muestreo (2010-2013) se especifican en la Figura 3. En todas las parcelas, la humedad de suelo respondió positivamente a los pulsos de precipitación, principalmente en las capas más superficiales (10 y 50 cm). En la vegetación natural, los mayores contenidos de agua se presentaron a los 100 cm de profundidad, principalmente debajo del dosel de los árboles (Figura 3a y b). En contraste, los mayores contenidos de humedad en la sabana se presentaron a los 50 cm en las parcelas con árboles (SA) y en los espacios abiertos (SI) (Figura 3c y d). Bajo la cubierta de buffel hubo mayores contenidos de humedad a 100 cm de profundidad, similar a lo registrado en el sitio natural (Figura 3e).

Figura 3 Humedad estacional (mm) en el perfil del suelo de 0 a 200 cm de profundidad para las parcelas de vegetación natural: a) árbol y b) inter-espacio; y en sabana: c) árbol, d) inter-espacio y e) buffel. Las columnas muestran la precipitación acumulada (mm).
Durante las temporadas de mayor precipitación, la mayor humedad superficial se presentó en las parcelas de los inter-espacios, primero en la sabana (SI) y el sitio natural (NI). Bajo el dosel de O. tesota en la sabana (SA) se obtuvieron contenidos de agua más bajos que debajo del dosel de la misma especie en el sitio natural (NA) (Figura 3a y c). La menor humedad en el suelo en SA, parece coincidir con la profundidad, en donde hay mayor cantidad de raíces del pasto buffel.
O. tesota es una especie con un sistema radicular doble, con una porción de su masa y de la longitud de sus raíces distribuida superficialmente y, otra a una profundidad aproximada de 100 cm, mientras que su raíz profunda y vertical puede alcanzar el manto freático (Nilsen et al., 1984). Bajo el dosel de árboles en la sabana se detectaron las mayores diferencias significativas en la cantidad de agua del suelo hasta los 80 cm de profundidad. El cambio en el patrón de utilización ó disponibilidad de humedad en el suelo bajo O. tesota en la sabana coincide con las profundidades a las que se distribuyen las raíces de esa especie y del zacate buffel (Mnif y Chiaeb, 2009). Este sobrelape de nichos incrementa la competencia por agua disminuyendo su disponibilidad para la especie arbórea con mayores necesidades de consumo (Kemp, 1983).
La mayor humedad volumétrica ocurrió en parcelas de buffel en la sabana, aunque no en las parcelas con O. tesota en el mismo sitio (Cuadro 3). Como consecuencia de los cambios en la cubierta vegetal y la disminución en la dominancia de especies arbóreas y arbustivas al transformar la vegetación natural a sabana de buffel, se observó mayor contenido de agua en el perfil profundo de las parcelas de buffel (Figura 3). El sistema radicular de buffel no parece rebasar los 100 cm de profundidad (Mnif y Chaieb, 2009), por lo que esta especie no utiliza agua a mayor profundidad; además, sus características como especie C4 le confieren un uso más eficiente y menor de agua, lo que contribuye a una mayor acumulación en su perfil profundo (Figura 3e). Este resultado coincide con los modelados para matorrales invadidos por pastos en desiertos calientes (Wilcox et al., 2012). En dichos modelos los autores asumen que el uso de agua se mantiene constante en el pasto; sin embargo, el agua que ya no es utilizada por las especies arbóreas y arbustivas que disminuyen su dominancia con la transformación a sabana, se adiciona al reservorio profundo en el suelo.
La menor cantidad de agua en los primeros 50 cm bajo el dosel de árboles (en la vegetación natural y sabana) durante los períodos considerados como secos fue notoria. Es posible que esto sea resultado de la mayor utilización de humedad por otras especies huéspedes establecidas bajo el dosel de O. tesota , debido al uso de agua por el mismo individuo utilizando su sistema radicular más superficial, o una combinación de ambas. O. tesota se caracteriza por albergar una gran diversidad de especies de plantas bajo su dosel (Suzán et al., 1996) dadas las condiciones ambientales menos severas en relación con las áreas abiertas o por una mayor humedad disponible debido a la redistribución hídrica (Dawson, 1993). Un mayor uso superficial de agua en parcelas de O. tesot a en la sabana (SA) puede ser consecuencia del aumento de especies con características de invasora creciendo bajo su dosel (Dawson et al. , 2012), como el caso del buffel, utilizando también la humedad somera del suelo.
Parcelas e inter-espacios funcionan como una unidad en la vegetación de las zonas áridas. Aún cuando la humedad bajo el dosel de O. tesota en la sabana (SA) siempre fue menor que en la vegetación natural (NA), la humedad a 150 cm permaneció sin cambios aparentes para ambos (Figura 3). Eso pudiera indicar alguna similitud en el uso del agua del suelo a esa profundidad dentro del perímetro del dosel de la parcela, en comparación con el uso por raíces laterales a esa misma profundidad en el interespacio (Walter, 1971). Así parece indicarlo la menor humedad en los inter-espacios (NI y SI) adyacentes, aún cuando el agua puede penetrar durante los pulsos de lluvia a profundidades aún mayores a 150 cm (Figura 3). Igualmente, una mayor disponibilidad de agua bajo el perfil del buffel a profundidades de 200 cm (datos no presentados aquí), indica que el agua puede infiltrar hasta esas profundidades cuando no es utilizada.
A pesar de los cambios tan importantes en el patrón de utilización de la humedad bajo el dosel de O. tesota en la vegetación natural y la sabana de buffel, parece no haber signos evidentes de efectos adversos en la especie, posiblemente debido a mecanismos de compensación en el balance hídrico de los individuos, aunque estos deberán ser evaluados con mayor detalle. Sin embargo, algunos autores han reportado que en Cercidium microphyllum (Torr.) Rose & I.M. Johnston, una leguminosa arbórea, se presentó mayor número de ramas con daño y mortandad cuando hay individuos de buffel creciendo bajo su dosel, aun cuando no hubo diferencias significativas entre su potencial hídrico y el de individuos sin la presencia del mismo pasto (Eilts y Huxman, 2013). Aunque no son totalmente claros los mecanismos por los cuales el buffel pueda inducir una condición de estrés sobre la nodriza, es evidente que existe una modificación en la disponibilidad de humedad influenciada por la presencia del buffel (Figura 3). Este efecto se pudo apreciar al analizar el perfil de humedad del suelo de las parcelas bajo el dosel de árboles durante las épocas seca y húmeda (Figura 4), que muestran comportamientos inversos en lo que corresponde a la zona vadosa (70-110 cm) de las parcelas estudiadas. Tales diferencias parecen deberse, en parte, a la utilización del agua disponible en el inter-espacio por las raíces de los árboles vecinos. En ambos casos los patrones de humedad en la sabana y vegetación natural son contrastantes a esas mismas profundidades, esto es, la humedad disponible en la sabana (SI y SA) disminuye mientras que en la vegetación natural (NI y NA) aumenta en ese intervalo de profundidad del suelo.
Efectos de la Transformación en el Ecosistema y Degradación
Los resultados del estudio muestran que los cambios debidos a la transformación a sabana de buffel afectan la disponibilidad de agua a nivel de parcela, así como los reservorios de nitrógeno total y disponibilidad de nitrógeno inorgánico. La sostenibilidad de la ganadería intensiva basada en sembrar zacate buffel debe considerar las modificaciones en el funcionamiento de la cubierta vegetal, lo cual ha sido motivo de cuestionamiento tanto en Sonora (Castellanos et al., 2002; Castellanos et al. , 2010) como en Australia (Dalal et al., 2005a). Con el cambio a sabanas de buffel se elimina la mayor parte de los árboles y arbustos (Figura 1), que son componentes importantes del ecosistema natural y en los que se encontraron los mayores niveles de agua y nutrientes en el suelo (Cuadro 2 y 3). Las modificaciones documentadas en la dinámica de agua y nitrógeno en el suelo son complejas e interactúan a diferentes niveles que pueden influir en cambios en el funcionamiento del ecosistema. Por ejemplo, modificaciones de las propiedades físicas del suelo, producto de la compactación del suelo de la sabana, influyen y retroalimentan la reducción en la capacidad de retención de agua en el suelo, disminuyendo la disponibilidad de agua en el perfil del suelo en algunos tipos de parcelas.
Por otro lado los cambios en ∂ y capacidad de retención de humedad del suelo (capacidad de campo) en parcelas del inter-espacio en la sabana, puede tener implicaciones importantes en el ciclo del agua (infiltración, escorrentía y acumulación en el perfil) y en la forma en que se acumulan los nutrientes del suelo (Cuadro 2 y 3). La reducción de la infiltración y la capacidad de retención de agua del suelo puede resultar en una menor resiliencia del sistema frente a la sequía en algunos ecosistemas (Falkenmark y Rockström, 2008), lo que permite dimensionar el nivel de degradación del ecosistema.
La menor disponibilidad de nitrógeno y cantidad de agua en las capas superficiales en la sabana de buffel, pudiera ir mermando a largo plazo la productividad, el establecimiento de especies y la cobertura futura de estos ecosistemas transformados. Esta reducción en la disponibilidad de recursos puede aumentar además la vulnerabilidad y el riesgo de degradación de la sabana de buffel en el mediano plazo, lo que permitiría explicar la disminución de esta especie exótica y el incremento de espacios abiertos en las sabanas con mayor edad de establecimiento (Castellanos et al., 2002) y la re-invasión de la misma sabana por especies de plantas fijadoras de nitrógeno. Este ciclo de pérdida en la disponibilidad de recursos-re-invasión puede llegar a generar una dinámica que exacerbe la degradación y aumente el riesgo de desertificación.
Conclusiones
El cambio de matorrales naturales en la Región Central de Sonora a sabanas de zacate buffel por intensificación de la ganadería, ha modificado el agua y nitrógeno del suelo espacial, disminuyendo temporalmente en las capas superficiales. Ese cambio en la cubierta vegetal, debido a la modificación de las prácticas de manejo ganadero, ha impactado los reservorios de nitrógeno y agua, así como las propiedades físicas del suelo que retroalimentan el funcionamiento del ecosistema, su hidrología y fertilidad. Los cambios en los reservorios de agua y nitrógeno a nivel de parcela fueron complejos. Al igual que otros estudios, se reportó mayor concentración de nitrógeno total en parcelas con cubierta vegetal que interespacios, en particular bajo árboles. Así, la disminución de nitrógeno en parcelas de buffel en la sabana fue menor a la esperada, considerando la pérdida del estrato arbóreo que funcionalmente constituye las islas de recursos. Sin embargo, los cambios a sabana modificaron la estacionalidad de los reservorios de nitrato en el suelo. La menor concentración de nitrato en la sabana durante las épocas secas, significa una menor ganancia neta de este recurso en el suelo.
La transformación de la cubierta vegetal a sabana involucró cambios importantes en los reservorios del agua, así como diferencias en su comportamiento horizontal y vertical en el perfil, particularmente a profundidades entre 100 y 150 cm. Los cambios en los reservorios de agua muestran que a diferencia del matorral natural, bajo el dosel de individuos de buffel, que representan casi 50% de la cubierta vegetal de la sabana, hay acumulación de humedad. En este trabajo también se muestra que con el cambio de la vegetación a sabana, el perfil de agua del suelo en las parcelas de árboles nodriza disminuye superficialmente y en la zona vadosa (±120 cm), una zona conocida por su importancia en la redistribución hídrica de especies arbóreas en ecosistemas de zonas áridas. Es claro que las modificaciones a nivel parcela pueden ser compensadas a nivel del paisaje, lo que determina una interacción compleja de las variables y mecanismos que intervienen durante la transformación del paisaje y su posible degradación, lo que puede suponer un mayor riesgo de desertificación en los ecosistemas transformados a sabana de buffel de la región central de Sonora.











 nueva página del texto (beta)
nueva página del texto (beta)





