Introducción
En la ciudad de México se producen 45 949 850 toneladas por año de basura en forma de residuos sólidos. Parte de este material es inerte, compuesto de vidrio, metales, plásticos, etc., y el resto son residuos orgánicos sólidos, como desperdicios de cocina y jardín que son fácilmente degradables (URL 1).
El compostaje es una buena opción para solucionar este problema por diferentes razones: la biotransformación de desperdicios a través de este proceso conduce a la eliminación de residuos potencialmente tóxicos (Vinneräs et al., 2003), porque el producto final, la composta, mejora la calidad del suelo al adicionarse al mismo como abono orgánico y porque algunas compostas suprimen el desarrollo de fitopatógenos (Craft y Nelson, 1996).
El compostaje es considerado como la descomposición biológica aerobia en donde parte de la materia orgánica es transformada a sustancias estables parecidas a los ácidos húmicos (Farrell y Jones, 2009) y como una herramienta biotecnológica en la transformación de los residuos sólidos orgánicos en productos agrícolas apropiados (Baffi et al., 2007).
Los microorganismos que participan en el compostaje requieren carbono y relativamente poco nitrógeno para su actividad. Si reciben esos elementos en una relación correcta, se reproducen rápidamente y consecuentemente, la descomposición de los residuos orgánicos también se acelera. La relación C/N óptima durante el inicio del proceso del compostaje de residuos, es de 25 hasta 35. Si la relación es más alta, la descomposición es más lenta. Si la relación es < 20 durante el compostaje, se podría producir amoníaco gaseoso, lo cual no solamente daña al medio ambiente sino también empeora la calidad de la composta (Bernai et al., 1998).
A los dos o tres días del inicio el compostaje, el autocalentamiento normalmente eleva la temperatura de la composta a 55-60 °C o más. Después de algunos días a temperatura máxima, hay un descenso gradual de ésta que conduce a temperaturas mesofílicas; durante este periodo, estas poblaciones microbianas son reemplazadas por las mesofílicas que sobrevivieron al proceso termofílico. De manera que hay una sucesión de ambientes, debido principalmente a la modificación de sustratos y temperaturas, y a una serie correspondiente de poblaciones microbianas, pues el incremento de la temperatura durante el compostaje tiene como consecuencia el rápido rompimiento de los compuestos orgánicos por microorganismos termofílicos, por lo que la materia orgánica comienza a ser más estable (Raut et al., 2008).
La descripción de los microorganismos que intervienen en el proceso de compostaje es complicada, debido a que las poblaciones y las comunidades varían continuamente en función de la evolución de la temperatura, nutrientes, oxígeno, contenido de agua, pH, etc. Los microorganismos que más participan en el proceso son hongos y actinomicetos por su capacidad para degradar residuos de plantas y animales como celulosa, quitina y pectina, y en algunos por su termotolerancia (Farrel y Jones, 2009). La participación de los actinomicetos durante el proceso de compostaje es relevante, debido a su capacidad enzimática para hidrolizar substancias orgánicas complejas (celulosa, pectina, etc.) (Tiquia, 2002). Asimismo, muchas de las especies que participan en este proceso son tolerantes a las temperaturas que alcanza el mismo. Por tal motivo, Streptomyces albogriseolus y S. thermovulgaris son los actinomicetos termófilos más frecuentemente aislados de las compostas (Chen et al., 2013). Los hongos filamentosos constituyen un grupo muy amplio; pueden estar implicados durante el proceso de compostaje, participando en la degradación aeróbica de la materia orgánica debido a su alta capacidad lignocelulolítica; Aspergillus fumigatus, termófilo, ha sido encontrado frecuentemente en compostas (Golueke et al., 1954).
Una alternativa para mejorar el proceso de compostaje es la búsqueda de microorganismos con capacidad de síntesis de enzimas hidrolíticas bajo diferentes condiciones de pH y temperatura que permitan acelerar el proceso. Se asume que el proceso se acelera incrementando el número de microorganismos mediante adición artificial de los mismos, aumentando o sustituyendo la población nativa microbiana, proceso que se conoce como bioaumentación (Zeng et al., 2009). El objetivo de este trabajo fue evaluar el potencial de algunos microorganismos, aislados de diferentes compostas, que pudieran ser utilizados en el proceso del compostaje.
Materiales y métodos
Como fuente de aislamiento de los microorganismos se utilizaron muestras de 5 compostas proporcionadas por el Centro de Investigación en Biotecnología Aplicada del IPN. El aislamiento se hizo con diluciones seriadas y siembra para bacterias en Agar Nutritivo, para hongos en PDA y Czapeck para actinomicetos. Con el propósito de simular las condiciones en las que se lleva a cabo el proceso de compostaje, a todos los microorganismos se les hicieron pruebas in vitro de crecimiento a temperaturas de 28, 37, 45 y 55 °C y a valores de pH de 5.5, 7.0 y 8.5 durante 72 horas de incubación.
La prueba cualitativa de degradación enzimática de celulosa se hizo con el colorante Rojo Congo para la visualización de halos de hidrólisis de carboximetilcelulosa (CMC Sigma Aldrich) alrededor de las colonias a probar, usando el sistema de difusión en placas de agar (Teather y Wood, 1982; Mikán y Castellanos, 2004). La presencia de enzimas pectinolíticas fue detectada usando un medio de cultivo sólido descrito por Hankin et al. (1971) visualizando también halos de hidrólisis mediante la precipitación de la pectina no hidrolizada con una solución de hexadeciltrimetil bromuro de amonio (CTAB Sigma Aldrich).
La determinación cuantitativa de hidrólisis de celulosa y pectina para determinar las actividades enzimáticas específicas se hizo empleando el método de Somogyi (1952) conjuntamente con la cuantificación de proteínas por el método de Bradford (1976).
A los aislados microbianos seleccionados se les confrontó directamente en medio de cultivo para descartar efectos de antagonismo entre ellos para su posible uso durante el compostaje, de acuerdo a la metodología de Furhmann (1994).
Con base en los resultados obtenidos de la cuantificación de actividad celulolítica y pectinolítica específicas, así como las pruebas de antagonismo, se seleccionaron los microorganismos que obtuvieron las mayores actividades enzimáticas, para la elaboración de un inóculo. Para ello se cultivaron el hongo y las actinobacterias seleccionadas hasta la formación de esporas. Se cosecharon las esporas de los microorganismos por separado con solución salina para después ajustar a 1 × 109 UFC mL-1 cada suspensión para inocular 5 mL kg-1 de substrato (Wei et al., 2007; Zeng et al., 2009). Para la conservación a largo plazo de las cepas se colocaron en suspensión con glicerol al 15% como agente crioprotector y almacenadas a -70 °C.
El sustrato utilizado estuvo compuesto por residuos de poda de jardín y residuos domésticos. El mismo se secó a temperatura ambiente, se molió y pasó por un tamiz con malla de 0.850 mm de apertura. La mitad del substrato se esterilizó y tanto el esterilizado como el no estéril se humedecieron al 50% de su capacidad de retención de agua, con agua esterilizada. Las macetas donde se hizo el ensayo fueron previamente desinfectadas con hipoclorito de sodio.
Los tratamientos fueron los siguientes: 1) sustrato estéril sin inocular, 2) sustrato estéril inoculado, 3) sustrato no estéril sin inocular y 4) sustrato no estéril inoculado.
Se evaluaron periódicamente durante 70 días los siguientes parámetros: nitrógeno total (método modificado de Kjeldahl, Jackson, 1982); materia orgánica total y carbono total (método Walkley-Black, Jackson, 1982); relación C/N; pH (Jackson, 1982) y azúcares reductores totales (Somogyi, 1952).
Los datos obtenidos se sometieron a análisis de varianza (univariado) vía modelo general lineal y un análisis discriminante canónico (multivariado) (ADC) con cálculo de distancias de Mahalanobis para analizar simultáneamente las múltiples variables de respuesta y determinar las diferencias significativas entre los tratamientos, en todos los casos α = 0.05. Las medias de clase por tratamiento para cada una de las variables canónicas, se graficaron en ejes cartesianos para representar los niveles de separación entre tratamientos. Se utilizó el paquete estadístico SAS V.9 (URL2).
La identificación taxonómica del hongo se determinó por medio de la morfología de las esporas asexuales y de los conidióforos. Se tomó en cuenta la forma, el color y la ornamentación de las conidiosporas, el tipo de los conidióforos, la forma de la célula pié ("L" o "T") o de la vesícula conidial (redonda, elíptica o claviforme), el área fértil de la vesícula conidial con o sin, una o varias capas de métula que da lugar a fiálides o células conidiógenas productoras de cadenas largas de conidios (Raper y Fennell, 1965).
La identificación taxonómica de las bacterias se llevó a cabo amplificando el gen ribosomal 16S con los oligonucleóticos universales para procariotes 27f y 1495r (Bianciotto et al., 1996), así como los oligonucleótidos fD1 y rD1 (Weisburg et al., 1991). Los fragmentos se clonaron utilizando el sistema TOPO y se secuenciaron, después se sometieron a análisis BLAST para determinar su homología con otras secuencias del Gene Bank.
Resultados y discusión
Las actinobacterias estudiadas fueron identificadas como Streptomyces albogrisoleus y S. tendae; el hongo como Aspergillus fumigatus.
En la Figura 1 se muestra la ubicación filogenética de los actinomicetos aislados en este estudio. La cepa ENCB70 pertenece al clado 110 (Streptomyces albogriseolus - S. viridostaticus), mostrando secuencias idénticas a las especies tipo. Mientras que la cepa ENCB77 se ubica en el clado 103 que contiene al menos 7 especies diferentes, dentro de ellas la especie tipo de S. tendae con la que nuestra cepa tiene un 100% de similitud en la secuencia del gen 16S RNA. Los clados fueron definidos por Labeda et al. (2012) en su revisión comprensiva sobre la filogenia de la familia Streptomycetaceae.

Figura 1 Dendrograma construido con secuencias del gen 16S RNA de las cepas obtenidas y varios actinomicetos del género Streptomyces. Las especies tipo se marcan con una (T), el número de acceso aparece junto al nombre respectivo. El árbol se construyó usando 1352 nucleótidos para el análisis, mediante el modelo de dos parámetros de Kimura y Neighbor-Joining como método de agrupamiento. La robustez de cada nodo se evaluó por bootstrap con 1000 pseudoréplicas, los valores porcentuales se muestran en cada nodo. La secuencia de K. griseolas se usó para enraizar el árbol. La escala indica 0.5% de divergencia estimada entre las secuencias.
Las actinobacterias y los hongos filamentosos predominaron en los ensayos de aislamiento de microorganismos a partir de las compostas. De acuerdo con Inbar et al. (2005), los miembros del grupo de las actinobacterias son encontrados frecuentemente en suelo, rizósfera y en materiales que han sido sometidos al proceso de compostaje.
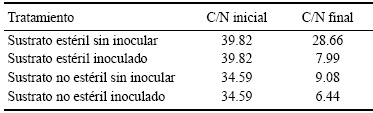
Los substratos ricos en materia orgánica (como es el caso del utilizado en el estudio el cual contenía 70% de materia orgánica), tienden a elevar su temperatura conforme la comunidad microbiana nativa descompone con rapidez los sustratos utilizables produciendo calor metabólico (McKinley y Vestal, 1984). En este estudio, las actinobacterias y el hongo filamentoso seleccionados mostraron ser termófilos; a una temperatura de incubación de hasta 55 ºC incrementaron su velocidad de crecimiento y esporulación.
En relación al pH, el hongo fue capaz de crecer a todos los valores probados; las actinobacterias crecieron únicamente a valores de pH 7. Estas propiedades de los microorganismos en estudio sugieren que en el proceso de compostaje donde las temperaturas suben a más de 55 ºC y el sustrato se alcaliniza, la actividad enzimática no disminuye, pues los actinomicetos son basófilos.
En el ensayo cualitativo de hidrólisis de la celulosa, bajo 3 condiciones de temperatura (28, 37 y 45 ºC) y 3 valores de pH (5.5, 7 y 8.5) en un diseño de pruebas cruzadas, ninguna actinobacteria fue capaz de hidrolizar CMC a pH 8.5; el hongo mostró actividad a esa condición de pH y a 28, 37 y 45 °C.
En cuanto a la hidrólisis cualitativa de pectina, a pH de 5.5 y a todas las temperaturas de incubación al igual que a pH de 8.5 y 55 ºC de incubación no hubo actividad pectinolítica en las actinobacterias. Esto podría explicarse porque las enzimas pectinolíticas son inhibidas a valores de pH ácidos y a cualquier temperatura las bacterias y las actinobacterias (Membré y Burlot, 1994), mientras que en estudios de actividad pectinolítica a pH ácido en algunos géneros de hongos se han encontrado isoformas de estas enzimas dependiendo de su punto isoeléctrico, aunque se han descrito la presencia de pectatoliasas en algunas especies de Streptomyces y Thermomonospora (Brühlmann et al., 1994).
En la determinación cuantitativa de la actividad de las celulasas, los 3 microorganismos tuvieron gran actividad celulolítica. Ramírez y Coha (2003), determinaron la actividad celulolítica cuantitativa de algunas cepas de Streptomyces sp., siendo la mayor actividad específica de 20.14 U mg-1 de proteína soluble encontrándose este valor por debajo de los mejores resultados obtenidos en este estudio.
Los resultados obtenidos de la cuantificación de la actividad celulolítica y pectinolítica, y el bioensayo de antagonismo, nos permitieron preparar el inóculo. Las características generales de los microorganismos se muestran en el Cuadro 1.
Cuadro 1 Características generales de los microorganismos seleccionados para la elaboración del inóculo de prueba.
AE = actividad enzimática.
En lo que respecta a la evaluación del potencial de degradación de los microorganismos sobre los residuos de poda de jardín y domésticos, la cantidad de nitrógeno total cuantificada al inicio del proceso fue de 1.28% en el suelo sin esterilizar y de 1.06% en el suelo esterilizado. La diferencia en estos valores probablemente fue debida al proceso de esterilización en donde al existir altas condiciones de presión y temperatura se pudieron desprender algunos compuestos volátiles que contienen nitrógeno como el amonio ocasionando una ligera pérdida de este elemento. La cantidad de nitrógeno total al final del período de incubación aumentó en todos los tratamientos menos en el que contenía el sustrato estéril sin inocular (Cuadro 2).
Cuadro 2 Cantidad de nitrógeno total al inicio y al final del proceso de compostaje (70 días).

NT = nitrógeno total.
Otros estudios (Wei et al., 2007) reportaron al inicio del compostaje porcentajes de N total de 2.7 y 2.8% en residuos orgánicos municipales; Xi et al. (2005) encontraron valores de 1.1-1.4% en residuos orgánicos frescos y Farrel y Jones (2009) obtuvieron valores de 1-2.5% al inicio del proceso en residuos orgánicos municipales. Los valores obtenidos en el presente estudio están dentro de los intervalos reportados por los autores mencionados.
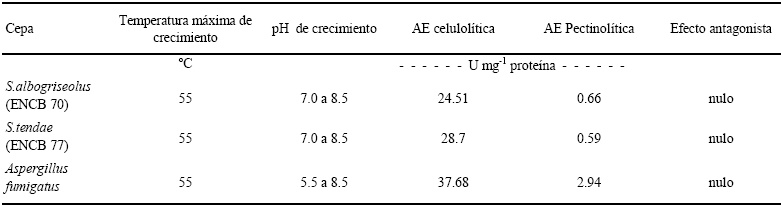
La proporción de materia orgánica al inicio del proceso fue del 70% del total del sustrato, durante el proceso estos valores fueron disminuyendo mostrando al final de 70 días 24.61% en el sustrato no estéril inoculado, mientras que en el sustrato estéril sin inocular (sustrato control), este valor se mantuvo en 53.13% siendo el más alto en comparación con los demás tratamientos (Figura 2).
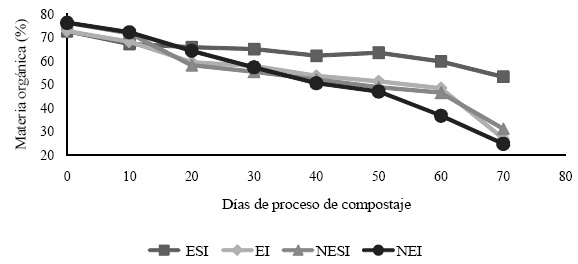
Figura 2 Materia orgánica en el sustrato durante el proceso de compostaje. ESI = sustrato estéril sin inocular; EI = sustrato estéril inoculado; NESI = sustrato no estéril sin inocular; NEI = sustrato no estéril inoculado.
La relación baja C/N (menor de 25) es tradicionalmente utilizada para establecer el grado de madurez de una composta (Bernai et al., 1998). La relación C/N de los 3 tratamientos con microorganismos de este estudio al final del proceso fue menor de 25. El valor de la relación C/N más bajo se mostró en el sustrato no estéril inoculado, lo cual es un indicador de la estabilidad del producto final (Cuadro 3), además de mostrar el efecto positivo de la bioaumentación.
Cabe señalar que cuando el sustrato no estéril se inoculó con los microorganismos en estudio, la relación C/N final fue menor que cuando no se inoculó, lo que sugiere la participación activa de los microorganismos inoculados en el proceso.
Los valores de pH del sustrato al inicio del compostaje fueron ligeramente ácidos (pH 6) y se modificaron durante el proceso. Los procesos involucrados en la degradación de la materia orgánica con la producción de amonio derivado de la degradación de proteínas (Ming et al., 2008) condujeron a la alcalinización de los sustratos llegando a valores por encima de pH 8, a excepción del sustrato control (estéril sin inocular) (Figura 3).

Figura 3 Alcalinización del sustrato en compostaje a través de los días de incubación. ESI = sustrato estéril sin inocular; EI = sustrato estéril inoculado; NESI = sustrato no estéril sin inocular; NEI = sustrato no estéril inoculado.
La cantidad de azúcares reductores totales disminuyó desde los primeros días de incubación en los sustratos tratados hasta alcanzar los valores mínimos 0.016-0.036; mientras que en el sustrato estéril sin inocular se mantuvieron constantes (Figura 4). Los sustratos tratados y el sustrato sin esterilizar contenían comunidades microbianas que pudieron consumir esos compuestos hasta agotar casi por completo las fracciones degradables de celulosa y llegar a la estabilización de la materia orgánica, mientras que en el sustrato estéril sin inocular estos oligosacáridos se liberaron de la materia orgánica vegetal y acumularon de manera natural o probablemente por hidrólisis a través del calor externo recibido de la incubación a 45 ºC y al no haber microorganismos que terminaran de hidrolizar y consumieran los oligosacáridos liberados hubo acumulación de los mismos. El consumo de los azúcares es un proceso altamente eficiente que utiliza un sistema transportador en donde el consumo dentro de las células de los azúcares solubles frecuentemente ocurre segundos después de la liberación inicial de las fibras de celulosa. Después de haber sido transportados al citosol, los azúcares comienzan a ser transformados por otras enzimas en glucosa-6-fosfato para entrar a la ruta glucolítica (Carere, 2008).

Figura 4 Disminución de azúcares reductores totales en los sustratos tratados y acumulación de los mismos en el sustrato estéril sin tratar, durante el proceso del compostaje. ESI = sustrato estéril sin inocular; EI = sustrato estéril inoculado; NESI = sustrato no estéril sin inocular; NEI = sustrato no estéril inoculado.
El resultado del análisis de varianza univariado indica que existen diferencias altamente significativas (P ≤ 0.0001) para las variables pH y cantidad de azúcares reductores; en cambio, para el caso del contenido de materia orgánica no se encontró diferencia significativa (P = 0.24).
Como parte del análisis discriminante canónico (ADC), se calculó el cuadrado de la distancia Euclidiana entre grupos (d2). Estos valores se sometieron a pruebas de hipótesis utilizando las distancias de Mahalanobis que permitieron determinar los niveles de significancia por comparaciones pareadas entre los grupos (Cuadro 4).
Cuadro 4 Análisis discriminante canónico de los diferentes tratamientos.

***: P ≤ 0.0001. NS: diferencia no significativa.
El resultado del análisis discriminante canónico, se muestra en la Figura 5, en el que se observan los niveles de separación entre los tratamientos en términos de medias de clase para cada variable canónica, en donde los ejes CAN1 y CAN2 explican el 99.96% de la varianza total.
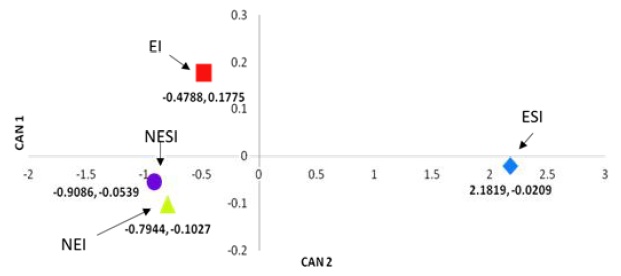
Figura 5 Medias de clase para cada tratamiento, ubicados en los ejes canónicos Can1 y Can2 resultantes del Análisis Discriminante Canónico. ESI = sustrato estéril sin inocular; EI = sustrato estéril inoculado; NEI = sustrato no estéril inoculado; NESI = sustrato estéril sin inocular.
De acuerdo al ADC, no se tuvieron diferencias estadísticamente significativas entre los tratamientos 2, 3 y 4, con lo cual se puede inferir que los microorganismos inoculados al sustrato esterilizado tuvieron un potencial de degradación por sí mismos similar al total de los microorganismos que se encontraban de manera endógena en el sustrato original sin esterilizar. Sin embargo, si tomamos en cuenta que la relación C/N baja (menor de 25) es tradicionalmente utilizada para establecer el grado de madurez de una composta, el valor de la relación C/N final del sustrato no esterilizado e inoculado fue de 6.44, cuando el sustrato no se esterilizó, ni se inoculó (presencia solo de la población nativa), el valor fue de 9.8, lo que sugiere, en el caso del sustrato no estéril e inoculado con los microorganismos seleccionados, la activa y funcional participación de éstos últimos; en el caso donde solo hubo la presencia de la población nativa del sustrato en estudio, sugiere una buena participación de los microorganismos nativos del mismo.
Por otro lado el tratamiento control (sustrato esterilizado sin inocular) muestra diferencias significativas con respecto a los otros tratamientos, pues se trata del sustrato esterilizado sin inocular, donde no hubo modificaciones del mismo en términos de nitrógeno total, materia orgánica, pH, azúcares reductores totales, carbono total y relación C/N. La diferencia en el compostaje entre este tratamiento y los tratamientos inoculados y el natural se muestra en la Figura 6.
Conclusiones
En las compostas utilizadas para aislar microorganismos, las actinobacterias y los hongos filamentosos predominaron en los ensayos de aislamiento. Las actinobacterias seleccionadas fueron identificadas como Streptomyces albogrisoleus y S. tendae; el hongo como Aspergillus fumigatus. Tanto las actinobacterias como el hongo filamentoso seleccionados mostraron ser termófilos; a una temperatura de incubación de hasta 55 °C incrementaron su velocidad de crecimiento y esporulación.
El potencial de compostaje del consorcio de los microorganismos aislados y estudiados fue positivo ya que el valor bajo de la relación C/N, tradicionalmente utilizada para establecer el grado de madurez de una composta, bajó considerablemente durante el proceso. Así mismo se observó que los microorganismos presentes en el sustrato ensayado también tuvieron una participación activa, manifiesta a través de un valor bajo de la relación C/N.
El grado de madurez de la composta obtenida con la bioaumentación en los 70 días del proceso logró incrementarse con los microorganimos inoculados en el substrato original, lo que sugiere que los mismos podrían utilizarse en el proceso de compostaje para acelerarlo y ser utilizado en corto tiempo para el mejoramiento de la calidad de suelos pobres.











 text new page (beta)
text new page (beta)