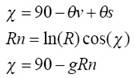Introducción
Por largo tiempo se han estudiado los patrones fenológicos de las plantas terrestres en relación con el medio ambiente y factores endógenos (Rathcke y Lacey, 1985). La caracterización de las etapas de desarrollo de la vegetación (fenología) permite conocer los patrones adaptativos de las plantas ante el cambio climático, al determinar los procesos biogeoquímicos asociados. El análisis del impacto del cambio climático (calentamiento global) en la fenología de la vegetación (Peñuelas y Filella, 2001; Schwartz et al., 2006; Parry et al., 2007), muestra efectos en el tiempo de las fases de desarrollo (floración, inicio del crecimiento del follaje, senescencia, latencia, etc.) de las plantas. Asimismo, los cambios fenológicos de la vegetación inciden en los flujos de carbono y agua entre la atmósfera y las plantas (Running y Nemani, 1991; White et al., 1999; Wilson y Baldocchi, 2000; Kramer et al., 2000), por lo que es importante caracterizar los estadios fenológicos; particularmente en relación con los tiempos de presentación, duración de los eventos y masividad (sincronización del evento en las especies de una comunidad) (Post et al., 2008).
Los patrones fenológicos de la vegetación se estudian por el monitoreo directo de plantas o conjuntos de ellas in situ (Borchert, 1983; Heideman, 1989; Bullock y Solis-Magallanes, 1990). Este esquema tiene altos costos referente a la caracterización de ecosistemas terrestres, por lo que se buscan métodos alternativos tales como la observación en herbarios (Borchert, 1996; Ochoa-Gaona y Cruz-Arias, 2002) o la toma de fotografías digitales montadas en estructuras por encima de la vegetación (Richardson et al., 2009; Parihar et al., 2013), entre otros. Ante esto, la tecnología de los sensores remotos, dado su enfoque espacial exhaustivo y la temporalidad de las visitas a una misma área (pixel), plantea una solución eficiente y de bajo costo (Zhang et al., 2012). La caracterización fenológica del crecimiento del follaje en biomasa o ecosistemas terrestres, a escala regional o global, se ha hecho con los sensores AVHRR (Shabanov et al., 2002; Stöckli y Vidale, 2004), MODIS (Zhang y Anderson, 2004; Zhang et al., 2006) y sensores del satélite Landsat (Fisher et al., 2006). Para la modelación de la fenología se han utilizado diferentes índices de vegetación (IV) (Zhang et al., 2012), de los que sobresalen el NDVI (Rouse et al., 1974), el EVI (Liu y Huete, 1995) y el EVI2 (Jiang et al., 2008), en los que los datos de los IV se filtran para reducir su variabilidad y poder detectar umbrales que definan los estadios fenológicos (Zhang et al., 2012; Atkinson et al., 2012); tarea más o menos exitosa, como una aproximación semi-empírica.
En el caso de la floración de la vegetación, los patrones se han estudiado poco a nivel satelital, por lo que se requiere del diseño de las bases metodológicas para su caracterización, particularmente si se consideran esquemas simultáneos de definición de los umbrales y fases del crecimiento del follaje. La floración es un estadio crítico para la viabilidad de la vegetación (Rathcke y Lacey, 1985), de tal manera que la definición de su presencia y duración, así como su intensidad, requiere del conocimiento de los factores que inciden en los umbrales de su inicio y terminación, los cuales son relativamente poco conocidos (Rathcke y Lacey, 1985; Primack, 1985). En términos económicos, la floración de los bosques tropicales con diferentes niveles de perturbación en la Península de Yucatán, como ejemplo, impacta en la apicultura de la región (INEGI, 2012), por lo que su caracterización es muy importante. Adicionalmente, los bosques tropicales en México almacenan las mayores cantidades de carbono de la biomasa viva de los ecosistemas del país (de Jong et al., 2010), por lo que resulta indispensable conocer los patrones de evolución fenológicos ante el cambio climático y las intervenciones humanas.
Patrones temporales y espectrales de la vegetación
Para poder caracterizar la fenología de la vegetación es conveniente analizarla en términos de dos ciclos relativamente diferentes: crecimiento y decrecimiento del follaje, así como floración; aunque en muchos casos ambos ciclos se presentan en forma combinada.
Crecimiento y Decrecimiento del Follaje
Se muestra en la Figura 1 de forma esquemática la evolución temporal de un índice de vegetación asociado al estadio del desarrollo del follaje y su senescencia, para el caso de bosques perennes (Figura 1a) y caducifolios (Figura 1b). Este patrón es típico en las caracterizaciones cuando se usan sensores remotos (Zhang y Anderson, 2004; Zhang et al., 2006); aunque generalmente el patrón emerge en forma definida después de remover los ruidos espectrales y suavizar los datos (Zhang et al., 2012; Atkinson et al., 2012).
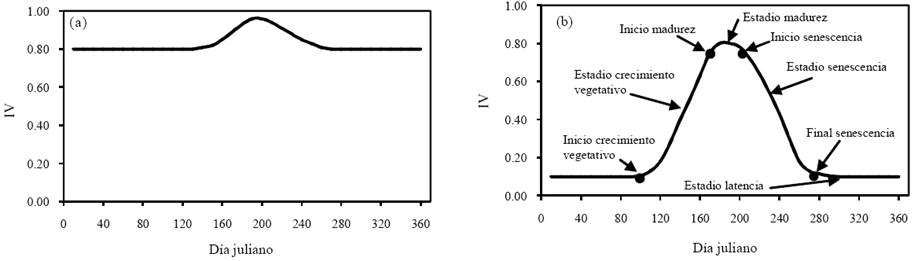
Figura 1 Patrones esquemáticos de la evolución temporal de un índice de vegetación en bosques: (a) perennes; (b) caducifolios. IV = índice de vegetación.
En el caso de bosques con diferentes niveles de caducidad del follaje o bosques mixtos, el patrón temporal es intermedio entre el bosque perenne y el caducifolio (Zhang et al., 2006), lo que se caracteriza por la diferencia entre el IV máximo y mínimo. Este enfoque se utiliza para evaluar la caducidad de un bosque (Cuba et al., 2013).
El patrón de la Figura 1b permite definir los umbrales y la duración de los diferentes estadios del crecimiento del follaje en función de la evolución temporal del IV (Zhang et al., 2012).
Para entender los patrones espectrales de las bandas de R e IRC, en la Figura 2 se muestran simulaciones radiativas asociadas al crecimiento de un cultivo (medio homogéneo o turbio) usando como fondo dos tipos de suelos, con dos niveles de humedad (seco y húmedo) cada uno (Paz et al., 2005), donde se observa que las curvas iso-IAF (IRC = a0 + b0R, donde a0 y b0 dependen del índice de área foliar o IAF) van desde la línea del suelo o IAF = 0 (IRC =aS+bSR, donde aS y bS caracterizan al suelo) hasta degenerar en un punto (R∞, IRC∞) de saturación de las bandas, que representa un medio ópticamente denso o de reflectancias en el infinito. El IRCR∞ representa el valor del IRC asociado a R∞, que es la reflectancia de saturación del R, que alcanza valores para IAF alrededor de 2 (tasa máxima de eficiencia fotosintética). Si se deja fijo al suelo (propiedades ópticas) se obtiene una curva iso-suelo (Figura 2).
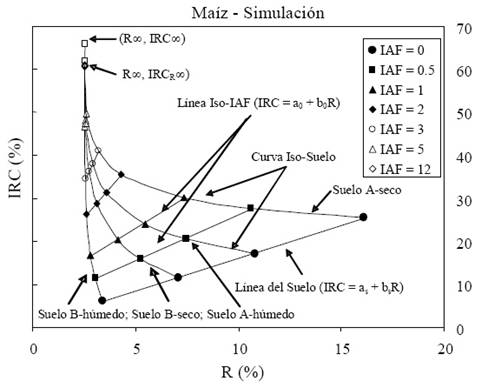
Figura 2 Simulaciones radiativas del crecimiento de un cultivo, que muestra los patrones espectrales asociados al espacio del R-IRC.
Considerando solo el crecimiento vegetativo, en la Figura 2, se observa que la banda del R disminuye y la del IRC se incrementa al crecer el cultivo, lo que denota patrones contrarios entre sí. Para suelos muy oscuros (que no se muestran en la Figura 2), la banda R tiende a cero al inicio del cultivo y se incrementa al crecer la vegetación (Shabanov et al., 2002), de forma que R e IRC muestran patrones similares entre sí.
Al considerar la evolución temporal de la vegetación, las condiciones de iluminación solar cambian, lo que introduce efectos que distorsionan los valores del R e IRC. Para tomar en cuenta este efecto es conveniente estandarizar estas condiciones, mediante un modelo simplificado de geometría de iluminación-visión (Bolaños y Paz, 2010):
donde: θv es el ángulo cenital de visión, θs el ángulo cenital de iluminación solar, χ es una variable angular de posición, R es la reflectancia de cualquier banda, Rn es la reflectancia normalizada por posición angular y efecto de escala (función logaritmo natural) y g es un parámetro que define la geometría sol-sensor.
La ventaja del modelo es que solo tiene un parámetro, el cual puede estimarse con un solo dato de medición. En lo siguiente solo se considerarán reflectancias normalizadas y estandarizadas a la geometría θv = 0° y θs = 30°, de tal forma que todas las mediciones espectrales tienen una base común de observación. La inversión del modelo de geometría sol-sensor, relaciones (1), para estimar reflectancias no normalizadas introduce errores (Bolaños y Paz, 2010), por lo que no es necesaria en términos de su uso en índices de vegetación y evitándose así la propagación de errores.
Las mismas simulaciones radiativas se muestran en la Figura 2 y en la Figura 3, pero normalizadas y estandarizadas, donde las reflectancias se multiplicaron por -1 para hacerlas positivas.
Se observa en la Figura 3 que las curvas iso-suelo reducen su curvatura, lo que aproxima mejores patrones más o menos lineales o exponenciales. Así, se puede usar un índice de vegetación que considere las curvas iso-suelo para el análisis de los patrones temporales de la vegetación (Paz et al., 2011), pero en términos de reflectancias normalizadas y estandarizadas:
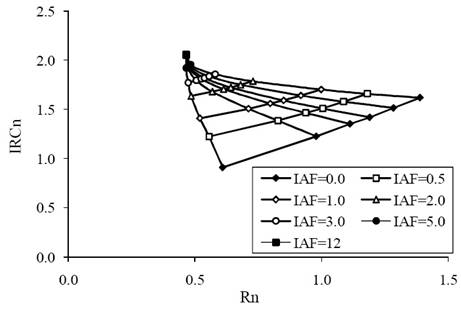
Figura 3 Simulaciones radiativas del crecimiento de un cultivo, que muestran los patrones espectrales asociados al espacio del Rn-IRCn estandarizado por geometría sol-sensor. IAF=índice de área foliar.
En lo siguiente se utilizarán los parámetros dIRCns = 0, dIRCn∞ = 3, a nS= 0 y b nS = 0.8 para los análisis de diferentes experimentos.
La Figura 4 muestra la evolución temporal de Rn e IRCn, así como del IVISn, para el caso de un cultivo de frijol, cuyo experimento esta descrito en Reyes et al. (2011).
Las reflectancias Rn e IRCn (Figura 4) tienen patrones contrarios en la etapa vegetativa y de senescencia, por lo que el IVISn presenta un patrón de crecimiento y decrecimiento, similar al de la Figura 1b. El patrón de la Figura 4, de evolución temporal de reflectancias, normalizadas o no, es similar al que se observa para el caso de bosques en general (Nilson et al., 2012).
El patrón temporal que se discute en la Figura 4 no muestra, aparentemente, la aparición de floración (etapa reproductiva). Para revisar esta situación es conveniente analizar un experimento de maíz, donde el suelo debajo del cultivo se cambió mediante el uso de charolas deslizantes (Bausch, 1993). Las reflectancias se midieron hasta el punto de máximo índice de área foliar solo en la etapa vegetativa y reproductiva. La Figura 5 muestra la evolución de Rn, IRCn e IVISn para el caso de un suelo relativamente oscuro (reflectancia del rojo del 12 %). Se observa en esta figura que la banda Rn muestra un cambio de la etapa vegetativa a la reproductiva con un incremento en su valor, a diferencia del crecimiento vegetativo que se caracteriza por la disminución de Rn (Figura 4 y 5). El índice IVISn muestra el efecto de la etapa reproductiva con una disminución de su valor.
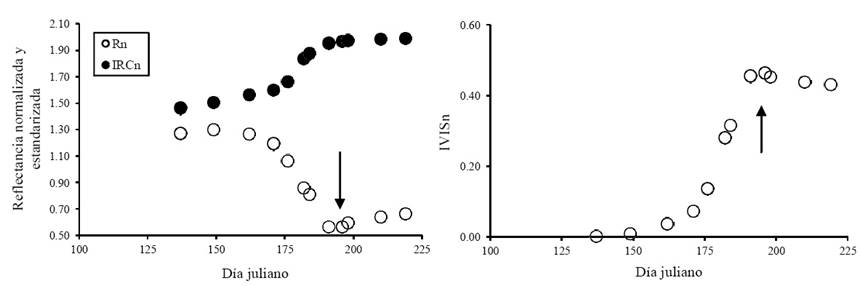
Figura 5 Evolución temporal de Rn, IRCn e IVISn para el caso de un cultivo de maíz, con suelo relativamente oscuro, que muestra el efecto de la etapa reproductiva.
Para el mismo experimento de la Figura 5, pero para el caso de un suelo claro (reflectancia del rojo del 30%), la Figura 6 muestra la evolución temporal de Rn, IRCn e IVISn. Se observa el efecto del suelo (propiedades ópticas) en la etapa reproductiva donde Rn e IVISn permanecen constantes.
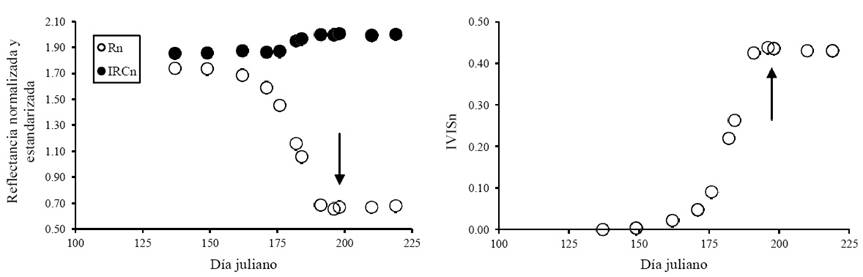
Figura 6 Evolución temporal de Rn, IRCn e IVISn para el caso de un cultivo de maíz, con suelo claro, que muestra el efecto de la etapa reproductiva.
Derivado de la discusión anterior, se puede decir que la etapa reproductiva en un cultivo puede observarse o no (queda enmascarada), lo que depende de la intensidad y propiedades ópticas del fondo del cultivo. Este efecto de floración o etapa reproductiva puede conducir a errores en la estimación de la biomasa aérea cuando se usan sensores remotos (Shen et al., 2010).
Floración
En el caso de la vegetación herbácea se conocen los siguientes estadios asociados a la etapa de floración (Lang, 1965): (a) inducción floral (transición del desarrollo vegetativo al reproductivo en el meristema apical); (b) diferenciación temprana de las yemas florales; (c) desarrollo de yemas florales; y (d) antesis (apertura de las yemas florales y despliegue de flores). Para la vegetación arbórea la fenología es más compleja, pero se distinguen dos mecanismos generales que definen la transición del meristema vegetativo a la iniciación floral: (a) el meristema vegetativo cambia a reproductivo formando el eje de floración y (b) el meristema vegetativo permanece con la producción de flores lateralmente (Halle et al., 1978). Los factores que controlan la inducción floral en los árboles son diferentes de los de la antesis (Borchert, 1983), por lo que es importante diferenciarlos. La inducción floral generalmente está controlada por factores endógenos y, parcialmente, por ambientales (Borchert, 1983; Rathcke y Lacey, 1985).
En bosques tropicales caducifolios, en alguna medida, los eventos de precipitación en el periodo seco generalmente se asocian a la aparición de la floración (Opler et al., 1976; Heideman, 1989; Borchert, 1983 y 1996; Valdez-Hernández et al., 2010). El control de la floración (parcialmente) por factores climáticos permite utilizar modelos fenológicos con relativo éxito (Li y Zhou, 2012; y modelos revisados en este trabajo). No obstante esta situación, la información meteorológica en México es escasa y desactualizada para utilizar esta estrategia para caracterizar la fenología de la vegetación natural.
En los bosques tropicales la floración se presenta bajo dos mecanismos: (a) floración (expansión de yemas florales) acompañada de expansión de nuevas hojas y (b) floración sin hojas (expansión de yemas florales) (Borchert et al., 2004; Valdez-Hernández et al., 2010).
En bosques tropicales con caducidad del follaje, la floración suele presentarse posterior o al término de la caída de hojas en la primavera (Borchert, 1996; Lobo et al., 2003; Valdez-Hernández et al., 2010), aunque también puede haber presencia de nuevo follaje y su expansión (Bullock y Solis-Magallanes, 1990; Kikim y Yadava, 2001). En bosques tropicales caducifolios generalmente se presenta un evento de floración y en los perennes dos o tres (Valdez-Hernández et al., 2010). En términos de los estratos de los bosques, la fenología del estrato superior e inferior casi siempre están sincronizadas (Kikim y Yadava, 2001), por lo que la vegetación herbácea y arbustiva presentan patrones fenológicos similares a la vegetación arbórea, la cual tiene una sincronización entre especies para la presencia colectiva de eventos de floración (Opler et al., 1976; Heideman, 1989; Bullock y Solis-Magallanes, 1990; Borchert et al., 2004) que pueden asociarse con la coevolución de las plantas y sus polinizadores (Rathcke y Lacey, 1985).
La discusión anterior, en términos espectrales, plantea que la floración acompañada por la expansión del follaje puede definirse por un incremento del IV (incremento del follaje) y después una reducción con la apertura de la flores; aunque estos eventos pueden, o no, estar sincronizados. En el caso de floración sin expansión del follaje, el incremento de tejido fotosintético (yemas y botones florales) implica un incremento (de menor magnitud al del follaje) del índice de vegetación (no necesariamente detectable con sensores remotos) y, posteriormente, una disminución de éste debido a la aparición de flores. Estos mecanismos de incremento y decremento del IV se asocian con la vegetación caducifolia, pero no necesariamente pueden aplicarse a la vegetación perenne, en donde la reflectancia del fondo verde predomina sobre la de la floración, a menos que su intensidad modifique el patrón de color.
El uso de cámaras digitales para detectar los eventos de floración muestra que la banda del rojo se incrementa (inicio de la floración a su pico) y después se reduce (pico de la floración a final) (Crimmins y Crimmins, 2008; Richardson et al., 2009). Desafortunadamente, las cámaras digitales normales no tienen filtros para observar el infrarrojo cercano, por lo que su información es limitada. En experimentos de floración en vegetación herbácea (número de flores), se observa que con el incremento de la floración las bandas del R e IRC crecen simultáneamente (Hunt y Williams, 2006; Chen et al., 2009). En el caso de bosques, Nilson et al. (2012) muestran que la banda del R se incrementa y disminuye en la ocurrencia de la floración, en forma similar que para el caso de la floración en vegetación herbácea. La banda del IRC, con ruido, muestra un patrón similar, pero no sincronizado, aparentemente, con la banda del R. Algo similar se observa en vegetación herbácea (Hunt y Williams, 2006).
De la revisión de los patrones temporales y espectrales de la vegetación, se concluye que el conocimiento asociado a la floración es todavía reducido, por lo que resulta importante generar una aproximación experimental que contribuya a definir los alcances y limitaciones de uso de índices de vegetación para su caracterización de esta etapa fenológica; además de lo que se discutió previamente, en el sentido de que la floración en presencia del crecimiento del follaje puede producir un cambio en los IV.
El objetivo principal de este trabajo fue caracterizar la etapa reproductiva de los bosques tropicales caducifolios, a partir de datos espectrales de un experimento simulado de componentes de la vegetación, a fin de sentar bases para el desarrollo de modelos fenológicos que puedan calibrarse con información de sensores remotos. Para ello se analizaron los patrones espectrales de diferentes tipos de vegetación de modo que pudiera caracterizarse en forma apropiada, así como definir los alcances y límites del uso de la información espectral. Tomando como referencia las bandas espectrales que usan la mayoría de los sensores remotos en satélites, en este trabajo se decidió considerar solo las bandas del rojo (R) e infrarrojo cercano (IRC), que se usan en los índices espectrales de la vegetación para caracterizar el crecimiento y senescencia de las plantas, dado su alto contraste en estos tipos de cobertura.
Materiales y métodos
Con el objetivo de aproximar el evento de floración en un bosque tropical caducifolio o vegetación caducifolia en general, se desarrolló un experimento usando el enfoque propuesto por Ge et al. (2006), donde la vegetación y sus estadios fenológicos se generan a partir de componentes (por ejemplo: tallos, yemas, flores abiertas y postflores) al cambiar sus proporciones. Para el experimento se usaron flores de plantas ornamentales del género Chrysanthemum sp. de tres colores (blancas, amarillas y lilas) en diferentes etapas fenológicas (fácilmente de conseguir en la región), así como follaje verde de algunas otras especies, ramas senescentes y frutos de algunos arbustos. Para las mediciones de reflectancias se utilizó un radiómetro con resolución espectral de 5 bandas (Azul, Verde, Rojo, Infrarrojo Cercano e Infrarrojo Medio; similares a las bandas del sensor TM del satélite Landsat), un datalogger para el almacenamiento de datos y una cámara fotográfica digital. Las mediciones se realizaron a una altura de 120 cm, por lo que el área de visión circular tuvo un diámetro de 60 cm.
Los estadios simulados se muestran en el Cuadro 1, en donde los estadios del 1 al 3 corresponden a la pre-floración, los estadios del 4 al 6.66 a la floración y los 7 y 8, a la post floración. Al usar la escala fenológica BBCH (Meier, 1977) se generó una escala que aproxima la evolución temporal de los estadios simulados, particularmente en el caso del periodo del pico de la floración, hasta la caída total de las flores (del 4 al 6.66).
Los estadios de pre floración se muestran en la Figura 7 y en la Figura 8 los estadios asociados a la floración. Se observa que los escenarios simulados son aproximaciones gruesas a los eventos fenológicos de la vegetación caducifolia, pero capturan la esencia del proceso. El experimento se diseñó para generar un análisis cualitativo de la evolución de las reflectancias y el IV para que, en conjunto con la evidencia experimental previa, fuera posible desarrollar un modelo fenológico espectral y definir los alcances y limitaciones en el uso de los índices de vegetación.
Los estadios pre floración fueron los mismos para todos los tipos de flores: blanca, amarilla, lila y mezcla de todas. Los estadios post floración también fueron los mismos.
Resultados y discusión
En la Figura 9 se muestra el Rn, IRCn e IVISn para los diferentes tipos de flores en los estadios de la floración (4 al 6.66), los cuales se enumeraron por conveniencia del 1 (inicio o estadio 4) al 5 (final o estadio 6.66), con 3 en el pico (estadio 6).
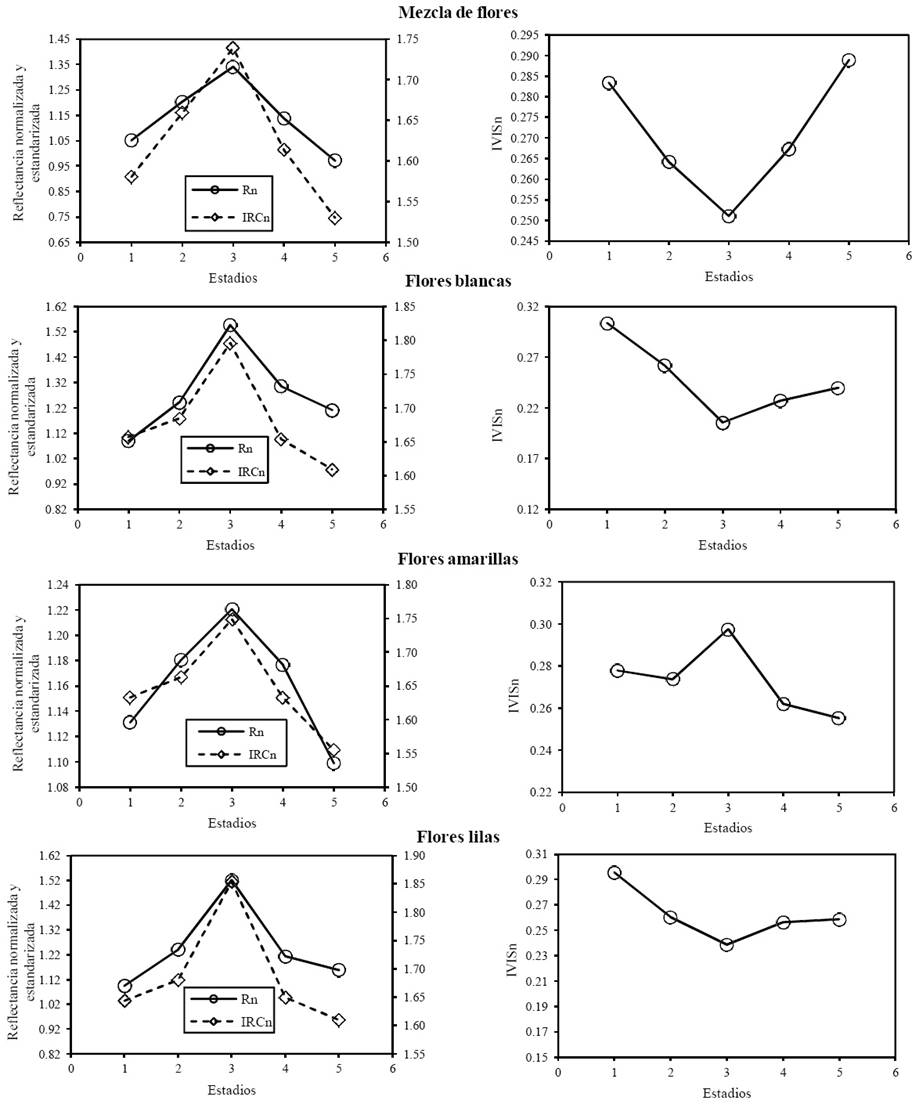
Figura 9 Estadios de la floración donde estadio 1 = inicio, 3 = pico y 5 = final. Rn e IRCn son reflectancias normalizadas y estandarizadas del rojo e infrarrojo respectivamente, que toman valores de 0.8 a 2.30 para ángulos de iluminación de >0° hasta 30° y pueden alcanzar valores de 3.98 a 60° de iluminación.
Con relación a la banda del rojo e infrarrojo cercano, los patrones muestran que ambas bandas crecen y decrecen en forma simultánea, tal como lo observaron otros autores (Crimmins y Crimmins, 2008; Richardson et al., 2009; Nilson et al., 2012). El IVISn decrece hasta el pico de la floración y después crece hasta el término de la misma; aunque en algunos casos este tipo de crecimiento no se observa y es contrario a lo esperado (flores amarillas; Shen et al., 2009).
Los estadios pre floración, floración y post floración en términos del IVISn se muestran en la Figura 10.
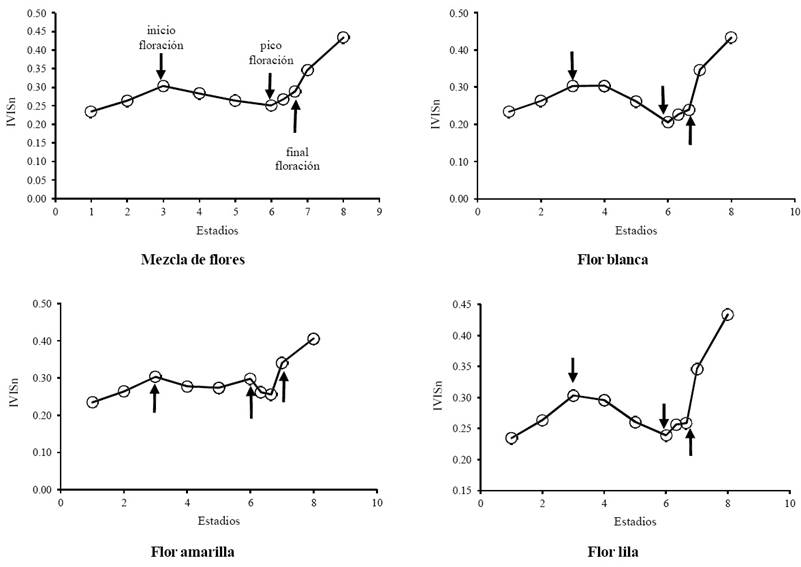
Figura 10 Índice IVISn para los diferentes tipos de flores, en los estadios de pre-floración, floración y post floración.
Los resultados del IVISn para los experimentos, muestran que la floración es detectable si se presenta un incremento de tejido fotosintético (pre floración) y, que el pico de la floración está asociado, generalmente, al valor más bajo del índice, antes del inicio del crecimiento del follaje (post floración). El uso de IV desarrollados para analizar el crecimiento de las hojas (Rn e IRCn tienen patrones contrarios) tiene limitaciones intrínsecas con relación a la floración (Rn e IRCn tienen patrones similares). Un modelo aproximado de la fenología completa de los bosques tropicales se muestra en la Figura 11, en donde no es posible discriminar el término de la floración y el inicio del follaje.
El patrón de la floración que se muestra en la Figura 11 solo se detecta cuando la floración es intensa y sincronizada, además de que el fondo de la vegetación no es tan claro para enmascarar el color de las flores y sus mezclas.
Conclusiones
La revisión y análisis de los patrones temporales de las bandas del rojo e infrarrojo cercano, normalizadas y estandarizadas por efecto de la geometría sol-sensor, mostró tendencias contrarias (una banda se incrementa y la otra se reduce) que permiten que los índices de vegetación generen crecimiento y decrecimiento (senescencia) del follaje. Cuando se presenta un cambio de la etapa vegetativa a la reproductiva en un cultivo agrícola, por ejemplo, los índices de vegetación detectan este estadio fenológico como contrario al patrón vegetativo o sin cambio, lo que depende del tipo de fondo debajo del cultivo.
En el caso de la vegetación arbórea caducifolia, la revisión experimental muestra que la floración se asocia a un incremento y decremento de la banda del rojo. El análisis de los resultados del experimento de este trabajo, para simular los estadios pre floración, floración y post floración, muestran que en la floración las bandas del rojo y del infrarrojo cercano tienen tendencias similares (crecen o decrecen al mismo tiempo), por lo que los índices de la vegetación responden con variaciones contrarias y pequeñas, en relación al follaje. Bajo la condición de un incremento del tejido fotosintético en la pre floración, es posible desarrollar un modelo fenológico que estime el inicio de la inducción floral, el inicio de la floración y su pico, aunque el término de la floración resulta difícil de detectar, cuando se enmascara por el inicio del crecimiento vegetativo del follaje.
Este trabajo muestra que es necesario desarrollar un nuevo índice de vegetación que detecte la floración, al considerar que las bandas del rojo e infrarrojo cercano tienen tendencias similares, contrario a los patrones de crecimiento del follaje para los que los índices fueron desarrollados.











 nueva página del texto (beta)
nueva página del texto (beta)