Introducción
El rosal, actualmente es el cultivo florícola con mayor superficie cultivada bajo invernadero en el Estado de México, cuenta con una superficie de 668 ha que corresponden a un volumen de producción de 5 302 996 toneladas, principalmente en los municipios de Villa Guerrero, Tenancingo y Coatepec Harinas (SIAP, 2010). En 2008, en el Estado de México se cultivaron 646 ha de rosales, siendo los municipios de Villa Guerrero y Tenancingo los mayores productores, tan solo en ambos municipios se cultivaron 550 ha (SAGARPA, 2008). El rosal es la planta de jardín más popular en el mundo y comercialmente es una de las más importantes como flor de corte (Yamada et al., 2007). La producción de la rosa es altamente dependiente de insumos químicos, lo que ha propiciado un incremento en el costo de producción y un alto impacto ambiental. En los últimos años se ha propuesto el uso de moléculas señal como el ácido ascórbico (AA), ácido salicílico (AS) y peróxido de hidrógeno (H2O2), entre otros, para incrementar la calidad y productividad del cultivo, dichas moléculas son económicas e inocuas (Mora-Herrera et al., 2011).
El AA está presente en cloroplastos, citosol, vacuolas y espacio apoplástico. El AA es quizás el antioxidante no enzimático más importante en las plantas, que participa en la defensa contra el estrés oxidativo biótico y abiótico por su función en la degradación del H2O2 vía el ciclo del glutatión- ascorbato (Smirnoff, 1996). El AA también participa en otros procesos fisiológicos tales como: fotosíntesis, cofactor enzimático, homeostasis del sistema redox, precursor en las rutas de síntesis de moléculas del metabolismo primario y secundario (Smirnoff, 1996) y regulador de la actividad enzimática de las peroxidasas (Sánchez et al., 1997; Stasolla y Yeung, 2007). Además está involucrado en el crecimiento, desarrollo y modulación del ciclo celular así como de la división y elongación celular (De Pinto y De Gara, 2004).
Existen evidencias de que el AA aplicado exógenamente en algunos cultivos promueve el crecimiento, lo que lleva a un mejor rendimiento (El-Tohamy et al., 2008); se ha demostrado que esto está asociado con un incremento en los pigmentos fotosintéticos, en canola (Sakr y Arafa, 2009), papa (Romero-Romero y López-Delgado, 2009), berenjena (Abd El-Aziz et al., 2006) y crisantemo (Mora- Herrera et al., 2011). Por otro lado, las POX participan en varias funciones fisiológicas de las plantas tales como: lignificación, entrecruzamiento de polisacáridos de la pared celular, oxidación del ácido indolacético, regulación de la elongación celular y oxidación de fenoles ligados al crecimiento (Yoshida et al., 2003).
El objetivo de este estudio fue evaluar el efecto del ácido ascórbico sobre el contenido de pigmentos fotosintéticos, actividad enzimática de la POX, y crecimiento vegetal del cultivo del rosal variedad Fetera®.
Materiales y métodos
El trabajo se realizó en un invernadero semi- tecnificado en el Centro Universitario Tenancingo de la Universidad Autónoma del Estado de México (UAEM), ubicado en el Km 1.5 de la carretera Tenancingo-Villa Guerrero, Estado de México, en los 18°57’N y 99°35’O,a un aaltitud de 2066 m.
Como material biológico se utilizaron plantas de rosal (Rosa sp, variedad Fetera®) sembradas en camas de suelo enriquecido con materia orgánica y cascarilla de cebada en septiembre de 2010, como se realiza en la región, establecidas en el invernadero de rosa para investigación del Centro Universitario UAEM Tenancingo. El experimento se llevó a cabo en los meses de marzo a julio de 2011.
Aspersiones de Ácido Ascórbico
Se hicieron soluciones de ácido ascórbico (Reasol) con concentraciones de 0 (testigo), 600 y 1200 mg L-1 ajustadas a un pH 5.6 con KOH 1N, las cuales se prepararon 24 horas antes de las aplicaciones para que el AA quedara en su forma oxidada (Dehidroascorbato DHA) y se les agregó polisorbato 20 (Tween, Reasol) como surfactante al 0.01% (Mora-Herrera et al., 2011). Las aspersiones se hicieron sobre el haz de las hojas de la planta de rosal (35 mL por planta) dos veces por semana durante el tiempo que duro el experimento. Las aspersiones se realizaron en basales en pleno desarrollo vegetativo hasta floración.
La aplicación se realizó con gota fina usando un aspersor manual (Venus-Pro) con capacidad de 2 L, con boquilla de cono.
Parámetros Evaluados
Las variables evaluadas fueron: actividad enzimática de la peroxidasa (POX) y pigmentos fotosintéticos, así como número de yemas por tallo, número de laterales, altura y grosor de los tallos. Todas las variables fueron evaluadas tres meses después de iniciada la aplicación de AA. El experimento se realizó con 90 plantas (30 plantas por tratamiento).
Cuantificación de la actividad enzimática de la Peroxidasa (POX). La extracción de proteína se realizó de acuerdo al método de Anderson et al. (1995); se maceró un fragmento (100 mg) apical de hoja madura de la parte central del tallo principal. La proteína total se extrajo en una proporción de 1:4 mL con el amortiguador de fosfato de potasio (Baker; 50 mM, ajustado a un pH 7.2) conteniendo 5 mM de dithiothreitol (Sigma; DTT), 1 mM de ácido etilen diamino tetracético (Sigma; EDTA) y 2% de polyvinyl pirrolidona (Baker; PVP). El extracto se centrifugó a 10 000 rpm durante 10 minutos y se mantuvieron a una temperatura de 4 °C. El sobrenadante se usó para cuantificar proteína y actividad enzimática de la POX. La actividad enzimática de la POX se midió de acuerdo al método descrito por Mora Herrera et al. (2011), en una mezcla de reacción con amortiguador de fosfato de sodio 50 mM ajustado a un pH 7.0, 3.33 mM de guaiacol, 4 mM de H2O2 y 0.020 mL del sobrenadante de la muestra en un volumen final de 3 mL. La reacción se inició con la adición del sobrenadante. La oxidación del sustrato (guaiacol) se midió por el incremento en la absorbancia a 470 nm durante tres minutos en intervalos de 30 seg.
Para expresar la actividad enzimática de la POX se usó el coeficiente de extinción del guaiacol ε = 2.6 mmol-1 mm-1, en la ecuación nmol min-1 mg-1 = (ε) (volumen final/volumen de la muestra) (mg de proteína). La cuantificación de proteína se realizó con un espectrofotómetro tipo nanodrop (Thermo Científica) usando una longitud de onda de 280 nm.
Cuantificación de los pigmentos fotosintéticos. La cuantificación de los pigmentos fotosintéticos se hizo de acuerdo al método de Lichtenthaler y Wellburn (1983). Para ello 50 mg de tejido de hojas maduras tomadas de la parte central del tallo principal, se maceraron en 2 mL de acetona previamente refrigerada (4 °C) al 80%. El extracto se centrifugó a 2500 rpm durante 10 min en una centrífuga Eppendorf AG, 22331 Hamburg y el sobrenadante se recuperó y ajustó a 2 mL. Se midió la absorbancia en un espectrofotómetro (Thermo scientific, Genesys 10-S) a 470, 646 y 663 nm. Las concentraciones de clorofila a (Chl a), clorofila b (Chl b), xantofilas y carotenoides (x+c) se calcularon empleando las fórmulas:
Los resultados obtenidos se expresan en mg g-1 de peso fresco (PF).
Diseño Experimental
Se utilizó un diseño experimental completamente al azar, con 90 plantas divididas en tres bloques con 10 plantas por tratamiento. Se consideraron 10 plantas de rosal como la unidad experimental. Con los datos se realizó un análisis de varianza (ANOVA) y una comparación de medias (Tukey, P ≤ 0.05) mediante el programa estadístico StarGraphics plus versión 5.0.
Resultados y discusión
Las plantas de rosal variedad Fetera® tratadas con AA 1200 mg L-1, mostraron un incrementó en la longitud y el diámetro del tallo principal, así como yemas y laterales, con respecto al tratamiento testigo (Cuadro 1), este incremento en el crecimiento vegetal puede llevar a un posible aumento en la productividad mediante el manejo del cultivo indicado. La función del AA aplicado de forma exógena en el incremento de la productividad, también fue reportado en caobas, en donde las aspersiones de AA contrarrestaron el efecto de la salinidad ayudando a la división, elongación celular y actividad meristemática (Abd El- Aziz et al., 2006). En la berenjena se reportó que el AA incrementó número de hojas, de ramas y peso fresco de las plantas (El-Tohamy et al., 2008). En el trigo las aspersiones de AA favorecieron la capacidad fotosintética en las hojas e incrementaron la actividad enzimática de la catalasa, aún en condiciones salinas (Athar et al., 2008). En gladiolos el AA ayudó en el desarrollo vegetativo aumentando el número de hojas y el crecimiento de las plantas, e induciendo la floración (Abd El Aziz et al., 2009); en tubérculos de papa el AA aumenta pigmentos fotosintéticos y la productividad en el cultivo (Romero- Romero y López-Delgado, 2009); en haba el AA favoreció el desarrollo vegetativo (Younis et al., 2009) y en crisantemo el AA favoreció significativamente la longitud del tallo, peso seco, número de botones y tallos por planta con respecto al testigo (Mora-Herrera et al., 2011). Con estas evidencias y los resultados obtenidos en el cultivo del rosal en esta investigación, se demuestra la función del AA en favorecer el desarrollo y crecimiento de un gran número de cultivos.

Los resultados son el promedio de 30 plantas por tratamiento. ± e. s. † valores con la misma letra son estadísticamente iguales de acuerdo con la prueba de Tukey (P ≤ 0.05)
Cuadro 1 Efecto del ácido ascórbico (AA) en la longitud y diámetro del tallo, número de yemas y laterales en plantas de rosal variedad Fetera®.
Por lo que se sugiere que este compuesto sea incluido en el manejo integrado del cultivo de rosa, ya que el incremento de la productividad depende de la cantidad de área foliar activa, así como la calidad del tallo floral depende de la longitud y grosor, variables que fueron incrementadas con AA a dosis de 1200 mg L-1; además, su aplicación es económica e inocua al ambiente y a la salud como lo menciona Mora-Herrera et al. (2011). Autores como Davey et al. (2000) y Pastori et al. (2003), señalan que al AA favorece la lignificación, división celular y en la respuesta de la planta al ataque de patógenos.
El tratamiento de AA 1200 mg L-1 incrementó significativamente el contenido de la clorofila b, con respecto al testigo (Figura 1). Es posible que el AA asperjado a las plantas de rosal en el presente experimento, haya participado en varios eventos fisiológicos induciendo incremento en el desarrollo debido a que el AA participa en actividades biológicas en la célula vegetal como: a) cofactor de enzimas, b) fotoprotector, c) donador/dador de electrones en las reacciones de la membrana plasmática o en los cloroplastos, d) crecimiento de la pared celular, e) elongación celular y resistencia a diferentes tipos de estrés abióticos (Smirnoff, 1996; Smirnoff y Wheeler, 2000; Davey et al., 2000).
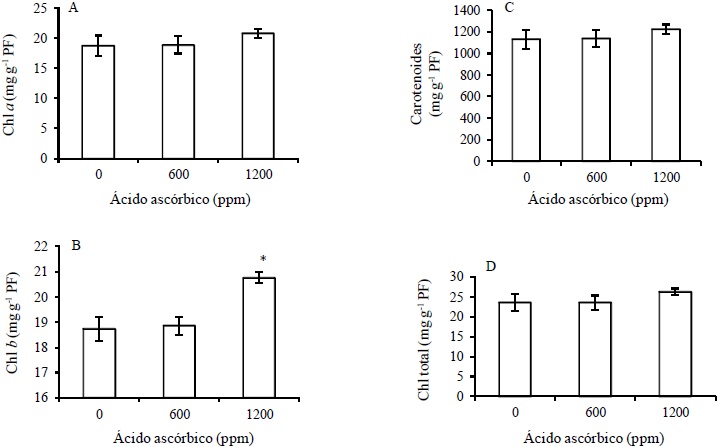
Los resultados son el promedio de 9 muestras medidas por triplicado por tratamiento ± e.s. (*) Significativamente diferentes con respecto al testigo (Tukey, 0.05).
Figura 1 Efecto del ácido ascórbico (AA) en pigmentos fotosintéticos: A) Clorofila a, B) Clorofila b, C) Carotenoides y D) Clorofila total en plantas de rosal variedad Fetera®.
La importancia de los pigmentos fotosintéticos en el desarrollo y crecimiento de las plantas es primordial debido a su participación en la fotosíntesis y por lo tanto en la producción de fotosintatos (Smirnoff, 1996). Se ha demostrado que el AA asperjado en plantas de soya acelera los procesos fotosintéticos (Golan-Goldhirsh et al., 1995) a través de la inducción del contenido de clorofila (Dolatabadian y Jouneghani, 2009; Khan et al., 2010), lo que lleva a incrementar los azúcares reductores (Abd El-Aziz et al., 2006). Por lo que en este trabajo, el incremento de la clorofila b mediada por AA observada en el cultivo de rosal, coadyuvó al incremento vegetativo encontrado en el cultivo.
Se demostró que en plantas de berenjena, el AA asperjado incrementa el contenido de N (nitrógeno), P (fosforo) y K (potasio) lo que está implicado en el crecimiento y desarrollo (Abd El-Aziz et al., 2006; El-Tohamy et al., 2008). De acuerdo a Smmirnof (1996), el AA tiene una función central en la fotosíntesis como disipador de electrones, principalmente en el exceso de luz. Y una de las funciones de la clorofila b es la de disipar energía durante la radiación, por lo que el AA indujo este pigmento como parte de su función en la fotosíntesis.
Con respecto a la actividad enzimática de la POX, se encontró que esta tuvo un incremento en las plantas de rosal variedad Fetera® tratadas con 600 mg L-1 de AA con respecto al testigo (Figura 2). Este resultado confirma la función de señal del AA, donde concentraciones bajas pueden generar respuestas que varían de acuerdo al cultivo y condiciones experimentales (Smmirnof, 1996; Romero-Romero y López-Delgado, 2009). Así, se ha encontrado que en trigo (Khan et al., 2006; Athar et al., 2008), canola (Dolatabadian et al., 2008) y frijol (Dolatabadian y Jouneghani, 2009) la aplicación de AA no modifica la actividad enzimática de la POX, aunque afecta otras enzimas antioxidantes (Athar et al., 2008). Mientras que, en crisantemo la aplicación de AA sí incrementa la actividad de la POX (Mora-Herrera et al., 2011). Algunas de las funciones fisiológicas de las peroxidasas en las plantas son: a) participación en la biosíntesis del etileno, b) defensa contra infecciones, c) cicatrización y d) lignificación de la pared celular (McInnis et al., 2006). De ahí la importancia de que el AA favorezca la inducción de la actividad de la POX en el cultivo del rosal.
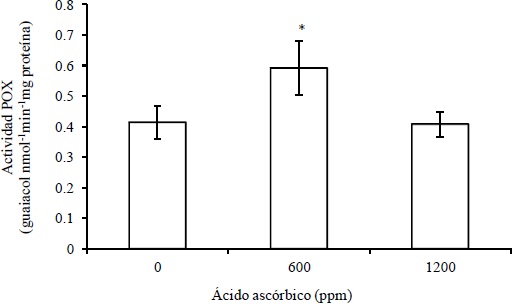
(*) Significativamente diferentes con respecto al testigo (Tukey, 0.05).
Figura 2 Respuesta de la aplicación de ácido ascórbico sobre la actividad enzimática de la POX en plantas de rosal variedad Fetera®.
De acuerdo a resultados de investigaciones similares la actividad enzimática de la POX va a depender además de la concentración de aplicación, de la forma y número de aplicaciones, del tipo y etapa fenológica del cultivo tratado, entre otros factores.











 nueva página del texto (beta)
nueva página del texto (beta)



