Introducción
El suelo es un componente natural de los sistemas terrestres, que influye en la regulación y purificación del agua, gases, interviene en el intercambio gaseoso (especialmente del dióxido de carbono), tiene la capacidad de soportar vida vegetal y animal, es un detoxificante de los residuos urbanos e industriales, contribuye en la descomposición de la materia orgánica (MO) y es parte del paisaje (Angers y Caron, 1998).
Uno de los factores que influye en las funciones del suelo es su estructura y uno de los indicadores más empleado para su estudio es la estabilidad de agregados. La agregación del suelo (Figura 1) es el resultado de la floculación, cementación y el reacomodo de las partículas del mismo (Six et al., 2000) y es controlada por el contenido de carbono orgánico del suelo (COS), la biota, las asociaciones iónicas y el contenido de arcillas y carbonatos (Duiker et al., 2003). Según Six et al. (2000) la formación y estabilización de agregados se lleva a cabo por la unión de materia orgánica particulada (MOP) unida a excreciones de microorganismos y mucus de lombrices. Si la actividad microbiana decrece, disminuye la formación de agregados y eventualmente se generarán perturbaciones. Disrupciones como la labranza disminuyen la formación de nuevos microagregados dentro de macroagregados y la protección que la materia orgánica del suelo (MOS) ejerce sobre estos microagregados (Figura 1).
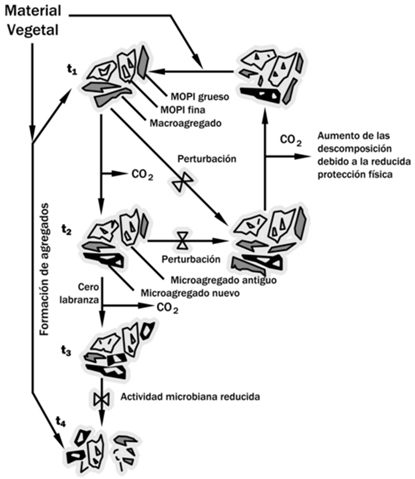
Figura 1 Ciclo de vida de un macroagregado. Se demuestra la formación de microagregados al interior de macroagregados. Adaptado de Six et al. (2000).
La estructura del suelo es definida como la forma en que se agrupan las partículas individuales de arena, limo y arcilla generando espacios vacíos denominados poros (Bronick y Lal, 2005). La estructura está relacionada directamente con las fases sólida, líquida y gaseosa del suelo, y en particular con su dinámica. Es de vital importancia para el funcionamiento del suelo ya que regula el flujo de agua, nutrientes y el almacenamiento y el flujo de gases, lo cual influye en la actividad y desarrollo de los organismos vivos (Angers y Caron, 1998).
Entre los principales factores que influyen en la estructura y agregación del suelo se encuentran: (1) fauna del suelo, (2) microorganismos, (3) variables ambientales (4) agentes cementantes inorgánicos y (5) las raíces. En las últimas décadas se ha publicado una gran cantidad de revisiones bibliográficas acerca de la importancia de la estructura del suelo, dos de las más importantes y actuales son las de Six et al. (2004) y Bronick y Lal (2005). Las revisiones sobre la importancia de los sistemas radicales y su relación con la estructura del suelo, en los ecosistemas y la agricultura han sido menos numerosas. Destacan las de Gregory et al. (2006) y Hinsinger et al. (2009) sobre la dinámica de las propiedades bioquímicas y biogeoquímicas de la rizósfera y su relación con la agregación del suelo.
La investigación en las últimas cinco décadas se ha centrado en dilucidar los mecanismos por los cuales las raíces afectan la estabilidad del suelo; cabe destacar, que la mayor parte de ésta, se ha realizado en suelos agrícolas. La finalidad de dichos estudios ha sido el establecimiento de parámetros morfo-funcionales e indicadores de la calidad del suelo con fines de aprovechamiento agroecológico y conservación, tales como: profundidad de enraizamiento, contacto raíz- agregado, densidad de raíces, distribución de raíces en el perfil arable; tamaño, distribución y forma de los poros creados por raíces y estructura. (Six et al., 2004; Gregory et al., 2006; Powlson et al., 2011). En varios de estos trabajos se encontraron ciertos impedimentos metodológicos para estudiar los sistemas radicales de forma más precisa, por lo que la investigación actual se ha orientado hacia el uso de nuevas metodologías no invasivas de laboratorio (ex situ) y en campo (in situ). Entre éstas, se puede citar a la tomografía axial computarizada, la resonancia magnética y la utilización de rizómetros en el campo, entre otras (Asseng et al., 2000; Faget et al., 2012).
Los principales procesos por los cuales las raíces afectan la agregación, pueden ser agrupados en cinco categorías: (1) penetración de raíces, (2) modificación del régimen hídrico, (3) producción de exudados, (4) entrelazamiento de agregados causados por las raíces y (5) descomposición de raíces muertas (Angers y Caron, 1998; Six et al., 2004; Bronick y Lal, 2005).
Un aspecto fundamental en las relaciones suelo-raíz es que los sistemas radicales de las distintas especies vegetales afectan de manera diferente la agregación del suelo (Whalley et al., 2005). El impacto del crecimiento de las raíces sobre la estructura del suelo es diferente en los sitios donde habitan vegetación natural, plantas cultivadas o pastizales; por lo tanto, el tipo de vegetación modifica parámetros físicos y químicos del suelo como densidad aparente, humedad relativa, porosidad total, porosidad interna de los macroagregados y pH, entre los más importantes. Tanto los suelos con vegetación natural como los pastizales presentan, por lo general, una mayor diversidad biológica que beneficia la estructura del suelo en comparación con los suelos con plantas cultivadas (Six et al., 2004). En un estudio realizado en suelos agrícolas de Jalisco en donde se compararon diferentes usos del suelo, Martínez-Trinidad et al. (2008) reportaron que al incrementar el manejo de los suelos, hay una disminución de los valores de variables de la estructura del suelo, como la porosidad interna de los agregados. La investigación sobre el crecimiento de las raíces en pastizales y suelos cultivados, es más abundante que en los suelos con vegetación natural, debido a que este tipo de estudios se han enfocado mayoritariamente en la producción agrícola y en menor medida, a la conservación del recurso suelo.
Otro factor que afecta el desarrollo de las raíces y por consecuencia su relación con la formación de agregados del suelo es el manejo agronómico que se le dé a los suelos arables. La aplicación de operaciones de labranza convencional (LC) conduce al decremento de parámetros físicos relacionados con la estructura del suelo (conductividad hidráulica, porosidad y resistencia a la penetración entre los más importantes) (Ramírez et al., 2006), mientras que otros tipos de manejo agronómico como la aradura con cinceles, labranza mínima, siembra directa y la agricultura de conservación (cero labranza, incorporación de residuos vegetales y rotación de cultivos) mejoran considerablemente el desarrollo de los sistemas radicales, incrementando el valor de los parámetros relacionados con la estructura y agregación del suelo (Shaxson y Barber, 2003; Govaerts et al., 2006; Ramírez et al., 2006; Thierfelder et al., 2005). Son este tipo de estudios comparativos de diferentes manejos agronómicos, los que han generado mayor información acerca de la dinámica, formación, estabilidad y estructura suelo y de donde han sido identificados los principales procesos por los cuales las raíces afectan la agregación del suelo (Dorioz et al., 1993; Degens, 1997; Angers y Caron, 1998; Six et al., 2000, 2004; Bronick y Lal, 2005).
Los cambios tecnológicos en la agricultura, la creciente importancia del cambio climático y el papel central que tienen las raíces en procesos como el secuestro del carbono, obligan a revisar permanentemente el estado del conocimiento sobre las raíces en relación con la estructura del suelo (Powlson et al., 2011).
Con base en los antecedentes aquí referidos, el objetivo de este estudio fue realizar una revisión de las investigaciones acerca de los procesos físicos y bioquímicos mediante los cuales las raíces afectan la formación de los agregados del suelo, con énfasis en suelos agrícolas con diferentes manejos agronómicos.
Arquitectura de las raíces y la estructura del suelo
La arquitectura de las raíces favorece cambios en la estructura del suelo, principalmente en la conectividad de los poros, los cuales se reordenan mejorando el drenaje e incrementando los potenciales mátricos de la rizósfera, observable en todos los casos por un mayor número de macroporos en la rizósfera (Whalley et al., 2005). Sin embargo, el efecto de la penetración de las raíces sobre la agregación se da a través de una interacción entre la arquitectura de las raíces (por ejemplo, magnitud de ramificaciones laterales o grosor) y las características estructurales del suelo (granulometría y compactación) (Carter et al., 1994).
Los sistemas radicales de diferentes especies vegetales, dependiendo del tipo de suelo y del sistema de manejo interactúan de manera disímil, generando estructuras y niveles de agregación variables. (Chan y Hennan, 1996; Walley et al., 2005; Greogory et al., 2006). Los distintos sistemas radicales explotan porciones diferentes de suelo, por lo tanto, están sujetas a diversas condiciones ambientales y tienen una actividad metabólica diferenciada (Fitter, 2002).
La arquitectura radical puede ser modificada por el manejo agronómico que se practique en los suelos agrícolas; los principales cambios que se presentan son: (1) modificación en la distribución espacial de las raíces (Ball-Coelho et al., 1998; Qin et al., 2005), (2) cambio en la longitud de las raíces (Hilfiker y Lowery, 1988; Holanda et al., 1998, Qin et al., 2005), (3) alteración en la biomasa radical (Dwyer et al., 1996) y (4) cambios en la formación y estabilidad de los agregados del suelo (Ball-Coehlo et al., 1998; Rasse et al., 2000; Lipiec et al., 2006). La alteración de estos parámetros morfológicos junto con la rotación de cultivos puede influir de manera benéfica en la productividad de los agroecosistemas (Gregory et al., 2006).
Las rotaciones de cultivos pueden ser utilizadas en suelos donde existen problemas de compactación. Al introducir plantas cuyas raíces puedan penetrar este tipo de suelos, se pueden crear poros estables, que al descomponerse las raíces formen bioporos abiertos, los cuales pueden ser empleados por las raíces de cultivos posteriores. Esta perforación biológica, mediante la incorporación de especies apropiadas en la rotación, puede ser económicamente ventajosa (Greogory et al., 2006). Algunos reportes indican que la formación de bioporos es menor en rotaciones de oleaginosas y leguminosas anuales (Cresswell y Kirkegaard, 1995; Gregoy, 1998). A comparación de cultivos perennes como la alfalfa, donde se observa que el cultivo de maíz después de un año de crecer alfalfa cambia sus patrones de distribución radical colonizando hasta un 41% de los poros creados por la alfalfa (Rasse y Smucker, 1998). Sumado al efecto que tienen las rotaciones de cultivo, si estas prácticas son acompañadas de la reducción de la labranza y la incorporación de residuos vegetales (Agricultura de Conservación), los efectos pueden beneficiar aún más a la estructura del suelo. Fuentes et al. (2011) observaron que la rotación de cultivos genera una mejor estructura en suelos arcillosos por sus diferentes tipos de sistemas radicales en agricultura de conservación (Figura 2). Son este tipo de interacciones las que permiten generar una línea de investigación en la que puedan ser estudiados los cultivos y las posibles rotaciones que beneficien, no solo la productividad de los suelos agrícolas, sino también a la conservación del suelo, beneficiando su estructura.
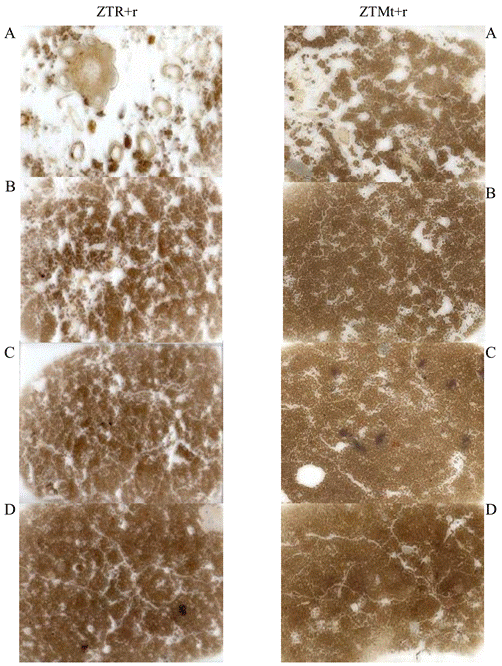
Se aprecia una estructura mejor desarrollada en el tratamiento donde hay rotación, ya que las raíces de los cultivos de maíz y trigo (zonas de color blanco) penetran a distintas profundidades. Tomado de Fuentes et al., 2011.
Figura 2 Imágenes de secciones delgadas (5 × 7 cm) a distitntas profundidades del suelo A: 0-5 cm, B: 5-10 cm, C: 10-15 cm y D: 15-20 cm bajo cero labranza (ZT), monocultivo de trigo (Mt) o rotación (R) e incorporación de residuos (+r).
Procesos físicos donde intervienen las raíces sobre la estructura del suelo
Penetración de raíces y estructura del suelo. Las raíces ejercen presiones sobre el suelo de hasta 2 MPa cuando crecen (Reid y Goss, 1982); amplían los poros existentes y crean otros nuevos, generan un mayor empaquetamiento de las partículas y microagregados, y modifican la disposición de las partículas de arcilla (Dorioz et al., 1993). La densidad aparente se incrementa entre el 12 y 35% cerca de la zona de influencia de las raíces (rizósfera) con respecto a la densidad aparente del suelo fuera de la rizósfera (Young, 1998). Las modificaciones ocurren a una distancia de entre 50-200 μm alrededor de las raíces y aumentan la estabilidad de los agregados del suelo dentro de la rizósfera (Caravaca et al., 2002). La alfalfa (Medicago sativa L.) se caracteriza por un sistema radical de gran longitud y diámetro, que promueve el flujo del agua por los macroporos y por lo tanto, afecta directamente los ciclos de humedecimiento y secado del suelo, y de manera indirecta, la agregación (Rasse et al., 2000). Algunos cultivos como el trigo, la cebada y la soya son capaces de generar meso y macroagregados por efecto de la penetración de sus sistemas radicales y su posterior descomposición (Gregory et al., 2006; Micucci y Taboada, 2006; Lipiec et al., 2012), lo que libera MO que sirve como sustancia agregante. Materechera et al. (1994) identificaron un efecto sinérgico entre la penetración de las raíces y la actividad de la fauna del suelo, en especial las lombrices, que a su paso crean galerías (poros interconectados) que pueden ser empleadas por las raíces para su crecimiento. Las lombrices al ingerir partículas de suelo y mantillo forman núcleos de MO, mucus y minerales que ayudan a estabilizar la estructura del suelo. La continuidad del sistema de poros es modificada por la penetración de las raíces y propicia la formación de nuevos agregados. Esto sugiere que existe una mayor proporción de agregados pequeños en suelos cultivados que en los no cultivados, debido al rompimiento de agregados mayores por acción de las raíces (Materechera et al., 1994). El efecto de la penetración de las raíces en la agregación se daría mediante una interacción entre la arquitectura de las raíces (por ejemplo, magnitud de ramificaciones laterales, densidad y diámetro) y las características estructurales del suelo (compactación, textura, porosidad) (Carter et al., 1994). La penetración de raíces disminuye las proporciones relativas de macroagregados inestables y aumenta la proporción de microagregados estables (con altos contenidos de C). El C de los microagregados estables no se encuentra disponible para la biota del suelo y actúa como un almacén de carbono (Carter et al., 1994; Six et al., 2000).
Los mecanismos involucrados en la formación de agregados donde predominan las partículas de arena son: (1) la adhesión por los pelos radicales da lugar a la formación de rizocorazas y (2) la alta densidad de las raíces provoca la disminución de la porosidad del suelo, mayormente en zonas donde los agregados se encuentran fuertemente consolidados (Figura 3). En suelos arenosos, el diámetro de las raíces es un factor importante. Las raíces finas (< 2 mm) han sido relacionadas con la formación de agregados; en este caso las raíces se encontraron localizadas dentro de los agregados actuando como una red de entramado de partículas (De León-González et al., 2007).
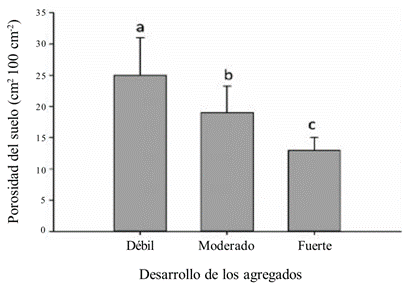
Se observa que en el suelo arenoso (79% de arena) la porosidad disminuye considerablemente en donde se localizan agregados fuertemente desarrollados, debido al entrelazamiento de las raíces con las partículas del suelo (rizocorazas). Adaptado de De León-González et al., 2007
Figura 3 Porosidad del suelo en zonas colonizadas por raíces de girasol de diferentes tamaños.
En suelos arcillosos la penetración de las raíces genera microcompactación alrededor de la rizósfera (que ayudará al flujo de agua y aire), lo cual crea entramados densos que ayudan a crear condiciones fisicoquímicas adecuadas para el crecimiento de las raíces y la formación de agregados (Bruand et al., 1996). Estas raíces se descomponen y aportan MOP que actúa como agente cementante de las partículas del suelo y como fuente de C para los microorganismos que producen excreciones, las cuales actúan como pegamento para la formación de agregados (Gregory et al., 2006).
Modificación del régimen hídrico del suelo y desarrollo radical. En relación a las condiciones hídricas del suelo, la actividad de las raíces promueve: (1) que se sequen zonas específicas y se unan las arcillas con los exudados orgánicos de las raíces, formando agregados debido a la absorción del agua (Reid y Goss, 1982); (2) que los exudados tapen los poros reduciendo el humedecimiento y el rompimiento de los agregados antes formados (Caron et al., 1996); y (3) que el agua fluya mayormente por los poros creados por las raíces vivas (Rasse et al., 2000), modificando el balance iónico y osmótico en la rizósfera mediante la absorción de nutrientes y la rizodepositación (Bronick y Lal, 2005). Estos tres procesos conducen al cambio en la frecuencia de los procesos de humedecimiento y secado del suelo, por lo tanto repercuten en la formación de agregados en el suelo (Whalley et al., 2005). Diversas investigaciones han abordado el efecto de la rizósfera de diferentes especies vegetales en los procesos infiltración, absorción y potenciales mátricos del suelo (Chan y Hennan, 1996; Whalley et al., 2005; Darrah et al., 2006). Whalley et al. (2005) encontraron que la rizósfera del maíz y la cebada tienden a ser más secos y tener un potencial mátrico mayor que el del suelo en donde no se presenta el efecto por las raíces; los autores sugirieron que estas diferencias se deben principalmente al ángulo y la conectividad de los poros creados por las raíces. Sin embargo Hallet et al. (2003) estudiaron las características hidráulicas de la cebada, canola, papa y una especie de pasto en bloques de suelo excavados en campo. Encontraron diferencias significativas en la absorción y la repelencia de agua, para todas las especies. Sin embargo, no hubo diferencias entre el suelo y la influencia de los sistemas radicales a distancias de 1 y 2 mm de la zona de influencia de la rizósfera. Por lo que es necesario un mayor número de investigaciones que permitan evaluar la importancia de los cambios en la rizósfera, a través de modelos que involucren el desarrollo completo de los sistemas radicales de diferentes especies vegetales; con ello, se podrá conocer el significado de los cambios estructurales e hidráulicos en la rizósfera y cuantificar el significado de estos procesos para los distintos cultivos (Gregory, 2006).
Se ha reportado que las raíces tienen un crecimiento disminuido cuando se cultivan en suelos compactados (generalmente cuando se practica la labranza tradicional) porque no son capaces de penetrar y desplazar el suelo (Clark et al., 2003). A diferencia de donde se practican las técnicas de labranza convencional, cuando se aplican técnicasde agricultura de conservación, aumenta la cantidad de agua disponible para el crecimiento de los cultivos (Rasse et al., 2000; Fuentes et al., 2009; Verhulst et al., 2011; Huang et al., 2012) permitiendo un crecimiento óptimo de las raíces (Muñoz-Romero et al., 2010, 2011), y aumentando su densidad y longitud en los estratos superficiales (Ball-Coelho, 1998; Qin et al., 2005), por lo que es importante rotar los cultivos con diferentes sistemas radicales que potencialicen estas mejoras. Además, en los sistemas agronómicos donde la labranza se reduce y se incorporan residuos, el potencial hídrico de las raíces y de las hojas sufre cambios que están relacionados directamente con el transporte y la disponibilidad de nutrientes (Grzesiak et al., 2012), afectando de manera significativa la arquitectura de las raíces y el desarrollo de la parte aérea de las plantas.
Procesos bioquímicos donde intervienen las raíces sobre la estructura del suelo
Producción de exudados de las raíces. Durante el crecimiento de las raíces son generados una gran cantidad de compuestos orgánicos denominados exudados de las raíces. Entre estos compuestos se encuentran principalmente carbohidratos, ácidos carboxílicos y aminoácidos en diferentes concentraciones (Lynch y Whipps, 1990). Dichos compuestos pueden ser agrupados en dos conjuntos: los que contienen bajas y altas cantidades de mucílagos (bajo-Mr y alto-Mr respectivamente). Entre los bajo-Mr se encuentran los aminoácidos, ácidos orgánicos, azúcares, fenoles y otros metabolitos secundarios; mientras que los alto-Mr incluyen los mucílagos (polisacáridos) y las proteínas (Walker et al., 2003). Los exudados de las raíces desempeñan un papel importante en las plantas como atrayentes y repelentes químicos en la rizósfera y su zona de influencia (Estabrook y Yoder, 1998; Bais et al., 2001). Tales compuestos pueden inhibir el crecimiento de otras plantas, absorber iones específicos (Hawes et al., 2000) y regular las comunidades microbianas del suelo, proporcionando relaciones simbióticas benéficas para el desarrollo de la planta y la estructura del suelo (Nardi et al., 2000).
La investigación acerca de los exudados que producen las raíces y la forma cómo estos compuestos ayudan a estabilizar los agregados del suelo, encara las complicaciones metodológicas que presentan este tipo de estudios, sobre todo en condiciones naturales y con técnicas no destructivas. La mayoría de estos estudios han sido realizados bajo condiciones de laboratorio, debido a la complejidad para extraer cantidades suficientes de raíces y caracterizar los compuestos orgánicos exudados por las raíces (Morel et al., 1991; Walker et al., 2003).
Los exudados alteran el suelo circundante a las raíces con la secreción continua de compuestos orgánicos y el crecimiento de células de la cofia, provocando el secado del suelo (Vermeer y McCully, 1982; Ray et al., 1988; McCully, 1995; Sims et al., 2000). A medida que el suelo se seca, la conductividad hidráulica disminuye. Cuando esto ocurre la viscosidad de los exudados aumenta y la resistencia al movimiento de las partículas del suelo en contacto con los exudados se incrementa, alcanzándose el grado de estabilización máximo dentro de la rizósfera (Walker et al., 2003). La dinámica de formación de agregados derivada de la concentración de exudados es diferente según la textura del suelo. Morel et al. (1991) demostraron que al incorporar mucílago y mucílago modificado (adicionado con glucosa) en las puntas de las raíces de maíz (zonas meristemáticas), aumentó significativamente la estabilidad de los agregados donde se adicionó mucílago a diferencia de donde no se agregó. Independientemente de la actividad de otros microorganismos, el cambio se produjo inmediatamente después de la incorporación del mucílago. Sin embargo, estos efectos varían con el contenido de arcilla del suelo estudiado; por ejemplo la estabilidad de los agregados en suelos con 17, 25 y 45% de arcilla duró 14, 30 y 42 días respectivamente (Morel et al., 1991; Traoré et al., 2000).
La estabilización de la estructura del suelo alrededor de los sistemas radicales se debe a dos efectos que interactúan entre ellos: (1) el incremento de las fuerzas de adhesión entre las partículas y (2) la disminución de las tasas de humedecimiento y secado del suelo (Czarnes, et al., 2000). Sin embargo, el grado de influencia de las raíces sobre la estructura del suelo a través de los exudados es muy variable, debido a que la producción y composición de los exudados depende de: el régimen hídrico (Watt et al., 1994; Czarnes et al., 2000), las comunidades bacterianas asociadas con el metabolismo de los exudados (Baudoin et al., 2003), la profundidad del suelo (Merbach et al., 1999), el tiempo (las mayores producciones se han observado en estadios tempranos del desarrollo radical) (Gransee y Wittenmayer, 2000) y las especies vegetales (Haynes y Beare, 1997; Hutsch et al., 2002). Esta última característica es de vital importancia, ya que la producción de exudados en las plantas responde principalmente a la arquitectura de los sistemas radicales (Fitter, 2002), el flujo y la absorción y disponibilidad de nutrientes en el suelo (Liao et al., 2001; Rubio et al., 2001). Se sabe que las leguminosas (plantas que exploran la parte superficial del suelo y que tienen un mayor flujo de nutrientes a diferencia de otros sistemas radicales), pueden beneficiar con una mayor producción de exudados (Walker et al., 2003), sin embargo, falta investigar sobre el efecto de otras especies vegetales que pueden aumentar la producción de cementantes orgánicos e inorgánicos, no sólo en la superficie del suelo, sino también en estratos más profundos que generen una mejor estructura de éste y contribuyan al secuestro de C.
Entrelazamiento de agregados causados por las raíces. Las raíces y los residuos de las raíces se entrelazan con hifas de hongos micorricícos (principalmente micorrizas arbusculares) iniciando la formación de macroagregados. El crecimiento de la biota del suelo (bacterias y hongos) produce exudados (que actúan como agentes cementantes de los macroagregados) por la descomposición de residuos frescos de raíces (Six et al., 2002). Existen varias revisiones bibliográficas que describen los procesos mediante los cuales la asociación raíces-hifas generan sustancias cementantes que favorecen la agregación del suelo (Tisdall y Oades, 1982; O’Neill et al., 1991; Rillig, 2004; Rillig y Mummey, 2006). Estos últimos autores mencionan cinco factores principales en los que las hifas de micorrizas, entrelazadas con las raíces, actúan en la formación de agregados.
Efecto biológico I. Las hifas influyen en el crecimiento de colonias bacterianas, ya que sus exudados junto con los de las raíces constituyen un sustrato ideal para el crecimiento de determinadas especies de hongos y bacterias que son importantes para la agregación del suelo (Budi et al., 1999; Bezzate et al., 2000; Hildebrandt et al., 2002; Mansfeld-Giese et al., 2002). La presencia de micorrizas arbusculares modifica la rizodepositación de compuestos asociados con la agregación del suelo (Marschner y Baumann, 2003).
Se ha observado que la reducción de la labranza aumenta las proporciones de comunidades bacterianas y fúngicas del suelo, lo que sugiere que las prácticas agronómicas de conservación aumentan la capacidad de recuperación a largo plazo de dichas comunidades (principalmente micorrizas), beneficiando la estructura del suelo al asociarse con las raíces (Drijber et al., 2000; Brito et al., 2012).
Efecto biológico II. La interacción de las micorrizas con la cadena alimenticia del suelo se vuelve más compleja y organismos como microartrópodos, nemátodos y lombrices ayudan a generar una mejor estructura gracias a la transformación de la materia orgánica por medio de la digestión (Rillig y Mummey, 2006; De León et al., 2011).
Recientemente se ha demostrado que la actividad biológica del suelo depende del tipo de manejo agronómico que se realiza. Peigné et al. (2012) propusieron que la cero labranza induce una mayor cantidad de macroporos estables relacionados con la actividad biológica del suelo como consecuencia de una mayor producción de cementantes orgánicos para la agregación, mientras que en la labranza convencional, predomina la macroporosidad mecánica (sólo por la acción de la penetración de las raíces), la cual es propensa a una disrupción más rápida, debido a que se producen pocos cementantes orgánicos.
Efecto bioquímico. Los mucílagos, polisacáridos y otros compuestos extracelulares que son secretados o contenidos en las paredes celulares de hongos micorricícos y no micorricícos, actúan como agentes cementantes de las partículas del suelo para formar agregados (debido a la interacción con las colonias bacterianas, materia orgánica y raíces) (Caesar-TonThat y Cochran, 2000; Caesar-TonThat et al., 2001; Caesar- TonThat, 2002). La glomalina, sustancia de tipo proteico, forma parte de la pared celular de las hifas de las micorrizas; hasta la fecha no son de todo claros sus efectos sobre la agregación (Rillig y Mummey, 2006). Se ha propuesto que la glomalina está relacionada con las proteínas del suelo (GRSP por la siglas en inglés, Glomalin-Related Soil Protein) y actúa como adhesivo hidrófobo de las partículas elementales para formar agregados (Driver et al., 2005).
Efecto físico I. Al igual que las raíces, las hifas se entrelazan con partículas y microagregados secando zonas específicas (en menor magnitud que las raíces), aumentando la cohesión entre las raíces-suelo-hongos, modificando los ciclos de humedecimiento y secado, y aumentan la estabilidad de los agregados (Rillig y Mummey, 2006).
Efecto físico II. Las partículas primarias como la arcilla se pueden alinear a lo largo de las micorrizas. Las hifas actúan como máquinas excavadoras (Wessels, 1999) que pueden ejercer presiones considerables sobre las partículas del suelo adyacentes (Money, 1994), y forzar físicamente a la MO y a las partículas de arcilla a formar agregados (Rillig y Mummey, 2006).
Otra manera en que las raíces se entrelazan y promueven la formación de agregados del suelo son las rizocorazas (estructuras de partículas de suelo que rodean las raíces) (Watt et al., 1994). Tienen como principales funciones la adquisición de nutrientes y agua, además del almacenamiento de esta última para la planta. Se creía que estas estructuras sólo se presentaban en gramíneas; sin embargo, Moreno-Espíndola et al. (2007), encontraron que las rizocorazas pueden formarse en dicotiledóneas como amaranto (Amaranthus hypochondriacus) y girasol (Helianthus annus) en suelos arenosos; además., son un mecanismo de agregación que da lugar a micro- y macroagregados, aunque la duración de dichas estructuras no está aún determinada.
Descomposición de raíces muertas. La descomposición de raíces muertas presenta beneficios para la formación y estabilidad de la estructura del suelo. A la cosecha de los cultivos, el C almacenado derivado de las raíces alcanza 50 % del C total, mientras tan sólo el 13 % corresponde a biomasa aérea (Gale et al., 2000a, b). Tanto la parte aérea como la parte subterránea de las plantas, sirven como almacenes para la captura de C y se ha observado que los sitios con vegetación forestal capturan mayores cantidades de C a diferencia de los terrenos agrícolas (Etchevers et al., 2004). Powlson et al. (2011) señalaron que la clave para el proceso de secuestro de C en suelos arables es la profundidad a la cual las raíces exploran el perfil del suelo.
El C proveniente de la descomposición de las raíces es encontrado como MOP ocluida, asociada con las fracciones de limo y arcilla extraíble con cloroformo desde la biomasa microbiana. La hipótesis sobre el alto aporte de C por parte de las raíces en descomposición parte de tres supuestos: (1) la alta recalcitrancia del C de las raíces, (2) La protección de la MOP (proveniente de las raíces) dentro de los microagregados y (3) la naturaleza química del C proveniente de los exudados de las raíces (Puget y Drinkwater, 2001).
La magnitud de la descomposición de raíces muertas puede deberse en gran medida al tipo y cantidad del material vegetal y al manejo agronómico (por ejemplo, las prácticas de labranza convencional invierten el suelo, propiciando un cambio en la dinámica de la descomposición de raíces). La formación de agregados a partir de la MO fresca, (raíces de los cultivos) suelo, dependiendo de la densidad del sistema radical y de su constitución, podrían generar una mayor o menor cantidad de f macroagregados, que ayudaría a estructurar el suelo (Six et al., 2002). Durante la senescencia de las raíces, se forman más agregados estables en comparación a con el estado vegetativo (Rasse et al., 2002). Se ha observado que reducciones en la intensidad de la labranza incrementan la biomasa radical en los horizontes superficiales, aportando una mayor cantidad de MO (Sidiras et al., 1999; Ozpinar y Baytekin, 2006); por otro lado, la tasa de descomposición de las raíces depende de las características morfológicas de los cultivos y la lignificación de sus tejidos (Bingham et al., 2010). Además, la rotación de cultivos aporta cantidades de MO tanto en estratos superficiales como profundos, debido a la penetración de las raíces de las diferentes plantas cultivadas.
Técnicas para el estudio de las raíces
Para el estudio de las raíces se pueden utilizar diferentes métodos directos e indirectos. Los primeros comprenden: excavación, zanjas, monolitos y los rizotrones y minirizotrones. Con este tipo de técnicas se hacen observaciones directas del desarrollo radical (Böhm, 1979; Atkinson, 2000). Los métodos indirectos incluyen: tinciones (para observar arquitectura y elongación), uso de isótopos estables (Böhm, 1979), análisis e interpretación de imágenes (Richner et al., 2000) y las sondas de neutrones rápidos (que sirven para calcular el contenido de agua presente en el suelo, que se relaciona con la densidad y distribución de las raíces y para calcular la densidad aparente del suelo) (OIEA, 2003).
Recientemente, la arquitectura de los sistemas radicales ha comenzado a ser analizada con nuevas tecnologías como: (1) el uso de marcadores fluorescentes, utilizado en estudios sobre de la distribución (horizontal y vertical) de las raíces (Faget et al., 2010, 2012), su crecimiento en condiciones de sequia (Gregory et al., 2009) o en la determinación de la eficiencia en el uso de los nutrientes del suelo (Palta et al., 2007); (2) uso de imágenes digitales con software especializado, el cual ha sido empleado principalmente para estudios de morfología y topología radical (Le Bot et al., 2010). En esta misma dirección, la tomografía por resonancia magnética (MRI) se ha convertido en una herramienta muy potente para visualizar raíces dentro de sustratos del suelo en el tiempo. En combinación con la tomografía por resonancia magnética, la tomografía por emisión de positrones (PET) puede ser utilizada para visualizar las raíces de las plantas individuales (Faget et al., 2012). El perfeccionamiento de estos y otros métodos no invasivos, como los rayos X y la tomografía computarizada, permitirán generar sistemas expertos de clasificación y medición de raíces, lo que permitirá precisar el efecto de diferentes sistemas radicales en relación con la estructura del suelo y al mismo tiempo,, describir y comprender mejor los mecanismos responsables de esta relación.
Conclusiones
Los sistemas radicales de las especies vegetales afectan de diferentes maneras la formación de agregados del suelo, debido a su propia arquitectura, el medio en el que se desarrollen y las asociaciones con la biota del suelo que estas puedan favorecer, estableciendo condiciones físicas y bioquímicas para la formación de la estructura del suelo. Existen plantas, como la alfalfa y el maíz, que pueden potencializar la generación de macroporos estables, que sirvan para el desarrollo de cultivos, mejorando la estructura del suelo y aumentando la producción de los agroecosistemas. Sin embargo, es necesario aumentar los conocimientos acerca de los mecanismos que favorecen estas condiciones estructurales del suelo, así como la magnitud específica de diferentes especies vegetales y cómo estas pueden ser combinadas con otras plantas para generar una mejor producción de cultivos sin afectar la estructura del suelo. De forma particular, se requieren más investigaciones sobre los efectos benéficos para el suelo de rotaciones que involucren especies vegetales con diferentes arquitecturas de raíces y distintas profundidades de enraizamiento.
Las investigaciones acerca de las raíces y su relación con la formación de estructura en el suelo, han comenzado a centrarse en los últimos años en la obtención de parámetros morfológicos radicales como indicadores de agregación del suelo para fines agroecológicos; el modelado del crecimiento y arquitectura radical; así como, la interacción y magnitud de los efectos que generan diferentes sistemas de manejo (principalmente de labranza) sobre el desarrollo de las raíces. La continuación a estos estudios y la creación de nuevas líneas de investigación, nos ayudarán a implementar técnicas de gestión, aprovechamiento y conservación de la estructura del suelo. Los estudios acerca de la agregación por efecto de la asociación de las raíces con micorrizas y de los exudados de ambos organismos como agentes cementantes de los agregados, han sido los más abundantes hasta hoy en día. Sin embargo, una gran limitante es que la mayor parte de los estudios se han realizado en el laboratorio, lo que supone que las conclusiones obtenidas pueden no ser completamente aplicables a las plantas que crecen en condiciones naturales. Para poder alcanzar este objetivo es necesario desarrollar métodos que puedan aplicarse en plantas que crecen en medios naturales (o cultivadas) para cuantificar estos compuestos químicos y su participación en la formación de la estructura del suelo.
Sin embargo, no es sencillo determinar la magnitud exacta de cada uno de los procesos en los que actúan. Aunque en los últimos 50 años la investigación se ha centrado en explicar detalladamente los mecanismos físicos y bioquímicos en los que las raíces participan para modificar la estructura del suelo, existen muchos cuestionamientos al respecto, que tendrán que ser respondidos con la implementación de un análisis holístico y multidisciplinario.











 nueva página del texto (beta)
nueva página del texto (beta)


