Introducción
El amaranto (Amaranthus hypochondriacus), planta cultivada por los Aztecas en Mesoamérica desde la época precolombina, no se ha estudiado lo suficiente a pesar de las cualidades alimenticias que se le reconocen. Las diferentes especies del género Amaranthus tienen la capacidad de adaptarse a diversos entornos bajo presiones ambientales como salinidad, baja humedad, altas temperaturas y presencia de insectos (Bressani, 2003). A. hypochondriacus, una de las especies cultivadas del género Amaranthus, es originario de México, tolera las condiciones de semiaridez, características de la región central del Valle de México. A pesar de su importancia agronómica, se conoce muy poco sobre los aspectos biológicos del cultivo como es el caso de la microbiota con la que se asocian sus raíces.
Los microorganismos del suelo son fundamentales en los agroecosistemas debido a que participan en la formación de la estructura edáfica (Caesar-TonThat et al., 2007) y en la descomposición de la materia orgánica (MO) por medio de la producción de enzimas extracelulares (Gil-Sotres et al., 2005; Allison y Jastrow, 2006). Dichas funciones favorecen el crecimiento vegetal (Garbeva et al., 2004) al aumentar la disponibilidad de nutrimentos como el nitrógeno y el fósforo (Kohler et al., 2007), además de participar en la degradación de sustancias tóxicas (plaguicidas, herbicidas, hidrocarburos) (Elsas et al., 1997; Abed et al., 2002; Garbeva et al., 2004; López y Dias, 2004; Solyanikova y Golovleva, 2004; Nwaogu et al., 2008). En el ambiente edáfico, la región de la rizosfera concentra la mayor proporción de los microorganismos activos, los cuales utilizan los compuestos mucilaginosos (azúcares solubles, antibióticos, ácidos orgánicos y compuestos volátiles) exudados por las células radicales (McCully, 2005; Lesuffleur et al., 2007). Dentro de la rizosfera se incluyen micro hábitats particulares como la rizocoraza que es una estructura muy resistente y frecuente en plantas establecidas en suelos arenosos; las rizocorazas están formadas por una densa capa de granos de arena y limo alrededor de las raíces finas de las plantas, sujetadas principalmente por los pelos radicales absorbentes (McCully, 1999). Las rizocorazas se han encontrado principalmente en raíces de gramíneas (Read y Gregory, 1997; Haling et al., 2010) y más recientemente en A. hypochondriacus y Helianthus annuus (girasol) (Moreno-Espíndola et al., 2007). La unión estrecha entre las raíces y las partículas del suelo favorece la concentración de compuestos orgánicos exudados por la planta así como el aumento de la actividad microbiana, especialmente las bacterias que colonizan la coraza (Toal et al., 2000; McCully, 2005). En la rizocoraza existe una red de interacciones de señales químicas que enlazan las raíces con la microbiota asociada (Mathesius, 2003).
La importancia de los índices de producción de enzimas extracelulares (IME), radica en el papel que juegan las poblaciones microbianas en la liberación al suelo de nutrimentos disponibles, útiles para otros organismos (Cerón y Melgarejo, 2005; Roesti et al., 2005); dicha participación es mediada por la producción de enzimas intra y extracelulares (Schimel y Weintraub, 2003; Raynaud et al., 2006). La identificación de las enzimas que puede producir una bacteria permite conocer su perfil degradativo, el cual estará en relación con las rizodeposiciones (Alami et al., 2000; Nannipieri et al., 2003).
Los suelos de la zona montañosa del sur del Valle de México son poco intemperizados y se caracterizan por un alto contenido de minerales de pómez y feldespatos (De León-González et al., 2007); son propensos a la erosión, lo cual afecta la producción de amaranto, maíz, nopal y flores en la región. En estos suelos los componentes biológicos como la comunidad microbiana y las raíces de las plantas cultivadas participan activamente en la formación de macroagregados estables (de 2 a 5 mm) (De León- González et al., 2006). Moreno-Espíndola et al. (2007), reportaron que la presencia de rizocorazas favorecen la estructura de suelos inestables.
Los microorganismos juegan un papel clave en los procesos que se llevan a cabo en los ecosistemas, incluyendo la adquisición de nutrimentos, los ciclos del carbono y del nitrógeno, y la formación de suelo, por lo que tienen una influencia directa o indirecta sobre la productividad, diversidad y composición de la comunidad vegetal. Debido a lo anterior, la agricultura actual plantea el uso de biofertilizantes como una herramienta para el desarrollo agrícola sostenible (Terry y Leyva, 2006; Fernández et al., 2006; Philippot et al., 2006). El estudio de la comunidad microbiana asociada a A. hypochondriacus en suelos arenosos del centro de México con problemas de estabilidad estructural, generará información valiosa para el diseño de estrategias de manejo tanto del cultivo, como del potencial biotecnológico de las bacterias asociadas. El uso de inóculos bacterianos para producir biofertilizantes debe partir de la identificación de las capacidades metabólicas de los microorganismos naturalmente asociados a la planta de interés y del suelo en el que se establecen (Uribe et al., 2010). El objetivo del presente trabajo fue estudiar los cambios fenotípicos de la comunidad bacteriana en relación con los caracteres fisiológicos y bioquímicos y su contribución al enriquecimiento nutricional de los suelos de rizocoraza de A. hypochondriacus, en diferentes etapas: siembra, floración, cosecha y postcosecha, en un suelo arenoso del Valle de México.
Materiales y métodos
Ubicación del sitio de estudio y características del suelo
El sitio experimental se ubica en Tulyehualco, México D. F. (19° 15’ N, 99° 13’ O, 2280 msnm). El suelo se clasifica como Udic Ustifluvent (Soil Survery Staff, 2003) o Eutri-Tephric Fluvisol (Segura et al., 2005); se compone de 70, 140 y 790 g kg-1 de arcilla, limo y arena, respectivamente; y presenta baja estabilidad estructural (De León-González et al., 2007). El clima es templado, con una precipitación anual de 537 mm; la temperatura media es de 17.3 °C. El suelo se ha trabajado bajo labranza mínima en los cinco años previos, realizando el deshierbe con azadón. Las parcelas experimentales tuvieron una superficie de 9 m2 (4 parcelas en total). Las semillas de amaranto se sembraron directamente en la parcela durante julio de 2008; las plantas se desarrollaron en condiciones de temporal. Se aplicó una dosis única de fertilización (80-40-00, N-P-K) en la época de floración. Se obtuvieron dos monolitos de suelo-raíces de amaranto mediante un cilindro de PVC (25.5 cm de diámetro interior por 37.5 cm de largo) en cuatro épocas: en el momento de la siembra (testigo), en la floración, durante la cosecha y la postcosecha (0, 45, 90 y 120 días después de la siembra, respectivamente). Se tomaron muestras de suelo adherido a la rizocoraza de las plantas de amaranto con una aguja de disección estéril. El suelo de rizocoraza de los dos monolitos obtenidos en cada época de cultivo, se dividió en nueve muestras de 5 g cada una. Todas las muestras se preservaron en 45 mL de glicerol al 20%, a -18°C en oscuridad.
Aislamiento y purificación bacteriana
Para el aislamiento de las bacterias se tomó una alícuota de 1 mL de la suspensión de suelo de cada una de las muestras preservadas en glicerol al 20%, previamente homogeneizada. La purificación se realizó por el método de serie de cinco diluciones decimales en agar nutritivo (AN) y en agar extracto de suelo (AS) (Hamaki et al., 2005). La temperatura de incubación fue de 27 °C y el tiempo de incubación de los cultivos fue de 24 hen AN y de 72 hen AS. De un total de 320 colonias obtenidas, se eligieron 38 colonias bacterianas completamente al azar abarcando las cuatro épocas de muestreo y los dos medios de cultivo. Cada aislado bacteriano se resembró de tres a cinco veces hasta purificarlo; su pureza se confirmó al analizar las características coloniales respecto a la forma celular con un microscopio en contraste de fase 100x (Olympus Bimax 50) y por la respuesta a la tinción de Gram (Prescott et al., 1999). Asimismo, se observó la presencia de cuerpos intrusivos, cápsula, formación de esporas y el metabolismo respiratorio (oxidación y fermentación de glucosa, reducción de sulfatos, reducción de nitratos, actividad catalasa y citocromo-oxidasa) (Hugh y Leifson, 1953; Kovacs, 1956; Meynell y Meynell, 1979; MacFaddin, 2003).
Producción de enzimas extracelulares
La capacidad de producción de enzimas extracelulares se evaluó en medios de cultivo específicos en placa (Lányi, 1987). Se probó la producción de ocho enzimas extracelulares (g L-1): a) Esculinasa: peptona 1; esculina 1 mL L-1; FeSO4 1; agar bacteriológico (ab) 20; medio base dulce (mbd), 1 L, a pH 7; b) Fosfatasa: Na-p-nitrofenilfosfato 2; Tris-HCL 50 mL L-1; ab 20; mbd 1 L, a pH 7; c) Quitinasa: quitina molida 1; ab 20; mbd 1 L, a pH 7; d) Amilasa: almidón soluble 1.5; agar 20; mbd 1 L, a pH 7; e) DNAsa: medio DNAsa (Bioxon) 47.2; ab 20; mbd 1 L, pH 7; f) Lipasa: polisorbato 80 10 mL L-1;CaCl2 0.1; mbd 100mL; pH7 g) Gelatinasa: medio gelatinasa (Bioxon) 11; mbd 1000 mL; pH 7; h) Lecitinasa: mbd 500 mL; yema de huevo 50 mL. La formulación del medio base dulce (mbd) utilizado en todas las pruebas exoenzimáticas fue (g L-1): Na2HPO4 12H2O 3.5; KH2PO4 0.98; MgSO4 7H2O 0.03; NH4Cl 5.0; solución de oligoelementos 0.2 mL L-1. La solución de oligoelementos consistió de (gL-1):EDTA monobásico 50; ZnSO4 7H2O2.2; CuCl2 2H2O 5.5; MnCl2 4H2O 5; FeSO4 7H2O 4.7; CuSO4 5H2O 1.5; CaCl2 6H2O 1.6. Para cada enzima extracelular se realizaron cultivos en placa por triplicado, incubados a 27 °C por 48 h. A partir de los resultados positivos de estas pruebas se calculó el índice medio de producción de las mismas (IME), el cual indica la proporción de aislados bacterianos que participan en la hidrólisis de la materia orgánica (MO) presente en la rizocoraza (Ferrara-Guerrero, 1993), empleando la Ecuación 1:
donde:
RP = frecuencia de respuestas positivas a la producción de cada enzima extracelular.
Ne = número de enzimas probadas.
Caracteres nutricionales de los aislados bacterianos
Esta parte del análisis fenotípico se basó en las capacidades nutricionales de cada aislado bacteriano con base en la utilización de compuestos orgánicos simples como única fuente de carbono y energía. Para cada aislado bacteriano se probaron veintiséis sustratos orgánicos de acuerdo a lo propuesto por Stanier et al. (1966): a) aminoácidos: serina, glutamato, prolina, triptófano, arginina, ornitina, alanina y metionina, b) carbohidratos: arabinosa, glucosa, ribosa, sacarosa, gluconato y almidón, c) ácidos orgánicos: malonato, succinato, fumarato, adipato, lactato y citrato, d) ácidos grasos: acetato, propionato y capronato y e) alcoholes: manitol, sorbitol y glicerol. Cada prueba se realizó por triplicado y se incluyó un testigo que únicamente contenía el sustrato sin inocular. Las pruebas se realizaron con medio mineral base dulce y la fuente de carbono a una concentración final de 0.1%, con excepción de los azúcares donde fue de 0.2%. Cada tubo de prueba se inoculó con 0.5 mL del cultivo bacteriano, se incubaron a temperatura ambiente durante 15 días; el crecimiento microbiano se verificó visualmente. Con los resultados de esta prueba se calculó el índice medio de utilización (IMU) de los compuestos orgánicos, que indica la cantidad de sustratos utilizados por cada aislado bacteriano (promedio de utilización de sustratos de una familia química, de un compuesto o del total de compuestos probados). La Ecuación 2 para calcular el IMU fue:
donde:
p = porcentaje de utilización de cada compuesto (suma de los compuestos utilizados entre el número total de compuestos probados).
N = número total de compuestos probados para cada familia química.
Análisis estadístico
Para identificar los diferentes fenotipos bacterianos presentes en la rizocoraza del amaranto a lo largo del estudio, se empleó un método de análisis multivariado de conglomerados estableciendo la distancia euclidiana y el logaritmo de Ward. Para ello se empleó el programa STATISTICA 8.0®. Los resultados de las pruebas morfológicas, fisiológicas y bioquímicas se trabajaron en lenguaje binario.
Resultados y discusión
Los treinta y ocho aislados bacterianos procedentes de la rizocoraza de amaranto, caracterizados en el presente estudio (Cuadro 1, Figura 1), mostraron una capacidad elevada para hidrolizar hidratos de carbono de alto peso molecular, lípidos y proteínas de los tejidos vegetales y animales en descomposición presentes en el suelo (Cuadro 2 y 3). En general, la forma celular predominante en los aislados bacterianos fue bacilar; únicamente dos de ellos presentaron forma filamentosa (AN1E1 y AS2E1b). En el 86% de los aislados se observó la formación de espora, ninguno presentó cápsula y en el 44% se encontraron cuerpos intrusivos. El 86.8% de los aislados fueron Gram positivo y el restante 13.2% Gram negativo.
Cuadro 1 Nomenclatura de 38 aislados bacterianos obtenidos de rizocorazas de Amaranthus hypochondriacus establecido en un suelo arenoso pomáceo del sur del Valle de México.
| Clave | Medio de cultivo | Época | Clave | Medio de cultivo | Época |
|---|---|---|---|---|---|
| AN1E1 | Agar nutritivo | Siembra | AN1E3 | Agar nutritivo | Cosecha |
| AN2E1 | Agar nutritivo | Siembra | AN2E3 | Agar nutritivo | Cosecha |
| AN3E1 a | Agar nutritivo | Siembra | AN3E3 a | Agar nutritivo | Cosecha |
| AN4E1 a | Agar nutritivo | Siembra | AN4E3 | Agar nutritivo | Cosecha |
| AN5E1 b | Agar nutritivo | Siembra | AN5E3 | Agar nutritivo | Cosecha |
| AS1E1 | Agar suelo | Siembra | AS1E3 | Agar suelo | Cosecha |
| AS2E1b | Agar suelo | Siembra | AS2E3 | Agar suelo | Cosecha |
| AS4E1b | Agar suelo | Siembra | AS3E3 | Agar suelo | Cosecha |
| AS5E1 a | Agar suelo | Siembra | AS4E3 | Agar suelo | Cosecha |
| AN1E2 | Agar nutritivo | Floración | AN1E4 b | Agar nutritivo | Postcosecha |
| AN2E2 | Agar nutritivo | Floración | AN2E4 b | Agar nutritivo | Postcosecha |
| AN3E2 | Agar nutritivo | Floración | AN3E4 b | Agar nutritivo | Postcosecha |
| AN4E2 | Agar nutritivo | Floración | AN4E4b | Agar nutritivo | Postcosecha |
| AN5E2 | Agar nutritivo | Floración | AN5E4 a | Agar nutritivo | Postcosecha |
| AS1E2 | Agar suelo | Floración | AS1E4 | Agar suelo | Postcosecha |
| AS2E2 b | Agar suelo | Floración | AS2E4 | Agar suelo | Postcosecha |
| AS3E2 a | Agar suelo | Floración | AS3E4 | Agar suelo | Postcosecha |
| AS4E2 a | Agar suelo | Floración | AS4E4 a | Agar suelo | Postcosecha |
| AS5E2 a | Agar suelo | Floración | AS5E4 | Agar suelo | Postcosecha |
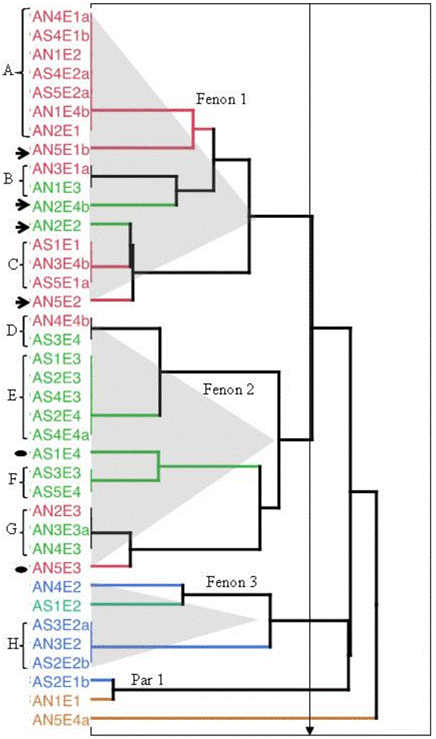
Se consideraron 16 pruebas morfológicas, 8 pruebas fisiológicas y 34 pruebas bioquímicas. Nomenclatura de los aislados: ADN = agar nutritivo; AS = agar extracto de suelo; E = época.
Figura 1 Análisis de Cluster (distancia euclidiana de 0.5, método de Ward), de 38 aislados bacterianos procedentes de la rizocoraza de Amaranthus hypochondriacus de acuerdo a su índice de similitud.
Cuadro 2 Respuesta de los aislados bacterianos al metabolismo respiratorio, a la producción de enzimas extracelulares y al uso de nutrimentos orgánicos pertenecientes a distintas familias químicas como única fuente de carbono y energía.
| Aislado | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Metabolismo respiratorio | ||||||||||||||||||||||||||||||||||||||
| Oxidación de glucosa | + | + | + | + | + | + | + | + | + | + | + | + | - | - | - | - | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - |
| Fermentación de glucosa | + | + | + | + | + | + | + | + | - | - | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | - | + | + | + | + | + | + | - |
| Reducción de nitratos | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | - | + |
| Respiración de sulfatos | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Citocromo-oxidasa | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | + | + | + | + | + | + | + |
| Catalasa | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Enzimas extracelulares | ||||||||||||||||||||||||||||||||||||||
| DNAsa | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | + | + | + | + | + | - | + | + | + | + | + | + | + | - | + | + | + | - | - | + |
| Quitinasa | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | + | + | + | + | + | + | + | - | + | + | + | + | + | + | + | + | - | - | - | + | + | - |
| Fosfatasa | - | - | - | - | - | - | - | - | - | - | + | - | - | - | - | + | - | - | - | - | - | - | - | + | + | + | - | - | - | - | - | - | - | - | - | - | - | - |
| Tweenasa | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | + | + | - |
| Gelatinasa | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Esculinasa | + | + | + | + | + | + | + | + | + | + | + | - | - | - | - | - | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | - | - |
| Amilasa | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Lecitinasa | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Nutrimentos | ||||||||||||||||||||||||||||||||||||||
| Serina | + | + | + | + | + | + | + | + | - | - | - | + | + | + | + | + | + | + | + | + | + | + | + | - | - | - | + | + | + | + | + | + | + | + | + | + | + | - |
| Glutamato | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - |
| Prolina | + | + | + | + | + | + | + | - | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Triptófano | - | - | - | - | - | - | - | - | + | + | - | - | - | - | - | - | - | - | - | - | - | - | - | + | + | + | + | + | + | + | - | - | + | + | + | + | + | + |
| Arginina | + | + | + | + | + | + | + | - | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | - | + | + | + | + | + | - |
| Ornitina | + | + | + | + | + | + | + | + | + | + | - | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | - | + | + | + | + | + | - |
| Alanina | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | - | - | - | - | - | - | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Metionina | - | - | - | - | - | - | - | - | - | - | + | - | - | - | - | - | + | + | + | + | + | + | + | - | - | - | - | - | - | - | + | - | + | + | + | + | + | + |
| Arabinosa | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | - | - | - | - | - | - | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - |
| Ribosa | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - |
| Glucosa | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | - | - | + | + | + | + | + | + | + | + | + | + | + | + |
| Sacarosa | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | - | - | - | - | - | - | - | - | - | + | + | + | + | + | + | + | + | + | + | + | - |
| Almidón | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Gluconato | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - |
| Malonato | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | - | - | - | + | + | + | + | + | + | + | - |
| Succinato | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Fumarato | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | - | - | - | - | + | + | + | - | - | - | - | + | + | + | + | + | + | + | + |
| Adipato | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | + | + | + | + | + | - | - | - | - | - | - | - | - | - | - | - | - | - | + | + |
| Lactato | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - |
| Citrato | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - |
| Acetato | + | + | + | + | + | + | + | + | - | - | + | + | + | + | + | + | - | - | - | - | - | - | - | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - |
| Propionato | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | - | + | + | + | + | + | + |
| Capronato | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | - | - | - | - | + | + | + |
| Manitol | + | + | + | + | + | + | + | + | + | + | + | - | - | - | - | - | + | + | + | + | + | + | + | + | - | - | + | + | + | + | + | + | + | + | + | + | + | + |
| Sorbitol | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - | - | + | + | + | + | + | + | + | + | + | + | + | - |
| Glicerol | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | - |
Aislados que conforman el Fenon 1, del 1 a 16 (AN4E1a, AS4E1b, AN1E2, AS4E2a, AS5E2a, AN1E4b, AN2E1, AN5E1b, AN3E1a, AN1E3, AN2E4b, AN2E2, AS1E1, AN3E4b, AS5E1a y AN5E2, respectivamente); Fenon 2, aislados del 17 al 30 (AN4E4b, AS3E4, AS1E3, AS2E3, AS4E3, AS2E4, AS4E4a, AS1E4, AS3E3, AS5E4, AN2E3, AN3E3a, AN4E3 y AN5E3, respectivamente); Fenon 3, aislados del 31 al 35 (AN4E2, AS1E2, AS3E2a, AN3E2 y AS2E2b, respectivamente); Par 1, aislados 36 y 37 (ASE1b y AN1E1) y aislado 38 (AN5E4a).
Cuadro 3 Índice medio de actividad exoenzimática (IME) e índice medio de utilización de compuestos orgánicos (IMU) por fenon, par o aislado.
| Aislado | IME | IMU | Aislado | IME | IMU |
|---|---|---|---|---|---|
| -----------------%---------------- | -------------------%------------------ | ||||
| AN4E1 a | 50 | 89 | AS4E3 | 75 | 77 |
| AS4E1 b | 50 | 89 | AS2E4 | 75 | 77 |
| AN1E2 | 50 | 89 | AS4E4 a | 75 | 77 |
| AS4E2 a | 50 | 89 | AS1E4 | 63 | 85 |
| AS5E2 a | 50 | 89 | AS3E3 | 88 | 77 |
| AN1E4 b | 50 | 89 | AS5E4 | 88 | 77 |
| AN2E1 | 50 | 89 | AN2E3 | 75 | 89 |
| AN531 b | 50 | 81 | AN3E3 a | 75 | 89 |
| AN3E1 a | 50 | 85 | AN4E3 | 75 | 89 |
| AN1E3 | 50 | 85 | AN5E3 | 75 | 89 |
| AN2E4 b | 63 | 85 | FENON 2 | 74 | 81 |
| AN2E2 | 38 | 85 | AN4E2 | 75 | 77 |
| AS1E1 | 38 | 85 | AS1E2 | 63 | 73 |
| AN3E4 b | 38 | 85 | AS3E2 a | 63 | 92 |
| AS5E1 a | 38 | 85 | AN3E2 | 63 | 92 |
| AN5E2 | 50 | 85 | AS2E2 b | 63 | 92 |
| FENON 1 | 48 | 86 | FENON 3 | 63 | 85 |
| AN4E4 b | 63 | 77 | AS2E1b | 63 | 96 |
| AS3E4 | 63 | 77 | AN1E1 | 63 | 100 |
| AS1E3 | 75 | 77 | PAR 1 | 63 | 98 |
| AS2E3 | 75 | 77 | AN4E4 a | 50 | 46 |
Con excepción de los aislados AS1E1, AS5E1a, AN5E2 y AN3E4b, todos presentaron respuesta positiva a la oxidación de glucosa en condiciones aerobias; salvo los aislados AN3E1a, AN4E2, AN1E3 y AN5E3, el resto fueron capaces de fermentar la glucosa en condiciones anaerobias. El aislado AN5E4a no oxida ni fermenta la glucosa. Sólo los aislados AN1E1 y AS2E1b mostraron respuesta negativa a la reducción de nitratos; el 94.7% de ellos mostraron actividad desnitrificante (Cuadro 2) y ninguno redujo los sulfatos. Todos los aislados produjeron la enzima catalasa y únicamente el aislado AN4E2 resultó negativo a la producción de citocromo- oxidasa. Estos resultados sugieren la presencia en los suelos rizocorázicos de una comunidad bacteriana aerobia facultativa, lo cual corresponde a lo reportado por Prescott et al. (1999) y Koneman (2001). Para las bacterias del género Bacillus, comunes en los microambientes de la rizosfera, el oxígeno no es un factor limitante (Branda et al., 2001). La diversidad metabólica de los aislados les permite una amplia adaptación a las variaciones de oxigenación que pueda haber en la rizocoraza durante las diferentes etapas del cultivo. La textura arenosa de estos suelos y la no saturación de los poros por agua permiten la presencia de O2 y muy probablemente se favorezca la presencia de heterótrofos anaerobios facultativos como Pseudomonas, Bacillus o Micrococcus capaces de reducir los nitratos (Holt et al., 1994) hasta óxidos nitroso y nítrico. Todos los aislados fueron capaces de emplear succinato como única fuente de energía y carbono (Cuadro 2). El triptófano, la metionina y el adipato fueron las fuentes de carbono menos utilizadas y el almidón el más utilizado (Cuadro 2).
Todos los aislados fueron capaces de producir gelatinasa, amilasa y lecitinasa (Cuadro 2). Únicamente los aislados AN2E4b, AN5E2, AS1E4 AS3E3 y AS5E4 produjeron fosfatasas y sólo dos produjeron lipasas (AS2E1b y AN1E1). La producción de DNAsa y quitinasa mostraron un comportamiento más variado (Cuadro 2). Todos los aislados con excepción de algunos agrupados en el fenon 1 (Cuadro 1, Figura 1), mostraron un IME igual o mayor al 50% (Cuadro 3).
En resumen, los aislados bacterianos procedentes de la época de siembra emplearon en mayor medida carbohidratos y ácidos grasos; durante la floración, carbohidratos y alcoholes; en la cosecha, alcoholes, ácidos grasos y carbohidratos, y durante la postcosecha, ácidos orgánicos y grasos (Figura 2). La producción de enzimas extracelulares fue menor durante la siembra; la producción de twenasa sólo fue observada en esta época; igualmente, en esta época se observó la mayor capacidad de utilizar una gran diversidad de fuentes de carbono de bajo peso molecular pertenecientes a una amplia gama de familias químicas (Figura 2).
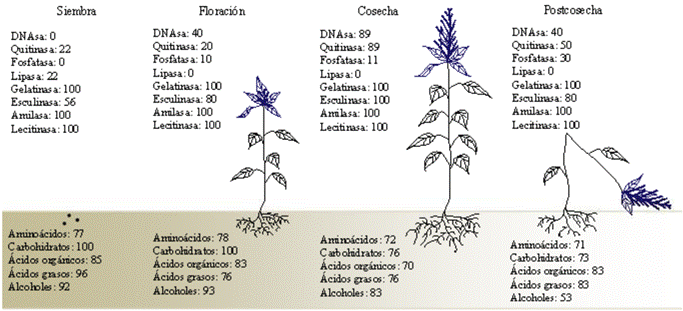
Figura 2 Porcentaje de producción de enzimas extracelulares y de uso de nutrimentos pertenecientes a diferentes familias químicas como única fuente de energía por los 38 aislados bacterianos procedentes de la rizocoraza de A. hypochondriacus durante cada una de las cuatro épocas consideradas en el estudio.
El análisis de conglomerados realizado con los resultados de las 16 pruebas morfológicas, 8 fisiológicas y 34 bioquímicas, agrupó a una distancia euclidiana de 0.5 a los 38 aislados bacterianos en tres fenones, un par y un aislado sin agrupar (Figura 1):
a) En el fenon 1 se agruparon 16 de los 38 aislados (AN4E1a, AS4E1b, AN1E2, AS4E2a, AS5E2a, AN1E4b, AN2E1, AN5E1b, AN3E1a, AN1E3, AN2E4b, AN2E2, AS1E1, AN3E4b, AS5E1a y AN5E2), todos bacilos Gram positivo con la menor capacidad degradativa (IME de 48%), pero con una alta capacidad de utilizar una amplia gama de compuestos orgánicos simples como única fuente de carbono y energía (IMU de 86%) (Cuadro 2 y 3). Dentro del fenon se observan tres grupos, en ellos los subgrupos A, B y C se agruparon a una distancia euclidiana de cero a siete, dos y tres aislados respectivamente, ya que sus respuestas a las pruebas fisiológicas aplicadas fueron idénticas (Figura 1), por lo que podrían pertenecer a una misma especie. El aislado AN2E4b se separa del subgrupo B ya que es el único que presenta cuerpos intrusivos, utiliza la metionina y junto con AN5E2 del subgrupo C, produce fosfatasa. Éste último, junto con AN5E1b, AN2E2 y AN5E2, se agrupan a una distancia euclidiana mayor con estos subgrupos sugiriendo que se trata de especies distintas que comparten ciertos caracteres bioquímicos con los otros aislados. Este fenon se conforma principalmente por aislados provenientes de la época de siembra.
b) El fenon 2 reúne 14 aislados (AN4E4b, AS3E4, AS1E3, AS2E3, AS4E3, AS2E4, AS4E4a, AS1E4, AS3E3, AS5E4, AN2E3, AN3E3a, AN4E3 y AN5E3), bacilos Gram positivo, con mayor capacidad degradativa que los agrupados en el fenon 1 (IME de 74%) pero con un valor del IMU ligeramente menor (81%) (Cuadro 2 y 3). Dentro de este fenon se observan cuatro agrupaciones (D, E, F y G) con distancia euclidiana de 0 que podrían pertenecer a la misma especie (Figura 1). El aislado AN5E3, junto con el par formado por AS3E3 y AS5E4 (subgrupo F),producen fosfatasa; este subgrupo se destaca por mostrar el IME más elevado (87.5%). El aislado AS1E4 se separa de este par ya que es el único que no fermenta glucosa. Este fenon está integrado por aislados obtenidos durante la cosecha y postcosecha, épocas en las que se observaron altos valores de producción de fosfatasa, enzima involucrada en la liberación de fósforo asimilable.
c) Fenon 3 agrupa cinco aislados (AN4E2, AS1E2, AS3E2a, AN3E2 y AS2E2b). Los bacilos Gram negativos, con un valor de IME menor que el fenon 2 (65%) y un IMU de 85% semejante al fenon 1 (Cuadro 2 y 3). Dentro de este fenon se observaron dos subgrupos formados por el par (AN4E2 y AS1E2) con mayor IMU (68.7%), mientras que los pertenecientes al subgrupo H se distinguen por producir una menor cantidad de enzimas extracelulares y tener una forma colonial plana y de textura mucosa. El fenon se formó por aislados provenientes de la época de floración (Figura 2).
d) En el par se reunieron los aislados AS2E1b y AN1E1 que son filamentos Gram positivo esporulados, sin cuerpos intrusivos que forman colonias de textura suave y forma irregular de color gris; olor característico a “tierra mojada”. Oxidan y fermentan la glucosa y no producen fosfatasa ni esculinasa (Cuadro 2 y 3). El valor del IME fue similar al fenon 3 (63%), pero a diferencia de los demás aislados, en este par se unieron los aislados capaces de utilizar todas las familias químicas probadas como fuente de carbono para su crecimiento (IMU de 98%) (Cuadro 2 y 3). Ambos aislados provienen de la época de siembra.
e) El aislado AN5E4a no se agrupó con ningún otro aislado, es un bacilo Gram positivo no esporulado y a diferencia del par 1, no fermenta ni oxida la glucosa, produce DNAsa, y no produce quitinasa ni lipasa (Cuadro 2 y 3). SuIME fue de 50% y el valor del IMU fue el más bajo (46%) (Cuadro 2 y 3), ya que no utiliza la mayor parte de los aminoácidos probados, ni la arabinosa y ribosa. Se aisló durante la época de postcosecha.
Debido al contacto estrecho entre las raíces y las partículas minerales del suelo, es muy probable que en las rizocorazas exista una mayor cantidad de rizodeposiciones constituidas por exudados, mucílagos y gomas, así como por estructuras celulares liberadas por las raíces al suelo y fácilmente metabolizables por los microorganismos para la obtención de energía, en comparación con el suelo adyacente que no está sujetado por los pelos absorbentes. Los altos valores del IMU observados en la mayoría de los aislados, indican que los sustratos de bajo peso molecular probados como única fuente de carbono pueden ser similares a los exudados radicales (Cuadro 3).
Durante las diferentes etapas del cultivo de amaranto ocurren cambios fisiológicos y metabólicos en las comunidades microbianas asociadas a la raíz. En este sentido, las variaciones de los valores del IME e IMU durante las tres épocas (floración, cosecha y postcosecha) pueden deberse a que los compuestos exudados por las raíces transforman las condiciones físicas y químicas del suelo modificando la calidad y cantidad de los sustratos disponibles (Kandeler et al., 2002; Marschner y Baumann, 2003; Marschner et al., 2004). Los resultados coinciden con Perry et al. (2006), quienes reportaron que los exudados radicales determinan la composición de las comunidades microbianas y sus actividades, además, que un mismo exudado es capaz de actuar como antimicrobiano o favorecer la disponibilidad de algún nutrimento dependiendo de su concentración y de la microbiota con la que interactúe. En los suelos, muchos de los sustratos disponibles son de elevado peso molecular (lignina, celulosa, sustancias húmicas), por lo que el papel de las enzimas extracelulares es de particular importancia; una vez que la hidrólisis de los polímeros ocurre, las células bacterianas absorben del exterior una serie de monómeros como la glucosa para su metabolismo.
Existen pocos trabajos dirigidos al estudio de las comunidades microbianas de la rizocoraza. Oyeyiola (2010), realizó un estudio sobre la comunidad bacteriana de la rizosfera de A. hybridus en un suelo arenoso de composición similar al suelo estudiado (arena: 88.1%, limo: 5.77% y arcilla: 10.13%); sus resultados reportan la presencia de bacterias de los géneros Bacillus, Pseudomonas, Micrococcus, así como un aumento en la densidad bacteriana entre los 70 y 90 días de la siembra, equivalente al periodo de cosecha en este estudio. De acuerdo con el análisis fenético realizado y con las características morfológicas y fisiológicas señaladas en el Manual de Bergey (Holt et al., 1994) para la familia Bacillaceae, la mayoría de los aislados obtenidos de la rizocoraza de A. hypochondriacus pueden pertenecer a dicha familia. Los subgrupos observados en los fenones 1 y 2 sugieren la presencia de al menos cinco especies de Bacillus. Las bacterias aerobias Gram positivo formadoras de esporas del género Bacillus han sido reportadas en un amplio número de suelos sujetos a diversas condiciones climáticas (Garbeva et al., 2003); los Bacillus poseen un potencial solubilizador de fósforo (Villegas y Fortin, 2002) y por lo tanto se les reconoce como promotores del crecimiento vegetal (Kloepper, 1994). En este estudio sólo cinco de los 38 aislados produjeron fosfatasas, pero todos produjeron lecitinasa, enzima extracelular asociada a la hidrólisis de fosfolípidos (Cuadro 2). Oyeyiola (2010), reportó la presencia de B. subtilis, agente de control biológico contra Fusarium oxysporum, con actividad solubilizadora de fosfatos y producción de amilasas y celulasas (Swain y Ray, 2009) y B. cereus, saprobio, productor de antibióticos y promotor del crecimiento vegetal (Kloepper, 1994; Vilain et al., 2006).
Los aislados Gram negativos del fenon 3 tienen características morfológicas y fisiológicas semejantes a bacterias de las familias Enterobacteriaceae y Pseudomonadaceae (Holt et al., 1994). Los géneros Enterobacter y Pseudomonas se han reportado como promotores del crecimiento vegetal (Chelius y Triplett, 2000), ya que ambos producen auxinas (Vázquez et al., 2000; Schütz et al., 2003).
Los aislados agrupados en el par presentan características morfológicas y fisiológicas semejantes a las de la familia Streptomycetaceae de acuerdo al Manual de Bergey (Holt et al., 1994). Dentro de esta familia, los Streptomyces son microorganismos heterótrofos que participan en la degradación de la MO (Mokni-Tlili et al., 2009). Ambos aislados se obtuvieron en la época de siembra, caracterizada por la presencia de los residuos más recalcitrantes de la cosecha anterior (tallos y raíces), ambiente que favorece el desarrollo de Streptomyces; suelen ser más frecuentes en las temporadas de estiaje cuando en el suelo ya se han metabolizado los compuestos orgánicos más lábiles (Porta et al., 2003; Atlas y Bartha, 2006). La posibilidad de que los miembros del par pertenezcan a este género también se basa en su aislamiento en medio AS que, de acuerdo con Hamaki et al. (2005), es un sustrato idóneo, además de que son los únicos que producen enzimas extracelulares capaces de hidrolizar aceites hidrogenados poliglicolisados (lipasa).
Estudios subsecuentes deben enfocarse en la identificación molecular (por ejemplo, en el análisis del segmento 16S rDNA) para determinar con certeza la identidad de los aislados. Adicionalmente, deberá probarse el potencial de los aislados como solubilizadores de fósforo, promotores del crecimiento vegetal y antagonistas fitopatógenos. Los treinta y ocho aislados bacterianos muestran características que los hacen potencialmente útiles como biofertilizantes y aceleradores de la degradación de la MO por lo que pueden ser estudiados para el desarrollo de estrategias de manejo agroecológico.
Conclusiones
Los tipos fisiológicos de la comunidad bacteriana cultivable en agar nutritivo y agar suelo asociada a las rizocorazas de A. hypochondriacus juegan un papel relevante en la disponibilidad de nutrimentos para la micro y macrobiota que habita en estos suelos y para las plantas cultivadas, por su fuerte potencial para producir enzimas extracelulares en todas las etapas del cultivo. Los aislados bacterianos se agruparon en tres fenones, un par y un aislado solo, que podrían pertenecer a las familias Bacillaceae, Enterobacteriaceae, Pseudomonadaceae y Streptomycetaceae. La época de siembra se caracterizó por la presencia de bacterias de la familia Streptomycetaceae; en dicha época, la producción de enzimas extracelulares fue menor pero se observó el uso de una amplia gama de fuentes de carbono. En la siembra y floración se identificaron los aislados bacterianos con mayor capacidad para usar fuentes de carbono de bajo peso molecular. En la cosecha y postcosecha se observó la mayor diversidad de tipos fisiológicos bacterianos con alto potencial degradativo ya que produjeron siete de las ocho enzimas extracelulares probadas. La distribución de las bacterias y sus tipos fisiológicos en las diferentes épocas sugieren que existe un efecto de las rizodeposiciones sobre la comunidad bacteriana que deberá ser estudiado. Asimismo, la manera en la que se distribuyen los perfiles de actividad exoenzimática y de uso de fuentes de carbono en cada época pueden emplearse para el diseño de sistemas de fertilización biológicos en los que la aplicación de una determinada cepa o de un consorcio microbiano se realice de manera más precisa y sistematizada.











 nueva página del texto (beta)
nueva página del texto (beta)


