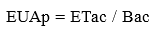Introducción
El agua es indispensable en la vida de las plantas e influye en su crecimiento y productividad. La poca disponibilidad de agua en el suelo puede ocasionar que la transpiración exceda el agua absorbida por las raíces, lo que se conoce como estrés hídrico (Munns y Tester, 2008). Actualmente la medida más utilizada para estimar este parámetro es el potencial hídrico (Ψ) (Taiz y Zeiger, 2002).
En los bosques tropicales estacionalmente secos de la Península de Yucatán es común que las plantas queden expuestas a períodos de estrés hídrico (Hasselquist et al., 2010). En estos bosques dominan las especies caducifolias ya que estan adaptadas para minimizar la pérdida de agua durante los períodos de baja disponibilidad (Murphy y Lugo, 1986). Dichas adaptaciones consisten en absición foliar, disminución del Ψ y almacenamiento de agua en sus órganos (Tyree et al., 2002).
La intensidad y duración del estrés hídrico influye en los efectos y la capacidad de las plantas para resistirlo (Engelbrecht, 2001; Garau et al., 2009), entre los principales efectos del estrés hídrico sobre el crecimiento esta la reducción en la altura, tallo, raíces, área foliar, peso foliar específico y biomasa de la planta (Farooqi et al., 1994; Engelbrecht, 2001; Khurana y Singh, 2004; Singh y Singh, 2006). Asimismo, la eficiencia de uso de agua en la productividad (EUAp) también es alterada debido a los cambios en la biomasa total y en la evapotranspiración (Turner, 1986).
Durante el estado de plántula se experimenta mayor estrés hídrico porque los individuos aún no han desarrollado un sistema radicular extenso ni profundo y su acceso al agua del suelo es limitado (Tyree et al., 2003; Lüttge, 2007). Esta etapa condiciona el establecimiento de las especies vegetales ya que el estrés hídrico puede provocar su muerte; por ello es necesario estudiar sus respuestas fisiológicas y morfológicas ante condiciones de baja humedad del suelo (Cregg, 2004).
El objetivo del presente estudio fue evaluar el efecto del estrés hídrico sobre el estado hídrico, crecimiento y la eficiencia del uso del agua en la productividad (EUAp) de plántulas de Cordia dodecandra (A.DC), Piscidia piscipula (L) y Leucaena leucocephala (Lam.) de Wit. bajo condiciones de invernadero.
Materiales y métodos
Sitio de Estudio
El estudio se realizó en un invernadero del Campus de Ciencias Biológicas y Agropecuarias (CCBA) de la Universidad Autónoma de Yucatán (UADY) ubicado en el km 15.5 de la carretera Mérida-Xmatkuil (20° 51’ 57.36” N y a los 89° 37’ 23.04” O). El invernadero tenía una superficie de 7 × 8 × 8 m (largo, ancho y alto), protegido con plástico de color negro alrededor y techo de lámina de zinc (exterior), con aislante de fibra de vidrio (interior).
Experimento
Las plántulas se obtuvieron de dos viveros certificados por la Comisión Nacional Forestal (CONAFOR). Las especies fueron propagadas por semilla y tenían tres meses (L. leucocephala) y cuatro meses (P. piscipula y C. dodecandra) de edad antes del trasplante. Estas especies caducifolias tienen un alto potencial económico; L. leucocephala (forrajera), P. piscipula (melífera) y C. dodecandra (maderable), por lo que se ha incrementado su plantación en los sistemas agroforestales en el Estado de Yucatán (Brewbaker, 1987; Reuter et al.,2008; Zamora et al., 2009).
Cada plántula se trasplantó a una maceta de plástico de 14 × 18 × 22 cm (diámetro inferior, altura y diámetro superior) conteniendo 3 kg de suelo rojo tipo Cambisol (Estrada-Medina et al., 2013) tamizado a 2 mm, secado al horno a 105 °C durante 24 h y dispuesto a capacidad de campo (CC) el día del trasplante. Para caracterizar el suelo se realizaron los siguientes análisis: textura (densimétrico), carbonatos (titulométrico) y materia orgánica (Walkey y Black) (Sparks et al., 1996). La textura del suelo fue franco arcillosa (33.04% de limos, 35.86% de arcillas y 31.10% de arenas) con 1.0% de CaCO3, 1.2% de materia orgánica y 0.49% de N.
Las macetas de ambos tratamientos se colocaron sobre mesas de 80 × 100 × 60 cm (alto, largo y ancho). Las plántulas tuvieron un periodo de aclimatación de dos meses (diciembre-febrero) con riegos semanales a CC. La CC del suelo utilizado se calculó gravimétricamente, para esto se seleccionaron cinco macetas con 3 kg de suelo seco que fueron regadas en exceso y se dejaron drenar libremente por 24 h bajo condiciones del invernadero. La CC promedio del suelo utilizado en las macetas fue de 1254.5 ml ± 38.14 por maceta (418.16 ml kg-1). Durante la aclimatación y el experimento se llevó un control de la radiación utilizando 2 líneas de 5 focos incandescentes de 150 watts, colocadas a lo largo de la parte media de las mesas y a 1.80 m de altura con respecto a la base de las macetas. Los focos se encendieron diariamente de manera automática de 6:00 a 18:00 h a través de un temporizador. Se cuantificó la radiación fotosintéticamente activa (PAR) cada 30 min dentro del invernadero con un sensor de PAR LiB-M003 conectado a una microestación meteorológica HOBO. Las condiciones promedio en el invernadero durante la aclimatación y el experimento fueron: luz total de 1.8 mol m-2 día-1, temperatura de 30.7 °C y humedad relativa de 54.1%.
Después del periodo de aclimatación, se seleccionaron 24 plántulas sanas, vigorosas y similares en sus características fenotípicas (altura y morfología). El diseño experimental consistió de dos tratamientos: con estrés inducido (CEI) y sin estrés inducido (SEI) con cuatro plántulas de cada especie por tratamiento. En el tratamiento CEI, el riego se suspendió al concluir el periodo de aclimatación, mientras que en el tratamiento SEI el riego continuó aplicándose semanalmente para restaurar la CC del suelo. El riego en el tratamiento SEI se calculó por diferencia entre el peso de las macetas a CC del último riego aplicado y el peso de las macetas a los siete días después del riego (Dwyer, 1986).
Las plántulas del tratamiento CEI de cada especie se observaron diariamente hasta detectar la manifestación del primer síntoma de marchitez en cada individuo. El número de días que se reporta para la observación de los síntomas de marchitez corresponde al momento en que todas las plántulas de cada especie manifestaron esta condición. El muestreo consistió en retirar las plántulas de cada tratamiento y cada especie de su maceta, para posteriormente evaluar el estado hídrico (potencial hídrico, contenido de agua -hoja, tallo y raíz-, y evapotranspiración), crecimiento (altura, longitud de la raíz, área foliar, peso foliar específico y biomasa seca) y eficiencia del uso del agua en la productividad (EUAp).
Estado Hídrico
El contenido relativo de agua en el suelo (CRAS), se expresó en porcentaje empleando la Ecuación 1, donde: Pf es el peso fresco de la muestra de suelo y Ps es el peso seco, después de secar la muestra de suelo en una estufa (105 °C hasta peso constante).
El potencial hídrico (Ψ): se midió al medio día en el tallo de las plántulas con una bomba de presión, empleando la metodología descrita por Scholander et al. (1965).
La evapotranspiración diaria (ET) se determinó usando la Ecuación 2, donde: PMmcc es el peso de la maceta a CC del último riego realizado, PMmdm es el peso de la maceta del día del muestreo y d son los días transcurridos entre el último riego realizado y el día del muestreo (Dwyer et al., 1986). La diferencia de pesos de las plántulas entre muestreos se consideró despreciable.
El contenido relativo de agua (CRA) se calculó usando la Ecuación 3, propuesta por Beadle et al. (1993), donde: Pf, Ps y Pt son el peso fresco, seco y túrgido de la planta, respectivamente. El peso túrgido se registró después de mantener el tejido vegetal sumergido en agua durante 24 horas. El peso seco se obtuvo secando la planta en una estufa a 65 oC hasta su peso constante. El CRA se obtuvo de las hojas (CRAH), el tallo (CRAT) y la raíz (CRAR).
Crecimiento
La altura de la planta (AP) fue medida con cinta métrica desde la base del tallo hasta el último nudo de la plántula. La longitud de la raíz (LR) se midió desde el cuello de la plántula hasta la cofia siguiendo la raíz más larga. La biomasa seca de las hojas y el tallo (BH+T) y de la raíz (BR) se obtuvo secando la muestra en una estufa a 65 °C hasta su peso constante. El área foliar (AF) se determinó en cada hoja con un medidor de área foliar portatil CI-202 Portable Area Meter (CID Bio-science, Inc. WA, USA).
Eficiencia del Uso del Agua en la Productividad (EUAp)
La EUAp se calculó usando la Ecuación 4, donde: ETac es el cociente de la ET diaria acumulada a partir de la suspensión del riego hasta el día del muestreo y Bac es la biomasa al inicio y al final del experimento dividido entre el número de días transcurridos.
Resultados y discusión
Estado Hídrico
El efecto del estrés inducido sobre las plántulas de C. dodecandra, P. piscipula y L. leucocephala sobre el estado hídrico fue la disminución en la evapotranspiración (ET) (Figura 1), el potencial hídrico (Ψ) al medio día y el contenido relativo de agua (Cuadro 1).
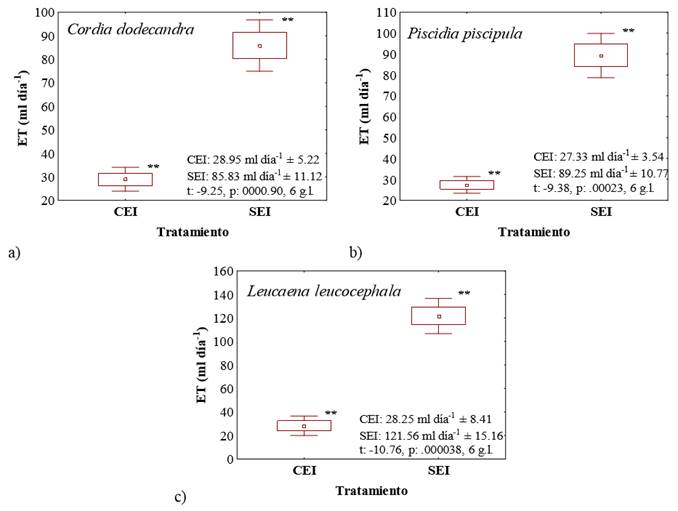
Figura 1. Evapotranspiración en las plántulas de a) Cordia dodecandra, b) Piscidia piscipula y c) Leucaena leucocephala con estrés inducido (CEI) y sin estrés inducido (SEI). Símbolo ** indica diferencias significativas (t de Student, P ≤ 0.01).
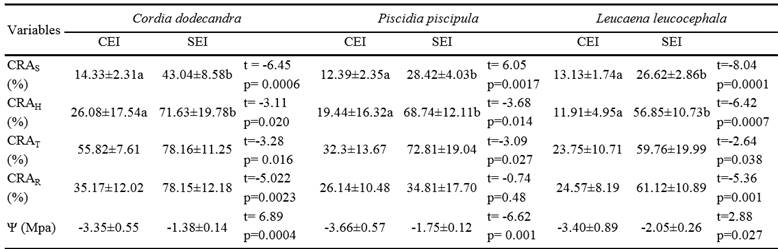
Promedio ± desviación estándar. CRAS = contenido relativo de agua en el suelo; CRAH = contenido relativo de agua en las hojas; CRAT = contenido relativo de agua en el tallo; CRAR = contenido relativo de agua en la raíz, Ψ = potencial hídrico al medio día. Letras distintas entre tratamientos por cada especie indican diferencias significativas (t de Student, P ≤ 0.05).
Cuadro 1. Variables de estado hídrico de Cordia dodecandra, Piscidia piscipula y Leucaena leucocephala con estrés inducido (CEI) y sin estrés inducido (SEI).
La ET registrada para el tratamiento CEI fue significativamente menor (P ≤ 0.01) que el tratamiento SEI para cada especie. En las plántulas de C. dodecandra del tratamiento CEI se presentó una disminución del 66% en la ET con respecto a la obtenida en el tratamiento SEI con diferencias significativas. En el caso de P. piscipula se observó una reducción del 69% en el tratamiento CEI en comparación al SEI presentando diferencias significativas (P ≤ 0.01). En cuanto a L. leucocephala la ET se redujo 76% en el tratamiento CEI respecto al SEI con diferencias significativas (P ≤ 0.01). En un estudio en campo con Hordeum vulgare la ET se redujó 75% cuando se disminuyó 15% el contenido de agua en el suelo (Dwyer et al., 1986). Jaleel et al. (2009), determinaron que el cierre estomático y la reducción del área foliar son las estrategias de evasión de la sequía más importantes que permiten a las plantas reducir la pérdida de agua. En este estudio, las condiciones experimentales fueron similares para todas las especies, por lo tanto la evaporación debió ser semejante entre tratamientos, sugiriendo que la transpiración es el factor principal causante de las diferencias en las tasas de ET encontradas. Las diferencias en la tasa de ET en el tratamiento CEI pudieron deberse también a la abscición foliar observada en P. piscipula y L. leucocephala. En el caso de C. dodecandra no se observó absición foliar pero las hojas se secaron y aparentemente murieron sin desprenderse de la planta.
Los Ψ al mediodía para cada una de las tres especies fueron significativamente menores (P ≤ 0.05) en el tratamiento CEI con respecto al tratamiento SEI. Turner et al. (1996), reportaron que el Ψ al mediodía de plántulas de Passiflora edulis bajo condiciones de invernadero fue de -1.5 MPa en el tratamiento húmedo (riegos diarios a CC) y -3.7 MPa en el tratamiento seco, después de una semana sin riego. Asi mismo, Veenendaal et al. (1995) obtuvieron Ψ al mediodía de -1 MPa al final de la estación húmeda y -3.2 MPa al final de la estación seca en plántulas deciduas de Terminalia superba en condiciones de campo. Las especies caducifolias presentan un comportamiento anhisohídrico, lo que les permite mantener mayor conductancia estomática y disminuir su Ψ a mediodía a medida que disminuye el del suelo (McDowell, et al., 2008). En el tratamiento CEI se presentó menor CRAS ocasionando que el Ψ de las plántulas disminuyera para alcanzar un valor más negativo que el del suelo y poder seguir absorbiendo agua. En el tratamiento SEI los valores de Ψ se deben a que al mediodía, la temperatura va en aumento estimulando la apertura de los estomas, por lo que la transpiración incrementa y el Ψ se hace más negativo (Figura 1, 2 y 3) (Hsiao, 1973). El Ψ presenta fluctuaciones diarias, siendo los valores más bajos los correspondientes al mediodía, ya que es cuando existe un mayor desequilibrio entre la transpiración y la absorción de agua (Veenendaal et al., 1995). Por esta razón el Ψ al mediodía ha sido propuesto como un indicador estandar para determinar el estrés hídrico en árboles (Naor et al., 1995; Ferreyra et al., 2004).
El contenido relativo de agua en el suelo (CRAS) de C. dodecandra en el tratamiento CEI fue 67% menor y significativamente diferente (P ≤ 0.05) al obtenido en el tratamiento SEI. En P. piscipula el tratamiento CEI presentó una disminución de 56% en comparación con el tratamiento SEI, con diferencias significativas (P ≤ 0.05). En cuanto a L. leucocephala se observó una reducción de 50% en el CRAS en el tratamiento CEI con diferencias significativas (P ≤ 0.05) respecto al tratamiento SEI. La diferencia en el CRAS de los tratamientos se debió al efecto de la suspensión del riego en el tratamiento CEI, lo que ocasionó que la disponibilidad de agua para la planta se redujera a medida que transcurrieron los días y la ET continuó (Torrecillas, 1997).
En C. dodecandra todas las plántulas del tratamiento CEI manifestaron pérdida de turgencia foliar como el primer síntoma de marchitez, a los 28 días de haber suspendido el riego. En cuanto a P. piscipula el primer síntoma fue el amarillamiento foliar que se observó en todas las plántulas a los 28 días, en algunas de las hojas con amarillamiento también se presentó abscición foliar. En el caso de L. leucocephala el amarillamiento se manifestó en los foliólulos de las hojas de todas las plántulas a los 26 días, presentándose abscición de algunos de ellos, sin embargo no se observó desprendimiento del raquis de la hoja. En un estudio en invernadero con cinco especies tropicales sometidas a estrés hídrico por 22 semanas, las plántulas deciduas de Dipteryx panamensis manifestaron pérdida en el ángulo de la hoja y amarillamiento foliar a los 56 días sin riego (Tyree et al., 2002). En otro estudio realizado en campo se sometieron a estrés hídrico 28 especies tropicales durante 22 semanas, las plántulas deciduas de Pseudobombax septenatum y Tabebuia rosea presentaron cambios en la orientación y estructura de la hoja y abscición foliar a los 15 días sin riego (Engelbrecht y Kursar, 2003); esto sugiere que las plántulas sometidas a estrés hídrico manifestan síntomas de marchitez en diferentes periodos dependiendo de la especie. Las diferencias en el tiempo de manifiestación de los síntomas de marchitez depende de la intensidad y duración del estrés, así como de la fase de crecimiento en que se encuentre la planta (Garau et al., 2009). En cuanto a los primeros síntomas de marchitez observados en P. psicipula y L. leucocephala, el amarillamiento foliar es una manifestación de la degradación de la clorofila (Smart, 1994). En C. dodecandra se presentó la pérdida de turgencia como primer síntoma de marchitez como consecuencia de la baja disponibilidad de agua en el suelo que provocó que el fuera mas negativo (Parra et al., 1999).
El contenido relativo de agua en las hojas (CRAH) de C. dodecandra fue 63% menor en el tratamiento CEI con respecto al tratamiento SEI con diferencias significativas (P ≤ 0.05). En P. piscipula se presentó una reducción de 57% en el tratamiento CEI respecto al SEI con diferencias significativas (P ≤ 0.05). En el caso de L. leucocephala en el tratamiento CEI se obtuvo 67% menos CRAH en comparación con el tratamiento SEI con diferencias significativas (P ≤ 0.05). Bajo las condiciones de este estudio, las plantulas redujeron más de la mitad su CRAH antes de comenzar a manifestar síntomas de marchitez; sin embargo, aún faltan estudios para conocer cual es el limite más bajo de agua que las plántulas de cada especie pueden alcanzar antes de llegar a su punto de marchitez permanente. Tyree et al. (2003), registraron una reducción de 85% en el CRAH en plántulas caducifolias de Dipteryx panamensis después de 56 días sin riego en comparación con plántulas sin estrés. Abbey y Joyce (2004), sugieren que la reducción en el CRAH es proporcional al Ψ del suelo, ellos observaron que en plátulas de Alium cepa regadas a 25% de la CC, el Ψ fue -1.2MPa y el CRAH se redujo 72%, mientras que con riegos de reposición de la ET semanales el Ψ fue 0 MPa y el CRAH fue de 90%. Cuando el Ψ del suelo disminuye las plantas regulan la apertura de los estomas reduciendo el flujo transpirativo, este mecanismo de evasión a la sequía, les permite evitar el riesgo a la deshidratación total de la planta (Silva et al., 1999).
El contenido relativo de agua en el tallo (CRAT) de C. dodecandra fue 28% menor en el tratamiento CEI respecto al tratamiento SEI con diferencias significativas (P ≤ 0.05). En cuanto a P. piscipula se presentó una disminución de 59% en el tratamiento CEI respecto al SEI con diferencias significativas (P ≤ 0.05). En L. leucocephala el CRAT se redujo 60% en el tratamiento CEI en comparación al SEI presentando diferencias significativas (P ≤ 0.05). En este estudio, se observó que la pérdida de agua en la planta fue mayor en las hojas que en el tallo, esto debido a que en la hoja es donde se lleva a cabo la transpiración (Gil-Pelegrín et al., 2005). Allen et al. (2009), determinaron que el contenido de agua en el tallo en plántulas de C. dodecandra y Cedrela odorata no fue afectado, en condiciones de campo, cuando la disponibilidad del agua en el suelo disminuyó.
El contenido relativo de agua en la raíz (CRAR) de C. dodecandra fue 55% significativamente menor (P ≤ 0.05) en el tratamiento CEI que en SEI. En P. piscipula no se presentaron diferencias significativas entre tratamientos. En L. leucocephala se presentó una disminución de 60% en el tratamiento CEI en comparación al SEI con diferencias significativas (P ≤ 0.05). El primer órgano de la planta que se enfrenta a la poca disponibilidad de agua en el suelo, es la raíz por lo que su CRAR disminuye en función de la del suelo (Gil-Pelegrín et al., 2005). Ante la baja disponibilidad de agua en el suelo las raíces presentan resistencia al flujo radial, una estrategia para evitar la deshidratación, (North y Nobel, 1991), ésta actua como un sistema de impermeabilización para restringir la pérdida de agua, pero al mismo tiempo reduce la capacidad de entrada del agua en el sistema radicular. En P. piscipula el CRAR no fue diferente entre tratamientos, lo que sugiere almacenamiento agua en la raíz en el tratamiento CEI (Jackson et al.,1995; Poorter y Markestein, 2008).
Crecimiento
Las variables de crecimiento (altura, longitud de la raíz, número de hojas y biomasa) no fueron afectadas por el estrés hídrico (Cuadro 2). Resultados similares se obtuvieron en un estudio en invernadero con Albizia lebbeck, Lysiloma latisiliquum y P. Piscipula durante 2 meses de aplicación de tres dosis de riego: riego continuo (1000 ml cada tercer día), riego intermedio (500 ml cada 15 días) y déficit de riego (250 ml cada 30 días) donde no se mostraron diferencias significativas en la altura de las plántulas (Tamayo-Chin et al., 2012). Por otra parte Wu et al. (2008), reportaron que en Zygophyllum xanthoxylum las diferencias en la biomasa de hojas y tallo solo se presentaron en el tratamiento de estrés severo (riego diario a 15% de la CC), mientras que el estrés moderado (riego diario a 30% de la CC) no mostró diferencias en comparación con el control (riego diario a 45% de la CC). Lo anterior sugiere que posiblemente ante condiciones de estrés hídrico más severas las plántulas de las especies estudiadas podrían manifestar cambios en su altura y biomasa.
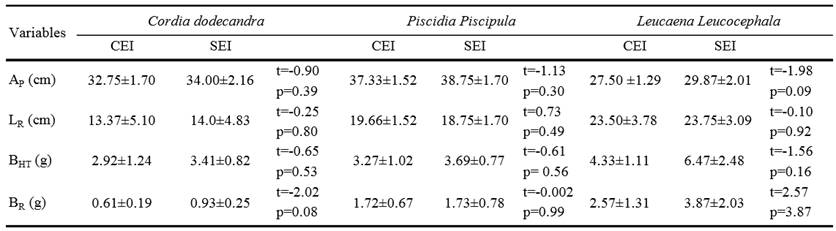
Promedio ± desviación estándar. AP = altura de la planta, LR = longitud de la raíz, BHT = biomasa de hojas y tallo, BR = biomasa de la raíz, AF = área foliar. No se presentaron diferencias significativas entre tratamientos para ninguna de las especies (t de Student, P ≤ 0.05).
Cuadro 2. Variables de crecimiento de Cordia dodecandra, Piscidia piscipula y Leucaena leucocephala con estrés inducido (CEI) y sin estrés inducido (SEI).
La longitud y biomasa de la raíz (LR y BR) no presentaron diferencias entre tratamientos para ninguna de las especies (Cuadro 2). El efecto del estrés hídrico sobre la distribución de la biomasa radicular es mínimo y la biomasa es afectada de manera indirecta a través de cambios en la tasa de crecimiento, lo cual puede deberse a ajustes en la relación fuente-demanda de agua en las plántulas (Wullschleger et al., 2005). Esto ha sido observado en plántulas caducifolias de Dalbergia sisso que bajo condiciones de estrés hídrico moderado no mostraron diferencias sobre el crecimiento y biomasa de la raíz (Singh y Singh, 2006).
El área foliar (AF) en las plántulas de C. dodecandra no presentó diferencias significativas entre tratamientos (Figura 2a). En P. piscipula el AF fue 35% significativamente menor (P ≤ 0.05) en el tratamiento CEI con respecto al SEI (Figura 2b). En L. leucocephala el AF se redujo 52% en el tratamiento CEI en comparación con el tratamiento SEI (Figura 2c) con diferencias significativas (P ≤ 0.05). El decremento en el AF de P. piscipula y L. leucocephala se debió a la absición foliar observada en algunas hojas maduras. Estudios como el realizado por Tamayo-Chim et al., (2012) reportaron 53 y 52% de reducción de AF en plántulas de P. piscipula y L. leucocephala sometidas a déficit hídrico (250 ml cada 30 días) respecto al de riego continuo (1000 ml de agua aplicada cada tercer día). Así mismo, Engelbrecht y Kursar (2003) observaron una disminución del 50% del AF en plántulas deciduas de Cordia alliodora y Pterocarpus rohrii en el tratamiento de sequía después de 22 semanas sin riego en contraste con el obtenido en el tratamiento húmedo. Los estudios anteriores sugieren que la variación en la disminución del AF y el tiempo en la que ésta se presenta, son dependientes de las adaptaciones que las especies desarrollan ante diferentes grados de estrés hídrico. El crecimiento foliar es uno de los primeros procesos fisiológicos que es afectado por la sequía (Boyer, 1968). Se considera que el decremento del AF es un mecanismo de evasión de las especies caducifolias para reducir la superficie evaporativa, de esta manera se reduce la tasa del uso de agua de la planta y por lo tanto, se conserva o evita la pérdida de agua durante los eventos de estrés hídrico (Kramer, 1983). De igual manera, la reducción del AF demuestra la capacidad de las plantas para tolerar y aclimatarse al estrés hídrico impuesto a través de respuestas morfogenéticas específicas (Khurana y Singh, 2004).
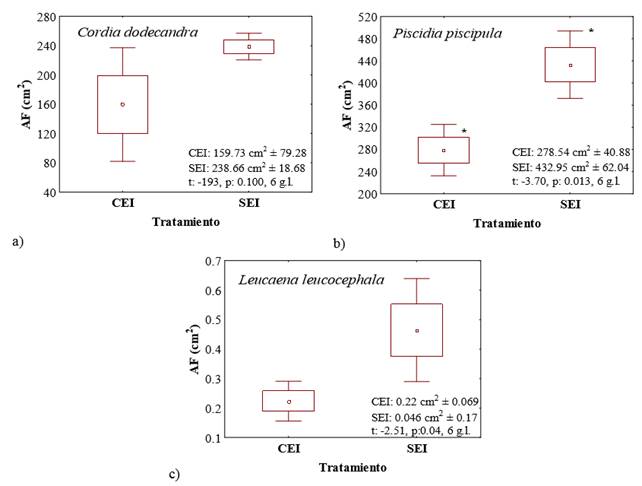
Figura 2. Área foliar en las plántulas de a) Cordia dodecandra, b) Piscidia piscipula y c) Leucaena leucocephala con estrés inducido (CEI) y sin estrés inducido (SEI). Símbolo * indica diferencias significativas (t de Student, P ≤ 0.05).
Las hojas de las especies estudiadas difieren morfologicamente, lo que les proporciona una estrategia adicional en su medio para soportar condiciones de baja disponibilidad de agua. Las hojas de C. dodecandra son simples, ásperas y pubescentes con un área foliar de hasta 28.15 cm2 ± 7.96 por hoja en plántulas de siete meses (este estudio). En cuanto a las hojas de P. piscipula estas son compuestas y divididas en láminas foliares individuales con un área foliar de hasta 10.68cm2 ± 6.55 por hoja en plántulas de siete meses (este estudio). En el caso de L. leucocephala las hojas son alternas y bipinnadas y sus foliólulos presentan un área foliar de 0.39 cm2 ± 0.21 llegando a tener un área por hoja de 376.08 cm2 ± 262.58 en plantas de seis meses (este estudio). A mayor área foliar se presenta menor control estomático (Sperry et al., 2002), por lo que las hojas compuestas de P. piscipula y L. leucocephala podrían ayudar a reducir eficazmente el área de la transpiración permitiendo al mismo tiempo el enfriamiento convectivo (Lebrija-Trejos et al., 2010). En C. dodecandra se observó pubescencia en las hojas, se considera que esta característica incrementa la capa límite lo que implica mayor resistencia a la transpiración (Meinzer y Goldstein, 1985). Smith y Nobel (1977), encontraron que en Encelia farinosa, el aumento de la pubescencia reduce la temperatura foliar, y por lo tanto, la transpiración, sin disminuir la fotosíntesis. Resultados similares se obtuvieron que Atriplex repanda que en condiciones de deficit hídrico aumentó en un 76% su pubescencia foliar logrando disminuir 29% su tasa transpiratoria (Silva y Acevedo, 1984).
Eficiencia de Uso de Agua en la Productividad (EUAp)
La EUAp en las tres especies del tratamiento CEI no presentaron diferencias significativas con respecto al tratamiento SEI. Para las plántulas de C. dodecandra del tratamiento CEI se calculó una EUAp de 0.0013 g ml-1 día-1 ± 0.0008, y SEI de 0.00092 g ml-1 día-1 ± 0.00013. En P. piscipula se obtuvo una EUAp de 0.0014 g ml-1 día-1 ± 0.0015 en el tratamiento CEI, mientras que en el tratamiento SEI fue de 0.009 g ml-1 día-1 ± 0.00056. En el caso de L. leucocephala se obtuvo una EUAp 0.0037 g ml-1 día-1 ± 0.0023 para el tratamiento CEI en comparación con 0.0014 g ml-1 día-1 ± 0.0010 para el tratamiento SEI. En este estudio se observó que la tasa de evaporación diaria (Figura 1) aumentó en el tratamiento CEI, mientras que la producción de biomasa diaria no presentó diferencias significativas entre tratamientos (Cuadro 1), esto sugiere que la EUAp debería incrementar, lo cual se observó pero sin diferencias estadísticas. Esto sugiere que ante un periodo de estrés más prolongado las variables de crecimiento si serían afectadas, reflejándose en un aumento de la EUAp. Por su parte Yin et al. (2005), reportaron un incremento de 65% en la EUAp con un tratamiento de riego de 25% de la CC, en contraste con riegos a CC aplicados a esquejes de Populus przewalskii. Estos resultados también se han observado en cultivos en invernadero como Lycopersicon esculentum en el que el riego parcial de la raíz (50% de la CC) incrementó 73% la EUAp, en comparación con un riego a CC (Zegbe et al., 2007).
Durante la eliminación del riego en las plántulas de C. dodecandra, P. piscipula y L. leucocephala se redujo el contenido de agua del suelo, lo que provocó que disminuyera el agua disponible para las plántulas y que la ET excediera a la extracción de agua por las raíces. La consecuencia directa de esto fue la reducción del contenido de agua en la planta, lo cual se manifestó a través de síntomas visuales de marchitez como amarillamiento y abscisión foliar en P. piscipula y L. leucocephala y pérdida de turgencia en C. dodecandra. Las principales estrategias que presentaron las plántulas de las especies estudiadas para evadir el estrés hídrico fueron: reducción del Ψ, del área foliar y abscisión foliar. La disminución del Ψ es una estrategia para poder continuar tomando agua del suelo, mientras que la abscisión y reducción del área foliar es una medida para disminuir la transpiración. Aunque se esperaba que las variables de crecimiento se vieran afectadas durante el experimento, esto no sucedió, lo que se atribuye a que el estrés impuesto no fue lo suficientemente severo o prolongado como para afectar la expansión celular de las especies estudiadas (Hsiao, 1973; Singh y Singh, 2006). De la misma manera, la EUAp no se vió afectada debido a que la biomasa no presentó cambios significativos, probablemente por tratarse de plántulas que aún estaban iniciando su desarrollo foliar.
Conclusiones
El efecto del estrés inducido sobre las plántulas de C. dodecandra, P. piscipula y L. leucocephala sobre el estado hídrico fue la disminución en la evapotranspiración, el potencial hídrico (Ψ) al medio día y el contenido relativo de agua. Las variables de crecimiento (altura, longitud de la raíz, número de hojas y biomasa), así como la EUAp no se vieron afectadas por el estrés hídrico. Las estrategias principales que presentaron las plántulas de las especies estudiadas para evadir el estrés hídrico fueron: reducción del Ψ (las tres especies), del área foliar (P. piscipula) y abscisión foliar (P. piscipula y L. leucocephala). En épocas de sequía se sugiere utilizar un valor de -3MPa como punto crítico de aplicación de riegos de auxilio a las plántulas de cualquiera de las tres especies, o bajo condiciones similares a las del presente estudio regar como máximo a los 25 días después del comienzo de la sequía o el último riego administrado.











 nueva página del texto (beta)
nueva página del texto (beta)