Introducción
Los procesos biológicos que ocurren en el suelo ejercen un gran control sobre el ciclo del carbono (Ryan y Law, 2005), y son de gran relevancia en estudios biogeoquímicos globales debido a que los suelos contienen más del doble de carbono que la atmósfera (Raich y Potter, 1995; Davidson y Janssens, 2006).Los dos procesos más importantes que afectan a este ciclo son la fotosíntesis de la vegetación y la respiración, en particular la respiración del suelo (RS) (Raich y Schlesinger, 1992).
La RS es el flujo total de CO2 producido por procesos metabólicos de los organismos, principalmente de los microbios al descomponer la materia orgánica del suelo (respiración heterotrófica) y la respiración de las raíces y micorrizas (respiración autotrófica) (Ryan y Law, 2005; Vargas et al., 2010a). Factores bióticos como la cantidad y calidad de hojarasca, la asignación de carbono hacia las raíces y respiración de éstas, el clima y la topografía; tienen gran influencia en las tasas de RS (McCulley et al., 2007). La importancia relativa de cada uno de estos componentes varía considerablemente entre cada sitio, y son parámetros difíciles de determinar debido a que se tienen que usar diversas técnicas para conocer su variación tanto espacial como temporal (Pumpanen et al., 2004). Además, la difusión del CO2 está en función de factores exógenos que afectan la porosidad y la tortuosidad del suelo, como lo son la humedad del suelo, la textura y la densidad aparente (Vargas et al., 2010b), que pueden variar en muchas escalas temporales. Asimismo, la proporción de RS autotrófica y heterotrófica puede variar estacionalmente (Ryan y Law, 2005), o cambiar de un segundo a otro por la alteración de la estructura del suelo debido a la macrofauna u otras perturbaciones (Reichstein y Beer, 2008).
La heterogeneidad de los ecosistemas tiene una gran influencia sobre la magnitud de los flujos de CO2 del suelo a la atmósfera. Investigar y cuantificar los principales efectos que tiene la heterogeneidad en el ecosistema sobre los flujos de CO2 permitirá mejorar el entendimiento de la variación de estos flujos a diferentes escalas espaciales, así como reducir la incertidumbre sobre los estimados de la respiración del suelo en ecosistemas heterogéneos (Riveros-Igueri y McGlynn, 2009).
Los flujos de CO2, de la superficie del suelo a la atmósfera para determinar el intercambio de gases, pueden ser medidos con diferentes técnicas (Welles et al., 2001; Davidson et al., 2002), como la absorción química de CO2 (Raich y Schlesinger, 1992), la recolección de muestras de gases en tiempos discretos para analizarlas en un cromatógrafo de gases (Rustad et al., 2000) y técnicas de micrometeorología que miden directamente el intercambio de CO2 a una mayor escala espacial (Baldocchi, 2003). Sin embargo, la técnica mas usada para determinar las tasas de RS es mediante sistemas de cámaras (Rayment, 2000), los cuales pueden ser de tres tipos: cámaras estáticas cerradas, cámaras dinámicas cerradas y cámaras dinámicas abiertas (Pumpanen et al., 2004).
Los sistemas de cámaras dinámicas abiertas determinan la tasa de respiración midiendo la concentración atmosférica de CO2 y la del interior de la cámara. La desventaja de estás radica en su complejidad mecánica, además no son recomendadas para usarse en mediciones de campo, debido a que son más susceptibles a errores con cambios en los diferenciales de presión y las velocidades de viento, provocando que una masa de aire pueda actuar como un flujo de CO2 (Rayment y Jarvis, 1997). En las cámaras cerradas, sin importar que sean dinámicas o estáticas, el flujo de CO2 se determina por el incremento en la concentración en la cámara, colocándola en un área conocida por un período de tiempo determinado (Pumpanen et al., 2004). La diferencia entre una cámara dinámica y una estática es la forma de cuantificar la cantidad de CO2: las estáticas lo hacen por absorción química y las dinámicas por medio de un analizador de gases en el infrarrojo (Bain et al., 2005). Algunos estudios sugieren que las cámaras estáticas cerradas pueden sobrestimar o subestimar las tasas de respiración del suelo (Bekku et al., 1995), con un error de hasta 10% (Rayment, 2000). Lo anterior se debe a que la acumulación de CO2 o H2O en la cámara puede saturar la capacidad de absorción química (Bain et al., 2005). Además, estas cámaras estáticas son insensibles a cambios abruptos en la concentración de CO2 y las mediciones son realizadas en puntos discretos en el tiempo (Savage et al., 2008). Sin embargo, la ventaja de utilizar las cámaras estáticas es que pueden tomar mediciones con una buena resolución espacial y son económicas.
Las cámaras dinámicas cerradas por su parte tienen la ventaja de realizar mediciones instantáneas de la concentración de CO2, pueden ser portátiles y automatizadas para almacenar los datos in situ. Por lo tanto, las mediciones de RS con este tipo de cámaras permiten mayor rapidez, agilidad y capacidad de réplica, lo que reduce la posibilidad de error (Davidson et al., 2002). No obstante, estos sistemas tienen la desventaja de causar un disturbio en el flujo de CO2, que va del suelo hacia la atmósfera. Dicho disturbio es ocasionado por un diferencial de presión o por la velocidad del viento dentro de la cámara, lo que finalmente hace que cambie el gradiente de la concentración de CO2. Como consecuencia de este cambio de concentración de CO2, puede generarse acumulación de vapor de agua dentro de la cámara (Welles et al., 2001). Pese a las desventajas mencionadas, estas cámaras dinámicas son las que se hallan en mayor proporción en las publicaciones de estudios sobre respiración del suelo (Bradford y Ryan, 2008).
En general, cualquier tipo de cámaras para medir respiración del suelo se pueden automatizar para realizar mediciones continuas en intervalos de tiempos cortos (minutos y segundos) teniendo así una buena resolución temporal (Savage et al., 2008). Las desventajas de automatizar las cámaras son: a) tienen un mantenimiento complicado y una inversión inicial alta (Savage et al., 2008); b) en el caso de que se quieran dejar instaladas en un solo punto, su representación espacial puede ser limitada; y c) están limitadas a las restricciones de energía y seguridad de sitios en estudio remotos.
No existe un diseño ideal para ningún sistema de respiración de suelo, pero se deben de considerar varios factores para mejorar su desempeño, tales como: la colocación de las cámaras (Hutchinson y Livingston, 2001; Xu et al., 2006), el uso de tubos de ventilación, el volumen del sistema (Davidson et al., 2002), el flujo del aire dentro del sistema (Bain et al., 2005), así como el uso de anillos (Heinemeyer et al., 2011).
Otro factor importante que debe de considerarse es el precio de los sistemas para determinar RS. Con base en los precios de catálogo, el sistema descrito en este trabajo tiene un costo aproximado de $7000 dolares americanos, en contrastraste con los sistemas que actualmente existen en el mercado (por ejemplo, LI-8100A LI-COR, Lincoln NE, USA) que permiten determinar la dinámica espacial de la RS pero que son relativamente costosos (aproximandamente $24 000 dolares americanos, en catálogo). Desarrollar y diseñar este tipo de herramientas en laboratorio permite disminuir costos y obtener resultados comparables.
El presente trabajo tuvo como objetivos: a) diseñar un sistema semi-automatizado para medir de manera rápida, exacta y precisa la variabilidad espacial de los flujos de CO2 del suelo en ecosistemas heterogéneos, y b) determinar la existencia de variación espacial de la respiración del suelo en diferentes micrositios característicos de un matorral xerófilo de Sonora.
Materiales y métodos
Sistema de Medición de Respiración de Suelo Basado en Cámaras Dinámicas Cerradas
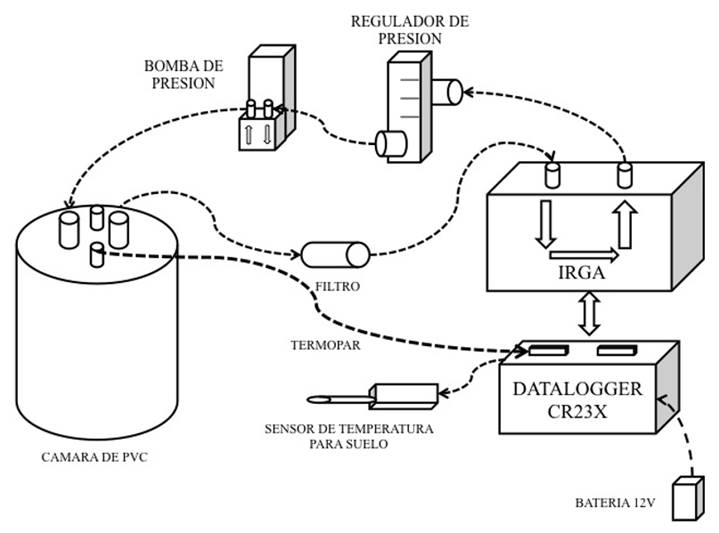
El sistema de respiración de suelo que se diseñó, se conforma por una consola de control y almacenamiento de datos (CR23X Micrologger, Campbell Sci, Logan UT, USA), un analizador de gases en infrarrojo (InfraRed Gas Analyzer, IRGA; LI-820 LI-COR, Lincoln NE, USA) para determinar la concentración de CO2 en forma de gas, una bomba neumática (GAST, Benton Harbor MI, USA) para hacer circular el aire por el sistema y un regulador de flujo (Cole-Parmer, Vernon Hills IL, USA), para mantener la velocidad de circulación del aire constante a 0.5 L min-1. Se utilizó una cámara de PVC para encerrar una porción de suelo (diámetro interior de 10 cm y altura de 12.8 cm) y un filtro (BALSTON DFU, Haverhill MA, USA) para prevenir impurezas en el sistema. El sistema se equipó con un termopar tipo T para monitorear la temperatura del aire dentro de la cámara, una salida de presión en la parte superior de la cámara (0.2 cm de diámetro interno y 1.8 cm de altura), un sensor periférico de humedad de suelo (HH2 Moisture Meter, Delta-T Devices, Cambridge, England) y un termopar en bayoneta tipo E para determinar la temperatura del suelo (Figura 1). El costo de los componentes del sistema de respiración de suelo se muestra en el Cuadro 1.

* Precio en doláres americanos. ** Precio antes de impuestos y no considerando gastos de envío.
Cuadro 1. Lista de precios de los componentes del sistema de respiración de suelo.
El sistema fue calibrado con CO2 a una concentración conocida de 390 mg L-1. Para determinar las tasas de RS, la cámara se sobrepone en el suelo o anillo del sitio de interés y el sistema mide durante 150 segundos el incremento de CO2 dentro de la cámara. La pendiente de la línea de concentración de CO2 dentro de la cámara con respecto al tiempo se usa para calcular la tasa de respiración con base en la Ecuación 1.
donde: F es el flujo instantáneo neto de CO2 o respiración de suelo (μmol m2 s-1); m es la tasa de cambio de concentración de CO2 con respecto al tiempo (pendiente); V es el volumen total del sistema (1.44 × 10-3 m3); P es la presión atmosférica (Pa); R es la constante de los gases (8.3144 m3 Pa mol-1 K-1); T es la temperatura del aire promedio durante la medición (K) y A es el área de la cámara de respiración de suelo (9.5 × 10-3 m2). Para obtener m se desechan los primeros 30 segundos de medición, pues al momento de insertar la cámara e iniciar la medición se pudo haber creado un diferencial de presión afectando el flujo de la respiración de suelo (Davidson et al., 2002). Después los datos son graficados, obteniendo la pendiente de la línea que mejor se ajuste a los datos de los últimos 120 segundos de medición (Figura 2).
Pruebas Experimentales de Respiración de Suelo
Se extrajeron 16 muestras de suelo de la región de Rayón, Sonora, México (29.74° N y 110.54° O) influenciadas por doseles de especies representativas de un matorral xerófilo y en zonas expuestas donde no hay vegetación. Las muestras se colocaron en cubetas de 20.5 cm de diámetro y 13.7 cm de altura. A cada muestra se le montó un anillo de PVC (diámetro interno de 10.8 cm) en el suelo a una profundidad de 4 cm para evitar que se provoquen disturbios en la estructura de suelo cada vez que se hagan las mediciones. Al momento de la extracción, se pretendió que la muestra tuviera las menores perturbaciones posibles para así conservar la estructura natural del suelo, es decir, conservar y no mezclar los diferentes horizontes de los que está compuesto.
El suelo colectado correspondió a sitios debajo de los doseles de diferentes especies: Acacia cochliacantha, Parkinsonia praecox y una asociación de Fouquieria-Jatropha. Las muestras fueron colectadas el 25 de septiembre de 2010 y el experimento se llevó a cabo del 7 al 18 de febrero de 2011. Debido a que éste se realizó meses después de haber recolectado las muestras de suelo se considera que la contribución de las raíces a la respiración del suelo fue nula.
En el laboratorio se tomaron mediciones de respiración de suelo durante 5 días en un ciclo de humedecimiento y secado después de aplicar un pulso artificial de lluvia. Las mediciones fueron tomadas entre las 14:00 y 16:00 h. La simulación del evento de lluvia fue de una lámina de 5 mm, debido a que este tipo de intensidad es el más frecuente en ecosistemas áridos y semiáridos (Loik et al., 2004).
Para los análisis estadísticos se tomaron las tasas de respiración de suelo resultantes y se les aplicó un análisis de varianza (ANOVA) de mediciones repetidas (Ende, 2001); para determinar diferencias entre las variables de micrositio, tiempo, y micrositio-tiempo; los datos fueron transformados a su logaritmo natural para conformar la homogeneidad de varianzas. Para probar las diferencias entre micrositios los días 2, 3 ,4 y 5 del experimento, se realizaron análisis de varianza (ANOVA) de una vía y su correspondiente análisis post hoc (Tukey HSD) para identificar las diferencias (Hochberg y Tamhane, 2008).
Resultados y discusión
La respiración del suelo varía temporalmente así como entre las diferentes muestras representativas del matorral xerófilo de Sonora (Figura 3 y 4), sugiriendo que en el ecosistema también existe esta variación espacial. Esto se pudo demostrar diseñando una cámara de respiración de suelo dinámica cerrada que mide los flujos de CO2 que emanan del suelo a la atmósfera instantáneamente. Los ecosistemas áridos y semiáridos son caracterizados por una marcada heterogeneidad espacial y sus dinámicas funcionales son peculiarmente controladas por la disponibilidad de agua en forma de pulsos (Loik et al., 2004). En estos ecosistemas, la respiración del suelo es un flujo muy dinámico que puede alcanzar tasas altas justo después de eventos de lluvia o ser crónicamente bajos durante periodos secos (Huxman et al., 2004). En el presente estudio mostramos un rango de variación de estas tasas entre 4 a 9 µmol m-2 s-1 durante los periodos húmedos y menores de 0.5 µmol m-2 s-1 en periodos secos (Figura 3), lo cual es común en ecosistemas áridos y semiáridos (Cable et al., 2011). La capacidad de detectar esta gran amplitud de los rangos de respiración de suelo, evidencía la capacidad del sistema diseñado en este trabajo para ser utilizado en estudios ecosistémicos de campo en donde se espera una alta variabilidad de RS. Contar con sistema portátil para tomar mediciones rápidas, en campo, con exactitud y precisión permite una amplia resolución espacial y capacidad de replicar tratamientos a través del tiempo en periodos con condiciones ambientales similares que permitan el rigor estadístico. Este sistema cuenta con la capacidad de determinar la RS in situ, por lo que disminuiría los riesgos de contaminación de muestras al evitar transporte y tratamiento posterior de muestras.

Figura 3. Tasas de respiración de suelo en muestras provenientes de distintos micrositios de un matorral xerófilo en Sonora. (A) y el porcentaje de humedad a través del tiempo (B) tras un evento artificial de humedecimiento (5 mm).

El panel (A) es el día 1; (B) día 2; (C) día 3; y (D) día 4 después del humedecimiento. Literales diferentes en las gráficas demuestran diferencias estadísticas de un análisis post hoc (Tukey HSD).
Figura 4. Comparación de las tasas de respiración de suelo a través de los días.
Algunas de las consideraciones para el diseño del sistema de respiración de suelo en comparación a sistemas existentes en el mercado incluyeron la decisión de no usar un ventilador para mezclar el aire dentro de la cámara con la finalidad de evitar subestimaciones en las tasas de respiración de suelo y mantener un flujo de 0.5 L min-1, como lo sugiere Davidson (2002). Otro aspecto importante en el sistema presentado es reconocer que, con la salida de presión de la cámara se pueden subestimar las tasas de respiración. No obstante, se considera que al mantener una circulación de gases adecuada entre el suelo y el IRGA este error es mínimo (Davidson et al., 2002). Esta salida de presión viene a sustituir los procesos de regulación de presión con los que cuentan los sistemas automatizados en el mercado.
Un periodo de 150 s de medición del sistema se considera adecuado debido a que en ese lapso se permite equilibrar el sistema (primeros 30 s) y se evita tener un comportamiento asintótico en la tendencia de incremento de CO2 dentro de la cámara (Figura 2). Se consideró que en un período mayor, la difusión del CO2 hacia la atmósfera se vería afectada debido al gradiente de concentración dentro de la cámara, es decir, el sistema se saturaría provocando subestimaciones de RS (Welles et al., 2001).
Cuando se usan anillos para realizar las mediciones, se debe de tomar en cuenta que al momento de la inserción se pueden cortar raíces someras y alterar la estructura del suelo, afectando las tasas de respiración de suelo, por lo que se debe de insertar el anillo de la manera menos brusca posible y con suficiente tiempo de anticipación. Estas consideraciones se deben de tomar en cuenta en especial en ecosistemas áridos y semiáridos, donde las plantas han desarrollado adaptaciones morfológicas, como las raíces someras (Hipondoka et al., 2003), y donde los suelos tienen gran contenido de arena, haciendo más frágil la estructura del suelo (Pavón y Briones 2000).
Heterogeneidad de la Respiración del Suelo en Diferentes Micrositios
Las pruebas experimentales muestran que la respiración del suelo varía entre las muestras de los diferentes micrositios del matorral xerófilo y a través de los días en que se realizó el experimento (Figura 3 y 4). Las tasas de respiración de suelo antes de un evento simulado de humedecimiento, es decir, en condiciones secas (0.34 ± 0.06%), fueron cercanas a cero coincidiendo con otros experimentos de la misma naturaleza (Fierer y Schimel, 2003; Huxman et al., 2004; Carbone et al., 2008). Cuando se simuló el evento de precipitación los flujos de CO2 del suelo incrementaron de forma significativa, pudiéndose observar diferencias entre los micrositios (Cuadro 2).
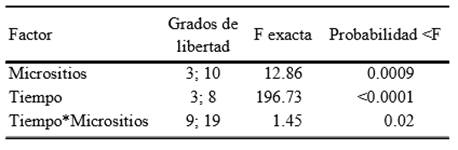
Cuadro 2. Resultados del análisis de varianza de mediciones repetidas de los datos obtenidos en experimentación.
Durante la etapa inicial se obtuvieron tasas de respiración de suelo de entre 4 y 9 μmol m2 s-1, parecidas a las presentadas por Huxman et al (2004) y Carbone et al (2008) en suelos similares. En caso de los suelos en estudio, durante los días subsecuentes al evento simulado de humedecimiento las tasas de respiración de suelo disminuyeron considerablemente (Figura 3), pero aún así mostraron algunas diferencias (Figura 4, Cuadro 2). Los micrositios que tuvieron las tasas de respiración de suelo mayores durante el experimento fueron: las influenciadas por P. praecox y A. cochliacantha, mientras que las influenciadas por la asociación Fouquieria-Jatropha y los sitios expuestos mostraron tasas más bajas.
Al inicio del experimento (día 1), se tomaron mediciones en seco, donde el promedio del porcentaje volumétrico de humedad fue de 0.34 ± 0.06 % y los flujos de respiración de suelo fueron cercanos a cero en todos los micrositios (Figura 3). El día 2 de experimentación (día del humedecimiento) se observó que las tasas de RS variaron con respecto a cada micrositio, siendo las mayores las correspondientes a las muestras de P. praecox, mientras que las de la asociación Fouquieria-Jatropha fueron las que presentaron tasas de respiración menores. La RS en micrositios expuestos y bajo el dosel de A. cochliacantha, mostraron valores similares (Figura 3 y 4, Cuadro 1 y 2), y el ANOVA de una vía no mostró diferencias significativas entre los tratamientos (Cuadro 2). Los elevados flujos de CO2 hacia la atmósfera durante este período se pueden atribuir en parte, a un efecto físico de desgasificación, en donde el agua va sustituyendo al aire que se encuentra en los micro y macro poros del suelo (Liu et al., 2002). El día 3 de experimentación, las tasas de RS disminuyeron considerablemente en todos los casos (Figura 3). Durante este día, al no haber una desgasificación, aunque exista humedad en el suelo, las tasas de RS fueron menores. En el día 4 de experimentación las tasas de RS mostraron un pequeño incremento en relación al día anterior (Figura 3) y se mostraron diferencias significativas de A. cochliacantha con respecto a la asociación Fouquieria-Jatropha y alos sitios expuestos, pero no con respecto a P. praecox (Figura 4). El día 5 de experimentación las tasas de RS se mantuvieron con valores bajos, y las diferencias entre micrositios mantuvieron el mismo patrón de comportamiento que el día anterior (Figura 4).

Cuadro 3. Resultados del análisis de varianza de una vía para los diferentes días de experimentación.
Con estos resultados se destaca que la respiración de suelo es heterogénea dentro de las diferentes muestras de micrositios representativos de un matorral xerofilo, debido probablemente a las características propias de cada micrositio, como son la calidad de los sustratos a descomponerse, los nutrimentos, la distribución de las raíces y la comunidad microbiana (Konopka, 2009). Es importante llevar a cabo estudios sobre la heterogeneidad en los ecosistemas in situ para realizar estimaciones adecuadas sobre la capacidad de fungir como fuentes o sumideros de carbono. Este avance en el conocimiento abre la posibilidad de realizar modelos que permitan proyectar emisiones de CO2 futuras y poder conocer el comportamiento de los ecosistemas, particularmente del suelo, en diferentes escenarios de cambio climático.
Conclusiones
- Después de haber realizado mediciones de respiración de suelo en laboratorio en muestras de diferentes micrositios del matorral xerófilo se detectó una amplia variación en este flujo. Durante periodos húmedos las tasas fueron altas (entre 4 y 9 µmol m-2 s-1), mientras que en periodos secos las tasas fueron menores a 0.5 µmol m-2 s-1. Sin embargo, aunque estas tasas fueron bajas, en algunos casos se encontraron diferencias estadísticas relevantes entre micrositios. Contar con este tipo de sistemas de medición de respiración de suelo permite realizar mediciones continuas a través del ecosistema y en el laboratorio en rangos de RS amplios de manera ágil y precisa.
- Las ventajas que presenta este tipo de sistema de medición de la respiración de suelo: son la posibilidad de transportarse fácilmente a sitios remotos para realizar estudios de heterogeneidad en el ecosistema; la posibilidad de realizar varias mediciones en un período de tiempo relativamente corto; su costo relativamente accesible, hace factible incrementar su uso, especialmente en países en vías de desarrollo, los cuales muchas veces son subrepresentados en estudios de escalas continentales-mundiales sobre el ciclo del carbono (Vargas et al., 2012).
- Contar con este tipo de instrumentos ayudará a cuantificar con mayor exactitud la aportación que la respiración de suelo tiene hacia la atmósfera; y también podrá contribuir a una mejor comprensión de cómo la disponibilidad de agua en el suelo influye sobre la dinámica de respiración dentro de éste.
- El entender la dinámica de los componentes del ciclo del carbono permitirá hacer mejores balances de este elemento en los diferentes ecosistemas. Además, con este tipo de estudios se proporcionará información valiosa acerca de los ecosistemas, que permita saber si éstos funcionan como fuentes o almacenes de carbono. Con ello, será posible generar información que ayude también a entender la respuesta de los ecosistemas ante diferentes escenarios de cambio climático. Actualmente en México, existen pocos estudios sobre RS (ver: Vargas y Allen, 2008; Vargas, 2012), por lo que aumentar la atención de la investigación científica en este flujo ecosistémico es de suma importancia para comprender la dinámica de la RS a nivel nacional e integrar a México en diferentes escalas de estudio.











 nova página do texto(beta)
nova página do texto(beta)