Introducción
La deforestación, el cambio de uso de suelo y de su cobertura, así como el manejo del suelo son eventos que influyen sobre los procesos de mineralización y modifican la liberación de CO2 y de otros gases que participan en el cambio climático global (Turner, 1989; IPCC, 2001; Chen et al., 2001a; Yimer et al., 2007). En el manejo convencional del suelo, con vocación forestal, que se destina a la agricultura se emplean prácticas como el barbecho, la aplicación de biocidas y fertilizantes industriales (Postgate, 2000), que favorecen los rendimientos, pero también alteran las características físicas, químicas y biológicas del suelo (Martikainen, 1984; Chartres, 1987; Priha y Smolander, 1995; Chen et al., 2001b).
Los reportes sobre el efecto de la aplicación de fertilizantes son divergentes (Martikainen, 1984; Priha y Smolander, 1995) e incluso contradictorios (WenHui y ZuCong, 2004). Esto puede atribuirse a la diversidad de ecosistemas edáficos sobre los que se aplican, así como a la naturaleza química de los productos aplicados. Entre los fertilizantes, los nitrogenados son de uso generalizado pues se considera que el N es el nutrimento limitante de la productividad en la mayoría de los ecosistemas (Giller et al., 1994); la comprensión de esta práctica permitirá conocer mejor el efecto del manejo del suelo sobre su fertilidad (Kemmitt et al., 2008), logrando el manejo sustentable del suelo y minimizando el riesgo como fuente de contaminación, tanto de los mantos freáticos como de la atmósfera, al propiciar la formación de NO3-, de NH4+, de N2O y de CH4 (Cotrufo et al., 2000; Thirukkumaran y Parkinson, 2000; Khalil et al., 2002; Khalil et al., 2007).
El barbecho, valorado por los campesinos como estrategia para retener la humedad de las primeras lluvias del ciclo, conlleva la destrucción de los agregados y favorece la mineralización de la materia orgánica del suelo (MO), la liberación de CO2 se incrementa (Kristensen et al., 2000) y el C almacenado en los suelos disminuye. Según Heat et al. (2003), esta práctica ha propiciado que en algunos suelos de bosque en Estados Unidos, se haya perdido más del 50% del C total secuestrado en ellos.
La diversidad química de los biocidas, su dosificación y frecuencia de aplicación, junto con la gama de propiedades físicas, químicas y bioquímicas del suelo (Vyas, 1988; Haney et al., 2000; Sorensen et al., 2001), son variables que modulan el efecto de los biocidas sobre la comunidad microbiana y su actividad. Se reporta que la aplicación de herbicidas de fenilurea, en un suelo limo arcilloso a largo plazo, reduce significativamente el número de bacterias heterotróficas (Kent y Triplett, 2002) y que altas dosis de herbicidas de sulfonilurea, reducen significativamente la mineralización de N (El-Ghamry et al., 2001); mientras que el glifosato estimula significativamente la mineralización de C y N, aún en concentraciones elevadas (Haney et al., 2000). Stockdale y Brookes (2006) proponen que es más probable la inhibición de los biocidas por los microorganismos que el proceso inverso.
Ante la heterogeneidad de resultados relativos a las consecuencias que implica el cambio del uso de suelo (Frey et al., 2004) y ante los pocos estudios sobre suelos forestales a altitudes mayores de 3000 m, se realizó este trabajo con el propósito de evaluar los efectos de la aplicación de fertilizantes nitrogenados y de biocidas en suelos con diferente uso, sobre las características edáficas del Parque Nacional Nevado de Toluca .
Materiales y métodos
Características de la Región en Estudio
La región de estudio se encuentra en la ladera norte del Parque Nacional Nevado de Toluca, entre los 18° 59’ y 19° 13’ N y los 99° 37’ y 99° 58’ O. Tiene suelos de tipo Regosol eútrico y Andosol úmbrico y háplico, con predominio de limos. El clima predominante es templado subhúmedo con lluvias en verano (Cw2); la temperatura anual promedio es menor a los 12 °C y su precipitación anual promedio es entre 900 y 1100 mm. En el área prevalecen poblaciones de Pinus hartwegii, P. montezumae y P. ayacahuite, oyamel (Abies religiosa), encino (Quercus laurina Bonpl.) y aile (Alnus acuminata Kunth), y se establecen cultivos de papa (Solanum tuberosum L.), maíz (Zea mays L.), cebada (Hordeum vulgare L.), avena (Avena sativa L.) y haba (Vicia faba L.), (Regil y Maass, 2009).
Muestreo de Suelos
En noviembre del 2004, en las comunidades de Rosa Morada y Dilatada, estado de México, se muestrearon suelos, de 0-10 cm de profundidad, ubicados entre los 3000 y 3140 m de altitud, con usos diferentes: con cultivo (SC), bosque (SB) y pradera natural (SP). Se obtuvo una muestra compuesta con al menos cuatro submuestras. Las submuestras de SC y de SP se obtuvieron con el método de zig-zag. Para tomar las muestras de los suelos de bosque, se identificaron tres árboles con altura y grosor del tronco semejantes, alejados entre sí no más de 100 m, con una pala recta se tomaron cuatro submuestras a un metro de distancia del origen, teniendo el tronco como punto de referencia, en direcciones perpendiculares orientadas hacia los cuatro puntos cardinales, las cuatro submuestras de cada uno de los árboles se mezclaron (Reyes et al., 2003). Las muestras fueron llevadas al laboratorio del ICAR-UAEM, secadas a la sombra y preparadas para su caracterización.
Caracterización de los Suelos
Se caracterizaron los suelos midiendo: contenido de humedad por el método AS-05 (NOM-021-RECNAT-2000) y capacidad de retención de agua por gravimetría (Forster, 1995); composición mecánica y clase textural, por Bouyoucos (Gee y Baunder, 1986); pH, en una suspensión suelo: agua (1:2.5) (Thomas, 1996); contenido de materia orgánica, por el método de Walkley y Black modificado (Nelson y Sommers, 1996); Ca++ y Mg++, con el método del versenato (NOM-021-RECNAT-2000). El nitrógeno total se cuantificó por el método de Kjeldahl (Bremner, 1996); la conductividad eléctrica, por el método AS-18 (NOM-021-RECNAT-2000) y la capacidad de intercambio catiónico y bases intercambiables, según el método AS-12, con acetato de amonio (NOM-021-RECNAT-2000).
Para determinar la mineralización se pesaron, de cada una de las 6 muestras de suelo,15 porciones de 30 g, se colocaron en frascos transparentes de 100 mL, agregándoles agua destilada hasta alcanzar el 40% de su capacidad para retener agua (CRA) y se preincubaron por 7 días a 18±2 °C. Al término de la preincubación, a 3 porciones de cada muestra se le aplicaron los siguientes tratamientos: sin modificación (testigo); con adición de 585.36 kg ha-1 de sulfato de amonio (amonio); con 250 kg ha-1 de urea (urea); enmienda con 1 L ha-1 de 2,4-D (2,4-D) y con adición de 2 kg ha-1 de captan (captan). No se consideró un tratamiento con la combinación de fertilizantes y biocidas. Los frascos con los suelos tratados se colocaron dentro de un frasco de vidrio ámbar, con capacidad de 1 L, que contenía 10 mL de agua y un frasco gotero de 50 mL con 20 mL de NaOH 1N. Se prepararon nueve frascos más, siguiendo el mismo procedimiento, excepto la presencia de suelo, como blancos. Los frascos se cerraron y se incubaron a 18±2 ºC, en obscuridad durante 56 días. Para evitar anaerobiosis, los frascos se destaparon durante 10 min cada tercer día. Al término del periodo de incubación se extrajeron los frascos que contenían NaOH y de inmediato fueron herméticamente cerrados y almacenados en un congelador a 4 °C hasta su análisis.
Para cuantificar la cantidad de CO2 liberada por la mineralización del C se tomaron tres alícuotas de 5 mL de NaOH 1 N, de cada uno de los frascos gotero, y se transfirieron a matraces erlenmeyer de 125 mL. Con agua destilada se ajustó el volumen a 50 mL y se tituló con HCl 0.01 N, utilizando fenolftaleína como indicador. La cantidad de C-CO2 producido se obtuvo con la ecuación de Stotzky (1965); los resultados se obtuvieron en mg C-CO2 kg-1 de suelo seco.
Para determinar la mineralización de N se cuantificó el nitrógeno mineral (NH4+ + NO3-) en el extracto del suelo de cada muestra. Para obtener los extractos se pesaron 20 g de suelo seco, se transfirieron a matraces de plástico de 250 mL y se adicionaron 80 mL de una disolución acuosa de K2SO4 0.5 M. Los matraces, herméticamente cerrados, se colocaron, a 18±2 °C, en un agitador orbital Lab-Line Mod. 3591, y se agitaron a 250 rpm, durante 45 min. Se obtuvo el extracto por filtración en papel Whatman No. 42 (Reyes et al., 2003). El N-NH4+ y N-NO3- se cuantificaron por colorimetría, en un analizador automático Skalar San mod. 2.2.6. Los resultados se expresaron en mg N-(NH4++NO3-) kg-1 suelo seco.
Los datos obtenidos fueron sometidos a un ANOVA monofactorial mediante el paquete estadístico Statgraphics plus y la prueba de LSD para identificar la diferencia entre los tratamientos.
Resultados y discusión
Caracterización de los Suelos Empleados
Los resultados relativos a la proporción de partículas minerales, obtenidos en este trabajo (Cuadro 1) indican que el uso o el manejo del suelo no han provocado una alteración del ecosistema (Virginia y Jarrel, 1983; Sahani y Behera, 2001; Reyes et al., 2003; Geissen y Morales, 2006; Mehta et al., 2008). La capacidad para retener agua (CRA) fluctuó entre 29.1 y 48.8%. En promedio (Cuadro 1), los suelos bajo cultivo (SC) tuvieron una CRA significativamente menor (P ≤ 0.05) a la cuantificada en los suelos de bosque (SB) y de pradera (SP). La diferencia puede atribuirse al decremento en el contenido de materia orgánica del suelo (Gupta et al., 1994; Yimer et al., 2008), proceso asociado a prácticas de cultivo, como barbecho y fertilización. Se aprecia que la MO en los SC es significativamente menor (P ≤ 0.05) a la encontrada en los SB y en los SP (Cuadro 2), lo que se traduce en una menor capacidad para retener agua (Gupta et al., 1994). Bajo una perspectiva ambiental, los datos obtenidos señalan que el cambio de uso de los suelos del PNNT (Parque Nacional Nevado de Toluca) de forestal a agrícola ha provocado que se pierda más del 55% del C secuestrado en los SB del Parque Nacional Nevado de Toluca (Cuadro 2), lo cual es superior a los datos reportados por Heat et al. (2003), en cambio de uso de suelo en bosques de Estados Unidos. La densidad aparente (Cuadro 1) fue significativamente menor (P ≤ 0.05) en los SB en comparación con los SP y los SC.
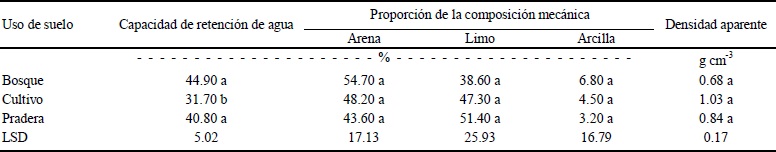
Valores promedio (n = 9) con letras iguales, en la misma columna, no difieren significativamente entre sí (P ≥ 0.05).
Cuadro 1 Propiedades físicas de suelos del Parque Nacional Nevado de Toluca, México, con diferente uso.
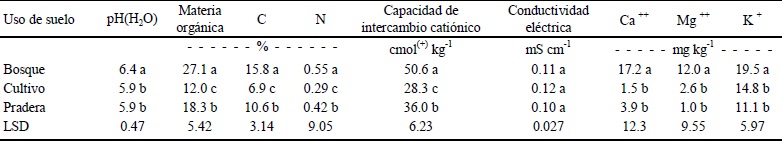
Valores promedio (n = 9) con letras diferentes, en la misma columna, difieren significativamente entre sí (P ≤ 0.05).
Cuadro 2 Propiedades químicas de suelos con diferente uso del Parque Nacional Nevado de Toluca, México.
El pH neutro, en los SB (Cuadro 2) del PNNT bajo la copa de Abies religiosa, coincide con los datos de Persson et al. (2000) para suelos de bosque, en Italia y Francia, cubiertos por Picea abies y Quercus pubescens, respectivamente. La acidificación asociada al cambio de uso de suelo puede atribuirse, en acuerdo con Stotzky y Bollag (1996), a la aplicación de fertilizantes nitrogenados.
El contenido de nitrógeno total (Nt) fue medio en el suelo de los SB y SP y, bajo en el de SC. El análisis estadístico de esta variable señaló diferencias significativas (P< 0.05) entre los tres usos de suelo (Cuadro 2) e indica que las prácticas de cultivo favorecen la salida del N del sistema edáfico. La pérdida de N puede atribuirse tanto a la extracción mediante los cultivos, como a la mineralización del N activo y/o del N almacenado, que estimula la aireación del suelo en el barbecho (Cameira et al., 1996; Kristensen et al., 2000; Pulleman et al., 2000; Poudel et al., 2001), y a los procesos de lixiviación y/o erosión. El incremento significativo de Nt en los SP en relación a los SC, pone en evidencia el efecto benéfico del descanso de los suelos.
Los SB tienen proporciones de Mg, Ca y K significativamente mayores (P ≤ 0.05) que los SC y los SP (Cuadro 2), y aún cuando son similares a los intervalos cuantificados por Persson et al. (2000) en suelos de ecosistemas forestales de Europa, las bajas concentraciones indican una muy pobre disponibilidad de minerales en la región bajo estudio, independientemente del uso de suelo. Entre los valores correspondientes a la capacidad de intercambio catiónico, aunque son similares a los reportados por Beldin et al. (2007), se identificaron diferencias significativas (Cuadro 2) entre los diferentes usos de suelo de acuerdo a los valores de conductividad eléctrica de los suelos pueden clasificarse como no salinos (Cuadro 2), no hubo diferencia significativa (P > 0.05) entre los tratamientos. A excepción del valor de la conductividad eléctrica, el resto de las propiedades químicas evaluadas fueron significativamente mayores en los SB, en comparación con los SC y los SP. Estos datos confirman que la conversión de suelos de bosques a tierras de cultivo modifica significativamente (P > 0.05) las propiedades químicas de los sistemas naturales (Sánchez et al., 2002); en efecto, se genera una reducción significativa en los nutrimentos del suelo (Srivastava y Singh, 1989, 1991; Prasad et al., 1995), especialmente en la proporción de materia orgánica, nitrógeno y carbono (Wander y Bollero, 1999; Atlas y Bartha, 2002; Álvarez-Solís et al., 2007).
Efecto del Uso y la Adición de Agroquímicos
A los 56 días de incubación los tratamientos testigo de los suelos de bosque (SB) y los suelos de pradera (SP) liberaron una cantidad significativamente mayor de CO2 que los suelos bajo cultivo (SC) (Cuadro 3). La liberación significativamente menor de C-CO2 observada en los SC parece confirmar la baja concentración de MO (Cuadro 2). Los resultados sugieren que el proceso de mineralización de C es dependiente de la fracción lábil de C (Reichstein et al., 2000) misma que habrá disminuido notablemente en los SC después de 20 años de cultivo y se habrá recuperado parcialmente en los SP, al término de cinco años de descanso. La pérdida de MO es un evento asociado al cambio de uso de suelo (Reyes et al., 2003), (i) el laboreo del suelo al romper los agregados, ocasiona que el C y el N de fácil mineralización, localizados en reservas físicamente protegidas, sean accesibles a la degradación microbiana (Buchanan y King, 1992; Kristensen et al., 2000) y (ii) la remoción casi total de los residuos vegetales, para ser empleados como forrajes o combustibles, da lugar a una disminución en la cantidad de MO que se incorpora al suelo (Lal, 2000). A estos factores se suman otros cambios sobre el contenido de la MO provocados por prácticas agronómicas como: tipo de cultivo, rotaciones y manejo de residuos (Janzen, 1987; Omay et al., 1997; Stevenson y Cole, 1999).
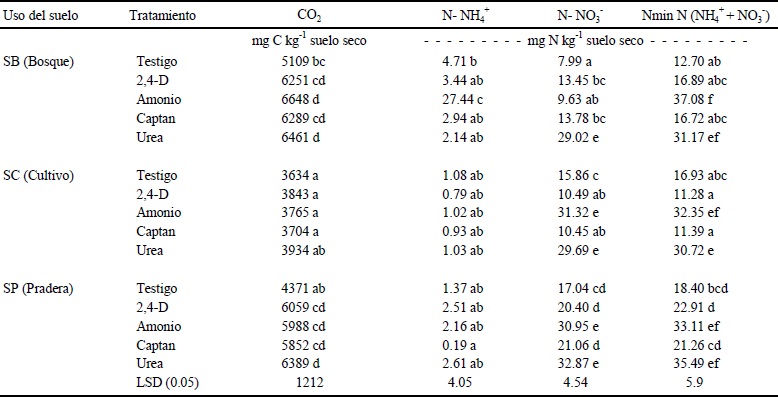
Valores promedio (n = 9) con letras diferentes, en la misma columna, difieren significativamente entre sí (P ≤ 0.05).
Cuadro 3 Valores del CO2 y N mineral (NH4++NO 3-) formados en suelos con diferente uso del Parque Nacional Nevado de Toluca, México, sometidos a incubación por 56 días bajo diferentes tratamientos de fertilizantes y biocidas.
Los tratamientos con biocidas y fertilizantes nitrogenados sobre los SB y SP provocaron que la formación de CO2 se incrementara significativamente, hasta en un 42% en los SP, en referencia al tratamiento testigo correspondiente (Cuadro 3); en los SC los tratamientos no modificaron significativamente esta variable de respuesta. El efecto del fertilizante nitrogenado urea sobre la respiración del suelo, en los SC y SP, fue el mayor con respecto a los otros tratamientos, lo cual podría evidenciar la falta de N disponible en estos ecosistemas (Giller et al., 1994); o al ambiente fisicoquímico que limita la disponibilidad de la MO (Kemmitt et al., 2008) y la actividad de los microorganismos (Chen et al., 2001b).
Kunc y Rybárová (1983), Schinner et al., (1983), Chen et al., (2001a y b) han observado que la aplicación de biocidas, como 2,4-D y captan se asocian a una reacción inicial de estrés seguida de un incremento en la liberación de CO2. Este efecto, observado también en la presente investigación (Cuadro 3), puede atribuirse a la existencia de poblaciones microbianas que resisten la alteración del ambiente, se adaptan e incluso utilizan estos biocidas como sustratos de su actividad metabólica.
Aún cuando la concentración de Nmin en los tratamientos testigo medida como la suma de N -NO3- y N-NH4+ al término de los 56 días de incubación, siguió el orden SP > SC > SB (Cuadro 3), no se encontraron diferencias significativas entre los suelos con diferente uso. Estas observaciones difieren de los resultados obtenidos por Högberg (1997) y Deenik (2006) quienes coinciden en que la degradación de los suelos, asociada al cambio de su uso, modifica drásticamente la dinámica del nitrógeno en suelos forestales.
Los tratamientos con amonio y urea, independientemente del uso de suelo, dieron lugar a un incremento significativo (P ≤ 0.05) en la proporción de Nmin, cuya concentración se incrementó más de tres veces en SB con amonio respecto al testigo (Cuadro 3), atribuible a la incorporación del N mineral y a la inexistencia de su demanda por vegetales o por microorganismos. Los tratamientos con biocidas no provocaron una modificación significativa en la concentración de. Nmin en comparación con sus testigos correspondientes.
La concentración de N-NH4+, al concluir el período de incubación de los suelos, no presentó diferencias significativas entre los tratamientos con el testigo (Cuadro 3); solamente los SB con amonio tuvieron una concentración significativamente mayor al resto de los tratamientos y usos de suelo. Este resultado parece indicar que las poblaciones nitrificantes en los SB están disminuidas, ya sea en su diversidad o en su tamaño, lo cual podría explicar que los diferentes tratamientos sobre los SB tengan la proporción más elevada de N-NH4+ (Cuadro 3). El resultado también podría atribuirse a una pobre calidad de la MO disponible; sin embargo los valores de la relación C:N son homogéneos y fluctúan entre 25 y 29, para los diferentes usos de suelo (Cuadro 2).
En cuanto a la proporción de N-NO3-, en los tratamientos testigo (sin adición de biocidas o fertilizantes) de los suelos bajo diferente uso, se encontró que los SB tienen una concentración significativamente menor (P ≤ 0.05) que los otros dos usos de suelo, lo cual parece confirmar una baja actividad nitrificante en los suelos de bosque estudiados. Los resultados obtenidos en los tratamientos restantes (Cuadro 3) confirman que la adición de fertilizantes nitrogenados incrementa la mineralización del N (Martikainen, 1984; Priha y Smolander, 1995) en forma inversamente proporcional a la degradación de los suelos (Sánchez et al., 2002). En los tratamientos con biocidas, al concluir la incubación, se observó que la proporción de N-NO3- tuvo un incremento significativo en los SB y una reducción significativa en los SC; el aumento de N-NO3- en los SP no fue significativo. Los incrementos observados en los SB y en los SP pueden atribuirse, en acuerdo con Kunc y Ribárová (1983) y Malanchuk y Joyce (1983) a la presencia de microorganismos que pueden adaptarse al 2,4-D amina y degradarlo. La disminución sugiere, por el contrario, que la actividad de la microbiota edáfica en suelos degradados es más susceptible de ser negativamente afectada por la aplicación de biocidas (Aon et al., 2001). En este sentido Chen et al. (2001a y b) sostienen que biocidas como el captan afecta la dinámica del N en cuanto que los microorganismos que sobreviven pueden llegar dar lugar a una remineralización de los microorganismos que mueren.
Conclusiones
- La degradación asociada al cambio de uso de suelo, en el Parque Nacional Nevado de Toluca, ha provocado una disminución significativa de la MO, de la CIC y de la CRA en los suelos destinados al cultivo, así como la pérdida de más del 55% del C secuestrado y más del 40% del Nt almacenado en la MO de los suelos de bosque.
- La aplicación de sulfato de amonio, urea, captan o de 2,4-D sobre suelos de bosque o los destinados al pastoreo propician que la pérdida del C secuestrado, en forma de C-CO2, se incremente en más de 20 veces con relación al testigo.
- La adición de los fertilizantes nitrogenados favorece el incremento de la mineralización del N en forma inversamente proporcional a la degradación de los suelos. Así lo indica la persistencia del N-NH4+ en los suelos de bosque. Además en suelos cultivados con aplicación de 2,4-D amina y captan, se ejerce una influencia desfavorable en la mineralización del nitrógeno.











 nueva página del texto (beta)
nueva página del texto (beta)


