Introducción
En la década de l950 se inicia en México la Revolución Verde, con el incremento del uso de semillas mejorada, pesticidas y fertilizantes químicos, que buscaban incrementar la productividad de diferentes cultivos destinados a la alimentación humana o del ganado (Núñez, 2001). Sin embargo, el uso indiscriminado de fertilizantes ocasionó que se elevaran los niveles de nitratos en mantos freáticos, ríos y lagos (Castellanos et al., 2000); situación que prevalece hasta nuestros días. Por otro lado, las condiciones naturales de un suelo no aportan los nutrientes suficientes para cumplir con la demanda que ocasiona la agricultura intensiva, especialmente si no se implementan prácticas agrícolas adecuadas, como ocurre en el agro mexicano (Núñez, 2001). Así, es necesario utilizar alternativas que permitan lograr una producción sostenida y fomentar el manejo adecuado de los recursos bióticos y abióticos de los agroecosistemas (Aguirre, 2001; Thrall, 2005). Desde la década de los 70’s, el estudio de microorganismos promotores del crecimiento vegetal es una línea de investigación de gran impulso en países europeos, asiáticos y latinoamericanos, incluido México (Aguirre-Medina, 2006), destacándose aquellos microorganismos capaces de llevar a cabo la fijación biológica de nitrógeno. Existen investigaciones cuyo objetivo es el de esclarecer los factores que permiten una mejor interacción entre diferentes especies de plantas y microorganismos (Walley et al., 2004; Weir et al., 2004; Villegas et al., 2006; Giles et al., 2008; Zahir et al., 2010).
El uso de microorganismos promotores de crecimiento en la agricultura se denomina inoculación o biofertilización, es considerada una biotecnología que contribuye al desarrollo sostenible ya que favorece el desarrollo de los cultivos agrícolas, beneficia al productor y se ha descrito como ambientalmente segura, económica y socialmente aceptable (Urzúa, 2005; Aguirre-Medina, 2006; Bhattacharjee et al., 2008; Cong et al., 2009).
Entre los grupos microbianos del suelo más estudiados, se encuentra el grupo rhizobia, el cual agrupa a todas aquellas bacterias capaces de nodular una o más especies de leguminosas, y que llevan a cabo el proceso de fijación biológica de nitrógeno en asociación simbiótica con estas plantas (Moulin et al., 2001; Weir, 2011). Tras el establecimiento de la simbiosis se genera un nuevo órgano, el nódulo radicular, al interior del cual la bacteria fija nitrógeno; éste es aprovechado por la planta e incrementa su capacidad para desarrollarse en suelos pobres, especialmente aquellos carentes de nitrógeno (Trinchant et al., 2001). El grupo de los rhizobia incluye, actualmente, trece géneros que comprenden más de 70 especies, Rhizobium (Jordan, 1982), Allorhizobium (De Lajudie et al., 1998), Ensifer (Chen et al., 1988, Casida, 1982; Young, 2003), Mesorhizobium (Jarvis et al., 1997), Azorhizobium (Dreyfus et al.,1988), Bradyrhizobium (Jordan, 1982), Methylobacterium (Sy et al., 2001; Jourand et al., 2004), Devosia (Rivas et al., 2002, 2004), Phylobacterium (Valverde et al., 2005), Ochrobactrum (Trujillo et al., 2005), Shinella (Lin et al., 2008), entre las a-proteobacterias y dos géneros de la subclase b-Proteobacteria, Burkholderia (Moulin et al., 2001) y Cupriavidus (Chen et al., 2001; Vandamme y Coenye, 2004). Este grupo reviste gran importancia debido a las ventajas tanto ecológicas como económicas que puede proporcionar su adecuada aplicación (Villegas y Munive, 2005).
Una alternativa para mantener el nivel de producción agrícola, con un menor uso de agroquímicos y manejo sustentable, es la inoculación de microorganismos benéficos asociados a las especies cultivadas (Urzúa, 2005; Aguirre-Medina, 2006; Cong et al., 2009; Zahir et al., 2010). Sin embargo, es fundamental cuidar la adecuada selección de los microorganismos a utilizar como inoculantes, considerando su potencial biofertilizante, su capacidad de adaptación, permanencia en el sitio de interés y su facilidad de manejo. Por ello, éste trabajo se enfocó a generar una tecnología sustentable, con base en cepas nativas de rhizobia potencialmente útiles como biofertilizantes.
Materiales y métodos
Muestreo de Suelo y Nódulos
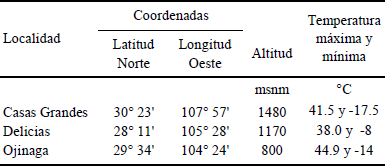
El estado de Chihuahua se localiza en el norte de México entre 25° 5’ y 31° 47’ N, y 103° 11’ y 109° 07’ O. Las condiciones climáticas predominantes son de tipo seco, clima seco árido en 28% de la superficie estatal, con una precipitación promedio anual menor a 300 mm y temperatura máxima de 40 °C; 46% del territorio estatal es semiárido con una precipitación promedio anual de 300 a 500 mm (CONAFOR, 2004; Núñez-López et al., 2007). Se muestrearon terrenos de cultivo de productores interesados en participar en el estudio de microorganismos con potencial biofertilizante. Debido a la enorme superficie del estado, se eligieron tres localidades con características edafoclimáticas diferentes y se privilegió el muestreo de cultivos de importancia económica para la región. Las tres localidades de muestreo se ubican en las coordenadas especificadas en el Cuadro 1.
En cada localidad se muestrearon diferentes terrenos, y en cada uno de estos se eligieron cinco puntos al azar, de donde se extrajo suelo a una profundidad de 15 cm, para hacer una mezcla compuesta y homogénea. Los suelos muestreados tienen historial de cultivo de alfalfa, cacahuate, nogal, papa, chile, durazno o manzano. Las muestras de suelo se secaron y conservaron en refrigeración hasta su uso. Simultáneamente, se colectaron nódulos radiculares de cacahuate y alfalfa, presentes en terrenos ubicados en los municipios de Ojinaga y Delicias. De estos nódulos se obtuvieron aislamientos, que fueron purificados y conservados en glicerol a -70 ºC. Las colonias se seleccionaron en primera instancia con base en la morfología colonial, aquellas que presentaron características de los rhizobia, como aspecto húmedo, bordes regulares, lisas, convexas, translúcidas u opacas a la luz transmitida, brillantes a la luz reflejada, mucoides, principalmente.
Aislamiento de Cepas de Rhizobia
Los nódulos se rehidrataron con 1 mL de agua destilada estéril durante 30 min. Enseguida se desinfectaron superficialmente con peróxido de hidrógeno al 70% durante 5 min, después se practicaron varios lavados con agua destilada estéril. Los nódulos se maceraron con ayuda de una varilla de vidrio y la suspensión obtenida fue utilizada para inocular cajas de Petri con medio TY (Vincent, 1974). Las cajas se incubaron a 28 °C, durante 5 días. Las colonias con morfología característica de bacterias del grupo rhizobia se resembraron pro estría cruzada en medio de cultivo sólido hasta su purificación.
Estimación de las Poblaciones Bacterianas en las Muestras de Suelo
El número de unidades formadoras de colonias (UFC), se estimó por triplicado en cada una de las muestras compuestas de suelo mediante la técnica de dilución decimal seriada y siembra por el método de difusión en cajas Petri (por triplicado). Los medios de cultivo utilizados fueron agar nutritivo y TY (Álvarez-Solís y Anzueto-Martínez, 2004; Zuberer, 1994). Las cajas se incubaron a 28 °C durante 5 días, al cabo de los cuales se efectuó el conteo en placa de las colonias presentes en cada dilución.
Identificación de Cepas Aisladas
La caracterización de los aislamientos se efectuó con base en características morfológicas y bioquímicas (Garrity et al., 2004), así como por análisis de secuencias del gen 16S rDNA. El aislamiento de DNA se efectuó utilizando el Wizard Genomic DNA purification Kit (Promega) de acuerdo a las instrucciones del proveedor. El DNA extraído se amplificó utilizando los oligonucleótidos FGPS-6 and FGPS-1509 (Normand, 1992) en un termociclador Master Cycler gradient (Eppendorf). Las condiciones de amplificación fueron las siguientes: desnaturalización inicial 3 min a 94 ºC durante un ciclo, desnaturalización por 30 s a 94 ºC, alineamiento 45 s a 60 ºC, elongación enzimática por 1:30 min a 72 ºC, durante 25-30 ciclos, y extensión final por 10 min a 72 ºC durante un ciclo. El producto de amplificación de 1500 pares de bases (pb) se verificó en geles de agarosa al 1% a 100 mV, teñidos con bromuro de etidio. Las bandas obtenidas se cortaron y se purificaron utilizando el QIAquick Gel Extraction Kit (Qiagen), según instrucciones del proveedor. Los productos obtenidos se secuenciaron directamente con los oligonucleótidos FGPS6 y 16S-1924r (5’-GGC ACG AAG TTA GCC GGG GC-3’) (Sy et al., 2001) en el Instituto de Biotecnología de la Universidad Nacional Autónoma de México (UNAM) en Cuernavaca, México, (www.ibt.unam.mx/sintesis).
Pruebas Fisiológicas
Se estimó la capacidad de crecimiento bacteriano bajo diferentes condiciones de cultivo, temperaturas de incubación de 32 y 42 ºC, pH del medio entre 4 y 8, y osmotolerancia (diferentes concentraciones de NaCl del medio de cultivo). Para llevar a cabo las cinéticas de crecimiento, se inocularon pre-cultivos en tubos con medio de cultivo líquido YMA. Las células fueron lavadas por centrifugación con una solución salina isotónica al 0.8% y resuspendidas en tubos conteniendo 5 mL de medio de cultivo YMA. El inóculo inicial fue una suspensión bacteriana ajustada a una DO600 = 0.08-0.1. El pH del medio se ajustó a 4.0, 5.5, 6.8 y 8.0, con HCl o NaOH. La concentración de NaCl se ajustó a 0.017, 0.51 y 0.85 moles L-1 en el medio de cultivo. Los tubos inoculados fueron incubados por una semana, durante la cual se midió la absorbancia cada 24 horas.
Inoculación y Evaluación de Cepas en Invernadero
La capacidad de nodulación y fijación de nitrógeno de los aislamientos obtenidos se estimó en condiciones de invernadero, en plántulas de alfalfa y frijol. Se utilizaron bolsas de plástico con suelo estéril procedente de la región muestreada con tres a cuatro plántulas por bolsa, mismas que fueron inoculadas. Previo a la inoculación de las plantas, los aislamientos se propagaron en medio líquido TY, durante 48 horas a 30 ºC, en agitación orbital a 150 rpm. Cada plántula se inoculó con 1 mL de suspensión bacteriana a DO600 = 0.8. Los parámetros a evaluar fueron: altura de la planta, diámetro del tallo, altura del tallo, largo de la raíz, número y tamaño de los nódulos.
Resultados y discusión
Estimación del Número de Poblaciones Bacterianas
El conteo de UFC bacterianas en las muestras compuestas de suelo se efectuó tanto para poblaciones bacterianas totales, como para las colonias con morfología característica de rhizobia (Cuadro 2).
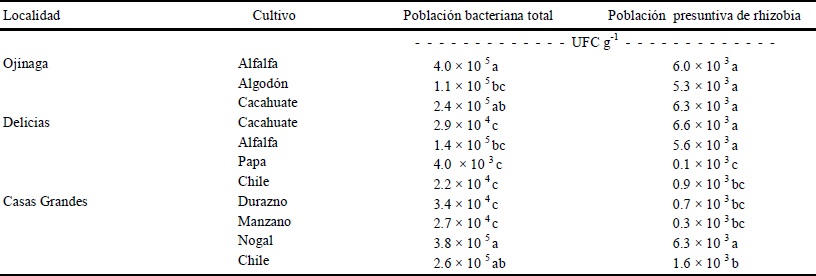
Letras iguales dentro de la misma columna no tienen diferencias estadísticas (Tukey, P ≤ 0.05).
Cuadro 2 Estimación de la población bacteriana presente en las muestras de suelo del estado de Chihuahua.
Se observó diferencia estadísticamente significativa (P ≤ 0.05) en el número de UFC de las tres localidades. El número mayor de poblaciones bacterianas totales se estimó en suelos con cultivo de alfalfa de Ojinaga (4.0 × 105 UFC g-1) y en suelo con nogal de la localidad de Casas Grandes (3.8 × 105 UFC g-1); mientras que la menor población se detectó en el suelo con cultivo de papa, en la localidad de Delicias (4 × 103 UFC g-1), suelo sometido a la aplicación intensiva de agroquímicos.
En cuanto a la población del grupo rhizobia, el número de UFC fue mayor en el suelo con el cultivo de cacahuate de la localidad de Delicias (6.6 × 103 UFC g-1 suelo) y menor en el suelo con el cultivo de papa de esta misma localidad (0.1 × 103 UFC g-1 suelo). Al efectuar el aislamiento de las colonias con características morfológicas relacionadas con el grupo rhizobia, algunas presentaron una baja tasa de supervivencia in vitro, obteniéndose una colección de 24 aislamientos bacterianos provenientes de suelo donde se cultivó alfalfa, cacahuate, algodón, papa, chile, durazno y manzano, y siete aislamientos obtenidos directamente de nódulos radiculares de alfalfa. Lo que dio un total de 31 aislamientos que se identificaron preliminarmente con base en sus características morfológicas (como ya se describió en la sección de materiales y métodos), presentaron colonias rojas, rosas y blanquecinas (en medio con rojo Congo), apariencia húmeda y mucosa, de superficie convexa. Se han demostrado diferencias, en la población microbiana del suelo, relacionadas con cambios en el contenido de agua, niveles de carbono, nitrógeno y pH del suelo (Doran, 1980; Reis et al., 2004), sin embargo, es difícil determinar la cantidad de microorganismos en un suelo, y cuál es la población microbiológica necesaria para que un suelo agrícola funcione de manera óptima (Tate III, 1995).
Reis et al. (2004), destacaron como condicionante de la mayor o menor abundancia de microorganismos benéficos en el suelo, el manejo del cultivo y la época del muestreo combinado con el tipo de planta hospedera, debido a la composición de los exudados radiculares y la relación C/N de la rizósfera. Otro factor en la detección de microorganismos es el medio de cultivo utilizado para evaluar estas poblaciones, ya que cualquier modificación en la humedad, materia orgánica o el pH del suelo, puede influir. Las bacterias fijadoras de nitrógeno tienen ventaja sobre otras bacterias en condiciones donde el nitrógeno disponible es limitante o completamente deficiente; sin embargo, se ha encontrado que los fertilizantes nitrogenados añadidos a los cultivos tienen efectos negativos sobre estas poblaciones. Además, la distribución de microorganismos fijadores de nitrógeno no está completamente dictada por la disponibilidad de nitrógeno en el ambiente, sino que es aleatoria, y puede predecirse con base en las características del hábitat (Zehr et al., 2003).
Identificación de Cepas Aisladas
Se analizaron las secuencias del gen 16S rDNA de las 31 cepas, mostrando que la mayoría de las obtenidas del suelo cultivado con alfalfa, cacahuate y manzano se agrupaban con Ensifer meliloti (antes Sinorhizobium meliloti). Las bacterias pertenecientes al género Ensifer también se encontraron en el suelo cultivado con papa, chile y durazno. Se identificó Rhizobium sp. en la rizósfera de cacahuate. Las bacterias que nodularon las variedades de frijol y alfalfa fueron identificadas como E. meliloti.
Pruebas Fisiológicas
Al cultivar las cepas bajo diferentes condiciones fisiológicas, destacó la cepa LMS485 (Ensifer sp.) aislada del suelo con cultivo de chile, proveniente de la localidad de Delicias, alcanzando una DO600 de 0.547 en sólo 24 h bajo incubación a diferentes temperaturas y en presencia de diferentes concentraciones de NaCl en el medio de cultivo. En medio de cultivo con diferentes valores de pH, destacó la cepa LMS479, capaz de crecer en pH desde 4.0 hasta 8.0, ésta cepa fue aislada de nódulos de cacahuate de Ojinaga e identificada como E. meliloti. La inestabilidad de los aislamientos en condiciones de laboratorio, su capacidad de crecimiento a diferentes temperaturas, pH y concentración de sales del medio, y la utilización de diferentes compuestos de carbohidratos y nitratos son características de éstas poblaciones. Este comportamiento, integrado con la información proporcionada por los agricultores, sugiere que las poblaciones microbianas presentes en los suelos estudiados se han adaptado al medio, respondiendo al uso de agroquímicos, y otros factores bióticos y abióticos. Este es uno de los principales obstáculos que limitan los beneficios de las biotecnologías basadas en el uso de microorganismos, como los fijadores de N2, debido a que su metabolismo se ve alterado por las condiciones edáficas y ambientales. Dado que la fertilidad del suelo es dependiente de la acción de los organismos del suelo que reciclan los nutrientes, es necesario favorecer las condiciones óptimas para el funcionamiento de estos organismos. La interacción positiva entre las plantas y los microorganismos puede mejorar la nutrición de los cultivos agrícolas, aumentando su tolerancia a limitaciones ambientales y ayudando a controlar biológicamente a los patógenos, en consecuencia, reduciendo la necesidad de fertilizantes y pesticidas.
Evaluación de Cepas en Invernadero
Los parámetros evaluados en las plantas de frijol mostraron que las cepas inoculadas influyeron de manera independiente: 1) en la altura de las plantas, se observó que la cepa LMS497 presentó diferencia estadísticamente significativa (P ≤ 0.05) con respecto al resto de las cepas inoculadas; 2) en diámetro del tallo, la cepa LMS489 presentó mayor diferencia con respecto al resto de las cepas inoculadas; 3) en la altura del tallo la cepa LMS486 mostró ser la mejor (P ≤ 0.05) respecto al resto de los aislamientos; 4) mientras que para largo de la raíz, la cepa LMS470 causó el mayor aumento, respecto al resto de los aislamientos (Cuadro 3).
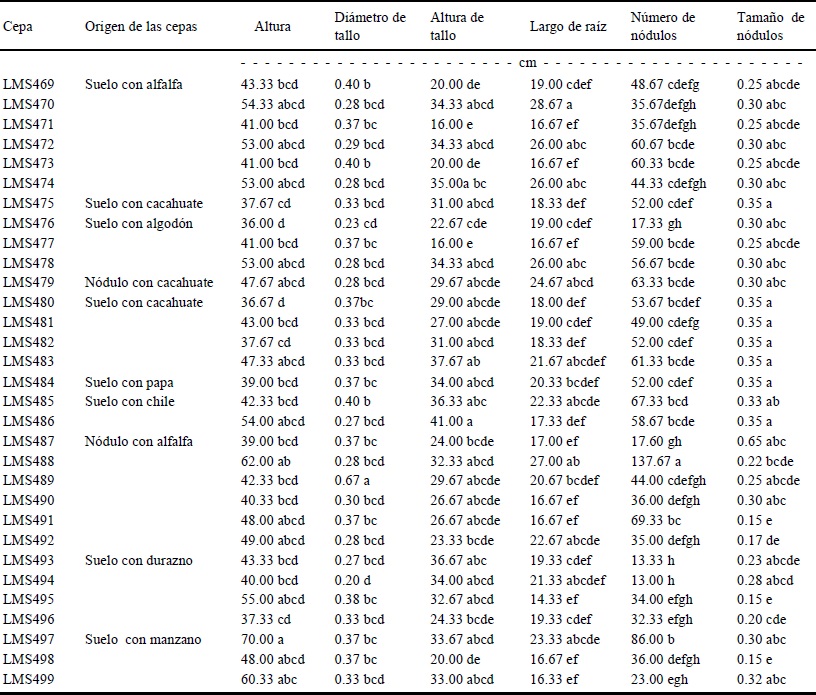
Letras iguales dentro de la misma columna no tienen diferencias estadísticas (Tukey, P ≤ 0.05).
Cuadro 3 Características de plantas de frijol inoculadas con las cepas seleccionadas, bajo condiciones de invernadero.
En frijol, la cepa LMS488 indujo un mayor número de nódulos, siendo estadísticamente significativa la diferencia (P ≤ 0.05) respecto al resto. Esta cepa fue aislada de nódulos de alfalfa de Delicias, e identificada como Ensifer meliloti. El tamaño y color de los nódulos, fue variable, destacando la cepa LMS481, aislada del suelo con cultivo de cacahuate en Delicias, por inducir los nódulos de mayor tamaño. La inoculación en leguminosas, con rhizobia y bacterias promotoras del crecimiento vegetal, ha tenido una interacción positiva en el desarrollo radical de frijol y, en general, se favorece la nodulación y fijación de nitrógeno de las leguminosas (Aguirre-Medina et al., 2005).
En alfalfa (Cuadro 4), sólo se midieron las plantas que presentaron nódulos radiculares, en las cuales al evaluar la altura se encontró una diferencia estadísticamente significativa (P ≤ 0.05). Las plantas inoculadas con las cepas LMS473 y LMS499 presentaron mayor altura respecto al resto de las cepas inoculadas. En cuanto al diámetro del tallo, no se encontró diferencia significativa. En el largo de la raíz, las cepas LMS496, LMS497 y LMS498 presentaron los valores más altos. En frijol, la experiencia de inoculación ha tenido resultados muy variables, en general, las bacterias introducidas son responsables de una proporción pequeña de los nódulos formados, debido a que el resto lo forman las cepas nativas. Por otra parte, al ensayar capacidad de nodulación en alfalfa, se encontró diferencia estadísticamente significativa (P ≤ 0.05) con la cepa LMS499, aislada del suelo rizosférico de manzano (Casas Grandes), que presentó mayor cantidad de nódulos respecto a todas las cepas inoculadas. En el tamaño de nódulo se encontró diferencia estadísticamente significativa en las cepas LMS488 y LMS491 con respecto a las demás cepas.
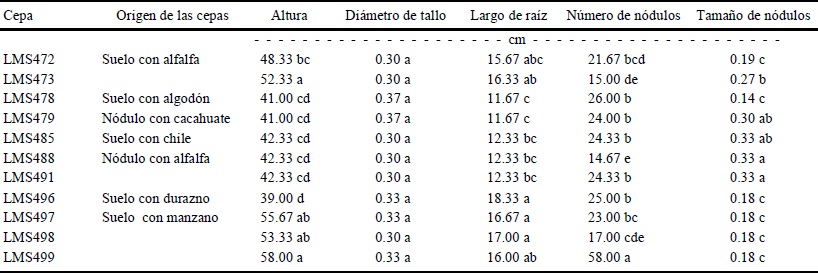
Letras iguales dentro de la misma columna no tienen diferencias estadísticas (Tukey, P ≤ 0.05).
Cuadro 4 Características de plantas de alfalfa inoculadas con las cepas seleccionadas, bajo condiciones de invernadero.
Se sabe que hay respuestas diferentes en la interacción microorganismo-planta y obedecen, en parte, a la especificidad simbiótica, es decir, al hecho de que algunos rhizobia forman nódulos en las raíces o tallos de ciertas leguminosas, donde se establecen, proliferan, se diferencian y fijan nitrógeno. Así, una especie de leguminosa establece simbiosis con un número ilimitado de especies de rhizobia y sus características derivan de elementos genéticos que pueden ganarse o perderse, con la consecuente modificación de la capacidad simbiótica (Oldroyd y Downie, 2008). Lo anterior lleva a pensar en la posible transferencia lateral de material genético, que podría explicar el hecho de que por primera vez se aísle una cepa de E. meliloti capaz de nodular frijol, y aunque se presenta una tasa muy baja, la simbiosis es fijadora de nitrógeno.
Hay factores que intervienen en el desarrollo de los nódulos, como es la concentración de metales en el medio, cuando falta molibdeno se forman más nódulos, pero son menos eficientes y su estructura se asemeja a la de los nódulos inactivos, la dificultad para la asimilación de molibdeno parece ser una de las principales limitaciones en la fijación del N2, especialmente en los suelos ácidos (Burdman et al., 2000; Aguirre-Medina y Kohashi-Shibata, 2002; Aguirre-Medina et al., 2005). Durante este estudio se encontró que plantas inoculadas con las cepas procedentes de suelo de cultivo de manzano con pH 4.7 generaron el mayor número de nódulos radiculares, en comparación con el resto de las cepas. Sin embargo, debe resaltarse que el número de nódulos es resultado de cierta disponibilidad fisiológica-genética de la planta (Martínez-Scott et al., 2002).
La respuesta de las plantas fue independiente del tamaño de la población, en ensayos con suelos de Ojinaga y Casas Grandes, la población relativa de rhizobia fue muy baja en comparación con la población bacteriana total, sin embargo se obtuvieron resultados positivos a la nodulación e incluso a la fijación de nitrógeno (tasas muy bajas), estas respuestas reflejan la influencia de las prácticas de cultivo a que se someten los suelos en estas regiones de Chihuahua.
Wang y Martínez-Romero (2000) sostienen que la búsqueda de bacterias con potencial biofertilizante se debe efectuar a partir de la población nativa del sitio donde se aplicarán, tesis defendida por otros autores (Silva y Vinuesa, 2007). Ello debido a que se favorece el aprovechamiento de la especificidad simbiótica y la capacidad de adaptación de las cepas de rhizobia para establecer una simbiosis efectiva a partir de cepas nativas. Además, debe considerarse que la fertilidad del suelo afecta directamente la actividad microbiana, por lo que para lograr un mayor estímulo en el desarrollo vegetal se requiere diseñar un inóculo multicepa que responda favorablemente a las condiciones ambientales. En el presente trabajo encontramos dos cepas de rhizobia con alto potencial biofertilizante (LSM479 y LSM485) por su tolerancia a condiciones adversas del medio, éstas deben acoplarse con otros microorganismos para que en conjunto se favorezca el desarrollo vegetal.
Conclusiones
- El análisis de poblaciones bacterianas en muestras de suelo, en tres localidades del estado de Chihuahua, reflejó el efecto de las diferentes prácticas agrícolas, incluida la aplicación de fertilizante químico. Se observó una mayor población bacteriana en suelos con cultivo de alfalfa de Ojinaga y de nogal de la localidad de Casas Grandes, mientras que la menor población se detectó en un suelo dedicado al cultivo de papa con aplicación de agroquímicos, en la localidad de Delicias.
- En este estudio se aislaron cepas con capacidad de crecimiento en condiciones que se consideran adversas y que sugieren una mayor flexibilidad fisiológica y capacidad de adaptación a las condiciones ambientales.
- La cepa Ensifer sp. LMS485, aislada de un suelo con cultivo de chile en Delicias, destacó por su capacidad de crecimiento en diferentes concentraciones de NaCl en medio de cultivo, y a diferentes temperaturas de incubación. Mientras que la cepa E. meliloti LMS479, aislada de nódulos de cacahuate de Ojinaga, mostró capacidad de crecimiento en un medio de cultivo con diferentes niveles de pH, uno de los principales factores limitantes del aprovechamiento de los inoculantes.
- El aislamiento de cepas identificadas como Ensifer meliloti a partir de nódulos de cacahuate, y con capacidad de nodular al frijol, lleva a considerar la transferencia lateral de material genético como una herramienta de adaptación para la sobrevivencia de las poblaciones bacterianas en ausencia de su hospedero original. Aunque el número de nódulos radiculares obtenidos fue bajo, resalta el hecho de que fueron los de mayor tamaño y dieron resultados positivos en la reacción de reducción de acetileno.
- La generación de una estrategia de desarrollo sustentable para el estado de Chihuahua requiere el diseño de inoculantes que permitan cubrir diferentes carencias nutricionales del suelo y la adaptación y supervivencia de las cepas bacterianas bajo diferentes esquemas de prácticas agrícolas.











 nueva página del texto (beta)
nueva página del texto (beta)