Introducción
El uso de los productos biológicos es una alternativa a los químicos convencionales en la agricultura y en auge en los últimos años (Pérez, 2010). En particular los elaborados a base de microorganismos benéficos son los que presentan atractivos beneficios a los cultivos debido a sus múltiples efectos sobre los fitopatógenos (Ibarra et al., 2006). No obstante, se ha visto que el uso de los productos comerciales no ha garantizado mejores resultados en la producción de cultivos en comparación por ejemplo al uso de microorganismos nativos (Elliot et al., 2009), ya que su presencia en el sitio de aplicación depende de varios factores que disminuyen su efectividad como el uso de agroquímicos (Moliszewska, 2001). Actualmente algunas técnicas biotecnológicas como la inmovilización celular y enzimática se han convertido en una herramienta de manejo de los microorganismos y sus subproductos, lo cual permite mantener o mejorar su actividad protegiéndola de los factores adversos (Alvarez et al., 2009). Dichas técnicas pudieran ser aprovechadas en la agricultura (Mahmoud y Helmy, 2009). Por lo general, estas inmovilizaciones se han realizado en materiales de sílice y polímeros sintéticos que son de alto costo; razón por la que se ha limitado su aplicación extensiva en la agricultura. El quitosano es un polímero natural obtenido de la desacetilación de la quitina, el cual se encuentra en gran proporción en el caparazón de los crustáceos (Lamarque et al., 2007). Este biopolímero posee características útiles en la agricultura, como su actividad antimicrobiana y la inducción de las respuestas de defensa de la propia planta (Rabea et al., 2003), el cual también ha mostrado compatibilidad en la inmovilización enzimática dada su versatilidad en las formas físicas disponibles como la formación de geles (Çetinus et al., 2009). Con todo, no existe información relacionada a la inmovilización de microorganismos benéficos en este biopolímero que pueda ser aplicado en la agricultura.
Por otro lado, es bien sabido de la existencia del microorganismo benéfico T. harzianum, el cual muestra actividad biológica significativa (Harman et al., 2004) que pudiera tal vez mejorarse para su aplicación agrícola mediante una técnica de inmovilización. Sin embargo, no existe información de los efectos sobre las plantas por parte de microorganismos inmovilizados en soportes activos como el quitosano. Estudios previos demuestran que la inducción de las respuestas de defensa provocados por el T. harzianum en plantas de maíz induce cambios metabólicos y anatómicos marcados (Shoresh y Harman, 2008).
Para contar con información en este campo, el objetivo del presente trabajo fue documentar la inmovilización del hongo T. harzianum en hidrogeles de quitosano como una alternativa para conservar su actividad al aplicarse al sustrato. Se verificó el efecto del microorganismo inmovilizado sobre el crecimiento, absorción de minerales, epidermis foliar, tejido vascular de hojas, raíz y tallo, así como sobre la asimilación de CO2 en plantas de tomate (Solanum lycopersicum) en condiciones de invernadero.
Materiales y métodos
El experimento se estableció en dos ciclos diferentes, uno en los meses de julio-agosto del 2009 y otro en los meses de marzo-abril de 2010. La síntesis de los hidrogeles de quitosano (Cs) y la inmovilización del T. harzianum (Th) fueron realizados en el departamento de Agroplásticos del Centro de Investigación en Química Aplicada (CIQA) de Saltillo, Coahuila, México. Las pruebas biológicas con las plantas de tomate se realizaron en la Universidad Autónoma Agraria Antonio Narro (UAAAN) de Saltillo, Coahuila, México.
Preparación de Reactivos y del Material Biológico
Los materiales utilizados en ambos ciclos fueron quitosano (Cs) grado técnico marca Marine Chemicals con un peso molecular viscosimétrico de 200 000, el cual se determinó en un viscosímetro tipo Ubbelohde, y un 87% de desacetilación determinado por infrarrojo (Brugnerotto, 2001). Se uso una cepa experimental de T. harzianum (Th) aislada de una huerta de nogal del municipio de San Pedro Las Colonias, Coahuila, México, cedida por el Departamento de Parasitología de la UAAAN. Los microorganismos se manejaron a una concentración de 1 × 109 UFC. Esta cepa fue reactivada en Papa-dextrosa-agar (PDA) marca Bioxon. Se utilizaron semillas certificadas de tomate cv. Río Grande (SEMINIS) de hábito determinado tipo saladette. Estas fueron sembradas en un invernadero tipo túnel.
El Cs inicialmente fue purificado a partir de una solución al 2% (p/v) en ácido acético al 1% (v/v), precipitado con NaOH, filtrado y lavado con etanol. La síntesis de los hidrogeles se hizo a partir de una solución al 2% (m/v) del Cs purificado en ácido acético al 1% (v/v), después se entrecruzó con glutaraldehído al 50% en solución acuosa, y por último se secaron los geles a 60 °C en estufa de aire circulante por 24 h. Los geles se dejan hinchar en agua, se secan y se pesan en ambos casos para determinar el porcentaje de hinchamiento con la siguiente fórmula:
donde:
%H = porcentaje de hinchamiento
Ph = peso del hidrogel hinchado
Ps = peso del hidrogel seco
Inmovilización de T. harzianum y Establecimiento del Experimento
La inmovillización del T. harzianum se realizó de la siguiente manera: se colocaron en 5g de gel seco en matraces erlenmeyer con 100 mL de caldo de papa y dextrosa previamente esterilizados en autoclave a 120 °C, posteriormente se agregó una aliquota de 1 mL de una suspensión de la cepa con una concentración de 1 × 109 UFC y finalmente fueron incubados por 72 h a 28 °C con agitación constante.
En el verano de 2009 se sembraron las semillas de tomate en invernadero. Para la siembra se utilizaron por tratamiento 20 macetas de polietileno color negro con capacidad de 0.5 kg. Las plantas fueron regadas cada 3 días con una solución nutritiva Douglas completa (Douglas, 1976). Se establecieron 6 tratamientos, éstos consistieron en dos tratamientos con T. harzianum inmovilizado en los hidrogeles de quitosano, los cuales fueron aplicados en dosis de 6 y 3 g por kg de sustrato (T1: P + 6gH + Th y T2: P + 3gH + Th);dostratamientos con los hidrogeles de quitosano a las mismas dosis pero sin el hongo (T3: P + 6gH y T4: P + 3gH); un tratamiento donde se aplicó el hongo en forma de suspensión (T5: P + Ths), el cual fue preparado al mezclar el contenido de 3 cajas petri en 3.5 L de agua corriente y distribuido el contenido en las 20 macetas correspondientes al tratamiento, conservándose la misma concentración antes mencionada de 1 × 109 UFC en cada una de las macetas y un testigo absoluto donde sólo está la turba (T6: P). Las variables evaluadas fueron: crecimiento (longitud y diámetro de tallos y número de hojas); biomasa vegetal (peso seco y fresco); anatomía de hojas, tallo y raíz; epidermis foliar; y contenido de minerales en materia seca.
Longitud y Diámetro de Tallos y Número de Hojas
La medición de la longitud de los tallos se tomó a los 20, 27, y 34 días después de la siembra (dds). Esta se realizó desde la base del tallo hasta el ápice. La medición del diámetro de los tallos y el conteo de las hojas se efectuó a los 20 y 34 dds. La medición del diámetro se realizó con un vernier ajustándola a la parte media del tallo.
Biomasa Fresca y Seca (Aérea y Radical)
Para medir esta variable se colectaron 3 plantas al azar de cada tratamiento a los 30 y 40 dds. La raíz se separó de la parte aérea, se pesó por separado y se secó en una estufa a 60 °C durante 24 h. Las muestras se almacenaron para un posterior uso.
Tejido Vascular de Raíz, Tallo y Hojas
Se realizó un estudio del tejido vascular de la raíz, tallo y las hojas. Para ello se tomaron 2 plantas por tratamiento al azar, a las cuales se les extrajeron 3 secciones tanto de la raíz, el tallo y las láminas foliares, a los 42 dds. Las secciones radicales de 1 cm fueron las ubicadas en la parte más cercana al tallo. Las secciones de tallo de 1 cm fueron las ubicadas en la parte más cercana a la raíz. Las láminas foliares muestreadas se ubicaron en la parte media de las hojas a dos tercios de altura de la planta, las secciones extraídas incluyeron un área de 1.5 cm2 de la región media de las nervaduras. Una vez extraídos los tejidos, se colocaron en mezcla fijadora de alcohol, ácido acético y formaldehido en una relación 18:1:1, seguido por la deshidratación en mezclas de xilol y alcohol a concentraciones 1:3, 1:1, y 3:1 sucesivamente, y se incluyeron en parafina. Las inclusiones en parafina se realizaron en placas de papel aluminio, de la cual se tomaron los moldes para realizar los cortes en un microtomo de rotación, el grosor de los cortes fue de 20 micras. Los cortes finos fueron colocados en portaobjetos, los cuales fueron sumergidos en 3 mezclas de alcohol (al 70, 96, y 100%) y posteriormente en xilol, carbol xilol, verde rápido y safranina. Por último se analizaron en microscopio VistaVision a 40x con cámara digital (Pixera) integrada. En esta se realizaron mediciones del área vascular transversal, el cual fue expresado en porcentaje con respecto al resto de los tejidos; diámetro y área perimetral de los vasos del xilema, el cual se reportó en μm2. Estas mediciones se realizaron con la ayuda del programa AxioVision 4.5.
Epidermis Foliar (Índice y Frecuencia Estomática)
Se analizó el arreglo de los estomas para cuantificar el índice y la frecuencia estomática. Los foliolos muestreados estaban ubicados en la parte media de las hojas a 2 tercios de altura de la planta. Las muestras se tomaron en una sola fecha, a los 35 dds, con la impresión de 3 foliolos de 3 plantas por tratamiento tomadas al azar. La impresión foliar se realizó colocando pegamento para PVC con una brocha en la cara abaxial y adaxial de cada hoja, colocando cinta adhesiva transparente sobre la película formada sobre la epidermis foliar y después se colocó ésta en un portaobjetos. Para esta variable se utilizó un microscopio VistaVision a 40x de objetivo.
Concentración Mineral
Se determinó la concentración mineral de las plantas a los 44 y 51 dds tomando 3 plantas al azar por cada tratamiento. La determinación de N se realizó por el método macrokjeldahl, el P por colorimetría y los metales Ca, Mg, K, Na, Cu, Z, Mn, y Fe por absorción atómica en un espectrofotómetro Varian AA1275.
En los meses de marzo-abril del 2010 se establecieron los mismos tratamientos que en el primer ciclo con 3 macetas por tratamiento, los cuales se manejaron bajo las mismas condiciones. Este ciclo se estableció sólo para medir la variable asimilación de CO2. Para ello se utilizó el equipo LI-COR Li-6400 Portable Photosynthesis System, los datos tomados fueron: asimilación de CO en mmol CO m-2 s-1; conductancia estomática en mol H O m-2 s-1; concentración intracelular de CO en mmol CO mol-1; y transpiración en mmol H O m-2 s-1. Las lecturas se realizaron a los 30 dds, para ello se ensayaron 3 repeticiones a cada tratamiento en un período de luminosidad de tiempo de 11:00 a 13:00.
Pruebas de Viabilidad de T. Harzianum y Análisis Estadístico
Con el objetivo de verificar la viabilidad y el crecimiento del hongo inmovilizado en los hidrogeles mezclados con la turba, para ambos ciclos (verano de 2009 y primavera de 2010) se hicieron pruebas a los 30 y 51 dds. Para ello se extrajeron muestras de suelo (1 g) de cada tratamiento donde se adicionó el hongo y se hicieron diluciones seriadas, las cuales se sembraron de 101 a 106 en PDA para poder hacer el conteo de las colonias.
Las variables de crecimiento arriba mencionadas fueron evaluadas bajo un análisis de varianza de una y dos vías. Se realizó la prueba de medias con Tukey al 0.05, para ello se utilizó el programa estadístico JMP (SAS Institute, 2002).
Resultados y discusión
Caracterización de los Hidrogeles de Quitosano e Inmovilización de Trichoderma harzianum
Se obtuvieron hidrogeles de Cs con un porcentaje de hinchamiento del 500%, los cuales eran fácilmente desmenuzables, no se deformaban con facilidad y no se incrustaban a las superficies así como en las manos, la humedad fue adecuada para el almacenamiento en envases cerrados (humedad recomendable próxima al 4%). El empleo de otros entrecruzantes como el formaldehído (Singh et al., 2006), o adicionando otros reactivos como el polivinil-alcohol pueden mejorar el hinchamiento y la absorción de agua (Gunasekarán et al., 2006). No obstante se ha reconocido que la presencia de reactivos (glutaraldehido, disocianato de tolueno) usados para lograr un mayor entrecruzamiento, contribuye al detrimento en el crecimiento de las células de los microorganismos (Bickerstaff, 1997), por lo que en este trabajo se minimizó en lo posible el uso de reactivos en la formación del hidrogel.
A las 72 horas de haber inmovilizado al T. harzianum se observó una coloración verde-obscuro, característica del crecimiento del hongo, comprobándose así su inmovilización en el Cs y alcanzando una concentración de 109 UFC. Al respecto, Abou-Sereih (2007) observó que aplicando Cs en forma líquida a diferentes concentraciones (de 0 a 4.5 mg mL-1) a cepas de Th el crecimiento lineal disminuía conforme se aumentaba la dosis, situación que no se presentó en este experimento con el uso de Cs en forma sólida y a dos dosis diferentes.
Asimismo, se comprobó la presencia de T. harzianum a los 30 y 51 dds del cultivo en ambos experimentos verano de 2009 y primavera de 2010 (Cuadro 1). En la colección de los sustratos del 2009, Th se encontraba en una concentración similar en los tratamientos que contenían el hongo inmovilizado o en forma libre, con una tendencia a la disminución conforme pasaba el tiempo. En las muestras recolectadas en abril de 2010 se observó la misma tendencia a la disminución, sin embargo, a los 30 dds en las muestras del tratamiento T1 y T2 (hongos inmovilizados) había mayor concentración en comparación al tratamiento T5 (aplicación del hongo en forma libre), lo que indica que hasta este tiempo sobreviven mayor cantidad de colonias del hongo en el hidrogel que los aplicados libremente (Cuadro 1).

† T1 y T2: muestras donde T. harzianum fue inmovilizado en los hidrogeles de quitosano. T5: muestras donde T. harzianum fue aplicado en forma de suspensión libre; P = turba; H = hidrogel.
Cuadro 1 Unidades formadoras de crecimiento del hongo Trichoderma harzianum (Th) en 1 g de las muestras de suelo donde se sembraron semillas de tomate.
En las observaciones a los 51 dds del 2010 se encontró que el T. harzianum en el tratamiento T1 se mantenía aún en una concentración alta, sin embargo, en el tratamiento T2 ya no estaba presente ni en la aplicación en forma de suspensión (T5), probablemente debido a las condiciones adversas para el crecimiento del mismo, como el pH del sustrato o la presencia de sales y posiblemente a la presencia de una bacteria fluorescente detectada en el medio haya sido más competitiva y no le haya permitido desarrollarse adecuadamente. Al respecto, Pastucha (2005) observó que aplicando gel de quitosano en suelos cultivados con soya, la composición cualitativa y cuantitativa de los hongos y bacterias presentes aumentaba, también notó que la presencia de bacterias atenuaba la presencia de los hongos, destacando en ellos el aumento de poblaciones benéficas. Sobre esto, no existen estudios detallados que expliquen por qué el mayor desarrollo de las bacterias es acompañado por un pobre desarrollo de los hongos, sin embargo, se ha reconocido que las comunidades microbianas se encuentran en una proporción definida (Myskow 1989), esto quiere decir que la multiplicación intensiva de bacterias está acompañada por un pobre desarrollo de hongos y viceversa. Por otra parte, Boer et al. (2003) indicaron que la composición de la comunidad bacteriana (como las Pseudomonas) puede ser un factor determinante en el desarrollo de la fungistasis en T. harzianum. Este fenómeno es atribuido a factores bióticos estrechamente ligados a la alcalinidad.
La inmovilización de T. harzianum también ha sido probada exitosamente por encapsulamiento en alginato, en el que se ha observado además que el hongo mejora su actividad enzimática comparada con la forma de suspensión (El-Katatny et al., 2003), sin embargo, el alginato como soporte presenta la desventaja de poseer baja estabilidad ante los componentes de los medios de cultivo como el fosfato y citrato (Aguilar-May et al., 2007).
Variables de Crecimiento y Biomasa Vegetal
Al realizar el análisis de varianza a las variables de crecimiento, la longitud de los tallos mostró diferencia altamente significativa, en la que resalta el efecto de disminución en la altura de las plantas en los tratamientos donde se aplicó el hidrogel con el hongo inmovilizado (T1 y T2), efecto que se marca conforme pasa el tiempo (Figura 1).
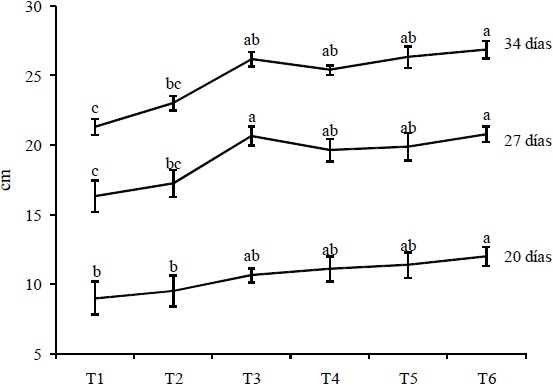
Figura 1 Longitud de tallos en plantas de tomate (Solanum lycopersicum) en los diferentes tratamientos con Trichoderma harzianum o hidrogeles de quitosano. Medias (± EE) con la misma letra no son diferentes estadísticamente (Tukey P ≤ 0.05). T1 y T2: aplicación de tratamientos donde T. harzianum fue inmovilizado en los hidrogeles de quitosano. T3 y T4: aplicación solo de hidrogeles de quitosano. T5: aplicación de T. harzianum en forma de suspensión libre. T6: testigo.
Para el caso del número de hojas, el análisis de varianza mostró significancia. En ésta no se observó una clara tendencia a la disminución en estos mismos tratamientos. El diámetro de los tallos presentó menor grosor en el día 20, pero en el día 34 no mostró diferencia con respecto a los demás tratamientos (Cuadro 2).
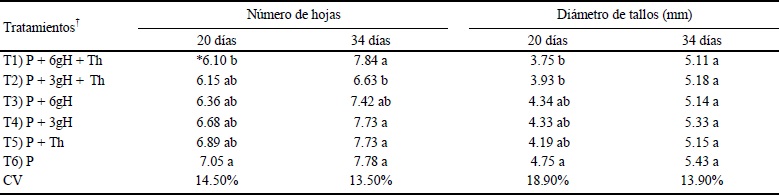
* Medias con la misma letra no son diferentes estadísticamente (Tukey P ≤ 0.05). † T1 y T2: aplicación de tratamientos donde T. harzianum fue inmovilizado en los hidrogeles de quitosano. T3 y T4: aplicación solo de hidrogeles de quitosano. T5: aplicación de T. harzianum en forma de suspensión libre. T6: testigo. P = turba; H = hidrogel.
Cuadro 2 Variables de crecimiento en plantas de tomate (Solanum lycopersicum) en los diferentes tratamientos con Trichoderma harzianum (Th) o hidrogeles de quitosano.
En la variable biomasa vagetal, solo el peso fresco y seco aéreos mostraron diferencia significativa. La prueba de medias mostró que T1 produce una menor biomasa (Cuadro 3). Estas respuestas muestran ser contrarias a los efectos producidos en otras plantas usando sólo T. harzianum (Mackenzie et al., 1995), en la que la respuesta común es el aumento en el crecimiento; al igual que el uso de Cs en sus distintas formas de aplicación, donde también mostró ser estimulador en el crecimiento vegetal (Nge et al., 2006; Cho et al., 2008). Sin embargo, no fue el caso en este experimento.
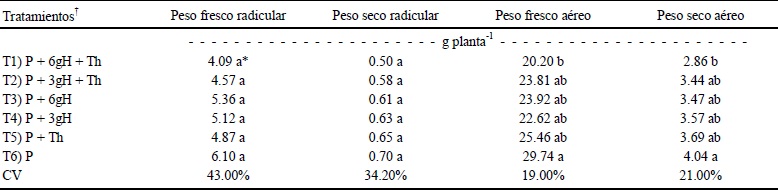
* Medias con la misma letra no son diferentes estadísticamente (Tukey P ≤ 0.05). † T1 y T2: aplicación de tratamientos donde T. harzianum fue inmovilizado en los hidrogeles de quitosano. T3 y T4: aplicación solo de hidrogeles de quitosano. T5: aplicación de T. harzianum en forma de suspensión libre. T6: testigo. PFR: Peso Fresco Radicular. PSR: Peso Seco Radicular. PFA: Peso Fresco Aéreo. PSA: Peso Seco Aéreo. P = turba; H = hidrogel.
Cuadro 3 Producción de biomasa vegetal en plantas de tomate (Solanum lycopersicum) en los diferentes tratamientos de Trichoderma harzianum (Th) o hidrogeles de quitosano.
Estudio de la Epidermis Foliar y del Tejido Vascular de Raíz, Tallo y Hojas
En los estudios de frecuencia e índice estomáticos no se observó diferencia estadística (Cuadro 4). En los estudios anatómicos de los haces vasculares tampoco se observa efecto alguno, el tamaño y la forma de los vasos de xilema fueron similares en todos los tratamientos.
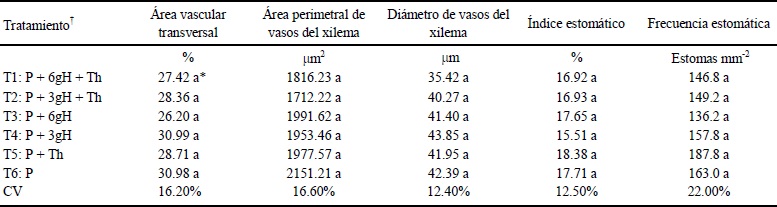
* Medias con la misma letra no son diferentes estadísticamente (Tukey P ≤ 0.05). † T1 y T2: aplicación de tratamientos donde T. harzianum fue inmovilizado en los hidrogeles de quitosano. T3 y T4: aplicación solo de hidrogeles de quitosano. T5: aplicación de T. harzianum en forma de suspensión libre. T6: testigo. P = turba; H = hidrogel.
Cuadro 4 Tejido vascular de la raíz, el tallo y las hojas a los 42 días y de la epidermis foliar a los 35 días en plantas de tomate (Solanum lycopersicum) en los diferentes tratamientos con Trichoderma harzianum (Th) o quitosano.
Contrario a estos resultados, la aplicación foliar de quitosano ha mostrado la habilidad de reducir la transpiración de plantas de pimiento (Capsicum annuum) aumentando el uso eficiente del agua, a través del cierre parcial o total de los estomas (Bittelli et al., 2001). También se ha documentado que T. harzianum, como inductor de resistencia sistémica, induce grandes cambios estructurales a nivel celular en las plantas de pepino (Cucumis sativus) cuando los hongos colonizan las raíces (Yedidia et al, 1999). Sin embargo, en estos estudios no se encontró modificación alguna (Figura 2).
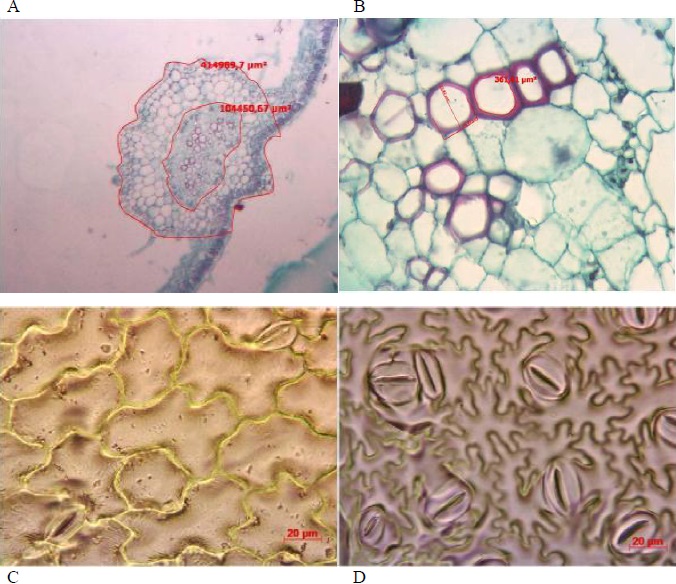
Figura 2 Mediciones de tejido foliar de plantas de tomate (Solanum lycopersicum) establecidas en turba donde se aplicó la dósis de 6 g de hidrogel con el T. harzianum. A: Área de haces vasculares en una sección transversal foliar (xilema y floema) a 10x. B: Área perimetral y diámetro unitario de vasos del xilema (metaxilema y protoxilema) de hojas a 40x. C y D: Haz y envés de foliolos a 40x.
Concentración Nutrimental
El análisis de la concentración mineral en la materia seca, muestra que solamente existió diferencia significativa en P, Ca y Cu (Cuadro 5). En general, el tratamiento (T1) donde se tenía la presencia del hongo inmovilizado a mayor dosis de hidrogel fue la que mostró una alta concentración de estos minerales respecto al resto de los tratamientos. Una explicación posible a este hecho es la habilidad del hongo T. harzianum para solubilizar minerales como el P, Mn, Fe, y Cu (Altomare et al., 1999). Por otro lado, el Cs presenta propiedades de quelación, intercambio iónico y adsorción de iones (Cartaya et al., 2009) que pudieran también explicar la mayor acumulación de minerales cuando se dispone de mayor cantidad cerca del área radicular. No se observó sin embargo diferencia estadística entre los tratamientos T3 y T4, correspondientes a los efectos de las dosis de hidrogel de Cs, lo que pudiera indicar un efecto sinérgico entre el material de soporte y los hongos.
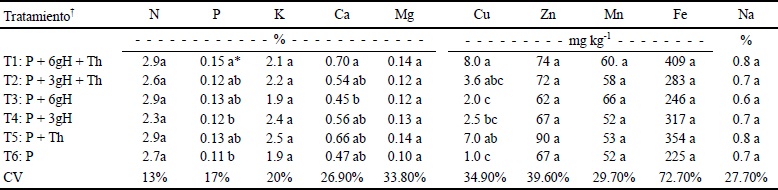
* Medias con la misma letra no son diferentes estadísticamente (Tukey P ≤ 0.05). † T1 y T2: aplicación de tratamientos donde T. harzianum fue inmovilizado en los hidrogeles de quitosano. T3 y T4: aplicación solo de hidrogeles de quitosano. T5: aplicación de T. harzianum en forma de suspensión libre. T6: testigo. P = turba; H = hidrogel.
Cuadro 5 Concentración mineral con base en materia seca en plantas de tomate (Solanum lycopersicum) en los diferentes tratamientos con Trichoderma harzianum (Th) o hidrogeles de quitosano.
Asimilación de CO 2
No se observó diferencia estadística en ninguna de las mediciones de la variable asimilación de CO2 (Cuadro 6). Estudios previos muestran que el Cs usado como película de recubrimiento foliar en algunas especies de plantas ocasiona una reducción en la fotosíntesis al inicio de la aplicación, pero en los días sucesivos ésta aumenta en comparación a las plantas no tratadas, debido quizá el aumento en la eficiencia en la asimilación de CO2 (Khan et al., 2002); el cual no está completamente entendido.
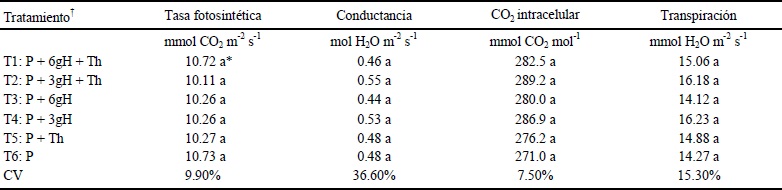
* Medias con la misma letra no son diferentes estadísticamente (Tukey P ≤ 0.05). † T1 y T2: aplicación de tratamientos donde T. harzianum fue inmovilizado en los hidrogeles de quitosano. T3 y T4: aplicación solo de hidrogeles de quitosano. T5: aplicación de T. harzianum en forma de suspensión libre. T6: testigo. P = turba; H = hidrogel.
Cuadro 6 Variables fotosintéticas en plantas de tomate (Solanum lycopersicum) en diferentes tratamientos con Trichoderma harzianum (Th) o hidrogeles de quitosano.
Por otro lado, Shoresh y Harman (2008) observaron que una cepa de Th producía grandes cambios en el proteoma de plántulas de maíz (Zea mays) cuando ésta estaba presente solo en la raíz, sobreexpresando proteínas foliares y disminuyendo la expresión de las de la raíz, a juicio de estos mismos autores, estos costos metabólicos relacionados en la resistencia inducida propiciarían un aumento en la tasa respiratoria y fotosintética. Sin embargo, en este trabajo la complementación de estos mecanismos no afectó las variables en cuestión.
A diferencia de otros trabajos en la que se reportan grandes beneficios en el crecimiento y desarrollo de las plantas por Trichoderma (Ozbay y Newman, 2004; Cho et al., 2008), en este trabajo no se observaron diferencias frente a las plantas del tratamiento testigo en la mayoría de las variables medidas; incluso aún se obtuvo un menor crecimiento de las plantas. Rabeendran et al. (2000) indican que en presencia de condiciones adecuadas de crecimiento será más difícil observar el beneficio de la aplicación de Trichoderma, a diferencia del crecimiento en condiciones subóptimas donde si se observan efectos benéficos. Por su parte Koch (2001) menciona que es posible, en una misma especie, obtener resultados positivos en algunos cultivares pero negativos en otros, e inclusive en Trichoderma puede encontrarse variación entre cepas, como la mencionada por Ousley et al. (1993) quien reportó que algunas cepas del hongo producen metabolitos fitotóxicos que reducen la capacidad germinativa de las semillas. Aunado a esto, no existe una revisión profunda de cuál es el comportamiento de los agentes de biocontrol con las plantas en ausencia de fitopatógenos (Koch, 2001).
Conclusiones
Es posible la inmovilización de Trichoderma harzianum en hidrogeles de quitosano, el cual presenta una viabilidad superior en los hidrogeles comparada al uso en forma de suspensión. Por otra parte, en los tratamientos donde estuvo presente este hongo inmovilizado propició un efecto de detención en el crecimiento longitudinal y una menor producción de biomasa en las plantas, pero se detectó un mayor contenido de minerales y no se observó efecto sobre la anatomía vascular, estomática, y de la actividad fotosintética en las plantas de tomate (Solanum lycopersicum). Esta investigación brinda la posibilidad de implementar una forma de manejo viable de los microorganismos benéficos en la producción de cultivos bajo condiciones de invernadero.











 nueva página del texto (beta)
nueva página del texto (beta)



