Introducción
El hierro está presente en todos los suelos, sin embargo, el Fe disponible para las plantas es extremadamente bajo debido a la escasa solubilidad de los óxidos-Fe(III) en condiciones aeróbicas (Schmidt, 2003), lo que origina una disminución significativa del rendimiento y calidad de las cosechas. El Fe es un elemento esencial para el funcionamiento de diversos procesos metabólicos y enzimáticos relacionados con el transporte de electrones, fijación de N, síntesis de ADN, clorofila y hormonas, es constituyente de hemoproteínas (citocromos, catalasa y peroxidasa) (Lobreaux y Briat, 1997). El crecimiento de las plantas con baja disponibilidad de Fe tiene importancia económica, dado que disminuye de manera significativa el rendimiento y calidad de las cosechas (Álvarez-Fernández et al., 2007) aunado a que las medidas correctivas que llevan a cabo los agricultores para prevenir o controlar la clorosis por deficiencia de Fe representan una proporción sustancial de los costos de producción total (Abadía et al., 2004; Rombolà y Tagliavini, 2007). La deficiencia de Fe altera la morfología y fisiología de las hojas (Bertamini y Nedunchezhian, 2005), consistentes en una disminución del número de células por unidad de superficie y desorganización en la estructura del cloroplasto, sin afectar el crecimiento de las hojas (Terry y Abadía, 1986). Cuando el estrés es severo, disminuye drásticamente la actividad fotosintética (Larbi et al., 2006), se detiene la división celular en los meristemos y se inhibe la producción de primordios foliares en los ápices del brote y con ello el crecimiento foliar (Römeld y Maschner, 1991, 1988). A nivel ultraestructural, se hace evidente la inadecuada formación de las membranas de los tilacoides (Platt-Aloia et al., 1983). El descenso en la concentración de clorofila está asociado con la disminución de proteínas, ya que ambas se unen mediante un enlace no covalente, para formar un complejo pigmento-proteínico que constituye la membrana de los tilacoides (Fodor et al., 1995). En diversas investigaciones relativas a parámetros fisiológicos en hojas Fe-deficientes se menciona que aún es escasa la información referente a los cambios que ocurren tanto en la estructura interna como en la superficie de las hojas afectadas por este estrés abiótico (Fernández et al., 2008). Dichos cambios pueden ser típicos de cada especie de cultivo, en hojas de limón mexicano deficientes en Fe, en los cloroplastos los tilacoides se apilan de manera desordenada, con escaso desarrollo del grana; además, se afecta el grosor de los parénquimas de empalizada y esponjoso por cambios en las dimensiones de las células (Maldonado-Torres et al., 2006). Hojas de pera y durazno Fe-deficientes no muestran cambios aparentes en cuanto al grosor (Morales et al., 1998), pero disminuye el tamaño y el peso de materia fresca y el diámetro promedio de los poros estomatales, sin afectar la densidad estomatal (Fernández et al., 2008). Para el cultivo de frijol (Phaseolus vulgaris L.), no se han reportado investigaciones de este tipo, siendo necesario caracterizar y entender las alteraciones que pueden presentar los cultivares sensibles a deficiencias de Fe, como una oportunidad de generar tecnologías de corrección. El objetivo de la presente investigación fue determinar cambios anatómicos y fisiológicos en hojas jóvenes de frijol de genotipos tolerante y susceptible a clorosis férrica en plantas expuestas a deficiencia de Fe combinadas con bajo y alto pH en el medio de crecimiento.
Materiales y métodos
Se utilizaron plantas de frijol de una línea tolerante (496) y una susceptible (33) a deficiencia de hierro; ambas derivadas de familias F3 e incrementadas siete generaciones, provenientes de la cruza de progenitores AC1028xPinto Sierra, susceptible y tolerante a la sequía, respectivamente (Ramírez y Nelly, 1998), adaptadas a los Valles Altos y seleccionadas a partir de 1992 por el Programa de Frijol de la Especialidad de Genética del Instituto de Recursos Genéticos y Productividad, en el Colegio de Posgraduados, México. Cuando las semillas, previamente germinadas, presentaron el primer par de hojas simples se trasplantaron en recipientes para ser nutridas con una solución preparada de macronutrimentos (meq L-1) (7 K+, 9 Ca+2, 4 Mg+2, 12 NO3 -, 1 H2PO4 -, 7 SO4 -2, y micronutrimentos (mg L-1) (0.62 Mn, 0.44 B, 4 0.11 Zn, 0.020 Cu y 0.48 Mo), sugeridas por Steiner (1984). El experimento se estableció en un invernadero con luz natural, con los factores de estudio: i) líneas de frijol (a) tolerante (496) y (b) susceptible (33), ii) tres niveles de Fe-EDTA (0, 0.5 y 2 mg L-1) en la solución indicada anteriormente y iii) dos condiciones de pH (6.0 y 8.5). Los doce tratamientos se distribuyeron completamente al azar con cuatro repeticiones, donde la unidad experimental fue un recipiente de 1.5 L con dos plántulas. La solución nutritiva se aireó cada 2 h durante 15 minutos, el pH se ajustó cada tres días de acuerdo al tratamiento y se cambió semanalmente. Las plantas desarrollaron durante cuatro semanas y al final se colectó la hoja trifoliada completamente expandida y más joven y se realizaron las siguientes determinaciones:
Estructura del Mesófilo y Anatomía del Cloroplasto
La anatomía del mesófilo se observó en el foliolo central de hojas trifoliadas jóvenes de la línea tolerante desarrollada con 2 mg L-1 de Fe y pH 6, como testigo, y de las dos líneas desarrolladas sin Fe, como tratamientos contrastantes. Para la preparación de las muestras se siguió la metodología descrita por Maldonado-Torres et al. (2006).
Contenido de Clorofila y Capacidad Fotosintética
Como una medida indirecta de la concentración de clorofila, se realizaron lecturas SPAD en las hojas jóvenes recientemente desarrollas en cada unidad experimental. La tasa fotosintética se cuantificó por medio de un sistema portátil de análisis de gases (IRGA) LI-6200, LI-COR, Lincoln. De cada planta se seleccionó una hoja recientemente madura y sana. Las evaluaciones se hicieron diariamente de las 11:00 a las 12:00 h.
Concentración Nutrimental y Materia Seca
A las hojas jóvenes colectadas se les determinó la concentración de P, K, Ca, Mg, Fe, Mn, Cu y Zn, para lo cual las muestras vegetales fueron digeridas con una mezcla de ácido nítrico y perclórico en proporción 2:1. Las lecturas se obtuvieron por espectrofotometría AES- ICP, en un equipo Varian, Liberty II. Para la determinación de N total, el material se digirió con una mezcla de ácido sulfúrico y ácido salicílico; posteriormente se destiló por arrastre de vapor (Bremner, 1965). La materia seca producida se determinó en el vástago de las plantas, las cuales se colocaron en una estufa con circulación de aire forzado a 70 °C durante 48 h.
Los datos de las variables consideradas fueron sometidos a un análisis de varianza de los efectos factoriales y pruebas de comparación de medias (Tukey P £ 0.05) con el programa estadístico SAS 9.1.
Resultados y discusión
Estructura Interna de Hojas Afectadas por Clorosis Férrica
En las micrografías electrónicas de los cloroplastos, que se presenta en la Figura 1, se observan las variaciones en la estructura del mesófilo de la hoja normal (A) y la clorótica (E) de la línea de frijol tolerante y la susceptible (I). En el corte transversal de la hoja verde (B) y su inverso (C) se observa un parénquima de empalizada y esponjoso bien organizados, con abundantes y bien estructurados cloroplastos. En la estructura interna de estos cloroplastos (D) se aprecia un sistema de tilacoides (t) estrechamente apretados en pilas, en forma de discos llamado grana (g) y los tilacoides (te) atraviesan el estroma (e) interconectándolos. En la hoja clorótica la sección transversal de la línea de frijol tolerante (F) y su inverso (G) muestran un mesófilo organizado pero el parénquima esponjoso más compactado y con menos espacios intercelulares que en la hoja verde, con escasos cloroplastos, de menor tamaño. En la hoja de la línea de frijol susceptible afectada por clorosis (J) y su inverso (K), el mesófilo se muestra desorganizado, con células de forma y tamaño irregular y con una aparente ausencia de cloroplastos. Estudios realizados por Terry y Abadía (1986) en plantas de remolacha con moderada clorosis férrica revelaron que la disminución de la actividad fotoquímica era debida a la reducción del número de unidades fotosintéticas por superficie de área foliar. En las hojas cloróticas de las dos líneas de frijol, el grado de desarrollo de los tilacoides fue escaso (H) y su inverso (L) y como consecuencia no hubo formación de grana. En hojas de remolacha azucarera se encontró que la falta de Fe provocaba una ruptura y deformación de las membranas del tilacoide, pobre orientación laminar, muy poco o nada de grana, pero un gran estroma (Platt-Aloia et al., 1983). La alta sensibilidad de los cloroplastos a la deficiencia de Fe y en particular de los tilacoides, se debe al alto requerimiento de Fe para el transporte de electrones en los fotosistemas, la ferredoxina y la biosíntesis de clorofila (Abadía et al., 2004).
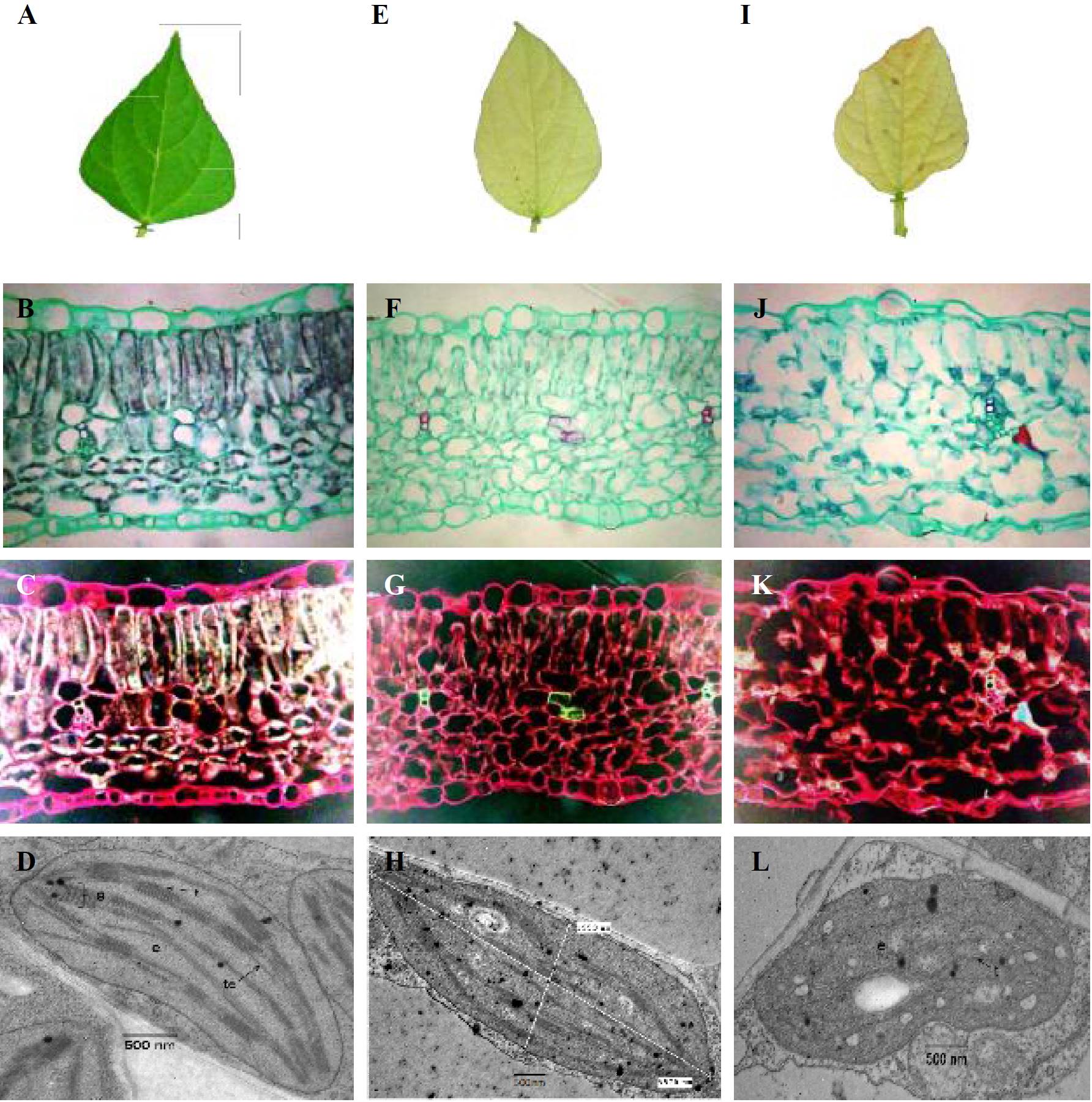
Figura 1 Apariencia de la estructura interna y ultracelular de hojas verdes y cloróticas de líneas de frijol tolerante y susceptible a clorosis férrica. Aspecto de la hoja verde de la línea tolerante (A, B, C, D), con 2 mg L-1 de Fe en la solución, y hojas cloróticas de la línea tolerante (E, F, G, H) y susceptible (I, J, K, L) desarrolladas sin Fe. Sección transversal (B, F, J) e imagen inversa de la sección transversal (C, G, K) observadas en el microscopio compuesto y micrografías electrónicas de transmisión de la estructura de los cloroplastos (D, H, L).
El grosor de las hojas verdes y cloróticas de la línea de frijol tolerante fue de 0.15 y 0.14 mm, respectivamente, mientras que el de la línea susceptible fue mayor (0.19 mm), probablemente por la mayor desorganización que se observó en la estructura interna y no por aumento en grosor de los parénquimas. Diferentes investigaciones indican que esta alteración puede variar según el cultivo, hojas de pera y durazno, con suficiencia y deficiencia de Fe no mostraron diferencias significativas en el grosor de hojas (Morales et al., 1998) o del mesófilo (Fernández et al., 2008), pero sí en la estructura interna. En hojas de limón mexicano (Citrus aurantifolia) con deficiencia de Fe, aumenta el grosor del mesófilo debido a un incremento en longitud y grosor de las células de parénquima en palizada y esponjoso, además de presentarse cambios a nivel celular y ultracelular (Maldonado-Torres et al., 2006).
La deficiencia de Fe afectó significativamente el tamaño de los cloroplastos de las dos líneas de frijol cuando la solución nutritiva estuvo carente de Fe, con respecto a los cloroplastos del tratamiento con 2 mg L-1 de Fe (Figura 2). El mayor efecto de la deficiencia de Fe ocurre en el tamaño de los cloroplastos y el contenido protéico de los mismos que en el número de células por unidad de área o el número de cloroplastos por célula. Aunque con deficiencia severa se inhibe la división celular y se reduce el crecimiento foliar (Terry y Abadía, 1986; Abadía et al., 2004).
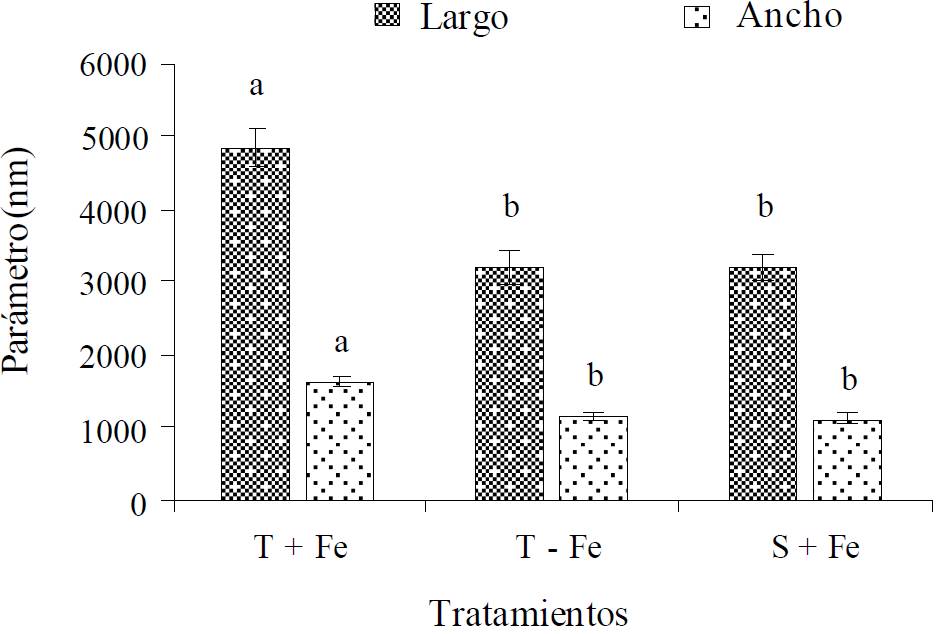
Figura 2 Largo y ancho de los cloroplastos de líneas de frijol tolerante (T) y susceptible (S) desarrolladas en solución nutritiva sin hierro (-Fe) y con 2 mg L-1 de hierro (+Fe). Los valores representan la media ± error estándar (n = 15). Letras iguales sobre las barras de cada parámetro son estadísticamente iguales (Tukey, P ≤ 0.05).
Lecturas SPAD y Capacidad Fotosintética
En el Cuadro 1 se muestran lecturas SPAD de hojas de líneas de frijol desarrolladas en soluciones con diferentes suministros de Fe y ajuste de pH. Los valores de las lecturas SPAD del genotipo tolerante fueron significativamente superiores (22.28) contra la susceptible (14.69). En ambas líneas las mayores lecturas SPAD se presentaron con un suministro de 2 mg L-1 de Fe en la solución y pH 6.0, mientras que, las más bajas sin suministro de Fe y con pH 8.5. Es conocido que la clorosis férrica puede ser causada por ausencia o suministro subóptimo de Fe (Abadía et al. 2004), o por condiciones de pH alcalino donde la disponibilidad de Fe es baja (Álvarez-Fernández et al., 2007).
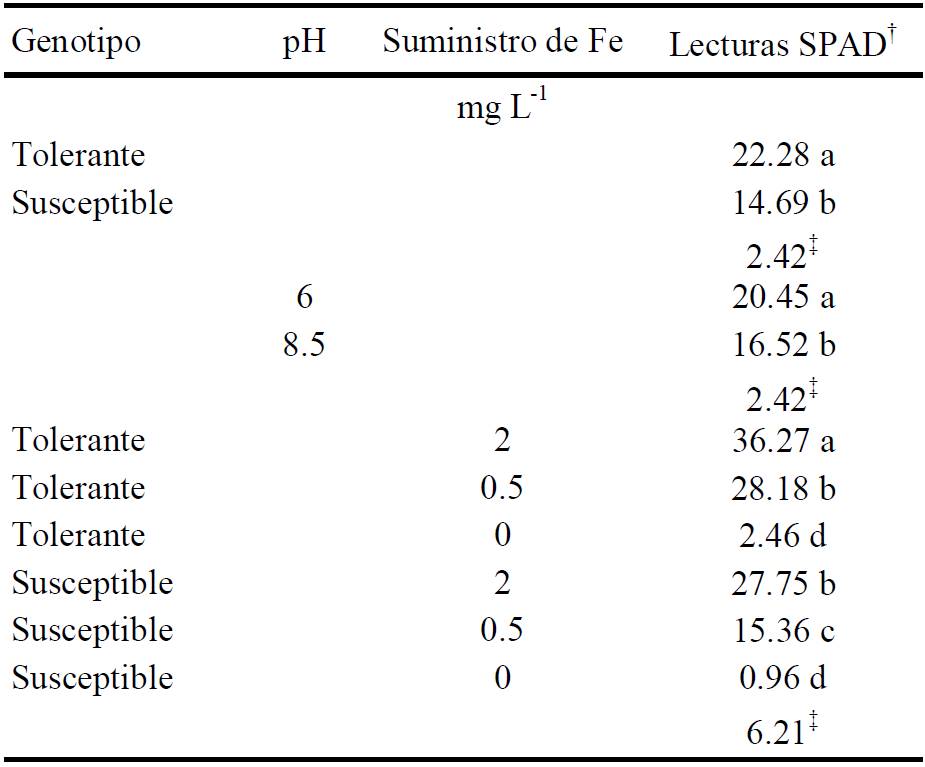
† Medias con la misma letra, dentro de la columna y factor, son estadísticamente iguales (Tukey, P ≤ 0.05). ‡ DMS = diferencia mínima significativa.
Cuadro 1 Efecto de la concentración de suministro de Fe y valor del pH en la solución nutritiva en las lecturas SPAD de hojas jóvenes de frijol provenientes del genotipo tolerante y susceptible a clorosis férrica.
La línea tolerante y susceptible presentaron las mayores lecturas SPAD (36.27 y 27.75, respectivamente) cuando desarrollaron en una solución nutritiva con un suministro de 2 mg L-1 de Fe y éstas, fueron estadísticamente iguales cuando la línea tolerante creció con 0.5 mg L-1 (28.18) de Fe y la susceptible con 2 mg L-1 de Fe (27.75). Estos resultados indican que la línea susceptible es menos eficaz en la utilización del Fe. Campbell y Nishio (2000) en plantas de remolacha susceptibles a deficiencia de Fe, también encontraron que la concentración de clorofila en la hoja disminuyó en mayor grado que en plantas tolerantes. Por otra parte, los síntomas de clorosis fueron muy pronunciados en ambas líneas y con las más bajas lecturas SPAD cuando no se suministró Fe, debido a que la deficiencia de Fe disminuye la concentración de pigmentos fotosintéticos (Ksouri et al., 2006). Aun cuando el Fe no forma parte de la molécula de clorofila, se considera esencial para su síntesis al formar parte de la protoclorofila (Abadía et al., 2004), por lo que, un inadecuado abastecimiento de Fe afecta de forma severa la biosíntesis y el mantenimiento de los niveles de clorofila. En hojas deficientes de Fe, declinan en el mismo grado los contenidos de clorofila y β-caroteno, mientras que ciertas xantofilas pueden aumentar (Morales et al., 1990). Este cambio en la composición de los pigmentos de los cloroplastos está probablemente relacionado con los cambios estructurales ya que la mayoría de las xantofilas están localizadas en la envoltura del cloroplasto y no en los tilacoides (Abadía et al., 2004). El descenso en la concentración de clorofila está también asociado con la disminución de proteínas, ya que ambas se unen mediante un enlace no covalente, para formar un complejo pigmento-proteínico que constituye la membrana de los tilacoides (Fodor et al., 1995).
El efecto de las concentraciones de Fe y pH de la solución nutritiva en la tasa fotosintética de hojas de frijol se muestra en la Figura 3. En los tratamientos con 0.5 y 2 mg L-1 de Fe, la asimilación de CO2 fue estadísticamente igual, pero significativamente mayor que en el tratamiento sin Fe. Las deficiencias extremas de Fe provocan reducción en el tamaño del follaje, en la capacidad de fijación y reducción de CO2 y disminución en la velocidad de transporte de electrones (Terry y Abadía, 1986). Römheld y Marschner (1991) indican que la falta de Fe en el follaje disminuye la estabilidad de la membrana de los tilacoides, acompañada de un decrecimiento en la cantidad de pigmentos, tales como clorofila a, b y carotenoides, así como una reducción en la actividad de los fotosistemas, generando un descenso significativo de la fotosíntesis neta. Una baja en la concentración de clorofila no sólo tiene repercusión en la capacidad fotosintética sino también en una mayor absorción de luz por la clorofila, la cual podría foto-inhibir procesos y foto-oxidar compuestos (Álvarez-Fernández et al., 2007).
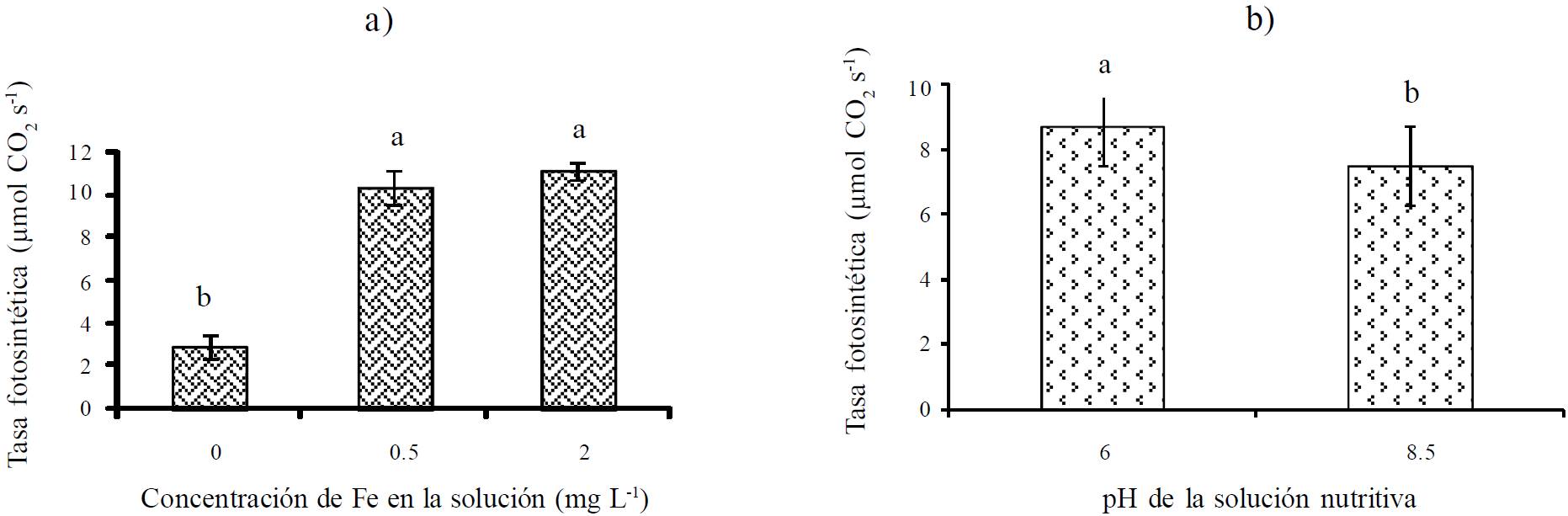
Figura 3 Efecto del nivel de suministro de Fe (a) y pH (b) de la solución nutritiva en la tasa fotosintética de hojas jóvenes de frijol. Los valores representan las medias ± error estándar (n = 9, 8 y 9 para 0, 0.5 y 2 mg L-1 de Fe, respectivamente; n = 12 y 14 para pH 6 y 8.5, respectivamente). Letras iguales sobre las barras son estadísticamente iguales (Tukey, P ≤ 0.05).
En las plantas que crecieron en solución nutritiva con pH 8.5 se observó una disminución significativa de la fijación de CO2 con respecto a las que crecieron en pH 6 (Figura 3b). En condiciones de pH alcalino, los cultivos presentan problemas de clorosis férrica, no por escasez de Fe total, sino debido a una deficiente disponibilidad de este elemento provocada por la disminución de su solubilidad, inhibiendo en la planta tanto su absorción como incorporación en los procesos metabólicos (Abadía et al., 2004). Por otra parte, la redistribución de Fe en la parte aérea puede ser fuertemente disminuida en suelos con altas concentraciones de HCO3 - debido a que estos aniones originan un incremento en el pH (6.2-7.0) del apoplasto de la hoja (Loeppert, 1986).
Las interacciones Fe por línea y Fe por pH en la fijación de CO2 en hojas jóvenes de frijol se presentan en el Cuadro 2. Los valores más altos de fotosíntesis en las dos líneas de frijol se obtuvieron cuando se agregaron 2 mg L-1 (10.62 μmol CO2 m-2 s-1) y 0.5 mg L-1 (12.33μmol CO2 m-2 s-1) de Fe en la solución nutritiva en la línea susceptible y tolerante, respectivamente, valores que fueron estadísticamente distintos entre líneas, lo cual es indicador de la diferencia entre éstas en la capacidad de utilización de Fe. Sin suministro de Fe, la fotosíntesis neta de ambas líneas se afectó severamente. Un estudio relacionado con el proceso de reverdecimiento de hojas severamente cloróticas mostró (Morales et al., 1990) que la actividad fotosintética tiene una fuerte interrelación con la concentración de clorofila debido a que la deficiencia de Fe de la hoja afecta principalmente la fisiología de los cloroplastos.
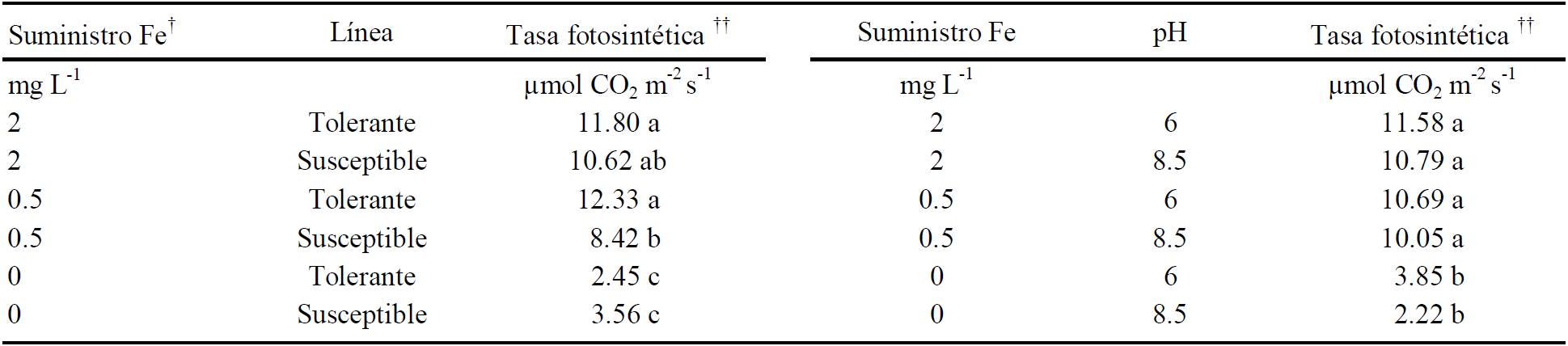
† Concentración de Fe (mg L-1) en la solución. ††Medias con la misma letra, dentro de las columnas, son estadísticamente iguales (Tukey, P ≤ 0.05).
Cuadro 2 Efecto del suministro de Fe, la línea de frijol y el pH de la solución sobre la tasa fotosintética.
El pH alcalino (8.5) no afectó la fotosíntesis neta de plantas que tuvieron Fe en el medio, de modo que estos datos fueron estadísticamente iguales a los de plantas desarrolladas con Fe y pH 6; sin embargo, sin suministro de Fe, la tasa fotosintética disminuyó significativamente, independiente del pH de la solución, lo cual era de esperarse pues aún con pH 6 no hubo Fe disponible.
Esto es lo que podría limitar la fotosíntesis y explicar, en parte, la menor tasa de fijación de CO2 por unidad de clorofila en hojas Fe-deficientes comparadas con hojas Fe-suficientes (Sharma y Sanwal, 1992). En general, algunos autores Röomheld y Marschner (1986), Abadía et al. (2004) y Jolley et al. (2004) e indican que la baja tasa fotosintética por la falta de Fe en la solución en ambas líneas de frijol, se puede atribuir a los bajos contenidos de almidón y azúcares, provocado por el deterioro del transporte fotosintético de electrones, al bajo contenido de clorofila y ferredoxina, y la baja regeneración de ferredoxina reducida. Adicionalmente, la lenta regeneración del bisfosfato de ribulosa, que actúa como sustrato para el CO2 en el ciclo de Calvin, contribuye al bajo contenido de carbohidratos.
Concentraciones Nutrimentales y Materia Seca
Concentraciones nutrimentales en hojas jóvenes de frijol por línea, nivel de suministro de Fe y pH se muestran en el Cuadro 3. La comparación de medias entre líneas muestra que el frijol tolerante tuvo mayor concentración de K, mientras que la susceptible mayor concentración de Ca, Cu y Zn. La mayor concentración de K puede atribuirse a que este elemento está involucrado en la función de dos enzimas asociadas con la actividad de respuesta al estrés por Fe, la ATPasa y la Fe+3-reductasa. Además con el simporte de H+ y con la acumulación de citrato para el transporte de Fe (Marschner et al., 1986) que presentan los fenotipos Fe-eficientes. Tagliavini y Rombolà (2001) hipotetizaron que la actividad y regulación de la ATPasa del plasmalema podría proveer niveles de pH apoplástico favorables y mejorar así la actividad Fe+3-reductasa.
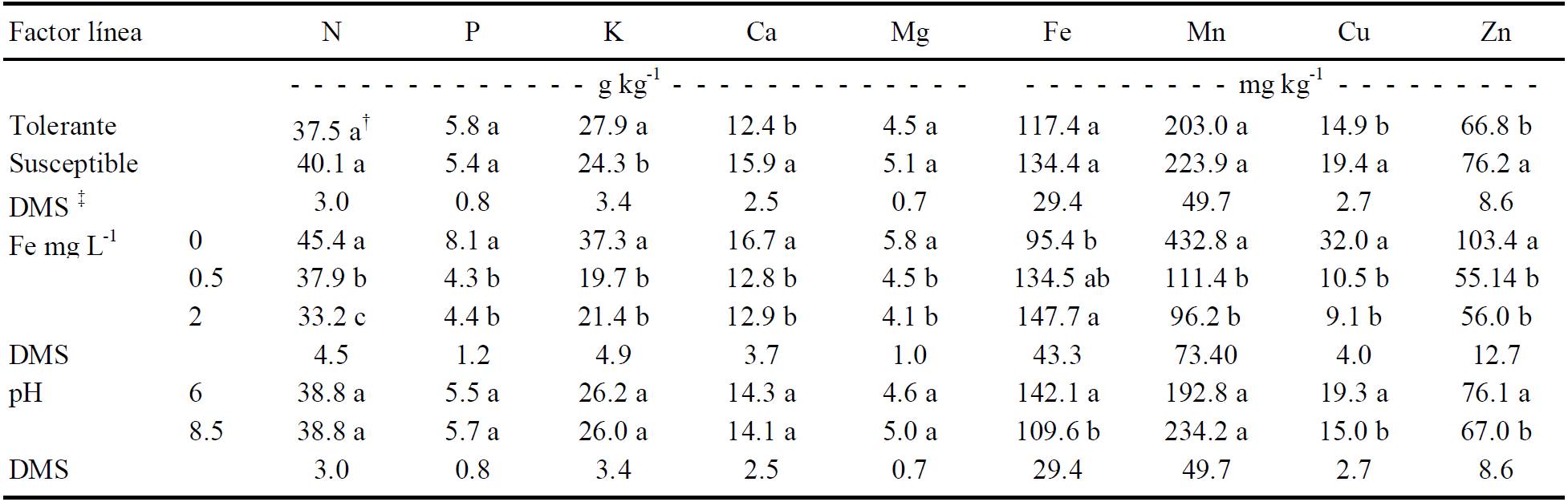
† Medias con la misma letra, dentro de la columna para cada factor, son estadísticamente iguales (Tukey, P ≤ 0.05). ¶ DMS: diferencia mínima significativa.
Cuadro 3 Efecto del genotipo de frijol, suministro de Fe y pH de la solución nutritiva en la concentración nutrimental en hojas jóvenes.
Shmidt (2003) y Álvarez-Fernández et al. (2007) mostraron que las hojas afectadas por clorosis férrica no modifican su concentración de Ca, sino más bien incrementan la absorción y acumulación de K. En cuanto a los micronutrimentos, se han listado interacciones importantes como un mecanismo de respuesta al estrés por Fe, especialmente la interacción con Zn (Jolley et al., 2004). Bajo deficiencia de Zn, una variedad de frijol (Phaseolus vulgaris) Zn-ineficiente activó dos de los tres mecanismos de respuesta al estrés por Fe e incrementó la absorción de Fe, acentuando más la deficiencia de Zn; mientras que la variedad Zn-eficiente minimizó la absorción de Fe, disminuyendo su actividad Fe+3-reductasa, para prevenir de esta manera un desbalance Zn/Fe (Jolley y Brown, 1991). Un comportamiento similar ocurrió en frijol deficiente en Fe, donde la concentración de Zn, Mn y Cu de la línea tolerante fue menor y estadísticamente diferente a la concentración de la línea susceptible. Sin embargo, en condiciones normales un exceso de Cu en tabaco provocó una severa clorosis férrica, debido a una distribución anormal de Fe, con tres veces más Fe en las raíces de plantas ricas en Cu que en plantas normales en Cu (Kobayashi et al., 2003).
La deficiencia de Fe extrema provocó significativamente mayores concentraciones de N, P, K, Ca, Mg, Mn, Cu y Zn, debido a una disminución importante de la biomasa. En los tratamientos con 0.5 y 2 me L-1 de Fe, la concentración de Fe foliar mostró un incremento conforme aumentó la concentración del mismo en la solución. La deficiencia de Fe estimula la acumulación de K (Shmidt, 2003; Maldonado-Torres et al., 2006), Mg (Álvarez-Fernández et al., 2007), Mn (Alam et al., 2001), Cu y Zn (Jolley et al., 2004) en hojas jóvenes, por su efecto catiónico. La mayor concentración de N en plantas que crecieron sin Fe pudo ser consecuencia de una menor producción de materia seca. La movilización y absorción de Mn puede incrementarse con la deficiencia de Fe en dicotiledóneas y monocotiledóneas no gramíneas usando la Estategia I (Alam et al., 2001).
Las concentraciones de N, P, K, Ca, Mg y Mn no fueron afectadas por el pH de la solución, en tanto que las concentraciones de Fe, Cu y Zn disminuyeron significativamente a pH 8.5, con respecto al pH 6. El pH de la solución nutritiva tuvo una función importante en la absorción de nutrimentos ya que afecta las reacciones de disociación, complejación y precipitación. Estas reacciones químicas impactan significativamente la especiación y disponibilidad de los metales (Steiner, 1984).
En el Cuadro 4 se muestra la interacción de líneas por Fe en la concentración de nutrimentos en las hojas. La adición de Fe a la solución no provocó diferencias significativas en la concentración de P, K, Mn, Cu y Zn en las dos líneas, pero cuando no se agregó Fe, la concentración de estos elementos se incrementó y fue significativamente diferente. Estos resultados coinciden parcialmente con otros estudios como el de Jolley et al. (2004), quienes encontraron en hojas cloróticas de Prunus persica mayor concentración de N, K, Ca, Mg y Mn que en hojas verdes. En otro experimento similar se obtuvieron incrementos de N, P, K y Mg, mientras que las concentraciones de Ca, Zn, Mn y Fe disminuyeron (Rombolá y Tagliavini, 2007). Por su parte, Abadía et al. (1989) no encontraron diferencias en los niveles de P, Mg, Na, Fe, Mn, Cu y Zn, en hojas de peral Fe-deficientes y normales. Por lo anterior, es claro que el efecto de la clorosis férrica en la composición mineral de las hojas difiere con la especie, el cultivar y las condiciones de desarrollo del cultivo (Morales et al., 1998).
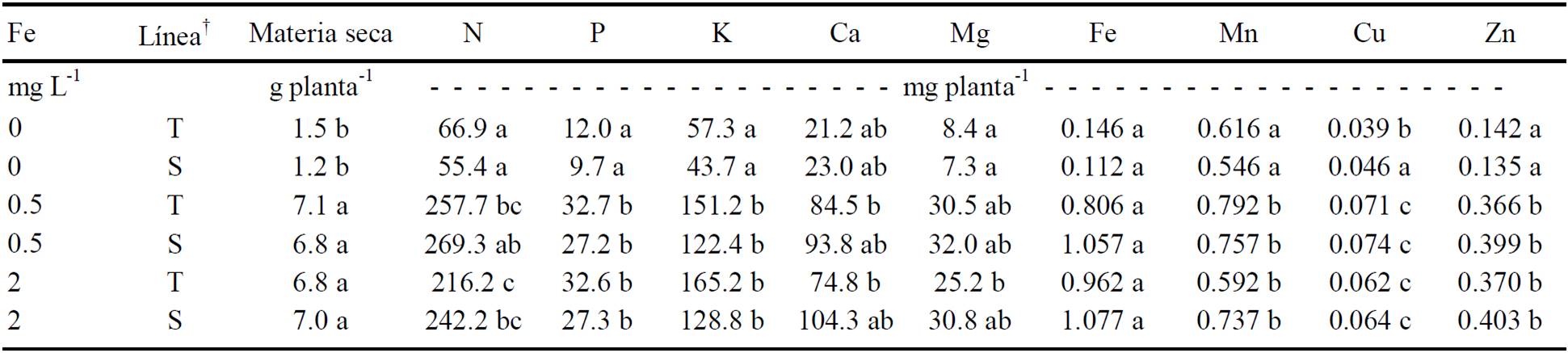
† T = tolerante; S = susceptible; †† Medias con la misma letra, dentro de la columna, son estadísticamente iguales (Tukey, P ≤ 0.05).
Cuadro 4 Efecto del genotipo de frijol y suministro de Fe en la acumulación de materia seca del vástago y contenido nutrimental en hojas jóvenes.
La acumulación de materia seca del vástago de ambas líneas (Cuadro 4) fue afectada significativamente cuando las plantas crecieron sin Fe, mientras que no hubo diferencia significativa entre líneas de frijol cuando éstas desarrollaron a la misma concentración de Fe (0, 0.5 o 2 mg L-1) en la solución. En promedio, la línea tolerante produjo 75.9% más materia seca y la susceptible 81.5%, cuando se les suministró 2 mg L-1 de Fe en la solución, respecto a la acumulación de estas mismas sin adición de Fe. En general, los parámetros de crecimiento están negativamente correlacionados con el grado de clorosis por Fe. En un estudio con plantas de Parietaria difusa desarrolladas en solución nutritiva carente de Fe, se presentaron síntomas de clorosis y disminución del crecimiento (Dell’Orto et al., 2003). En Trifolium sp. cultivado en suelo calcáreo, Wei et al. (1994) obtuvieron elevados coeficientes de correlación negativos entre el índice de clorosis y el peso de materia seca del brote, de la raíz, peso de la materia seca total y la relación peso seco de la raíz/peso seco de la parte aérea. Lo anterior debido a la participación del Fe en la síntesis de clorofila y en el funcionamiento de los sistemas captadores de energía luminosa, ligados con la fotosíntesis y la producción de materia seca.
Conclusiones
- El suministro de (hierro) Fe y el pH de la solución nutritiva provocaron respuestas morfológicas, fisiológicas y nutrimentales diferentes en las hojas de los genotipos o líneas de frijol tolerante y susceptible a clorosis férrica. En ausencia de Fe, las hojas de la línea tolerante presentaron un mesófilo más organizado, un parénquima más compactado, menos espacios intercelulares, aunque, escasa cantidad de cloroplastos y de menor tamaño respecto de las hojas verdes sin clorosis férrica. Por su parte, en las hojas cloróticas de la línea susceptible, el mesófilo se mostró desorganizado, con células de forma y tamaño irregular y con aparente ausencia de cloroplastos. En ambas líneas se observó escaso desarrollo de los tilacoides y ausencia de grana. En cualquier condición de los factores de suministro de Fe y pH del medio, la línea tolerante presentó concentraciones de clorofila más altas que la línea susceptible con excepción al nulo abastecimiento de Fe. El nivel de suministro de Fe de 2 mg L-1 en la solución nutritiva y el pH de 6 promovieron la mayor concentración de clorofila en ambas líneas, mientras que en ausencia de Fe y con pH 8.5 en el medio, se provocó el mayor grado de clorosis, evidenciado al presentar la lecturas SPAD más bajas.
- La tasa fotosintética fue función de la línea de frijol y del suministro de Fe pero no del pH del medio. La línea tolerante presentó mayor tasa fotosintética con menos suministro de Fe (12.33μmol CO2 m-2 s-1 y 0.5 mg L-1 de Fe) que la línea susceptible (10.62 μmol CO2 m-2 s-1 y 2.0 mg L-1 de Fe). En ambos casos la capacidad fotosintética fue severamente afectada en ausencia de Fe en la solución.
- La composición nutrimental foliar promedio en la línea tolerante, presentó significativamente mayor concentración de K en tanto que la susceptible mayor de Ca, Cu y Zn. La concentración de Fe en la hoja en ambas líneas se incrementó conforme aumentó el suministro de Fe y disminuyó a pH de 8.5, así como la de Cu y Zn.
- En el período evaluado, la producción de materia seca del vástago de ambas líneas de frijol fue afectada significativamente cuando las plantas desarrollaron en ausencia de Fe independientemente del pH en la solución nutritiva.











 nueva página del texto (beta)
nueva página del texto (beta)


