Introducción
La disponibilidad de hierro para los cultivos establecidos en suelos calcáreos es generalmente baja. Esto provoca deficiencia de hierro en las plantas y disminución de la producción y calidad de las cosechas. Cuando la deficiencia de hierro es muy severa se presenta un amarillamiento en las hojas conocido también como clorosis férrica. Una de las formas más eficaces de corregir dicha deficiencia es la aplicación del hierro en forma de quelato Fe-EDDHA (etilendiamino-di-(o- hidroxifenilacetato férrico) al suelo (Álvarez et al., 2005). Sin embargo, esta práctica se caracteriza por un alto costo (Lucena, 2009) y por tener implicaciones ambientales (Pestana et al., 2005). Adicionalmente, la efectividad del Fe-EDDHA puede ser limitada debido a su lixiviación a capas profundas del suelo, contiguas a los mantos de agua subterránea, lo cual podría imponer riesgos al ambiente y a la salud (Abadía et al., 2004). Aunque el Fe-EDDHA tiene el riesgo de lixiviarse, según Boxma y Groot (1971) éste presenta la más baja proporción de lixiviación en comparación con otros quelatos como el Fe-EDTA (etilendiaminotetracetato férrico) y Fe-DTPA (dietilentriaminopentacetato férrico). De la misma manera Lucena (2004) encontró que el Fe-EDDHA tiene un menor riesgo de lixiviación en comparación con el Fe-EDDHSA (etilendiamino-N, N’- di [(2-hidroxi-5-sulfofenilacetato férrico]). Un quelato es un compuesto químico en el cual una molécula orgánica rodea y se enlaza en varios puntos a un ion metálico, de manera que le protege de cualquier acción desde el exterior evitando su hidrólisis y su precipitación. Los quelatos, químicamente hablando, son por lo tanto, moléculas muy estables (Cadahía, 2005).
Desde 1930 se inició el uso de quelatos para corregir la deficiencia de hierro de los cítricos en países como Francia, Italia y España (Calderón, 1998). Esta práctica se ha intensificado en la actualidad, al grado de provocar la presencia de cantidades no usuales de hierro en las aguas subterráneas que son atribuidas al fenómeno de lixiviación de los quelatos. Liphadzi y Kirkham (2006) demostraron que no deben añadirse quelatos al suelo porque movilizan a los metales pesados, lixiviándose y contaminando las aguas subterráneas. En las zonas citrícolas del norte de México, donde predominan los suelos con características calcáreas, se ha demostrado la eficacia de la aplicación de hierro como quelato FeEDDHA para corregir la clorosis férrica de los cítricos (Rivera et al., 2007), por lo que la fertilización con quelatos de hierro podría aumentar en los próximos años para abastecer con hierro disponible a dichos árboles y otros cultivos.
La falta de respuesta de los cultivos a las aplicaciones de hierro en forma de sulfato ferroso y otras sales de hierro, ha ocasionado que se recurra a la utilización de los quelatos para prevenir y corregir la deficiencia de este elemento en muchos cultivos (Mortvedt, 1991). Los quelatos mas usados para corregir la deficiencia de hierro en suelos calcáreos son el EDDHA, EDTA y DTPA. Sin embargo, estos dos últimos no son eficaces debido a que, aunque quelatan al Fe3+, se unen también fuertemente al Ca2+, con lo cual se limita significativamente la formación de quelatos Fe-EDTA y Fe-DTPA y su asimilación por las plantas a pH mayores que 7 (Norvell, 1983). Debido a su carga negativa los quelatos de hierro son fácilmente lixiviados fuera de la zona de raíces, por lo que presentan riesgo de contaminación de aguas subterráneas con componentes orgánicos y metales, sobre todo cuando se aplican frecuentemente al suelo (Yehuda et al., 2003).
El movimiento de los iones poco afectados por la adsorción, se da preferentemente siguiendo el flujo de agua en el suelo (nitrato, cloruro y, en la mayor parte de los suelos, también sulfatos). Estos iones lógicamente tienden a descender con el agua de drenaje por gravedad y a ascender por la evapotranspiración. El movimiento descendente del hierro aplicado en forma de quelatos al suelo puede ocurrir de manera semejante ya que estas sustancias tienen un comportamiento similar al de dichos aniones. Según Siebner et al. (2004), tanto el ligando EDDHA como la forma férrica Fe-EDDHA llevan una carga negativa (-1), bajo las condiciones que prevalecen en suelos calcáreos. Esto los hace relativamente móviles en los suelos a través del flujo de masas. La presente investigación se realizó con el objetivo de medir la movilidad del Fe-EDDHA a través del suelo en sentido descendente, cuando el elemento así quelatado es aplicado a los suelos calcáreos de la zona centro del estado de Tamaulipas, México, para corregir la deficiencia de hierro en los cultivos.
Materiales y métodos
La presente investigación se llevó a cabo utilizando dos tipos de suelo agrícola: calcáreo y no calcáreo, ubicados en el municipio de Victoria, en la zona centro del estado de Tamaulipas, México. Los sitios experimentales se seleccionaron con base en los resultados de pruebas químicas del suelo como pH (Richards, 1973), conductividad eléctrica (Richards, 1973), contenido de carbonatos (Allison y Moodie, 1965), hierro extractable con DTPA (Lindsay y Norvell, 1978) y textura (Bouyoucos, 1951), siguiendo los procedimientos de la Norma Oficial Mexicana, NOM-021-SEMARNAT-2000 (Secretaría de Medio Ambiente y Recursos Naturales, 2003).
Las características del suelo calcáreo que corresponden a un Leptosol réndzico, son: textura migajón arcilloso, pH medianamente alcalino de 8.2, concentración muy alta de carbonatos de calcio (40.5%), contenido deficiente de hierro extraíble DTPA (1.24 mg kg-1) y baja conductividad eléctrica (0.15 mS cm-1). El suelo no calcáreo es un Luvisol vértico de color pardo en la capa superficial, que indica alto contenido de óxidos de hierro; presenta textura arcilla limosa, pH ligeramente ácido (6.5), concentración baja de carbonatos de calcio (8.8%), alto contenido de hierro extraíble DTPA (21.0 mg kg-1) y baja conductividad eléctrica (1.14 mS cm-1). La cantidad de Fe-DTPA encontrada en el suelo no calcáreo supera casi cuatro veces el nivel crítico de hierro en el suelo (4.5 mg kg-1) para los cultivos comunes según Lindsay y Norvell (1978).
Metodología General
Se colectó suelo de la capa arable en ambos sitios para ser llevado al laboratorio donde se realizó el experimento. La muestra de suelo colectado se secó a temperatura ambiente sobre papel de estraza y con la finalidad de homogeneizar el tamaño de los agregados se trituró con mortero de porcelana y se tamizó en malla de 10 mm. Una vez preparado el suelo, se colocó en tubos de policloruro de vinilo (PVC) de 5.08 cm de diámetro formando columnas de 10, 20 y 30 cm de altura para simular tres profundidades del suelo a través de las cuales se lixiviaría el hierro añadido sobre la superficie. No se consideró necesario utilizar columnas de suelo sin disturbar, debido a que la investigación pretende estudiar la movilidad del hierro quelatado en función de las características calcáreas del suelo tales como pH y contenido de caliza, manteniendo constante la condición física del mismo.
Se estudiaron también dos fuentes de hierro, Fe-EDDHA y FeSO4, las cuales se aplicaron en soluciones de 100 mg Fe L-1. Ambas fuentes de hierro se compararon con agua desionizada aplicada de la misma manera. Estas tres soluciones se adicionaron por goteo sobre las columnas de suelo mediante un dispositivo dosificador construido como se describe a continuación: se utilizó un recipiente de 20 L de capacidad para contener la soluciones de hierro, 18 tubos de 0.5 cm de diámetro con dosificadores de goteo conectados al recipiente, 18 tubos de PVC de 5.04 cm de diámetro llenos con los suelos estudiados para formar las columnas y 18 vasos de polietileno de 300 mL para recibir el lixiviado (Figura 1). Los tubos de PVC se colocaron en forma vertical, cada uno por encima de un vaso, alrededor de un cilindro de 46 cm de diámetro que sirvió como soporte de las columnas. Se dejó un espacio de 5 cm de altura sin suelo en la parte superior de cada tubo de PVC para contener la solución que se pudiera acumular encima de la superficie durante el goteo. El recipiente, utilizado como depósito de las soluciones de hierro, se colocó a una altura de 66 cm por arriba de la superficie de las columnas.
Lixiviación del Hierro Aplicado
Para medir la cantidad de hierro lixiviado se aplicaron por goteo 10 L de cada una de las soluciones de Fe-EDDHA y FeSO4 (100 mg Fe L-1); así mismo se adicionó agua desionizada sobre la superficie del suelo en cada columna. Se procedió primeramente a aplicar la solución de Fe-EDDHA ajustando el flujo a 8 gotas por minuto. Bajo cada columna se colocaron recipientes para recibir la solución filtrada por periodos de 12 h, durante 48 h, a fin de medir la concentración de hierro lixiviado en cada lapso. Terminado este proceso se lavó el sistema de goteo (recipiente, tubos dosificadores y columnas de PVC) con agua desionizada hasta quedar libre de residuos de Fe-EDDHA. A continuación se llevó a cabo la adición de la solución de FeSO4 y del agua a nuevas columnas de suelo, de la misma manera.
Hierro Extraíble del Suelo
Después de la aplicación del goteo de las soluciones férricas y agua desionizada durante 48 h sobre las columnas, se tomaron muestras de suelo de la columna de 30 cm de altura. Para ello se extrajeron secciones de suelo de 1cm de espesor a 1,10, 20 y 30 cm de profundidad, tanto de las columnas adicionadas con Fe-EDDHA como de las añadidas con FeSO4 y agua desionizada. Estas secciones se secaron a temperatura ambiente, se trituraron y tamizaron en malla de 2 mm para posteriormente medir el contenido de hierro en el suelo por extracción del elemento con solución de DTPA (Lindsay y Norvell, 1978). La cuantificación del hierro extraído se realizó por medio de un espectrofotómetro de absorción atómica.
Análisis Estadístico
El análisis estadístico de los datos del hierro presente en los lixiviados y del contenido de hierro extraíble con DTPA en las diversas capas del suelo tratado, se llevó a cabo mediante el análisis de varianza en arreglos factoriales de un diseño completamente al azar con tres repeticiones, a fin de comparar los suelos estudiados, las soluciones aplicadas por goteo, las profundidades del suelo y las interacciones de estos factores. En el análisis estadístico se incluyó también la prueba de Tukey.
Resultados y discusión
Lixiviación del Hierro Aplicado
En la Figura 2 se presenta la concentración de hierro encontrada en los filtrados de las columnas de suelo de 10, 20 y 30 cm de altura, después de dos periodos de goteo de 12 h, al inicio y al final de un tiempo total de 48 h de aplicación de las soluciones de Fe-EDDHA. No ocurrió lixiviación con FeSO4 y agua desionizada. Cuando se agregó Fe-EDDHA la concentración de hierro fue alta (32 mg Fe L-1) en el filtrado de la columna de 10 cm de altura del suelo calcáreo después 12 h de goteo, mientras que en las columnas de 20 y 30 cm la concentración del filtrado disminuyó hasta 0.3 mg Fe L-1. Durante las últimas 12 h de goteo, después de 36 h del inicio, la cantidad de hierro lixiviado fue igualmente alta en las columnas de 10, 20 y 30 cm de espesor, pues se encontró una concentración de más de 75 mg Fe L-1 en todos los lixiviados. Esto significa que después de 48 h de aplicación de la solución de hierro quelatado sobre el suelo, la movilidad del hierro fue alta independiente del tamaño de columna de suelo calcáreo, dentro del rango de 10 a 30 cm (Siebner et al., 2004). En el suelo no calcáreo la movilidad del Fe-EDDHA se incrementó más del doble durante las primeras12 h de goteo en comparación con el suelo calcáreo pero después de 48 h de goteo, la cantidad de hierro lixiviado fue alta en ambos suelos.
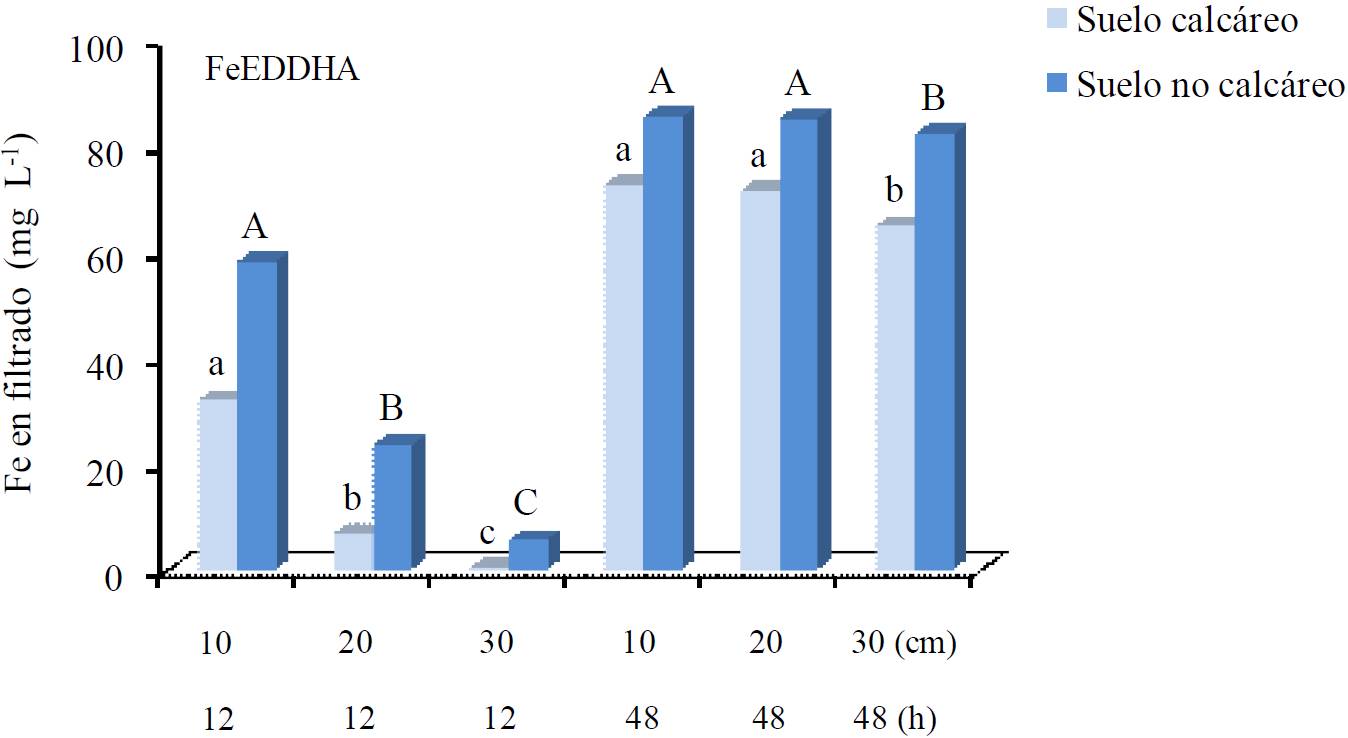
Figura 2 Concentración de Fe en los filtrados colectados durante 12 h al inicio y 12 h al final de un tiempo total de 48 h de goteo de agua y soluciones 100 mg Fe L-1 de Fe-EDDHA y FeSO4 , sobre la superficie columnas de suelos calcáreo y no calcáreo.
Cuando el hierro se aplicó a las columnas de suelo en forma de FeSO4, no se encontró el elemento en ninguno de los filtrados, lo que significa que el hierro aplicado bajo la forma de dicha sal no tuvo movilidad en el agua de filtración, debido a que al entrar en contacto con el suelo el metal fue precipitado, quedando depositado en la superficie de ambos suelos. La nula lixiviación de este hierro no quelatado en el suelo calcáreo se explica por el pH elevado y a la presencia de CaCO3 y HCO3 -, condiciones que disminuyen la solubilidad del hierro (Dell’Orto et al., 2003) debido a reacciones de precipitación del metal en forma de hidróxido férrico, causadas a su vez por la elevada concentración de iones OH-, propia de estos suelos (Lindsay, 1983). De acuerdo con Acevedo et al. (2004) bajo la condición de alcalinidad que se tiene en el suelo calcáreo estudiado, el hierro agregado en la solución de goteo comenzó a precipitarse inmediatamente hasta formarse hidróxido férrico cristalino. Cuando se aplicó agua desionizada a las columnas de suelo no se encontró hierro en los filtrados, lo que significa que el agua por sí sola no lixivió al hierro nativo en ninguno de los suelos estudiados.
Lo anterior significa que el hierro aplicado como Fe-EDDHA tuvo alta movilidad en el agua filtrada a través de ambos suelos y que al aumentar el tiempo de aplicación de las soluciones de hierro quelatado, aun en el suelo calcáreo, se incrementó la profundidad de lixiviación del elemento. Esto sugiere también que aplicaciones prolongadas o frecuentes del quelato tanto a suelos calcáreos como no calcáreos aumentarían el riesgo de contaminación del subsuelo y del agua subterránea con hierro y otros metales (Abadía et al., 2004). Lo mismo ocurriría con la aplicación de riegos pesados o con la ocurrencia de lluvias intensas sobre suelos fertilizados con el hierro quelatado. Como se ha mencionado, la alta movilidad del hierro aplicado como Fe-EDDHA se debe a que los quelatos son compuestos cargados negativamente y por lo tanto más expuestos a la lixiviación (Yehuda et al., 2003).
Hierro Extraíble del Suelo
En el Cuadro 1 se muestran las cantidades de hierro extraído con DTPA (Lindsay y Norvell, 1978) encontradas en el suelo a 1, 10, 20 y 30 cm de profundidad, después de 48 h de aplicar por goteo, agua y soluciones de 100 mg Fe L-1 en forma de Fe-EDDHA y FeSO4. En las columnas de suelo tratadas con Fe-EDDHA se encontraron cantidades elevadas de hierro en ambos sitios y en todas las capas mencionadas, aunque al comparar los suelos se observó que la concentración del metal fue significativamente menor en el suelo calcáreo. Estos resultados indican que la movilidad del hierro en sentido descendente fue elevada cuando el elemento se aplicó acompañado del quelato, aun en las condiciones alcalinas del suelo calcáreo. La movilidad del hierro se debió a la carga negativa del quelato que le permitió lixiviarse sin ser retenido por la carga negativa de los coloides del suelo (Domínguez, 1989). Esta capacidad del hierro quelatado de moverse libremente a través del suelo hace suponer que al aplicar Fe-EDDHA para corregir la deficiencia de hierro en los cultivos se tendría el peligro de que el metal asociado al quelato pudiera llagar hasta los mantos acuíferos (Yehuda et al., 2003). Por lo anterior se deduce que la aplicación recurrente de hierro en forma de Fe-EDDHA, como una práctica de fertilización de los cultivos en suelos calcáreos, podría provocar la lixiviación del micronutriente quelatado y quizás provocar contaminación del agua subterránea (Siebner et al., 2004). Este efecto sería aun mayor en el suelo no calcáreo.

La concentración de las soluciones de Fe-EDDHA y FeSO4 aplicadas fue 100 mg Fe L-1. Se utilizan letras minúsculas para comparar profundidades del suelo y mayúsculas para comparar los suelos.
Cuadro 1 Concentración de hierro en el suelo a varias profundidades, después de 48 horas de aplicación del elemento por goteo sobre la superficie.
Cuando el hierro se aplicó al suelo calcáreo en forma de sulfato ferroso la movilidad del metal fue mínima, ya que la concentración de hierro extraído fue alta solamente en el primer cm de profundidad donde se acumuló, mientras que en el resto de las capas se encontró una concentración casi igual que el contenido natural del suelo. En el sitio no calcáreo ocurrió una situación muy semejante pues la concentración de hierro extraído fue alta (350 mg Fe kg-1) a 1 cm de profundidad pero después de esta capa la concentración de hierro fue casi igual que el contenido natural del terreno, 21 mg Fe kg-1. Tales resultados demuestran que en ambos suelos la movilidad del hierro aplicado en forma de sulfato ferroso fue casi nula. El escaso movimiento del hierro en el suelo calcáreo se debió al pH elevado y a la presencia de CaCO3 y HCO3 - condiciones que disminuyen la solubilidad del hierro (Dell’Orto et al., 2003) provocando su precipitación en la superficie del suelo (Cadahía, 2005) y limitando su movimiento descendente.
El agua desionizada aplicada por goteo durante 48 h sobre la superficie, no alteró la cantidad de hierro extraíble con DTPA en el suelo calcáreo tal como se esperaba, dado que los minerales de hierro de estos suelos tienen muy baja solubilidad debido a las condiciones de alcalinidad (Dell’Orto et al., 2003); en este suelo el pH fue de 7.8, medianamente alcalino y el contenido de CaCO3 50.5%, elevado. Por el contrario en el suelo no calcáreo, con un contenido muy alto de hierro (21.0 mg Fe-DTPA L-1) que indica la presencia de cantidades elevadas de minerales de hierro de mayor solubilidad, la concentración del elemento extraíble con DTPA aumentó mas de 50% debido a la aplicación del agua que provocó en el suelo condiciones de saturación. Este incremento se debió quizá a la acidez del agua desionizada que presentaba un pH de 5.6 (medianamente ácido) y al pH ligeramente ácido del propio suelo (6.5) lo cual habría provocado mayor disolución de algunos minerales férricos del suelo (Lindsay, 1983). Lo anterior estuvo asociado también al bajo contenido de CaCO3 que implica un bajo poder amortiguador del suelo. El aumento del contenido de hierro extraíble en el suelo no calcáreo por la aplicación de agua quizás se podría explicar también por la disolución de algo del hierro nativo, provocada por reacciones redox que tienen lugar en los suelos cuando éstos se someten a condiciones de saturación de agua, causando reducción del Fe3+ a Fe2+ (Ponnamperuma, 1972). Según Lucas y Knezek (1983) un exceso de humedecimiento de los suelos no calcáreos incrementa la concentración de hierro Fe2+. Por lo anterior, se cree que el pH ligeramente ácido del suelo no calcáreo en combinación con la condición inducida de saturación de agua durante 48 h propició una reducción y mayor solubilidad del hierro nativo, lo cual explicaría el aumento de hierro extraíble con DTPA en este suelo a pesar de que el elemento no fue adicionado en el agua de goteo (Mortvedt, 1986).
Como resultado de la alta movilidad del hierro en sentido descendente cuando se aplicó como Fe-EDDHA al suelo para corregir la deficiencia de hierro en las plantas cultivadas, se asume que el elemento así quelatado puede perderse de la capa arable y quedar fuera del alcance de as raíces, lo que implicaría la necesidad de repetidas aplicaciones del elemento durante el ciclo del cultivo y por lo tanto el riesgo de contaminar el agua freática.
Conclusiones
El hierro aplicado en solución en forma de Fe-EDDHA sobre la superficie de suelos calcáreo y no calcáreo, presentó alta lixiviación en ambos suelos a través de una capa de 30 cm de espesor, pero el movimiento descendente del hierro quelatado fue aun mayor en el suelo no calcáreo. Cuando el elemento se adicionó como FeSO4 no tuvo lixiviación en ninguno de los suelos.











 nueva página del texto (beta)
nueva página del texto (beta)



