INTRODUCCIÓN
En el proceso de producción agrícola, una serie de pequeños cambios imperceptibles y acumulativos a escala local están ocasionando problemas ambientales globales, los cuales se reflejan en mayor degradación del suelo, pérdidas de la biota, emisiones de gases de invernadero, escasez de agua, elevado flujo de nutrimentos, entre otros. Esta situación reduce la aptitud de los agroecosistemas para resistir periodos inesperados de estrés, además de perder su capacidad para la producción de satisfactores para la sociedad. En la zona centro del estado de Veracruz se ha dado un cambio de uso del suelo dinámico y consistente de plantaciones de mango (Mangifera indica L.) a caña de azúcar (Saccharum officinarum L.) en los últimos 10 años; es decir, se pasó de una agricultura de bajo o nulo uso de agroquímicos como la practicada en huertas de mango a una de altos niveles de insumos sintéticos con el cultivo de caña de azúcar, con impactos negativos posiblemente en la calidad del suelo. Diversos estudios indican que la mayoría de los productores desconocen el impacto de las prácticas agrícolas sobre el ambiente y particularmente sobre la macrofauna edáfica (Paoletti et al., 1991, Birang, 2003).
En años recientes ha existido una renovada atención científica de evaluar bioindicadores de calidad del suelo debido a las preocupaciones con la degradación del suelo y la necesidad de una gestión sostenible de los suelos (Shukla, Lal y Ebinger, 2006; Barrios, 2007). Estas investigaciones han evaluado la relación entre el uso del suelo y la macrofauna edáfica (Barros et al., 2002; Eggleton et al., 2005; Mathieu et al., 2005); factores que permiten un balance dinámico ecológico y por consiguiente un desarrollo sustentable.
Los estudios de macrofauna se utilizan como bioindicadores de la calidad del suelo para determinar el grado de recuperación o degradación del mismo (Mummey et al., 2002; Dinesh et al., 2003) ya que Representan comunidades biológicas funcionales, donde participan detritívoros, descomponedores y depredadores las cuales en poblaciones dinámicamente estables favorecen cambios en las propiedades físicas y químicas del suelo. Por consiguiente, el uso y manejo sustentable del suelo puede mejorar o alterar la abundancia y riqueza de la biota en el suelo.
Gardi et al. (2002) indicaron que cuando se cambia el uso del suelo se alteran los procesos edáficos, afectando negativamente la macrofauna asociada y sus funciones esenciales. Estudios sobre macrofauna edáfica, mostraron que las termitas se asocian con el ciclo del carbono y con el nivel de la fertilidad del suelo (Jones, 1990); que las lombrices, miriápodos y otros invertebrados son sensibles a efectos tóxicos de químicos agrícolas (Paoleti et al. 1991) y que las lombrices mejoran la estructura y porosidad del suelo agrícola y reducen pérdidas de nitrógeno (Subler et al. 1998). Las hormigas, ácaros, ciempiés y arañas representan a los organismos depredadores y su función en los ecosistemas ha sido principalmente para mantener o restaurar la calidad del suelo y como bioindicadores para establecer el nivel de sustentabilidad del suelo (Lobry de Bruyn, 1999).
En el caso de la caña de azúcar se ha reportado que los invertebrados del suelo son importantes; en cuanto a biomasa (las lombrices de tierra predominan en 82%) y frecuencia (las hormigas representan 52%). Además, se ha encontrado cerca de 3000 individuos m2, mientras que en los otros fue de 1600 individuos m2 (Brown et al., 2001). Por otra parte, los insectos Diplopoda (milpiés) y Chilopoda (ciénpies) estuvieron presentes en 5% en suelo sembrado con maíz y de 10 a 30% en suelo agroforestal. Los tipos de suelo también pueden determinar la diversidad local de la macrofauna edáfica (Mathieu et al. 2005). Sin embargo, no se han llevado a cabo estudios de calidad y manejo del suelo en términos de macrofauna edáfica en donde se comparen agroecosistemas de mango y caña de azúcar (reciente y persistente).
El objetivo de la presente investigación fue conocer el efecto del cambio de uso de suelo (mango contra caña de azúcar) sobre la calidad del suelo en términos de la macrofauna edáfica, bajo el supuesto de que la abundancia de artrópodos es mayor en mango que en caña de azúcar por el manejo agronómico a que está sometido cada uno y al nivel en el uso de agroquímicos.
MATERIALES Y MÉTODOS
Descripción del Área de Estudio
La investigación se realizó en la Región Golfo Centro de Veracruz, México en los ejidos: El Cocuyo, Cerro Guzmán, Tierra Colorada, Plan de Manantial, Puente Jula, Faisán y la Víbora pertenecientes al municipio de Paso de Ovejas; los cuales se localizan entre las coordenadas 96° 19’ a 96° 35’ O y 19° 10’ a 19° 22’ N (Cuadro 1), a una altitud de 20 a 40 m. Esta área corresponde al Distrito de Desarrollo Rural La Antigua (DDR 036), bajo condiciones de riego. Además, está circunscrita en área de abasto de los ingenios cañeros El Modelo y La Gloria, los cuales cubren una superficie aproximada de 11 000 y 12 600 ha, respectivamente (Ascanio y Hernández, 2006). La región presenta un clima Aw2, cálido subhúmedo con lluvias en verano; con una precipitación media anual de 1271 mm, en los meses de junio a octubre y una temperatura media anual de 25.3 °C, de acuerdo con la clasificación de Köppen, modificada por García (1973). La vegetación característica es selva baja caducifolia en la zona de lomeríos y selva mediana perennifolia en tierras bajas. Los suelos en los sitios del presente estudio corresponden al tipo Fluvisol (Ascanio y Hernández, 2006; Domínguez y Aguilar, 1999).
Agroecosistemas Estudiados
Caña de azúcar. Se seleccionaron diez plantaciones de caña, en donde existieron previamente plantaciones de mango. Cinco plantaciones donde la plantación de mango había sido sustituida por caña hace seis años (caña reciente, CR) y otras cinco donde se había sustituido hace 20 años (caña persistente, CP). Esto implicó la tala de los árboles de mango, remoción de los troncos y quema de los restos de ramas y hojarasca. La parte basal del tronco y raíces se dejan en la parcela hasta que se descompongan con el tiempo o este seca para quemarse. A partir de ahí se hizo la preparación del suelo y la siembra de caña (variedades Mex 68-P-23 o Q-96).
Manejo agronómico del cultivo. El manejo en la zona implicó un paso de subsuelo, arado y fertilización con una dosis 254, 85 y 40 kg ha-1 de N, P y K, respectivamente. Además, se aplicó de dos a seis riegos por gravedad. Se dieron de dos a tres aplicaciones de herbicidas (ametrinas, atrazinas y triazinas) a razón de 6 l ha-1 y plaguicidas a base de Carbofuran para control de barrenadores y salivazo. El rendimiento promedio de caña es de 100.1 Mg ha-1. Las plantaciones se cosechan entre enero a marzo, previa quema y se corta en forma manual. Posteriormente, se hace una segunda quema para eliminar los rastrojos.
Mango. Se seleccionaron cinco plantaciones de mango (M) entre 20 a 25 años de edad, variedad manila.
Manejo agronómico del cultivo. Las malezas se controlan con dos pasos de rastra o con pastoreo de animales. No se utilizan herbicidas ni plaguicidas.
El periodo de cosecha ocurre en los meses de mayo a junio. El rendimiento promedio es de 6 Mg ha-1.
La selección de las parcelas de caña se realizó mediante el padrón de la Asociación de usuarios COANALAG (Concesionaria de Aguas Nacionales para la Agricultura y Ganadería), Módulo de riego La Antigua A. C. Se seleccionaron un total de 15 sitios de muestreo; cinco por tipo de agroecosistema mango (M), caña reciente (CR) y caña persistente (CP). Los criterios de selección adicionales fueron: parcelas con una superficie mayor a 2 ha; que las parcelas de M y CR estuvieran contiguas y que las de CR tuvieran no más de seis años de cambio de uso de suelo de mango a caña y las de CP donde el cambio de uso de suelo de mango a caña, hubiera ocurrido hace más de 20 años.
Determinaciones Físicas y Químicas del Suelo
Para determinar las propiedades físicas y químicas del suelo se tomaron 60 muestras compuestas de suelo (en cinco sitios, tres agroecosistemas y cuatro épocas de muestreo a dos profundidades de 00 - 0.15 m y 0.15 - 0.30 m. Se realizó un sólo muestreo en los meses de octubre, noviembre de 2005 y enero, marzo, mayo y agosto de 2006. En el laboratorio se analizaron las siguientes propiedades físicas: textura y sus componentes arena, limo y arcilla (método de Bouyoucos) y densidad aparente (método terrón parafinado). Las propiedades químicas determinadas fueron: pH (método electrométrico relación suelo agua 1:2), materia orgánica (método de Walkley y Black) y conductividad eléctrica (método acetato de amonio). Para hacer estas determinaciones se emplearon métodos oficiales, de acuerdo a la normativa mexicana NOM-021-RECNAT-2000 (SEMARNAT, 2000).
Muestreo de la Macrofauna
Para cuantificar la variación temporal de la macrofauna en cada agroecosistema, se tomaron muestras de cuatro repeticiones por parcela, en seis fechas (octubre y noviembre 2005; enero, marzo, mayo y agosto, 2006), lo cual generó un total de 360 sitios muestreados. Se obtuvieron monolitos de 20 × 20 × 20 cm de largo ancho y profundidad, respectivamente (Anderson e Ingram, 1993). El suelo se depositó en bolsas de plástico para llevarse al laboratorio, y revisar minuciosamente y extraer con pinzas entomológicas los diversos organismos de más de 1 mm de tamaño presentes en cada capa de suelo. Una vez obtenidos los organismos estos fueron contados e identificados taxonómicamente hasta orden.
El método de registro de la macrofauna fue por observación directa (Williams, 1987). Los organismos endogeicos (son los que viven bajo el suelo) fueron muestreados a dos profundidades (00-0.10 m y 0.10-0.20 m). Los organismos epigeicos (los que viven sobre la superficie del suelo) se colectaron de la hojarasca, y los anécicos (los que viven en la interfase hojarasca y la superficie del suelo) después de haber removido la hojarasca. Sólo algunos organismos colectados fueron preservados en alcohol para su posterior identificación taxonómica. En mango, las muestras se tomaron en el área de sombreo de los árboles; mientras que en caña, dos muestras se ubicaron arriba del surco y dos en el entresurco. El muestreo se realizó en días soleados. La macrofauna se clasificó en grupos de invertebrados con base a sus características taxonómicas.
Análisis Estadísticos
Para el análisis de datos del suelo, se aplicó análisis de varianza completamente al azar, con tres agroecosistemas como tratamientos y cinco cultivos como repeticiones. Para definir las diferencias se empleó la prueba de medias (Tukey, P < 0.05).
Con los registros numéricos de la macrofauna cuantificada, se determinó: riqueza, abundancia, índice de diversidad de Simpson y de Shannon - Wiener (Begon et al. 1987; Williams, 1987). La riqueza fue calculada con el número de las diferentes especies encontradas para cada periodo de muestreo y agroecosistema. A los datos se les realizó prueba de distribución normal, debido a que la abundancia de la macrofauna mostró eventos poco probables de ocurrir, una varianza superior al promedio y los datos no mostraron una distribución normal. Por lo anterior, para su análisis, los datos se transformaron al componente de raíz cuadrada. Asimismo, como la mayoría de los datos fueron menores a 10, en el componente de transformación se aplicó la raíz cuadrada de × + 0.5 y arcoseno (Little y Hills, 1979).
Los efectos del cambio de uso del suelo y periodos de muestreo sobre la macrofauna, se analizaron mediante análisis de varianza completamente al azar, usando el modelo lineal. Para definir las diferencias se empleó la prueba de medias (Tukey P < 0.05). Además, se empleó el análisis multivariado para componentes principales (Everitt, 2005), mediante una matriz de datos con 24 variables dependientes. Estas variables fueron estandarizadas antes de realizar el análisis multivariado. Para estos análisis se utilizó el programa Statistica Ver. 7.1.
RESULTADOS Y DISCUSIÓN
Características de los Suelos
Los suelos estudiados (Cuadro 2), tuvieron textura franca y se diferenciaron principalmente en el contenido de material orgánica. La cercanía entre las unidades de estudio permiten suponer su uniformidad en las características físicas y químicas de suelo, ya que no existieron diferencias significativas entre las cuatro épocas de muestreo y los tres agroecosistemas; excepto que existió similar promedio de materia orgánica entre caña reciente y caña persistente; sin embargo mango presentó 1% más que caña; lo cual se explica por el aporte de la hojarasca principalmente.
Cuadro 2 Características físicas y químicas de los suelos en los agroecosistemas caña y mango (n = 60).
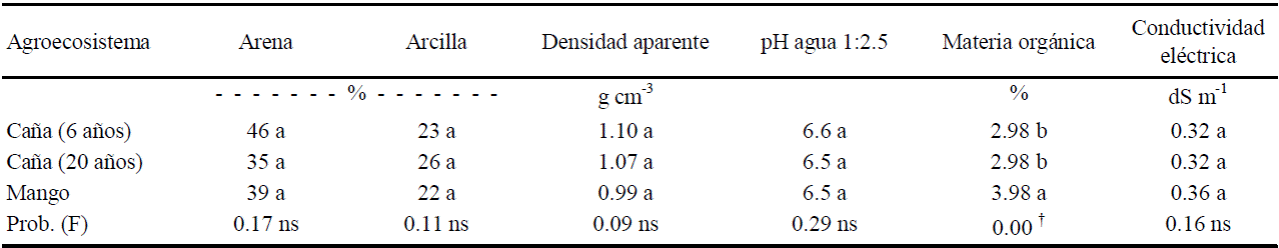
† Letras diferentes significa diferencia altamente significativa. ns = no diferencias significativas
La no diferencia estadística demostrada entre contenidos de materia orgánica de los agroecosistemas de caña de 6 y 20 años, coincide con lo reportado por Naranjo et al. (2006), quienes encontraron que después de 30 años de cultivo con caña no se modificaron las concentraciones de materia orgánica en el suelo.
Variación de la Macrofauna
A continuación se presentan los resultados de la macrofauna edáfica como bioindicador de sustentabilidad asociado al cambio en el uso del suelo, de mango a caña de azúcar.
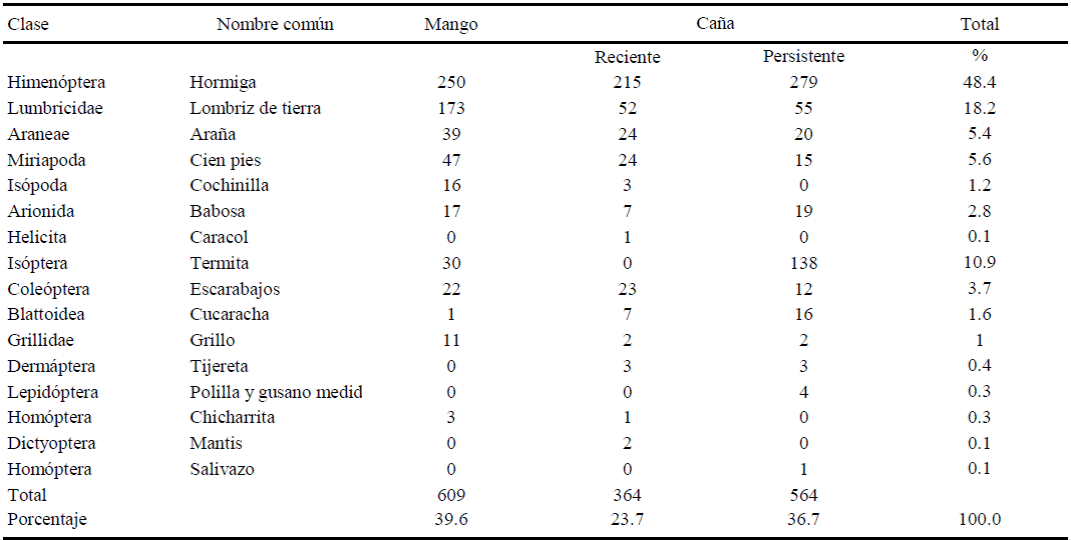
Del total de 360 muestras tomadas, se observaron 1537 invertebrados que pertenecen al grupo Annelida, Molusco y Artrópoda (Cuadro 3). Las hormigas (Formicidae) representaron 48% del total de invertebrados registrados y en menor proporción lombrices (18.2%), termitas (10.9%), cien pies (5.6%), arañas (5.4%), escarabajos o Coleóptera (3.71%) y babosas (2.8%). La presencia de los grupos Isópoda, Blattoidea, Grillidae, Dermáptera y Homóptera fue errática y ausentes en alguno de los agroecosistemas. Los grupos Coleóptera y Lepidóptera incluyen adultos y larvas. Mientras que Helicita y Dictyoptera estuvo presente sólo en mango e Himenóptera (Aeneolamia postica (Walter) sólo en caña (0.07%) en forma de ninfa y cerca de cuatro adultos m-2 en la parte aérea. Los Colémbolos no fueron contabilizados por su tamaño pequeño y abundante población, principalmente en mango.
La mayor frecuencia de invertebrados se presentó en mango (40%) y fue menor en orden descendente en caña persistente (37%) y caña reciente (24%). Es decir, que mango tuvo 1.67 veces más invertebrados que caña reciente y 1.08 veces más que caña persistente. Esto significa que el uso de suelo o tipo de agroecosistema afecta significativamente la incidencia y abundancia de macrofauna edáfica, especialmente en cuanto a lombrices, termitas y miriápodos. La presencia y mayor abundancia de lombrices en mango constituyen la principal referencia de mayor calidad del suelo (Fragoso, 1997; Huerta et al. 2005), lo cual se explica también por los ambientes menos disturbados o con sistemas de mayor cobertura vegetal. La abundancia de lombrices fue significativamente menor en el cultivo de caña, debido probablemente a un mayor laboreo del suelo (arado, subsoleo, aplicación de fertilizantes y control mecánico de hierbas) y uso de agroquímicos para el control de plagas de suelo y malezas) y posiblemente por su relativa poca movilidad; no así como lo hicieron los otros grupos de mayor movilidad, como hormigas y termitas. Lo anterior, apoya la hipótesis de que en caña persistente se presenta mayor estabilidad poblacional de macrofauna edáfica, respecto a caña reciente, dado a que los organismos se encuentran mayormente adaptados a ambientes perturbados. Lo anterior explica la similitud encontrada en cuanto a diversidad y riqueza de la macrofauna en mango y caña persistente. Estos resultados concuerdan con Barajas-Guzmán y Álvarez- Sánchez (2003), quienes reportaron una nula variación de riqueza taxonómica de fauna entre diferentes ambientes, pero sí una mayor variación taxonómica en el ambiente de vegetación secundaria al presentar valores más altos que en selva.
En mango fueron más abundante lombrices, ciempiés y grillos, en cambio en caña fueron las termitas y cucarachas. Lo anterior se relacionó con la mayor presencia de materia orgánica, humedad y la existencia de determinada macrofauna, en contraste con caña en donde la presencia de tallos en descomposición y humedad permitió la mayor incidencia de xilófagos. La incidencia de varios taxa de invertebrados (proporción de individuos m-2) en diferentes épocas de muestreo y diferentes agroecosistemas se muestran en la Figura 1. La abundancia de invertebrados presentó diferencias significativas (Tukey, P ≥ 0.05) en las distintas fechas. Durante los meses de marzo, mayo y agosto, mango y caña reciente tuvieron una tendencia similar en la dinámica poblacional de invertebrados. Sin embargo, en octubre y enero, meses con menor temperatura ambiental, en mango permanecieron mayores niveles de invertebrados. En caña persistente, la disminución de organismos en enero y mayo se explican por la eliminación de la cubierta vegetal por la cosecha de la caña. Los resultados coinciden con lo expresado por los productores de la región de estudio, quienes afirman que después de seis años de producción continua de caña de azúcar, “ya no se puede establecer ningún otro cultivo porque el suelo queda estéril y no produce más caña, sólo aplicando fertilizantes químicos”. También se encontró que muchos productores no conocen el papel de la macrofauna del suelo, lo cual coincide con lo señalado por (Birang, 2003). Normalmente los productores siguen las indicaciones de los técnicos de los ingenios, en cuanto a mantener libre de malezas y de insectos al cultivo”. Por ello, las hormigas pueden emplearse como bioindicadores de sustentabilidad del suelo, ya que las especies existentes en caña son depredadoras y contribuyen a la regulación de otras poblaciones y porque sus nidos contribuyen a mejorar la estructura de los suelos (Lobry de Bruyn, 1999). En ese sentido, es necesario establecer la densidad y tipo de hormigas que puedan considerarse como benéficas y que se tomen como punto de referencia.

Figura 1 Abundancia de varios grupos de invertebrados en muestreos de suelo en tres agroecosistemas en la región Golfo Centro de Veracruz, México.
Respecto al índice de diversidad de Shannon-Wiener, se encontró en mango un valor 1.39 veces más alto que en caña reciente (Cuadro 4). Lo contrario sucedió con el índice de dominancia de Simpson, el cual fue 1.9 veces mayor en caña reciente. Esto se relacionó con que 81% de los grupos de artrópodos (de un total de 16) estuvieron presentes en caña reciente. Además, se observó similitud entre los valores de mango y caña persistente.
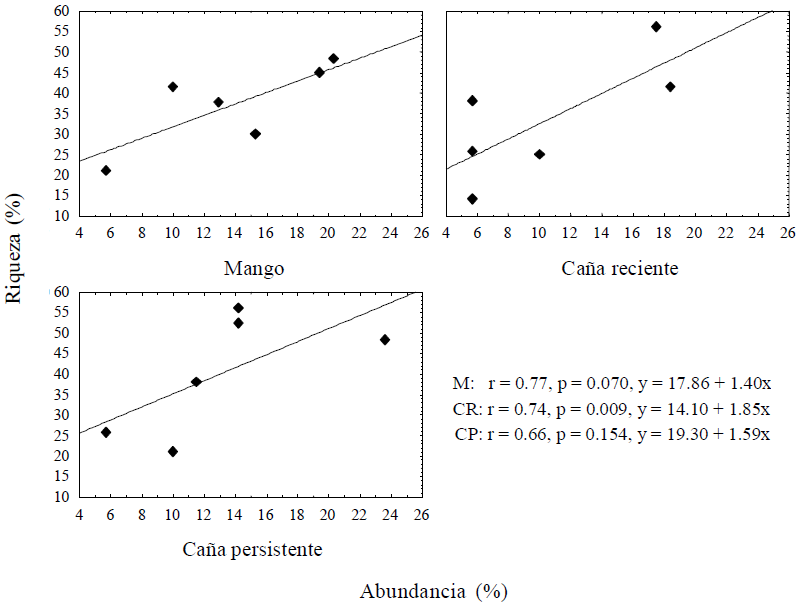
Respecto a la abundancia diferencial para cada agroecosistema evaluado, Miriápoda presentó diferencias altamente significativas (P ≥ 0.018), para cada agroecosistema evaluado. Por el contrario, existió una diferencia marginalmente significativa (P ≥ 0.053) para lombrices, por lo que se formaron dos grupos; el mayor numero en mango y la menor cantidad en caña; y una P ≥ 0.066 para isóptera siendo mayor en caña persistente (Figura 2). Los otros taxa estudiados no presentaron diferencias significativas. En cuanto a la correlación entre riqueza y abundancia, esta fue positiva alta (r = 0.66 a 0.77) en los tres agroecosistemas (Figura 3).
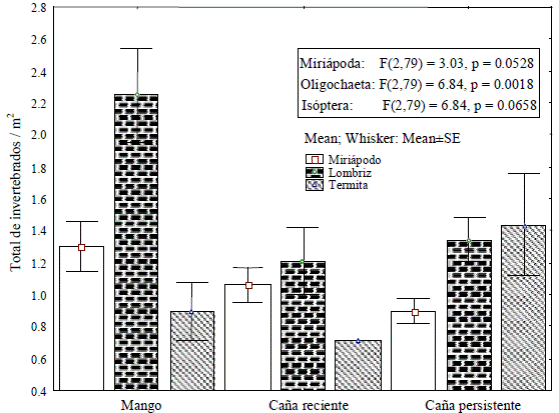
Figura 2 Total de macrofauna edáfica en tres agroecosistemas de la Región Golfo Centro de Veracruz, México.
Análisis de Componentes Principales
Acorde al análisis multivariado, las variables: para lombriz, miriápodos, araña e insectos (excepto termitas) y materia orgánica en el horizonte A explicaron 66.4% de la variación y se encontró una correlación positiva para el factor 1. Respecto a riqueza de invertebrados, esta estuvo positivamente correlacionada con materia orgánica del horizonte A (r = 0.60, P ≥ 0.031). Se confirmó la existencia de diferencias altamente significativas (P ≥ 0.05) de la riqueza de invertebrados entre el agroecosistemas mango y caña de azúcar (Cuadro 5).
Cuadro 5 Análisis multivariado de la macrofauna edáfica y propiedades del suelo, en tres agroecosistemas, Veracruz, México.

† Letras diferentes significa diferencia altamente significativa.
Mientras el follaje de la caña cubre el suelo, lo cual ocurre después de tres meses de cosecha, la incidencia de grupos y abundancia de invertebrados es mayor, no encontrando diferencias significativa por tipo de uso de suelo. Lo anterior, se explica porque hormigas, arañas y miriápodos están asociados con un amplio rango de hábitats y sus poblaciones se recuperan pronto después de eventos como quemas. Se registraron al menos ocho especies distintas de hormigas en caña, algunas de ellas reportadas como depredadoras (Aldana et al., 1995), otras se alimentan de las excretas de los pulgones y por ello se observaron con frecuencia en el follaje. Esto indica que acorde a la época, algunas especies se incrementan y otras se suprimen.
Normalmente los coleópteros, hormigas y termitas son invertebrados muy móviles y pueden resguardarse del fuego en madrigueras subterráneas (Mathieu et al. 2005). Otro factor que puede incider en la abundancia de la macrofauna edáfica es que previo a la cosecha de la caña se suspenden los riegos, por lo que al bajar la humedad del suelo disminuye la abundancia de invertebrados o buscan estratos de mayor profundidad, (no se evaluó) por lo que los daños por el fuego resultan de menor intensidad para la macrofauna. Una respuesta similar para coleópteros y hormigas fue reportada por Marín y Feijoo (2007), indicando que esto hace posible su utilidad como bioindicadores en ambientes perturbados.
La similitud estadística en la abundancia de especies en mango y caña, se explica porque siendo la caña un cultivo perenne y una vez cosechado, pasan cerca de cuatro a siete meses para recuperarse la macrofauna. Por otra parte, el agua de riego puede ser un medio eficiente para transportar cierta fauna edáfica; así también la dinámica poblacional puede afectarse igualmente por la compactación del suelo, como lo reportan Sánchez et al. (2003). En cuanto a la quema en caña, se hace en parcelas relativamente pequeñas (1 a 2 ha) e intercaladas con franjas de vegetación (guarda rayas), lo cual permite en cierta manera la conectividad de áreas que conforman el paisaje. Este elemento, como lo plantea Ewel (1986) podría considerarse en el diseño de un mosaico de agroecosistemas para mantener la biodiversidad de la macrofauna.
CONCLUSIONES
- El cambio de uso de suelo de mango a caña de azúcar afectó la abundancia y diversidad de macrofauna edáfica y su efecto funcional sobre las propiedades del suelo fueron modificadas negativamente. Asimismo dicha biodiversidad se afectó con las prácticas de cultivo en la caña de azúcar, pero se estabilizó una vez que el cultivo alcanzó su madurez fisiológica.
- Las franjas con vegetación secundaria y herbácea, localizadas en las orillas de las plantaciones y bordos de canales de riego pueden funcionar como potenciales refugios o áreas de amortiguamiento para la fauna edáfica, contribuyendo a su repoblación posterior a las perturbaciones (quemas, laboreo del suelo, aplicación de químicos entre otros). La medición de la macrofauna edáfica y factores fisicoquímicos del suelo como indicadores de calidad del suelo, permiten comprender el efecto de las decisiones como el cambio de suelo y uso de agroquímicos en la agricultura.











 nueva página del texto (beta)
nueva página del texto (beta)