Introducción
En México, el cultivo del pepino (Cucumis sativus L.) contribuye en la generación de divisas y empleos, por ser una de las principales hortalizas que se cultivan en el país. En 2004 se cosecharon a campo abierto 13 781 ha, con un rendimiento promedio de 25.44 Mg ha-1 (SIAP-SAGARPA, 2007).
Para la producción en campo, este cultivo se maneja en siembra directa. En cambio, bajo invernadero, por la necesidad de adelantar la cosecha para aprovechar las ventanas de comercialización, de evadir roedores y de hacer un uso más eficiente de la semilla híbrida de alto costo, es frecuente la producción de plántulas para trasplante (Wien, 1999).
Con el sistema de cultivo por trasplante combinado con el de hidroponía, es posible programar fechas de cosecha durante todo el año, lograr plantas más uniformes en tamaño, reducir el ciclo de cultivo y hacer un uso más eficiente del espacio y del tiempo. En tales condiciones las plantas presentan menor estrés por falta de agua, luz y oxigenación de la raíz, y por ende se obtiene mejor crecimiento y desarrollo (Default, 1998).
En el proceso productivo del pepino es importante obtener plántulas vigorosas, que garanticen un buen establecimiento y alta producción. El vigor se evalúa mediante indicadores como grosor de tallo, crecimiento de raíz, área foliar, grosor de la lámina foliar y materia seca. Un mayor vigor de la plántulas al momento del trasplante se puede reflejar en mayor precocidad del cultivo y eventualmente, en un mayor rendimiento total, como lo han señalado Sánchez et al. (1999) y Wien (1999) en tomate (Solanum lycopersicon Mill.) y Weston (1988) en pimiento (Capsicum annuum L.).
La obtención de plántula de calidad también requiere semilla con calidad genética y fisiológica y un ambiente favorable para la raíz y el vástago. En los semilleros, los contenedores de mayor uso son elaborados con poliestireno expandido; generalmente se trata de charolas de 200 cavidades con 25 a 30 mL por cavidad. Estas charolas germinadoras facilitan la producción de plántula, pero su reducido volumen restringe el crecimiento de las plántulas, lo que frecuentemente demerita su vigor (Marsh y Paul, 1988; Marr y Jirak, 1990).
La escasa información publicada acerca de la producción de plántula de pepino se ha generado principalmente en países nórdicos para cultivares de tipo europeo y con contenedores grandes hechos con lana de roca o turba vegetal (Wien, 1999), contenedores que para los productores mexicanos puede resultar costosos aunque el sistema de producción convencional en charolas de 200 cavidades no es adecuado por el rápido crecimiento inicial del pepino. Por ello es importante hacer estudios para determinar tamaños de contenedor y densidades de población que proporcionen plántulas vigorosas.
Se conocen los requerimientos nutrimentales para la producción de pepino en la etapa reproductiva (Jones et al., 1991; Resh, 1997), pero para plántula la información es escasa. Por tanto, es necesario hacer una correcta aplicación de los nutrimentos desde las primeras etapas de desarrollo del cultivo (Marschner, 1995), porque ayuda al enraizamiento y al vigor de las plántulas (Leskovar y Stoffella, 1995).
El objetivo de este trabajo fue determinar el efecto del tamaño de la cavidad del contenedor y de la densidad de población, así como de tratamientos de fertilización con nitrógeno (N), fósforo (P) y potasio (K) en el vigor de plántulas de pepino a la edad de trasplante (23 días después de la siembra).
Materiales y métodos
El estudio se llevó a cabo en condiciones de invernadero e hidroponía en Chapingo, estado de México, localizado a 19° 29’ N y 98° 53’ O, con una altura de 2240 m; se utilizó la variedad Saber como material vegetal, en la que se estudiaron dos factores.
El primer factor estudiado se denominó condición de crecimiento (CC) y comprendió cuatro niveles:
1 (CC1) espacio radical limitado y alta densidad de población (1100 plántulas m-2), que corresponde al manejo convencional de semillero en charolas de 200 cavidades con 28 mL de volumen por cavidad (tratamiento testigo);
2 (CC2) espacio radical limitado (charolas de 200 cavidades con volumen de 28 mL de capacidad por cavidad) y baja densidad de población (275 plántulas m-2) al sembrar sólo una de cada cuatro cavidades;
3 (CC3) espacio radical no limitado (charolas de 112 cavidades de 80 mL de capacidad cada una y alta densidad de población (816 plántulas m-2);
4 (CC4) espacio radical no limitado (macetas plásticas de 700 mL de capacidad) y baja densidad de población (100 plántulas m-2);
Como sustrato de siembra en las charolas se usó una mezcla de “turba vegetal” con perlita en proporción de 1:1 v/v.
El segundo factor estudiado comprendió cuatro tratamientos de fertilización (TF) con solución nutritiva para las plántulas en el semillero:
1 (TF1) solución nutritiva con 120, 20 y 140 mg L-1 de N, P y K (Urrestarazu, 2004), respectivamente, aplicados en cada riego a partir de ocho días después de la siembra (dds).
2 (TF2) solución nutritiva con 115, 26 y 120 mg L-1 de N, P y K, respectivamente, aplicados en cada riego a partir de 8 dds (Sánchez y Escalante, 1988).
3 (TF3) solución nutritiva con 172, 39 y 180 mg L-1 de N, P y K, respectivamente, aplicados en cada riego a partir de ocho dds (Sánchez y Escalante, 1988).
4 (TF4) como el TF3, pero aplicado al 25% de su concentración total de los 8 a los 12 dds, al 50% de los 13 a 17 dds, y al 75% de los 18 a 22 dds.
En cada TF la solución nutritiva se complementó con los siguientes minerales y concentraciones (en mg L-1): Ca 140; Mg 25; S 120; Fe 1.5; Mn 0.5; Zn 0.05; B 0.05 y Cu 0.01; con un pH de 6.5 y CE de 1.5 a 2.0 dS m-1.
De la combinación de las cuatro condiciones de crecimiento y de las cuatro modalidades de fertilización, se obtuvieron 16 tratamientos que se distribuyeron en un diseño experimental de bloques completos al azar con tres repeticiones; la unidad experimental fue de 28 plántulas. Para cada variable se hizo análisis de varianza bajo un diseño factorial de tratamientos y comparaciones de medias (Tukey, P ≤ 0.05).
Las variables evaluadas en cada planta fueron: área foliar (AF), longitud de tallo (LT), diámetro de tallo (DT), peso seco de follaje (PSF), longitud de raíz (LR), volumen de raíz (VR) y peso seco de raíz (PSR), todas medidas a los 23 días después de la siembra (dds).
El AF se midió con un integrador marca LI-3100 (LI-COR, Lincoln, Nebraska, EUA); la LT y LR con una regla milimétrica, y el DT con un vernier digital; antes de medir el PSF, los órganos (hojas y tallo) fueron colocados en bolsas de papel sin perforar y secados en estufa a 70 °C por 72 h; el VR se hizo por desplazamiento de agua en una probeta de 500 mL.
Los contenidos de N, P y K se midieron en muestras de hojas, las cuales se lavaron con agua corriente y agua destilada, posteriormente se colocaron en bolsas de papel sin perforar para su secado en una estufa con aire recirculante a 70 °C durante 24 h; las muestras secas fueron trituradas en un molino de acero inoxidable con malla número 40.
La determinación de N se hizo en 0.1 g de muestra seca que se sometió a digestión húmeda con una mezcla de ácidos sulfúrico, de acuerdo con el método de microkjeldahl (Chapman y Pratt, 1973). Para P y K se utilizó 0.5 g de material seco que se sometió a digestión húmeda con ácidos nítrico, perclórico y sulfúrico; el contenido de P se determinó por el método de molibdovanadato de amonio (Chapman y Pratt, 1973), con lectura de absorbancia a 470 nm en un espectrofotómetro Spectronic 20D de Bausch y Lomb, Milton Roy Company, USA y el K por flamometría (Chapman y Pratt, 1973) con un fotómetro de flama marca Corning 400. En todos los elementos las concentraciones se calcularon con base en peso seco.
Las condiciones de temperatura en el invernadero oscilaron entre 20 y 30 °C durante el día y entre 15 y 18 °C durante la noche. La trasmisión de radiación por la cubierta del invernadero fue del 70% de la radiación solar incidente en el exterior, que corresponde alrededor de 800 μmoles m-2 s-1, lo cual se considera adecuado para el crecimiento de las plántulas (Maroto, 1983).
Resultados y discusión
El análisis de varianza indicó que no hubo efectos de interacción entre condiciones de crecimiento (CC) x tratamiento de fertilización (TF). Para el factor CC hubo efecto significativo en todas las variables, para el factor TF las diferencias observadas fueron en área foliar, longitud de tallo, peso seco del follaje y longitud de raíz. Los coeficientes de variación oscilaron entre 5.93 y 10.72% y los coeficientes de determinación (R2) fueron superiores a 0.90 (datos no presentados).
La mayor expresión de vigor de plántulas a los 23 dds se obtuvo con la CC4 que superó a las otras tres condiciones de crecimiento en todas las variables relacionadas con vigor, excepto que tuvo menor longitud del tallo, carácter que también es un indicador de vigor; el área foliar por planta, y el peso seco de raíz y parte aérea de CC4, fueron estadísticamente mayores que para el resto de CC (Cuadro 1). Estos resultados se deben a que probablemente en el tratamiento de CC4, la raíz creció con menos limitaciones de oxígeno, agua y nutrientes que los otros tratamientos de CC al utilizarse un contenedor amplio, como también lo señalaron Peterson et al. (1991a) y Wien (1999), y a que con densidades bajas, hay una mayor intercepción de radiación solar por planta, que se traduce en una mayor tasa de producción de fotoasimilados y, en consecuencia, de materia seca acumulada que darán lugar a un mayor crecimiento y desarrollo de las plántulas (Reghin et al., 2006; Sakurai et al., 2007). El mayor vigor de las plántulas en pepino podría reflejarse posteriormente en mayor precocidad y rendimiento como ha ocurrido en tomate (Sánchez et al., 1999; Wien, 1999) y en pimiento (Weston, 1988). Hall (1989) encontró que el tamaño del contenedor en que crecieron plántulas de melón, influyó en la precocidad y rendimiento de esta hortaliza.
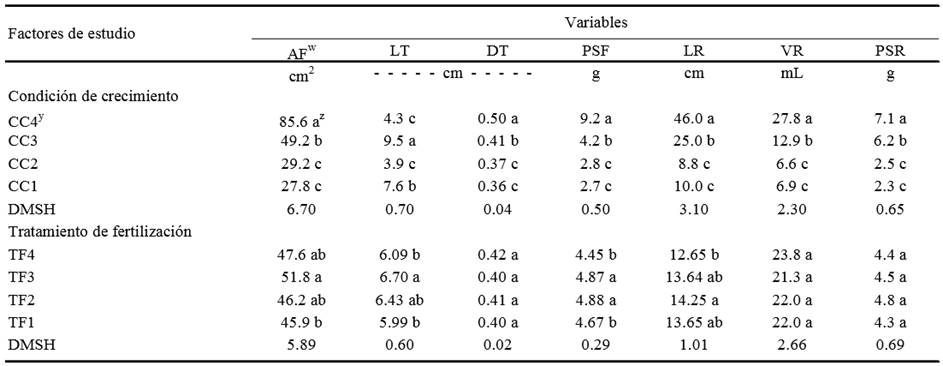
w AF = área foliar; LT = longitud de tallo; DT = diámetro de tallo; PSF = peso seco de follaje; LR = longitud de raíz; VR = volumen de raíz; PSR = peso seco de raíz. Los valores de estas variables corresponden al promedio por planta. Y CC1 = contenedor de 28 mL y 1100 plántulas m-2, CC2 = contenedor de 28 mL y 275 plántulas m-2, CC3 = contenedor de 80 mL y 816 plántulas m-2, CC4 = contenedor de 700 mL y 100 plántulas m-2, TF1 = solución nutritiva con 120 mg L-1 de N, 20 mg L-1 de P y 140 mg L-1 de K, TF2 = solución nutritiva con 115 mg L-1 de N, 26 mg L-1 de P y 120 mg L-1 de K, TF3 = solución nutritiva con 172 mg L-1 de N, 39 mg L-1 de P y 180 mg L-1 de K, TF4 = solución nutritiva con 230 mg L-1 de N, 52 mg L-1 de P y 240 mg L-1 de K diluida los primeros 8 a 12 días después de la siembra al 25% de su concentración, los siguientes cinco días al 50% de su concentración y los siguientes cinco días al 75%. z Dentro de cada columna, medias con la misma letra para cada factor de estudio, son estadísticamente iguales (Tukey, α ≤ 0.05), DMSH = diferencia mínima significativa honesta.
Cuadro 1. Comparación de medias entre condiciones de crecimiento (CC) y tratamientos de fertilización (TF) para diferentes caracteres en plántulas de pepino.
El nivel CC3 cuyo volumen disponible para la raíz era de 80 mL, a pesar de estar con alta densidad de plántulas (815 plántulas m-2) superó a los tratamientos CC1 y CC2 en todas las variables del vigor excepto en longitud de tallo; esto sugiere que hasta los 23 dds fue más importante el espacio radical que el aéreo para el crecimiento de las plántulas de pepino.
La mayor longitud de tallo registrada en CC3 y CC1 se atribuye al efecto de sombreado mutuo por la alta densidad de población, lo cual reduce el vigor de la plántula por tener tallos más delgados que en CC4. Marr y Jirak (1990) y Kemble et al. (1994) también encontraron que en ambientes restringidos de crecimiento radical y aéreo, se disminuye el grosor del tallo y aumenta su longitud y se reduce la ganancia de biomasa. Según Nesmith y Duval (1998) y Sakurai et al. (2007) las plántulas tienen cambios fisiológicos y morfológicos negativos en respuesta al sombreado mutuo y a la reducción del volumen de raíces, efectos que se van agudizando hacia el final de la etapa de semillero, lo cual demerita la calidad de la plántula y su comportamiento posterior al trasplante. Wien (1999) argumenta que la reducción en las tasas de crecimiento de plántulas que crecen en alta densidad y contenedores pequeños se debe a la combinación de varios factores ambientales; en la parte aérea, los individuos interceptan menos radiación por planta y ésta es más rica en rojo lejano que en plantas más espaciadas, lo que provoca eventualmente síntomas de etiolación; en la rizósfera el abastecimiento de oxígeno, nutrimentos y agua se ve limitado en contenedores pequeños; este autor sugiere que en esas condiciones la raíz produce menos citocininas y giberelinas y más etileno, lo que inhibe el crecimiento de la parte aérea.
Los resultados de longitud, volumen y peso seco de raíz (Cuadro 1) evidencian que en condiciones con menores limitaciones de espacio, el crecimiento de la raíz aumenta.
En plántulas de tomate sembradas en contenedores con celdas de 39.5 mL Weston y Zandstra (1986) encontraron que las plántulas manifestaron menos estrés durante el trasplante y el crecimiento fue mayor, tanto en raíz como en la parte aérea, al compararlos con plántulas que crecieron en contenedores de menor volumen. Peterson et al. (1991b), encontraron que en volúmenes reducidos (25 mL por cavidad) se incrementa la producción de etileno en plántulas de tomate y éstas producen raíces adventicias; además observaron que durante el periodo de semillero, la respiración de las raíces llegó a ser 10 veces menor que las de las plántulas crecidas en contenedores grandes (1500 mL), y que el peso seco de raíz llegó a incrementarse en 3 a 4 veces en estas últimas. La restricción de espacio para la raíz se da en sistemas de producción de plántula donde el volumen de sustrato es reducido y se reduce así el suministro de oxígeno para la respiración radical (Wien, 1999).
Se deduce entonces que el espacio para el crecimiento de la raíz tiene un efecto determinante sobre el vigor de las plántulas y que la baja densidad de población disminuye el estrés provocado por la competencia por luz entre las plántulas.
Entre los tratamientos de fertilización se encontró que el TF3 produjo las plántulas más vigorosas, al tener mayor cantidad de variables con valores máximos; en este tratamiento se aplicaron más nutrimentos de N-P-K durante los 23 dds; las plántulas con menor vigor se dieron con TF4 y TF1 (Cuadro 1). Como la media de AF más alta fue obtenida también en el TF3, se infiere que es necesaria una solución nutritiva que aporte desde el inicio del crecimiento de la plántula una cantidad alta de N, P y K. La mayoría de las hortalizas en su etapa de semillero crecen rápidamente, por lo que requieren altas cantidades de nutrimentos en periodos cortos (Widders y Lorenz, 1982). En pepino este efecto posiblemente también ocurre.
En longitud de tallo el TF3 también fue estadísticamente superior que el TF4 y TF1, aunque no difirió respecto al TF2. Preciado et al. (2002), encontraron que con dosis altas de nitrógeno (12 a 14 mol NO3 m-3) se promueve un mayor crecimiento del tallo en melón (Cucumis melo L.), pero no por elongación causada por limitaciones de luz, sino por una mayor tasa de crecimiento. En salvia (Salvia splendens L.), Jong-Go (2004) encontró que altas concentraciones de nutrimentos en la solución nutritiva provocan incrementos en el crecimiento de raíz, tallo y área foliar. En este estudio con pepino se encontró que los cuatro tratamientos de fertilización fueron estadísticamente iguales en diámetro de tallo.
En la acumulación de materia seca en follaje (Cuadro 1) los niveles TF2 y TF3 dieron un peso seco más alto que con los niveles TF4 y el TF1. Es probable que en los primeros días de crecimiento, las plántulas necesiten mayor cantidad de N-P-K que la dosis suministrada por una solución diluida al 25% de su concentración durante los primeros 8 a 12 dds, aunque posteriormente se eleve su concentración al 50 y 75% como en el TF4.
En longitud de raíz sólo en el TF2 las plántulas presentaron mayor longitud radical respecto a las plántulas del TF4. En volumen y peso seco de raíz, no hubo diferencias significativas entre niveles de TF. Según Preciado et al. (2002) dosis altas de N inducen un mayor desarrollo del vástago, pero disminuyen el crecimiento de la raíz.
La proporción más alta de N y K en tejido vegetal se encontró en la CC4, mientras que en fósforo no hubo diferencias estadísticas entre las distintas CC (Cuadro 2). Entre niveles de fertilización no hubo diferencia en la concentración de estos nutrimentos en tejido vegetal.
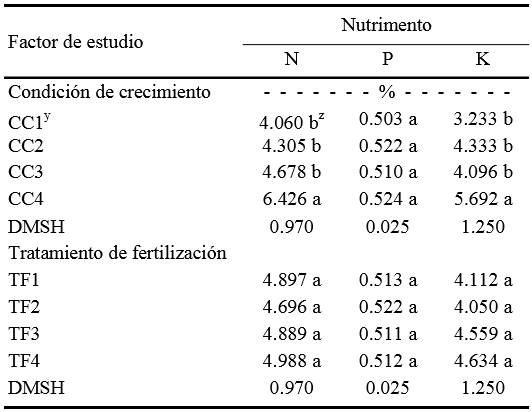
Y CC1 = contenedor de 28 mL y 1100 plántulas m-2; CC2 = contenedor de 28 mL y 275 plántulas m-2; CC3 = contenedor de 80 ml y 816 plántulas m-2; CC4 = contenedor de 700 mL y 100 plántulas m-2; TF1 = solución nutritiva con 120 mg L-1 de N, 20 mg L-1 de P y 140 mg L-1 de K; TF2 = solución nutritiva con 115 mg L-1 de N, 26 mg L-1 de P y 120 mg L-1 de K; TF3 = solución nutritiva con 172 mg L-1 de N, 39 mg L-1 de P y 180 mg L-1 de K; TF4 = solución nutritiva con 230 mg L-1 de N, 52 mg L-1 de P y 240 mg L-1 de K diluida los primeros 8 a 12 días después de la siembra al 25% de su concentración, los siguientes cinco días al 50% de su concentración y los siguientes cinco al 75%. z Dentro de cada columna, medias con la misma letra dentro para cada factor de estudio, son estadísticamente iguales (Tukey, ≤ 0.05), DMSH = diferencia mínima significativa honesta.
Cuadro 2. Comparación de medias entre condiciones de crecimiento (CC) y tratamientos de fertilización (TF) del contenido de nitrógeno (N) fósforo (P) y potasio (K) en hojas de plántulas de pepino.
Según Resh (1997), la concentración en tejido foliar de pepino en etapa vegetativa, debe ser de 5 a 6% de N; 0.4 a 0.6% de P y 4.5 a 5.5% de K, con base en la materia seca, y de acuerdo con Jones et al. (1991), los valores de estos elementos deben ser entre 3.8 a 4.49%, 0.34 a 1.25% y 3.9 a 5.0%, respectivamente. Al comparar los contenidos de N-P-K de los tratamientos aquí evaluados con los de Resh (1997), resultó que sólo con la CC4 se tuvieron contenidos apropiados de N y K y que en P todos los tratamientos estuvieron dentro del rango óptimo, pero con base en Jones et al. (1991), con CC3 también se tuvo valores óptimos para los tres elementos. Cabe aclarar que en pepino se carece de información específica para la etapa de plántula.
Los resultados aquí obtenidos muestran que en todos los tratamientos de fertilización aplicados, la cantidad de nutrimentos fue alta y que el espacio de crecimiento radical dado por el volumen de sustrato o aéreo dado por la densidad de siembra, determina en gran medida el crecimiento de las plántulas.
Conclusiones
- Las plántulas de pepino que crecieron en un volumen del contenedor de 700 mL y una densidad de siembra de 100 plantas m-2, fueron de mayor vigor que en cavidades de 28 mL y densidades de 1100 plantas m-2.
- En contenedores pequeños de 28 mL no hay diferencias entre una densidad alta (1100 plantas m-2) y una baja (275 plantas m-2), ya que ambas condiciones produjeron plántulas de pepino de menor área foliar, diámetro de tallo, peso seco de follaje, longitud, volumen y peso seco de raíz.
- Cuatro niveles de fertilización aquí probados tuvieron igual efecto en el crecimiento de las plántulas de pepino en diámetro de tallo, volumen y peso seco de raíz, aunque el nivel con mayor concentración de nitrógeno, fósforo y potasio produjo plántulas con mayor área foliar, longitud de tallo y peso seco de follaje, con respecto al nivel de menor concentración de estos elementos.
- Con el contenedor de 700 mL y densidad de 100 plantas m-2 se incrementó la absorción de nitrógeno y potasio, pero no la de fósforo, con respecto a las demás condiciones de crecimiento.











 text new page (beta)
text new page (beta)


