Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Terra Latinoamericana
versión On-line ISSN 2395-8030versión impresa ISSN 0187-5779
Terra Latinoam vol.27 no.2 Chapingo abr./jun. 2009
División I
Restauración del crecimiento radical por nutrimentos inorgánicos en Arabidopsis thaliana L. expuesta a cromo
Restoration of root growth using inorganic nutrients in Arabidopsis thaliana L. exposed to chromium
Ortiz–Castro R.1, Martínez–Trujillo M.1*, López–Bucio J.2, Cervantes C.2 y Carreón–Abud Y.1
1 Facultad de Biología. Químico–Biológicas. Universidad Michoacana de San Nicolás de Hidalgo. 58040 Morelia, Michoacán, México. *Autor responsable (codigogenetico@gmail.com).
2 Instituto de Investigaciones Químico–Biológicas. Universidad Michoacana de San Nicolás de Hidalgo. 58040 Morelia, Michoacán, México.
Recibido: mayo de 2007.
Aceptado: octubre de 2008.
RESUMEN
La entrada del cromo (Cr VI) en las raíces de las plantas ocurre mediante un sistema de transporte activo; no obstante, existe poca información sobre el mecanismo específico involucrado. En este trabajo se ha establecido un sistema in vitro para estudiar el efecto del Cr sobre el crecimiento de la raíz de Arabidopsis thaliana con el propósito de brindar información novedosa acerca del papel de los nutrimentos en la respuesta de la raíz al Cr. En A. thaliana, el tratamiento con dicromato de potasio 200 µM inhibió el crecimiento de la raíz primaria. Para evaluar el efecto de diferentes nutrimentos minerales en la reversión de los efectos causados por el dicromato sobre la raíz, se utilizó una línea transgénica de A. thaliana que contiene el promotor del gen AtCycB1;1 que codifica para una ciclina mitótica, fusionado al gen reportero de la β–glucuronidasa(uidA). Las plantas que expresan esta construcción genética (AtCycB1,1::uidA) se cultivaron en medio Murashige–Skoog (MS) sólido con nutrimentos minerales y sacarosa, suplementado con concentraciones de fosfato, sulfato o nitrato de 10 mM o 15 mM, con y sin 200 µM de dicromato de potasio. El crecimiento de la raíz primaria se restableció en gran medida por fosfatos y sulfatos (84 y 63%, respectivamente) pero no por nitratos, lo que sugiere una relación fisiológica en la toma por la raíz de estos nutrimentos con el dicromato. La restauración del crecimiento de la raíz primaria mostró una correlación directa con la actividad mitótica en los meristemos de las raíces, revelada por la expresión del marcador AtCycB1,1::uidA, lo que sugiere que la inhibición del crecimiento de la raíz causada por el dicromato afecta, principalmente, a la división.
Palabras clave: división celular, plantas, metales, fosfatos, sulfatos.
ABSTRACT
Cr (VI) uptake by roots occurs through an active transport system, but there is little information on the specific mechanism involved in this process. Using the model plant Arabidopsis thaliana, an in vitro bioassay was devised to study the effects of Cr on root growth to obtain novel information on the role of nutrient interactions in root responses to Cr. In A. thaliana, a 200 µM concentration of potassium dichromate inhibited primary root growth. To evaluate the effects of different mineral nutrients in root response to Cr, we analyzed the responses of A. thaliana transgenic plants that express the AtCycB1;1 promoter fused to the β–glucuronidase (uidA) reporter gene. Plants expressing the AtCycB1;1:uidA construct were grown in MS–agar medium (Murashige–Skoog) supplied with 10 or 15 µM concentrations of phosphate, sulfate and nitrate, with and without 200 µM dichromate. Primary root growth in 200 µM dichromate was largely restored by phosphate and sulfate treatments (84 and 63%, respectively), but not by nitrates; this suggests a physiological relationship of these nutrients with root growth responses to dichromate. Restoration of primary root growth by nutrients directly correlated with normal mitotic activity in the root meristem, as revealed by expression of the marker AtCycB1;1::uidA, suggesting that primary root growth is inhibited by dichromate mainly because it affects cell division.
Keywords: cellular division, plants, metals, phosphates, sulfates.
INTRODUCCIÓN
El Cr es un elemento de transición ubicado en el grupo VI–B de la tabla periódica. En su forma hexavalente (Cr VI) se encuentra asociado con oxígeno para formar el cromato (CrO42–) o el dicromato (Cr2O72–). La abundancia del Cr en la corteza terrestre varía de 100 a 300 µg g–1, sin embargo, la inadecuada disposición de desechos provenientes de procesos industriales tales como el curtido de pieles y la producción de aceros refractarios, lo han convertido en un contaminante del aire, el suelo y el agua (Cervantes et al., 2001). La A. thaliana se ha utilizado como un modelo para determinar los efectos de factores ambientales sobre el crecimiento y desarrollo de las plantas, ya que su corto ciclo de vida y el conocimiento de su genoma hacen que esta especie sea un sistema adecuado para el estudio de los efectos del Cr sobre el desarrollo vegetal. La raíz de A. thaliana tiene una estructura relativamente simple, los diferentes tejidos que la componen se originan de un grupo de células mitóticamente activas localizadas en el meristemo de la raíz (Dolan et al., 1993). En un trabajo previo, Ortíz–Castro et al. (2006) señalaron que el dicromato tiene un efecto dual en plantas de Arabidopsis dependiendo de su concentración en el medio ya que, mientras el tratamiento con concentraciones de 100 µM tiene un efecto estimulador en el crecimiento de la raíz y el follaje, concentraciones de 200 µM o mayores inhiben el crecimiento de la raíz primaria, afectan la producción del follaje y producen un amarillamiento de las hojas.
El cromato y el dicromato poseen una similitud geométrica y de carga con algunos aniones esenciales, lo cual puede afectar la nutrición mineral. Por ejemplo, algunos de los efectos inhibitorios (a concentraciones mayores a 100 µM) en el crecimiento de la raíz y del follaje podrían ser causados por la competencia del Cr con nutrimentos minerales esenciales mediante su unión a los transportadores. La entrada del Cr (VI) en las raíces de las plantas ocurre mediante un transporte activo (Skeffington et al., 1976), pero se carece de pruebas concluyentes del mecanismo específico involucrado. Una manera de evaluar la especificidad de los sistemas de transporte por diferentes elementos es mediante la identificación de las características morfológicas de la raíz que puedan ser utilizadas como marcadores de toxicidad y analizar los efectos que causan la combinación del Cr con otros minerales.
El fosfato y sulfato son similares a la geometría de los aniones que forman el Cr (VI), por lo que se plantea la posibilidad de que el Cr pueda penetrar a la raíz a través de los transportadores de estos nutrimentos y causar un efecto negativo sobre el crecimiento de la raíz. El nitrato, no obstante que posee una carga negativa, tiene una geometría diferente a los aniones del Cr (VI) por lo tanto fue útil como control negativo en este trabajo. Con la secuenciación del genoma de A. thaliana se ha determinado que existe una familia de al menos 13 genes que codifican transportadores de fosfato, algunos de los cuales se expresan en la raíz (Poirier y Bucher, 2002). Se han descrito también 12 genes que codifican para transportadores de sulfato, dos de los cuales se ha encontrado que se expresan en la raíz (Leustek, 2002). Se conocen 5 genes que codifican transportadores de nitratos (Crawford y Forde, 2002).
En este trabajo se estableció un sistema in vitro para evaluar el efecto del Cr (VI) en el desarrollo de la raíz de A. thaliana. Uno de los efectos más claros del Cr consistió en la inhibición del crecimiento de la raíz primaria; este efecto se utilizó como marcador fenotípico para estudiar la especificidad de las respuestas de la raíz al Cr. Para determinar si la inhibición del crecimiento de la raíz primaria estaba correlacionada con la inhibición de la actividad mitótica, se utilizó una línea transgénica de A. thaliana que contiene el promotor del gen AtCycB1;1 que codifica para una ciclina mitótica, fusionado al gen reportero de la β–glucuronidasa (uidA)(Colón–Carmona et al.,1999). El análisis histoquímico de la actividad del gen reportero uidA permitió detectar de manera temporal y espacial a las células que en ese momento estaban entrando a la fase de mitosis. Para determinar si nutrimentos minerales similares en carga y geometría con compuestos de Cr (VI) pueden interferir con la toxicidad de éste (restaurando el crecimiento de la raíz primaria y la actividad mitótica), se utilizó el dicromato de potasio en diferentes combinaciones de compuestos de fosfato, sulfato y nitrato, para además aportar información sobre el transporte de Cr (VI) en plantas y las interacciones de este metal con los nutrimentos utilizados.
MATERIALES Y MÉTODOS
Se utilizó la línea transgénica CycB1;1::uidA de A. thaliana (Colón–Carmona et al., 1999), la cual lleva fusionado el promotor de la ciclina mitótica CycB1;1 de Arabidopsis al gen reportero uidA (Jefferson et al., 1987) que codifica la enzima β–glucuronidasa. Las semillas fueron desinfectadas durante 10 min mediante tratamiento superficial con etanol al 95% (v/v) y por 15 min con solución al 6% de hipoclorito de sodio suplementada con Tritón X–100 al 0.01%. Las semillas se lavaron 3 veces con agua tridestilada estéril y se incubaron en oscuridad a 4 °C durante 24 h en la misma solución. Las semillas fueron colocadas en cajas de Petri con el medio de cultivo MS (Murashige y Skoog, 1962) 0.5X suplementado con sacarosa al 2% y agar para plantas (Phytotechnology laboratorios A111) al 0.7% (p/v). El pH se ajustó a 5.7 después de la adición del agar. Las cajas con las semillas en germinación se incubaron de manera vertical para favorecer el crecimiento de las raíces sobre la superficie del medio y medir el crecimiento de la raíz primaria. Las condiciones de crecimiento fueron: temperatura 28 °C, fotoperiodo de 12 h de luz (300 µM m–2 s–1) y 12 h de oscuridad. A los seis días de crecimiento las plántulas fueron transferidas a diferentes medios con suplementos de nutrimentos inorgánicos. La concentraciones de fosfatos, sulfatos y nitratos en el medio MS 0.5X fueron de 0.62 mM, 0.76 mM y 19.7 mM, respectivamente. Los tratamientos de sulfato, fosfato y nitrato fueron establecidos mediante la adición al medio de sulfato de potasio (K2S04), fosfato monobásico de potasio (K2HPO4) o nitrato de potasio (KNO3), respectivamente, en concentraciones de 10 mM o 15 mM. Los tratamientos establecidos se presentan en el Cuadro 1.

Las plantas se dejaron crecer durante seis días adicionales posteriores al transplante a una temperatura de 28 °C, con un fotoperiodo de 12 h de luz y 12 h de oscuridad. Al término de este periodo se midió la longitud de la raíz primaria en plantas crecidas verticalmente.
Análisis histoquímico de la actividad de β–glucuronidasa
La actividad de la b–glucuronidasa se determinó mediante el sustrato x–gluc (Phytotechnology laboratorios X877) que produce una coloración azul al dimerizarse. El procedimiento fue el siguiente: a) las plantas de A. thaliana CycB1;1::uidA de cada tratamiento se procesaron para el análisis histoquímico de la actividad de â–glucuronidasa incubándolas 12 h en una solución al 0.1% de 5–bromo–4–cloro–3–indolil, â–Dglucurónido (x–gluc), en amortiguador de fosfatos (NaH2PO4 y Na2HPO4, 0.1 M, pH = 7) conteniendo 2 mM (0.59 g L–1) de ferrocianuro de potasio (0.59 g L–1) y 2 mM (0.65 g L–1) de ferricianuro de potasio; b) las plantas se clarificaron con HCl 0.24 N en metanol al 20% (v/v) y se incubaron a 62 °C por 60 min. Se sustituyó la solución con NaOH al 7% (p/v) en etanol al 60% y se incubaron por 20 min a temperatura ambiente; c) las plantas se deshidrataron con tratamientos de etanol al 40%, 20% y 10% (v/v) por un periodo de 24 h cada vez; d) las plantas se fijaron en etanol al 5% (v/v) y glicerol al 50% (v/v). Las plantas se colocaron en portaobjetos de vidrio y se sellaron con barniz comercial. Estas preparaciones semipermanentes se utilizaron para el análisis histoquímico de β–glucuronidasa en el microscopio.
Las raíces de A. thaliana fueron observadas en un microscopio compuesto Axiostar Zeiss Plus. Las imágenes fueron capturadas con una cámara digital Sony Cybershot DSC–S75 adaptada al microscopio y procesadas con el programa Zeiss AxioVision 4AC.
Se obtuvieron los promedios e intervalos de confianza (α = 0.05) y se realizaron los análisis de varianza y pruebas de significación de Tukey (α = 0.05). Para cada tratamiento se utilizaron 10 plantas.
RESULTADOS Y DISCUSIÓN
Los efectos del Cr (VI) en el crecimiento y desarrollo de la raíz de A. thaliana pueden ser estudiados en un sistema in vitro utilizando medio MS–agar como substrato. Ortiz–Castro et al. (2006) establecieron que la concentración de 200 µM de dicromato es suficiente para inhibir el crecimiento de la raíz primaria.
Para tener un mayor conocimiento de la especificidad de las respuestas de la raíz al Cr (VI) e identificar posibles interacciones de éste con algunos nutrimentos minerales, se realizaron bioensayos en los que se estudió el efecto restaurador de la adición de fosfato, sulfato o nitrato al medio de cultivo de las plantas. La adición de fosfato de potasio en concentraciones de 10 mM o 15 mM al medio MS 0.5X con dicromato 200 µM, restauró el crecimiento de la raíz primaria en 63 y 84%, respectivamente; dichos resultados se obtuvieron utilizando el control sin fosfato de potasio (Figura 1). En contraste, el sulfato de potasio restauró el crecimiento en aproximadamente el 50% con ambas concentraciones (Figura 2). Sin embargo, el nitrato sólo tuvo un efecto pequeño restaurando el crecimiento cerca de 5% en los medios suplementados con este ion (Figura 3). El efecto diferencial de los iones sugiere que existe especificidad en las relaciones fisiológicas con el dicromato. Es posible que el mecanismo sea competitivo (por la geometría de los aniones) por los sitios activos o receptores de los transportadores; al haber mayor concentración de sulfato y fosfato es menor el efecto tóxico del Cr (VI), por lo tanto mayor el crecimiento de la raíz; lo cual no ocurre con el anión nitrato. La especificidad de los aniones estudiados también se refuerza con los resultados obtenidos en estudios de inhibición del crecimiento de la raíz primaria causados por el cobre, que en concentración de 90 µM inhibe completamente el crecimiento de la raíz primaria. En este caso, la adición de fosfato y sulfato no revierten el crecimiento de la raíz primaria en plantas de A. thaliana (Vargas et al., 2007). La interacción de otros aniones con el fosfato se ha reportado en plantas silvestres de Arabidopsis, en las que el incremento en la concentración de fosfato, hasta alcanzar 10 mM, disminuye la toxicidad causada por el arseniato, valorada como la emergencia de los cotiledones en la germinación en 80% (Lee et al., 2003).
Se han reportado interacciones de arseniato, sulfato y fosfato en la mitocondria de levadura debido a uniones indiscriminadas (Cortés et al., 2000). La relación fisiológica del fosfato y el sulfato con el dicromato, así como del fosfato con el arseniato, tienen como particularidad la similitud de la geometría de los aniones y de las cargas, lo que permite sugerir que existe un sitio de unión común de estos aniones con otras moléculas, que podría darse a nivel de los transportadores que participan en la toma de nutrimentos.
Se ha demostrado que el transporte de Cr (VI) en bacterias ocurre por un sistema de transporte de sulfato (Hryniewicz et al., 1990) y en levaduras se ha sugerido que éste ocurre por un transportador de aniones no específico, el cual transporta sulfato y fosfato (Borst–Pauwels, 1981). Mediante el uso de medios de cultivo con diferentes fuentes de azufre, se demostró que el sistema de transporte de sulfatos es utilizado para incorporar cromato en Candida sp., y en cierto grado en Sacccharomyces cerevisiae (Pepi y Baldi, 1992). En plantas se tiene poco conocimiento sobre la forma en que el Cr (VI) entra a la raíz; se ha sugerido que dicho proceso se realiza mediante un sistema de incorporación de sulfato (Shewry y Peterson, 1974). En un estudio cinético realizado con frondas vegetativas de Spirodela polyrhiza se encontró que el sulfato y cromato tienen un comportamiento que sugiere que estos compuestos compiten por los transportadores de sulfato disponibles (Kaszycki et al., 2005). Se ha observado que la presencia de Cr (VI) puede disminuir la incorporación de Ca, K, Mg, P y Cu en plantas de soya y de Salsola kali, sin embargo, en estos trabajos no se puede diferenciar el efecto específico en la interferencia del Cr (VI) en la incorporación de nutrimentos del efecto tóxico causado por éste (Turner y Rust 1971; Gardea–Torresdey et al., 2005). Los resultados permiten deducir que el fosfato y el sulfato disminuyen el efecto tóxico causado por el dicromato al restaurar el crecimiento de la raíz primaria; además sugieren que la entrada de Cr (VI) a la raíz ocurre por transportadores de sulfato que aportan información que sugiere que la incorporación puede ocurrir también mediante transportadores de fosfato.
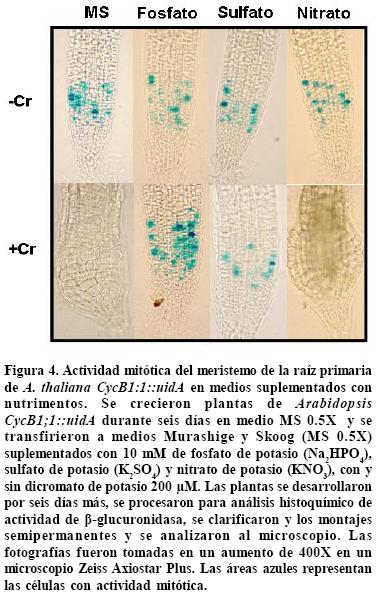
Se realizaron análisis histoquímicos de las raíces de las plantas de la línea CycB1;1:uidA mediante microscopía para determinar si la restauración del crecimiento de la raíz primaria causado por los suplementos de fosfato y sulfato fue acompañada por el reestablecimiento de la actividad mitótica. En la Figura 4 se presentan resultados representativos de estos experimentos para el tratamiento de nutrimentos en concentración de 10 mM. Las raíces en los medios con dicromato de potasio 200 µM y con suplementos de fosfato y sulfato presentaron una actividad mitótica similar a las raíces que estuvieron en los medios sin dicromato de potasio. Las plantas que crecieron en medios suplementados con nitrato de potasio no mostraron actividad mitótica y además el ápice de la raíz se diferenció haciéndose más ancho y con células más grandes (Figura 4). Estos resultados sugieren que hay una correlación entre la restauración del crecimiento de la raíz primaria por los nutrimentos y el restablecimiento de la actividad mitótica en el meristemo.
CONCLUSIONES
– En Arabidopsis thaliana, una concentración de 200 µM de dicromato de potasio inhibe el crecimiento de la raíz primaria.
– La adición de 10 y 15 mM de fosfato y sulfato al medio de crecimiento de las plantas que contiene dicromato 200 µM, permitió reestablecer el crecimiento de la raíz primaria. Estos resultados complementan los trabajos previos que sugieren que la entrada del dicromato a la raíz se realiza mediante los transportadores de sulfato y aportan información novedosa que sugiere como otra vía de entrada a los transportadores de fosfato.
– La restauración del crecimiento de la raíz primaria (inhibido por dicromato) por el fosfato y el sulfatos, se relacionan con una actividad mitótica normal en los meristemos de la raíz de las plantas transgénicas de la línea CycB1;::uidA, lo cual prueba que uno de los efectos del cromo en la inhibición del crecimiento es la alteración del proceso de división celular.
LITERATURA CITADA
Borst–Pauwels, G. W. F. H.1981. Ion transport in yeast. Biochem. Biophys. Acta 650: 88–127. [ Links ]
Cervantes, C., J. Campos–García, S. Devars, F. Corona–Gutiérrez, H. Loza–Tavera, J.C.Torres–Guzmán, and R.Moreno–Sánchez. 2001. Interactions of chromium with microorganisms and plants. Microbiol. Rev. 25: 335–347. [ Links ]
Colón–Carmona, A., R. Yuo, T. Haimovitch–Gal, and P. Doerner. 1999. Spatio–temporal analysis of mitotic activity with a labile cyclin–GUS fusion protein. Plant J. 20: 503–508. [ Links ]
Cortés, P., V. Castrejón, J. B. Sampedro, and S. Uribe. 2000. Interactions of arsenate, sulfate and phosphate with yeast mitochondria. Biochim. Biophys. Acta 1456: 67–76. [ Links ]
Crawford, N. M. and B. G. Forde. 2002. Molecular and developmental biology of inorganic nitrogen nutrition. In: C. R. Somerville, E. M. Meyerowitz, (eds.). The Arabidopsis book. American Society of Plant Biologists. Rockville, MD, USA. [ Links ]
Dolan, L., K. Janmaat, V. Willemsen, P. Linstead, S. Poethig, K. Roberts, and B. Scheres. 1993. Cellular organization of the Arabidopsis thaliana root. Development 119: 71–84. [ Links ]
Gardea–Torresdey, J. L., G. de La Rosa, J. R. Peralta–Videa, M. Montes, G. Cruz–Jiménez, and I. Cano–Aguilera. 2005. Differential uptake and transport of trivalent and hexavalent chromium by tumbleweed (Salsola kali). Arch. Environ. Cont. Tox. 48: 225–232. [ Links ]
Hryniewicz, M., A. Sirko, A. Palucha, A. Böck, and D. Hulanicka. 1990. Sulfate and thiosulfate transport in Escherichia coli K-12: identification of a gene encoding a novel protein involved in thiosulfate binding. J. Bacteriol. 172: 3358–3366. [ Links ]
Jefferson, R. A., T. A. Kavanagh, and M. W. Bevan. 1987. GUS fusion: â–glucuronidase as a sensitive and versatile gene fusion marker in higher plants. EMBO J. 6: 3901–3907. [ Links ]
Kaszycki, P., H. Gabry's, K. J. Appenroth, A. Jaglarz, S. Sedziwy, T. Walczak, and H. Koloczek. 2005. Exogenously applied sulphate as a tool to investigate transport and reduction of chromate in the duckweed Spirodela polyrhiza. Plant Cell Environ. 28: 260–268. [ Links ]
Lee, D. A., A. Chen, and J. I. Schroeder. 2003. ars1, an Arabidopsis mutant exhibiting increased tolerance to arsenate and increased phosphate uptake. Plant J. 35: 637–646. [ Links ]
Leustek, T. 2002. Sulfate metabolism. In: C. R. Somerville, E. M. Meyerowitz, (eds.), The Arabidopsis book. American Society of Plant Biologists. Rockville, MD, USA. [ Links ]
Marzluf, G. A. 1970. Genetic and metabolic controls of sulfate metabolism in Neurospora crassa: isolation and study of chromate–resistant and sulfate transport–negative mutants. J. Bacteriol. 102: 716–721. [ Links ]
Murashige, T. and F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiol. Plant. 15: 473–497. [ Links ]
Ortiz–Castro, R., M. Martínez–Trujillo, J. López–Bucio y C. Cervantes. 2006. Modificaciones en el desarrollo de la raíz inducidas por cromo en plantas de Arabidopsis thaliana. Ciencia Nicolaita 44: 107–120. [ Links ]
Pepi, M. and F. Baldi. 1992. Modulation of chromium (VI) toxicity by organic and inorganic sulfur species in yeasts from industrial wastes. BioMetals 5: 179–185. [ Links ]
Poirier, Y. and M. Bucher. 2002. Phosphate transport and homeostasis in Arabidopsis. In: C. R. Somerville and E. M. Meyerowitz, (eds.). The Arabidopsis book. American Society of Plant Biologists. Rockville, MD, USA. [ Links ]
Vargas–Palominos, L., M. Martínez–Trujillo, R. Ortíz–Castro y J. López–Bucio. 2007. Efecto de metales pesados sobre el crecimiento de la raíz primaria de Arabidopsis thaliana L. Ciencia Nicolaita 49: 101–112. [ Links ]
Shanker, A. K., C. Cervantes, H. Loza–Tavera, and S. Avudainayagam. 2005. Chromium toxicity in plants. Environ. Int. 31: 739–753. [ Links ]
Shewry, P. R. and J. P. Peterson. 1974. The uptake of chromium by barley seedlings (Hordeum vulgare L.) J. Exp. Bot. 25: 785–797. [ Links ]
Skeffington, R.A., Shewry, P. R., and P. J. Peterson. 1976. Chromium uptake and transport in barley seedlings (Hordeum vulgare L.). Planta 132: 209–214. [ Links ]
Turner, M. A. and R. H. Rust. 1971. Effects of chromium on growth and mineral nutrition of soybeans. Soil Sci. Soc. Am. Proc. 20: 93–98. [ Links ]














