Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Terra Latinoamericana
versión On-line ISSN 2395-8030versión impresa ISSN 0187-5779
Terra Latinoam vol.26 no.2 Chapingo abr./jun. 2008
División III
Relación entre la fertilidad del suelo y su población de macroinvertebrados*
Relationship Between Soil Fertility and its Macroinvertebrates Population
Esperanza Huerta Lwanga1‡, Jannet Rodríguez-Olán1, Isabel Evia-Castillo1, Efraín Montejo-Meneses1, Marcela de la Cruz-Mondragón1 y Roberto García-Hernández1
1 Colegio de la Frontera Sur Unidad Villahermosa. km 15.5 Carr. Villahermosa-Reforma, 86280 Villahermosa, Tabasco, México. ‡Autor responsable (ehuerta@ecosur.mx)
Recibido: febrero de 2006.
Aceptado: noviembre de 2007.
RESUMEN
Los macroinvertebrados del suelo intervienen en los procesos de infiltración, aireación e incorporación de materia orgánica en el suelo, y las condiciones biológicas del suelo se ven alteradas cuando existe un uso continuo de agroquímicos o el suelo es arado. En el presente estudio se investigó si la abundancia y la presencia de diferentes órdenes taxonómicas de macroinvertebrados pueden indicar el grado de fertilidad de un sistema. El estudio se llevó a cabo en 24 sitios, 17 manejados (policultivos arbóreos, frutales, cañaveral y pastos inducidos) y 7 naturales (selva, pastizal y vegetación riveriana), en los cuales se muestreó a los macroinvertebrados del suelo de acuerdo con el método internacional TSBF (monolitos de 25 x 25 x 30 cm). En cada sitio se realizaron entre 10 y 50 monolitos. Se encontró el mayor número de órdenes: 9, con el mayor índice de diversidad de Shannon (H = 2) en los ecosistemas como la selva, la vegetación riveriana, y la tierra de descanso con leguminosas, sitios con un contenido alto en materia orgánica (3-15%), fósforo disponible Olsen (13-24 mg kg-1) y nitrógeno total (0.14-0.43%), con valores de pH cercanos a 7. El número de órdenes disminuyó de acuerdo con el tipo de uso del suelo; en los policultivos arbóreos fue de 8 a 6, siendo de 1 a 5 en los monocultivos no arbóreos como el maíz o el pastizal inducido, sitios que presentaron los menores contenidos de materia orgánica (1.6-3.5%), fósforo Olsen (2-14 mg kg-1) y nitrógeno total (0.2%), con valores de pH cercanos a 5.
Palabras clave: agroecosistemas, ecosistemas naturales.
ABSTRACT
Soil macroinvertebrates intervene in the processes of infiltration, aeration and incorporation of soil organic matter. Soil biological conditions are affected by continuous use of agrochemicals or tillage. In this study we determined whether the abundance and presence of different orders of macroinvertebrates can indicate the degree of fertility of a system. The study was carried out in 24 sites, 17 managed (tree polyculture, fruit trees, sugarcane, and induced pasture) and 7 natural (rain forest, pasture, and riparian vegetation) systems. We sampled soil macroinvertebrates using the TSBF international method (25 x 25 x 30 cm monoliths). Ten to 50 monoliths were made per site. The highest number (9) of taxon orders was found with the highest Shannon diversity index (H = 2) in tropical rain forest, riparian vegetation and fallow land with legumes, sites with the highest organic matter content (3-15%), available Olsen phosphorus (1324 mg kg-1) and total nitrogen (0.14-0.43%), with pH values near 7. The number of taxon orders depended on land use; in tree polycultures it was 8 to 6 and 1 to 5 in non-tree monocultures such as maize or induced pasture, which were the sites with the least organic matter contents (1.6-3.5%), available Olsen phosphorus (2-14 mg kg-1), and total nitrogen (0.2%), with pH values near 5.
Keywords: agro systems, natural ecosystems.
INTRODUCCIÓN
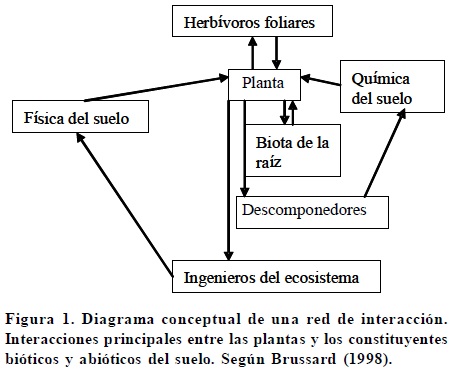
Los macroinvertebrados del suelo, organismos cuyo ancho es > 2 mm, conocidos como macrofauna, intervienen en distintos procesos: en la agregación y estructura del suelo, en la textura y consistencia del suelo, en el movimiento y la retención del agua, en el intercambio gaseoso y en las propiedades químicas y nutricionales del mismo (Lal, 1989; Brussard, 1998; Neher, 1999; Lavelle y Spain, 2001) existiendo un fuerte efecto del tipo de vegetación sobre ellos [Brussard, 1998 (Figura 1)].
La fertilidad del suelo, ya sea natural o fomentada por el agricultor, implica condiciones de presencia, cantidad y asimilabilidad de elementos nutritivos que hagan frente regularmente a las necesidades de las plantas, y se sobreentiende la ausencia de elementos tóxicos que puedan limitar o suprimir la productividad del suelo (Gauthier, 1971). En un sentido amplio, la fertilidad integra los atributos físicos, químicos y biológicos del suelo (Pieri, 1989; Astier-Calderón et al., 2002) al abastecer de agua, nutrientes y dando lugar a un sustrato para las plantas (Astier-Calderón et al., 2002).
En el presente estudio se parte de la hipótesis que se encontrará la menor cantidad y diversidad de macroinvertebrados del suelo en aquellos sitios en donde la presencia y disponibilidad de la materia orgánica (MO) es menor. Se espera encontrar el mayor número de taxas de macroinvertebrados en aquellos sitios con una alta fertilidad del suelo y se maneja entonces a los macroinvertebrados como indicadores del grado de fertilidad del suelo.
MATERIALES Y MÉTODOS
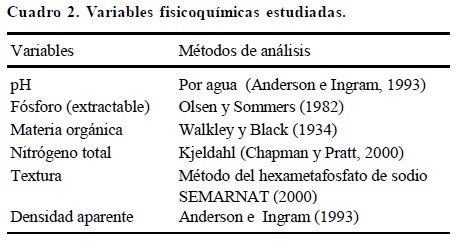
Al centro y sur del estado de Tabasco se muestrearon veinticuatro sitios pertenecientes a la región centro y región del río Usumacinta, que tiene una extensión de 121 591.66 km2, lo que representa el 51.06% de la extensión del estado, se encuentra bajo un índice de precipitación < 2000 mm, y una temperatura promedio anual de 25 a 30 °C. En un gradiente de ecosistemas naturales (selvas) a agroecosistemas (Cuadro 1; Figura 1). Los muestreos se efectuaron al final de la época de lluvias, cuando existe mayor actividad de los macroinvertebrados, ya que en época de baja humedad las lombrices se encuentran en estado de latencia. Con el método internacional TSBF, utilizado ampliamente en ambientes tropicales como base (Anderson e Ingram, 1993), se realizaron monolitos de 25 x 25 x 30 cm, de los cuales se colectaron todos los organismos. El número de monolitos varió dependiendo del sitio muestreado: en áreas pequeñas, como huertos familiares o policultivos de traspatio, se obtuvieron 10 monolitos distribuidos al azar con el fin de perturbar lo menos posible el cultivo; en selvas, monocultivos o policultivos de gran extensión, se realizaron 50 monolitos en un cuadrante de 18 x 8 m (con la información obtenida en estos cuadrantes se realizarán estudios geostadísticos que se discutirán en un documento posterior). Los macroinvertebrados se extrajeron in situ manualmente de cada uno de los monolitos. Se pesaron en fresco, contaron e identificaron por grandes grupos. Después de pesados todos los organismos se regresaron a los monolitos de donde fueron extraídos. De esta forma no hubo necesidad de fijar en alcohol los organismos y se hizo el conteo rápido. De cada uno de los monolitos se tomó una muestra homogénea de suelo para determinar, en laboratorio, el contenido de MO, nitrógeno total, fósforo disponible, pH y textura, de acuerdo con la norma oficial mexicana NOM-021-RECNAT-2000 (SEMARNAT, 2000) (Cuadro 2). La densidad aparente se determinó a través del método del cilindro (Anderson e Ingram, 1993).
Índice de diversidad. Se calculó el índice de diversidad de Shannon (H' = ∑ pilog2pi) en cada uno de los sitios; este índice es ampliamente utilizado en ecología (Barbault, 1997).
Análisis estadísticos. De cada uno de los sitios se obtuvieron las medias de la biomasa y la densidad de los macroinvertebrados. Al no obtener una distribución normal, los datos se normalizaron mediante la fórmula de x = √x+0.05, a excepción del nitrógeno y MO para los cuales se utilizó la normalización mediante arco seno con el programa Statistica (Statsoft, 1995). Una vez normalizados los datos se realizó el análisis de varianza, con una prueba post hoc de Tukey.
Para poder identificar las posibles relaciones entre la biomasa, la densidad y el número de taxas de los macroinvertebrados y las características fisicoquímicas del suelo, se llevó a cabo un estudio multivariado con el programa ADE-4 (Thioulouse et al., 1997). Para este análisis se trabajó sólo con 10 sitios (de 50 monolitos cada uno) y 12 variables (los sitios fueron aquéllos que presentaron todas las variables seleccionadas). Se realizó un análisis de correlación de Spearman entre las variables (datos sin normalizar), con el fin de observar las posibles relaciones significativas con la ayuda del programa Statistica (Statsoft, 1995).
RESULTADOS Y DISCUSIÓN
Composición de los Macroinvertebrados en los Diferentes Sistemas
La selva, la vegetación riveriana y la tierra de descanso con leguminosas fueron los ecosistemas con el mayor número de órdenes de macroinvertebrados (9-8) y mayor diversidad (H = 2; Cuadro 3). Los agroecosistemas, como el de yuca, el maizal, el cañaveral, el cultivo de plátano y pastizal inducido, presentaron menor número de órdenes de macroinvertebrados (5-1) y menor diversidad (H = ≤ 0.5). Sin embargo, los policultivos (policultivo de cedro y cultivo arbóreo de teca) presentaron un número intermedio de órdenes de macroinvertebrados (7), con una diversidad intermedia (H = 1.7; Cuadro 3), debido a que contaban con vegetación arbórea, en ese aspecto más parecido a lo obtenido en la selva que en un cultivo de maíz.
En las selvas se encontraron todos los grupos excepto isópodos, los cuales se observaron sólo en la vegetación riveriana; en los agroecosistemas no arbóreos predominaron los miriápodos, himenópteros y oligoquetos; en los agroecosistemas arbóreos se encontraron los mismos grupos que en la selva, a excepción de los nematodos de vida libre que sólo aparecieron en la selva.
Diversidad de Lombrices
Dentro de los oligoquetos, las especies de lombrices encontradas fueron Polypheretima elongata en la vegetación riveriana, tierra en descanso con leguminosas, y policultivo de cedro, Pontoscolex corethrurus en los pastizales, y lombrices nativas en las selvas (Diplotrema murchei, Lavellodrilus parvus, Lavellodrilus bonampakensis, Lavellodrilus sp. novo, Lavellodrilus sp2., Balanteodrilus pearsei), cultivo de teca (Lavellodrilus bonampakensis, Lavellodrilus sp. novo, Lavellodrilus sp. novo y B. pearsei), tierra de descanso (Glossoscolecidae sp., Balanteodrilus pearsei), y en un huerto familiar (Mayadrilus calakmulensis). En el cultivo de caña se encontraron especies nativas, como Balanteodrilus pearsei y Lavellodrilus bonampakensis, y en el cultivo de maíz sólo Balanteodrilus pearsei (parte de estos resultados fueron publicados en Huerta et al., 2006).
Biomasa y Densidad de Macroinvertebrados
Uno de los maizales fue el sistema que presentó la mayor biomasa fresca de macroinvertebrados (100 g m-2; Cuadro 3) y los oligoquetos constituyeron el 80% de la misma (Figura 2).
El policultivo de cedro fue el sistema con la mayor densidad de macroinvertebrados (430 individuos m-2), seguido de la tierra de descanso y la vegetación riveriana. Los sistemas con las menores densidades son los monocultivos (Figura 3).
Las lombrices representaron del 10 al 40% de la biomasa de los macroinvertebrados en los ecosistemas, mientras que, en los agroecosistemas, las lombrices representaron del 60 al 80%. Se observa un efecto del manejo del suelo sobre el porcentaje de biomasa de lombrices y otros macroinvertebrados, la mayor biomasa de miriápodos (diplópodos y quilópodos) se presentó en un relicto de vegetación natural (RU), mientras que la mayor biomasa de himenópteros se presentó en el platanar (CB); los coleópteros presentaron su mayor biomasa en el cultivo de teca (CT), mientras que los hemípteros y larvas de dípteros en la selva. El porcentaje de los otros miembros de macroinvertebrados disminuye conforme decrece la superficie arbórea, así, por ejemplo, en monocultivos y en el pastizal inducido, el porcentaje del resto de macroinvertebrados sin lombrices es de 13% y el de lombrices es de 87% (Figuras 2 y 3). En cuanto a densidad de macroinvertebrados se observa cómo en los sistemas manejados no arbóreos ésta no rebasa a los 100 individuos m-2 a excepción del pastizal inducido, mientras que en los policultivos arbóreos y selvas la densidad de macroinvertebrados va de 200 a más de 400 individuos m-2. Los oligoquetos son abundantes en todos los sistemas, pero mayormente en las selvas y sistemas manejados arbóreos. En el pastizal inducido, piñal y un maizal sólo se encontraron oligoquetos.
Macroinvertebrados y Variables Fisicoquímicas
La cantidad de nitrógeno total y fósforo disponible tiende a decrecer conforme los sistemas pasan de sistemas naturales a sistemas manejados. La selva y el policultivo de cedro fueron los sitios significativamente más altos en el contenido de estos dos elementos (Figura 4). Los sitios que presentaron las menores biomasas y densidades de macroinvertebrados fueron aquéllos con pH extremos de 3 u 8, con un contenido de MO inferior a 3 ó superior a 7%. Los sitios con porcentajes de arcilla de 20 a 60 presentan los mayores contenidos de MO y es allí donde se encuentran los organismos del suelo (Figura 5).
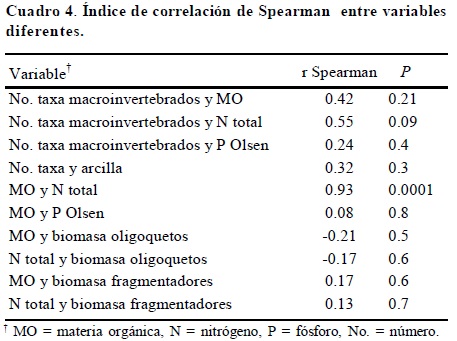
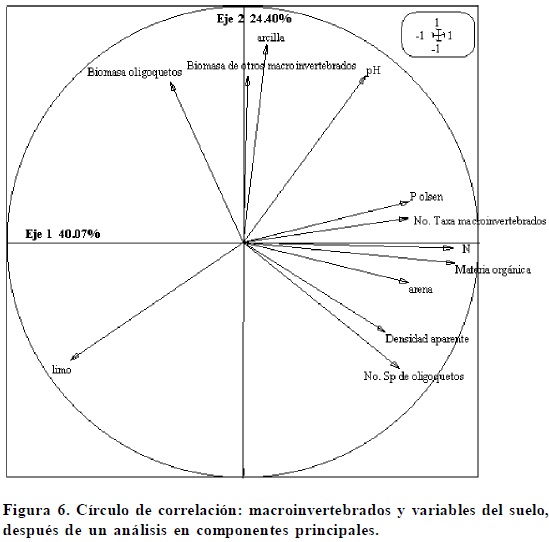
El análisis en componentes principales, con 64.2% de inercia en sus dos ejes, muestra en el Eje 1 que los sitios con el mayor número de órdenes de macroinvertebrados son aquéllos que presentan cantidades altas de nitrógeno total, fósforo disponible y MO, aunque el valor de correlación de Spearman (r) sólo muestra relaciones significativas entre la cantidad de MO y el nitrógeno total [r = 0.93, P = 0.0001 (Cuadro 4, Figura 6)]. Estos sitios son los de las selvas, que cuentan con casi todos los órdenes de macroinvertebrados (Figura 7). Por otro lado, los sitios con mayor biomasa de macroinvertebrados, donde se encontró a la lombriz endogea Polypheretima elongata, fueron el policultivo de cedro, la tierra en descanso con leguminosas y la vegetación riveriana, y los mayores pesos de biomasas frescas del resto de los macroinvertebrados se presentaron en el cultivo arbóreo de teca (Figura 7), con especies nativas de lombrices. En este análisis se observa que la selva (Figura 7) es el sitio con el mayor número de especies de lombrices y con valores de densidad aparente más elevados (Figura 6). Los sitios ricos en limo fueron el pastizal inducido, un mangal y una tierra en descanso en donde predominaron lombrices de la familia glossoscolecidae (Figura 7).
Se ha estimado que en el suelo viven de 5 a 80 millones de especies de animales, y éstos son mayormente artrópodos (Giller et al., 1997). En 1 g de suelo de bosque templado en Europa pueden existir 40 000 especies de bacterias (Tiedje, 1995) y en 1 m2 de suelo pueden haber 1000 especies de invertebrados (Schaefer y Schauermann, 1990), pero poca información existe de los organismos en suelos tropicales (Jimenez et al., 2001a).Existen los transformadores de la hojarasca que son miembros de la mesofauna y algunos de la macrofauna que se encuentran involucrados directamente en la descomposición de la hojarasca (Lavelle, 1996). Además, existen los llamados ingenieros del ecosistema (Jones et al., 1994) que son aquellos organismos que pueden modificar su entorno y la disponibilidad o accesibilidad de un recurso hacia otros organismos. La actividad de la fauna del suelo tiene un efecto profundo en las propiedades del suelo y en los procesos físicos y químicos (Hole, 1981). Los efectos directos o indirectos de los organismos del suelo hacia el suelo se han estudiado, pero aún hace falta profundizar en muchos de ellos. El conocimiento de la existencia de algún tipo de relación entre los organismos del suelo y el contenido de MO en el suelo no es reciente. En la India, Singh y Pillai (1975) observaron que la población de microartrópodos está relacionada con el contenido de MO. Maldegue (1959), Lal (1989), Lavelle et al. (1992) informan que en ambientes tropicales la mayoría de los grupos de la macrofauna se encuentran confinados en la parte superior, en los primeros centímetros del suelo, en donde existen las reservas de MO. También se sabe la importante participación de organismos como las lombrices de tierra en hacer disponibles a las plantas y a otros organismos elementos como el fósforo (Sharpley y Syers 1976; Mackay et al., 1982; Guggenberger et al., 1996; Jimenez et al., 2001b) y el nitrógeno (Svensson et al., 1986; Syers et al., 1979; Rangel et al., 2001). Los efectos de las lombrices sobre la dinámica de la MO dependen tanto de la escala temporal como de la espacial consideradas (Anderson y Flanagan, 1989; Lavelle et al., 1993; Jimenez et al., 2001a), y del tipo de manejo que se le dé al suelo. La sustentabilidad de la fertilidad del suelo en sistemas agrícolas en el trópico húmedo ha sido un tema de relevante importancia, por un lado, los suelos son continuamente degradados y, por otro, existe la necesidad de producir alimento (FAO, 1981; Lavelle et al., 1992). En el presente estudio se planteó como objetivo identificar la relación de algún grupo o grupos de macroinvertebrados del suelo e indicar el grado de fertilidad que éste puede presentar. De esta forma indicar que sistema asegura una alta fertilidad. Los macroinvertebrados producen efectos directos sobre las propiedades del suelo como lo son la humificación y mineralización de la MO (Lal, 1988). Sus actividades se realizan a una escala de centímetros a decímetros, y los denominados ingenieros del ecosistema (lombrices, termitas y hormigas) junto con las raíces determinan la arquitectura del suelo a través de la acumulación de agregados y poros de diferentes tamaños (Lavelle et al., 2006), lo que repercute en la estructura del suelo (Blanchart et al., 1997) y en la fertilidad del mismo.
La actividad de los macroinvertebrados se ve afectada por la sequía y el calor (McColl, 1975). La falta de cobertura vegetal puede inducir ambos factores. Las plantas y los desechos orgánicos proveen los hábitats de los organismos del suelo (Neher, 1999). En el presente estudio se observó el mayor número de órdenes de macroinvertebrados (8-9) y la mayor densidad de los mismos (> 200 individuos m-2) en los sistemas naturales, como la selva, la vegetación riveriana, la tierra en descanso y los policultivos arbóreos. La selva y el policultivo de teca fueron los sitios con mayores contenidos de nitrógeno total y fósforo disponible, así como los sitios con mayor número de especies distintas de lombrices. Los nematodos de vida libre fue el único grupo que sólo se presentó en la selva, mientras que los himenópteros, oligoquetos y miriápodos estuvieron presentes en todos los sistemas, variando en número y biomasa de acuerdo con el sistema, más abundantes en los sistemas naturales y agroecosistemas arbóreos. En los monocultivos de maíz, yuca o pastizal (inducido) se observo el menor número de órdenes de macroinvertebrados (5-1), así como las menores biomasas (< 20 g m-2) y densidades (< 100 individuos m-2), similar a lo observado por Brown et al. (2001) con cultivos de coco y pasto. Una biomasa mínima de 30 g m-2 de lombrices de tierra puede tener importantes consecuencias sobre el suelo y la productividad vegetal (Brown et al., 1999), esta biomasa se encontró en los policultivos arbóreos y sistemas naturales principalmente; en los monocultivos, como el plátano, maíz (Mz1), pastizal inducido y yuca, la biomasa fue menor.
La presencia o ausencia de macroinvertebrados puede ser indicador de la calidad del suelo. De hecho diversos autores proponen que una alta riqueza de taxas, o algunos grupos dominantes, puede revelar información sobre la calidad del suelo (Klemens et al., 2003) y sugieren también a los macroinvertebrados como proveedores de ciertos servicios ambientales, por ejemplo, contribuyen en el secuestro de carbono en el suelo (Lavelle et al., 2006; Brussard et al., 2007).
Velasquez et al. (2007) proponen dentro de un índice de la calidad del suelo a la materia orgánica y a la composición de las comunidades de macroinvertebrados y su abundancia (Lee y Foster, 1991; Pankhurst et al., 1995; Lavelle et al., 1997; Mathieu et al., 2005) entre otras variables. Los suelos de los sistemas naturales, como las selvas o bosques tropicales, cuentan con una entrada constante y frecuente de MO de origen vegetal y animal, por lo que los agroecosistemas deben de parecerse cada vez más a los sistemas naturales (Neher, 1999). En este estudio se observó que los policultivos arbóreos (policultivo de cedro, cultivo de teca) son dentro de los agroecosistemas, sistemas ricos en macroinvertebrados, con importantes características de fertilidad: contenido alto y medio de MO, nitrógeno total y fósforo disponible de acuerdo con la Norma Oficial Mexicana NOM-021-RECNAT 2000 (SEMARNAT, 2000), con un índice alto de diversidad de Shannon, y un número alto de grupos abundantes, similar a lo encontrado por Velasquez et al. (2007) en cultivos de café en Nicaragua.
CONCLUSIONES
- El presente estudio confirma la hipótesis inicial, se encontró el menor número de grupos taxonómicos en aquellos sitios con las menores condiciones de fertilidad medidas.
- El número de grupos taxonómicos de los macroinvertebrados y la proporción de individuos de cada grupo pueden aportar información sobre las condiciones, la cantidad y la disponibilidad de la materia orgánica en el suelo.
-Es necesario hacer estudios ulteriores en donde el nitrógeno mineralizable también sea estudiado y entonces ver de cerca la relación de los macroinvertebrados y esta variable.
AGRADECIMIENTOS
A Fondos Mixtos Tabasco, quienes financiaron esta investigación. A los estudiantes de bachillerato de los municipios de Centro, Balancan y Tenosique así como a Sheyla Uribe, quienes apoyaron en las actividades de campo y Rodimiro Ramos quien ayudó en la transformación de coordenadas en UTM a geográficas.
LITERATURA CITADA
Anderson, J. M. and P. W. Flanagan. 1989. Biological processes regulating organic matter dynamics in tropical soils. pp. 97-125. In: D. C. Coleman J. M. Oades, G. Uehara (eds.). Dynamics of soil organic matter in tropical ecosystems. Niftal Project. University of Hawaii. Honolulu, Hawaii. [ Links ]
Anderson, J. M. and J. S. I. Ingram. 1993. Tropical soil biology and fertility: a handbook of methods. 2nd ed. CAB International. Wallingford, UK. [ Links ]
Astier-Calderón, M., M. Maass-Moreno y J. Etchevers-Barra. 2002. Derivación de indicadores de calidad de suelos en el contexto de la agricultura sustentable. Agrociencia 36: 605-620. [ Links ]
Barbault, R. 1997. Écologie générale, structure et fonctionnement de la biosphere. 4 ed. Masson. Paris, France. [ Links ]
Blanchart, E., P. Lavelle, E. Braudeau, Y. Le Bissonais, and C. Valentin. 1997. Regulation of soil structure by geophagous earthworm activities in humid savannas of Cote d'Ivoire. Soil Biol. Biochem. 29: 431-39. [ Links ]
Brown, G., B. Pashanasi, C. Villenave, J. C. Patron, B. K. Senapati, S. Giri, I. Barois, P. Lavelle, E. Blanchart, R. J. Blakemore, A. V. Spain, and J. Boyer. 1999. Effects of earthworms on plant production in the tropics. pp. 87-147. In: P. Lavelle, L. Brussaard, and P. F. Hendrix (eds.). Earthworm management in tropical agroecoystems. CAB International. Wallingford, UK. [ Links ]
Brown, G., C. Fragoso, I. Barois, P. Rojas, J. C. Patrón, J. Bueno, A. Moreno, P. Lavelle, V. Ordaz y C. Rodríguez. 2001. Diversidad y rol funcional de la macrofauna edáfica en los ecosistemas tropicales mexicanos. Acta Zoológica Mexicana Número especial 1: 79-10. [ Links ]
Brussaard, L. 1998. Soil fauna, guilds, functional groups and ecosystem processes. Appl. Soil Ecol. 9: 123-135. [ Links ]
Brussaard, L., M. Pullemanb, E. Oue'draogoc, A. Mandod, and J. Sixe. 2007. Soil fauna and soil function in the fabric of the food web. Pedobiologia 50: 447-462. [ Links ]
Chapman, H. D. y P. T. Pratt. 2000. Métodos de análisis para suelos, plantas y aguas, Trillas, México, D. F. [ Links ]
FAO (Food and Agriculture Organization). 1981. Agriculture: Horizon 2000. Vol. 23. Développement Economique et Social. FAO. Rome, Italy. [ Links ]
Giller, K. E., M. H. Beare, P. Lavelle, A.-M.N. Izac, and M. J. Swift. 1997. Agricultural intensification, soil biodiversity and agroecosystem function. Appl. Soil Ecol. 6: 3-16. [ Links ]
Guathier, G. 1971. El suelo y sus características agronómicas. Tratado de pedología agrícola. Omega. Barcelona, España. [ Links ]
Guggenberger, G., L. Haumaier, R. J. Thomas, and W. Zech. 1996. Assessing the organic phosphorus status of an Oxisol under tropical pastures following native savanna using 31P NMR spectroscopy. Biol. Fertil. Soils 23: 332-339. [ Links ]
Hole, F. D. 1981. Effects of animals on soil. Geoderma 25: 75-112. [ Links ]
Huerta, E., C. Fragoso y P. Lavelle. 2005. Efecto de la aplicación de hojarasca de mucuna sobre densidad y biomasa de lombrices de tierra. Terra Latinoamericana 23: 533-544. [ Links ]
Huerta, E., C. Fragoso, J. Rodríguez-Olan, I. Evia-Castillo, E. Montejo-Meneses, M. de la Cruz-Mondragon, and R. Garcia-Hernandez. 2006. Presence of exotic and native earthworms in principal agro- and natural systems in Central and Southeastern Tabasco, Mexico. Caribbean J. Sci. 42: 359-365. [ Links ]
Jimenez, J., T. Decaens, R. J. Thomas, and P. Lavelle. 2001a. Soil macrofauna: an available but little-known natural resource. pp. 1-16. In: J. Jimenez and R. Thomas (eds.). Soil macroinvertebrate communities in the neotropical savannas of Colombia. Centro Internacional de Agricultura Tropical. Cali, Colombia. [ Links ]
Jiménez, J., A. Cepeda, D. K. Friesen, T. Decaens, and A. Oberson. 2001b. Phosphorus Availability in casts of an Anecic savanna earthworm in a Colombian Oxisol. pp. 199-211. In: J. Jimenez and R. Thomas (eds.). Soil macroinvertebrate communities in the neotropical savannas of Colombia. Centro Internacional de Agricultura Tropical. Cali, Colombia. [ Links ]
Jones, C. G. , J. H. Lawton, and M. Shachak, 1994. Organisms as ecosystem engineers. Oikos 69: 373-386. [ Links ]
Klemens, E., T. Stierhof, J. Dauber, K. Kreimes, and V. Wolters. 2003. On the quality of soil biodiversity indicators: abiotic and biotic parameters as predictors of soil faunal richness at different spatial scales. Agric. Ecosyst. Environ. 98: 273-283. [ Links ]
Lal, R. 1988. Effects of macrofauna on soil properties in tropical systems. Agric. Ecosyst. Environ. 24: 101-116. [ Links ]
Lal, R. 1989. Tropical ecology and physical edaphology. John Wiley. London, UK. [ Links ]
Lavelle, P. 1996. Diversity of soil fauna and ecosystem function. Biol. Int. 33: 3-16. [ Links ]
Lavelle, P. and A. Spain. 2001. Soil ecology. Kluwer. Amsterdam, The Netherlands. [ Links ]
Lavelle, P., E. Blanchart, A. Martin, A.V. Spain, and S. Martin. 1992. Impact of soil fauna on the properties of soils in the humid tropics. pp. 157-185. In: R. Lal and P.A. Sanchez (eds.). Myths and science of soils in the tropics Special Publication 29. Soil Science Society of America. Madison, WI, USA. [ Links ]
Lavelle, P., E. Blanchart, A. Martin, S. Martin, A.V. Spain, F. Toutain, I. Barois, and R. Schaefer. 1993. A hierarchical model for decomposition in terrestrial ecosystems: application to soils of the humid tropics. Biotropica 25: 130-150. [ Links ]
Lavelle, P., D. Bignell, and M. Lepage. 1997. Soil function in a changing world: the role of invertebrate ecosystem engineers. Eur. J. Soil Biol. 33: 159-193. [ Links ]
Lavelle, P., T. Decaens, M. Aubert, S. Barot, M. Blouin, F. Bureau, F. Margerie, P. Mora, and J. P. Rossi. 2006. Soil invertebrates and ecosystem services, Eur. Soil Biol. 42: 3-15. [ Links ]
Lee, K. E. and R. C. Foster. 1991. Soil fauna and soil structure. Aust. J. Soil Res. 29: 745-775. [ Links ]
Mackay, A. D., J. K. Syers, J. A. Springett, and P. E. H. Gregg. 1982. Plant availability of phosphorus in superphosphate and a phosphate rock as influenced by earthworms. Soil Biol. Biochem. 14: 281-287. [ Links ]
Maldegue, M. 1959. Importance et role de la microfaune du sol. Bull. Agric. Congo Belge 50: 5-34. [ Links ]
Mathieu, J., J. P. Rossi, M. Grimaldi, P. Mora, P. Lavelle, and C. Rouland. 2005. A multi-scale study of soil macrofauna biodiversity in Amazonian pastures. Biol. Fertil. Soils 40: 300-305. [ Links ]
McColl, H. P. 1975. The invertebrate Fauna of the litter surface of a Nothofaus trucata forest floor, and the effect of micro-climate on activity. N. Z. J. Zoology 2: 15-34. [ Links ]
Neher, D. A. 1999. Soil community composition and ecosystem processes. Agrofor. Syst. 45: 159-185. [ Links ]
Olsen, S. R. and L. E. Sommers. 1982. Phosphorus. pp. 57-62. In: A. L. Page, R. H. Miller, and D. R. Keeny (eds.). Methods of soil analysis. Part 2. 2nd ed. American Society of Agronomy. Madison, WI, USA. [ Links ]
Pankhurst, C. E., B. G. Hawke, H. J. McDonald, C. A. Kirkby, J. C. Buckerfield, P. Michelson, K. A. O'Brien, V. V. S. R. Gupta, and B. M. Doube. 1995. Evaluation of soil biological properties as potential bioindicators of soil health. Aust. J. Agric. Res. 35 : 1015-1028. [ Links ]
Pieri, C. 1989. Fertilité des terres de savanes. Ministére de la Cooperation et CIRAD-IRAT. Paris, France. [ Links ]
Rangel, A. F., R. J. Thomas, J. J. Jimenez, and T. Decaens. 2001. Nitrogen dynamics associated with earthworm casts of Martiodrilus carimaguensis in a Colombian Savanna Oxisol. pp. 195-198. In: Jimenez J., Thomas R. Soil Macroinvertebrate communities in the neotropical savannas of Colombia. CIAT. Colombia. [ Links ]
Schaefer, M., and J. Schauermann. 1990. The Soil fauna of beech forests: a comparison between a mull and a moder soil. Pedobiologia 34: 299-314 [ Links ]
SEMARNAT (Secretaría del Medio Ambiente y Recursos Naturales). 2000. Norma Oficial Mexicana NOM-021-RECNAT-2000. México, D. F. [ Links ]
Sharpley, A. N. and J. K. Syers. 1976. Potential role of earthworm casts for phosphorus enrichment of run-off waters. Soil Biol. Biochem. 8: 341-346. [ Links ]
Singh, J. and K. S. Pillai. 1975. A study of soil microarthropod communities in some fields. Rev. Ecol. Biol. Sol. 12: 579-590. [ Links ]
Statsoft. 1995. Statistica for Windows. Computer program manual. Statsoft. Tulsa, OK, USA. [ Links ]
Svensson, B. H., U. Bostrom, and L. Klemdtson. 1986. Potential for higher rates of denitrification in earthworm casts than the surrounding soil. Biol. Fertil. Soils 2: 147-149. [ Links ]
Syers, J. K., A. N. Sharpley, and D. R. Keeney. 1979. Cycling of nitrogen by surface-casting earthworms in a pasture ecosystem. Soil Biol. Biochem. 11: 181-185. [ Links ]
Thioulouse, J., D. Chessel, S. Dolédec, and J-P. Olivier. 1997. ADE-4: a multivariate analysis and graphical display software. Statistics and Computing 7: 75-83. [ Links ]
Tiedje, J. M. 1995. Approaches to the comprehensive evaluation of Prokaryote diversity of a habitat. pp. 73-82. In: D. Allsop, R. R. Colwell, DL. Hawksworth, (eds.). Microbial diversity and ecosystem function. United Nations Environment Programme (UNEP) CAB International. Wallingford, UK. [ Links ]
Velasquez, E., P. Lavelle, and M. Andrade. 2007. GISQ, a multifunctional indicator of soil quality. Soil Biol. Biochem. 39: 3066-3080. [ Links ]
Walkley, A. and I. A. Black. 1934. An examination of the Degtjareff method for determining soil organic matter and proposed modification of the chromic acid titration method. Soil Sci. 37: 29-38. [ Links ]
* Publicado en Terra Latinoamericana 26: 171–181.