Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Terra Latinoamericana
versión On-line ISSN 2395-8030versión impresa ISSN 0187-5779
Terra Latinoam vol.26 no.2 Chapingo abr./jun. 2008
División II
Ensayo
Bioquímica, fisiología y morfología de la senescencia nodular: una revisión crítica*
Biochemistry, Physiology and Morphology of Nodule Senescence: a Critical Review
Fabián Fernández-Luqueño1 y David Espinosa-Victoria1‡
1 Colegio de Postgraduados, Campus Montecillo. 56230 Montecillo, Estado de México. ‡Autor responsable (despinos@colpos.mx)
Recibido: junio de 2005.
Aceptado: abril de 2008.
RESUMEN
El nódulo es un órgano nuevo producto de la interacción altamente específica entre bacterias denominadas colectivamente rizobias, y las raíces y tallos de las leguminosas. El nódulo fija nitrógeno atmosférico por un periodo de tiempo determinado después del cual esta actividad decrece dando lugar a la lisis y, finalmente, a su muerte. La senescencia nodular es un conjunto de alteraciones fisiológicas, bioquímicas y estructurales que son inducidas por envejecimiento natural, o bien, cuando las plantas son sometidas a estrés. Los nódulos se clasifican, en función de su desarrollo, en determinados e indeterminados, y poseen un patrón de senescencia diferente. En nódulos de soya, alfalfa, frijol común y chícharo se han identificado diversos compuestos involucrados en el proceso de senescencia como proteasas, especies de oxígeno reactivo, nitrogenasa, leghemoglobina, hormonas, poliaminas, fitoalexinas y vitaminas. Diversos organelos celulares, como mitocondrias, cloroplastos, membrana celular, el aparato de Golgi y el núcleo, sufren importantes alteraciones durante la senescencia del nódulo. El retardo de la senescencia nodular puede incrementar el tiempo de fijación de nitrógeno, lo cual tendría implicaciones agronómicas y ambientales benéficas. Poco se conoce al respecto de los mecanismos moleculares involucrados en la senescencia nodular. La manipulación genética brinda herramientas que pudieran permitir reducir la expresión de los genes involucrados en la síntesis de compuestos que degradan la estructura interna del nódulo, o bien, incrementar los mecanismos de defensa del nódulo contra metabolitos antagonistas.
Palabras clave: fijación de nitrógeno, rizobia, poliaminas, simbiosis, estrés.
ABSTRACT
The nodule is a new organ which results from the highly specific interaction between rhizobia and legume roots and stems. The nodule fixes atmospheric nitrogen during a specific period of the symbiosis lifetime. Then, this activity decreases leading to nodule lysis and death. Nodule senescence is a cluster of physiological, biochemical and morphological alterations induced by natural aging and stress conditions. Nodules are classified in terms of their development as determinate or indeterminate, and they exhibit different patterns of senescence. In soybean, alfalfa, common bean, and pea nodules different compounds have been identified which are involved in the senescence process, such as proteases, types of reactive oxygen, nitrogenase, leghaemoglobin, plant growth promoters, polyamines, phytoalexins, and vitamins. Cellular organelles such as mitochondria, chloroplasts, cell membrane, Golgi apparatus, and nuclei undergo important alterations during nodule senescence. Delay of nodule senescence could increase the nitrogen fixing period, which might have beneficial agronomic and environmental implications. Little is known about the mechanisms involved in nodule senescence. Genetic manipulation might be used to reduce the expression of genes which encode the synthesis of compounds that degrade the nodule structure or to trigger the nodule defense mechanisms against antagonistic metabolites.
Keywords: nitrogen fixation, rhizobia, polyamines, symbiosis, stress.
INTRODUCCIÓN
Con excepción del género Parasponia de la familia Ulmaceae, la habilidad para fijar nitrógeno biológicamente con bacterias gram-negativas del suelo está restringida a especies de la familia Fabaceae (Szczyglowski y Amyot, 2003; Young et al., 2003). Las bacterias simbiótico mutualistas que fijan nitrógeno atmosférico en las leguminosas son colectivamente llamadas rizobias (Perret et al., 2000; Brewin, 2002; Broughton, 2003), las cuales están agrupadas en 13 géneros: Rhizobium, Sinorhizobium, Mesorhizobium, Bradyrhizobium, Azorhizobium y Allorhizobium (Zakhia y De Lajudie, 2001; Dakora, 2003), Devosia (Rivas et al., 2003), Blastobacter (Berkum y Eardly, 2002), Methylobacterium (Abdoulaye et al., 2001), Burkholderia (Vandamme et al., 2002), Wautersia (Chen et al., 2001), Ochrobactrum (Trujillo et al., 2005) y Labrys (Chou et al., 2007). Estas bacterias inducen la formación de órganos altamente especializados denominados nódulos (Voisin et al., 2002a, b; Broughton, 2003) , en donde el nitrógeno fijado (NH3) es convertido en ureidos o amidas (Puppo et al., 2005) y, posteriormente, exportado al resto de la planta (Whitehead et al., 2001). A cambio de N las rizobias reciben de la planta energía y C en forma de ácidos dicarboxílicos (Lodwig et al., 2003; Barsch et al., 2006). Las células infectadas de los nódulos contienen unidades independientes denominadas simbiosomas (Wittenberg et al., 1996; Garg y Geetanjali, 2007) conformadas por un bacteroide, la membrana peribacteroidal (MPB) la cual es de origen vegetal (Day et al., 2001; Brewin, 2004) , y contiene más de 51 proteínas (Catalano et al., 2004), y por el espacio peribacteroidal que comprende el fluido entre el bacteroide y la MPB (Hossain et al., 2006).
Tanto las plantas como las rizobias crecen y se reproducen independientemente, pero no fijan nitrógeno atmosférico de forma aislada (Denison, 2000). Además, la simbiosis requiere de una combinación compatible entre la planta y la cepa del rizobia (Brewin, 2002; Bala y Giller, 2006). Sin embargo, algunas rizobias son bastante promiscuas, Rhizobium sp. cepa NGR234, por ejemplo, puede infectar a más de 100 géneros de leguminosas (Pueppke y Broughton, 1999). Por otro lado, ciertas especies de Rhizobium, Sinorhizobium y Mesorhizobium colonizan y forman nódulos en el frijol común (Phaseolus vulgaris L.) capaces de fijar nitrógeno atmosférico (Martínez-Romero, 2003). En general, con base en el tipo de crecimiento, existen dos tipos de nódulos (Gualtieri y Bisseling, 2000). Los nódulos de crecimiento determinado (NCD), presentes en especies de algunos géneros como Glycine, Lotus y Phaseolus, alcanzan en pocas semanas su crecimiento máximo y tienen forma esférica debido al carácter no persistente de su meristemo. Por otra parte, los nódulos de crecimiento indeterminado (NCI), presentes en especies de algunos géneros como Medicago, Trifolium y Pisum, tienen un meristemo apical persistente que confiere a los nódulos una forma alargada (Becana et al., 2000). Denison (2000) y Kiers et al. (2003) demostraron que tanto en NCD como en NCI es posible encontrar más de una cepa de rizobia por nódulo.
De 12 años a la fecha se han publicado más de 30 revisiones de la simbiosis rizobia-leguminosa (Puppo et al., 2005), de las cuales sólo dos abordan el tópico de senescencia nodular en las leguminosas (Swaraj y Bishnoi, 1996; Puppo et al., 2005), ambas publicadas en inglés. Este ensayo es una aportación actualizada, a disposición de lectores hispanoparlantes interesados en conocer las principales alteraciones que se presentan durante la senescencia nodular en leguminosas.
El objetivo de este ensayo es dar a conocer los avances científicos relacionados con la bioquímica, fisiología y morfología de la senescencia nodular, con base en las aportaciones más importantes que se han publicado en los últimos años.
¿Qué es la Senescencia Nodular (SN)?
No existe una definición clara de SN. Alesandrini et al. (2003) la definen como una disminución rápida de la fijación biológica de nitrógeno que afecta el rendimiento de la semilla (Lawn y Brun, 1974b), mientras que Pfeiffer et al. (1983) la definieron como el periodo en el cual se pierde la actividad de la nitrogenasa residual. Por otro lado, para Andreeva et al. (1998) y Evans et al. (1999) la senescencia es un evento bioquímico y fisiológico que requiere de la transcripción genética de novo (Howard et al., 2003), presentándose en el estadio final de la maduración y concluyendo con la muerte del nódulo.
La SN y su Importancia Agronómica y Ambiental
Van de Velde et al. (2006) formularon la hipótesis de que al retardar el proceso de SN, podría haber un efecto benéfico sobre el rendimiento y la calidad de la semilla. Sin duda, esto tendría un impacto favorable en la actividad agrícola, debido a que se disminuiría el uso de fertilizante nitrogenado sintetizado a partir de N atmosférico mediante el proceso de Haber-Bosh, a expensas de combustibles derivados del petróleo (Nosengo, 2003). Hay mucha evidencia de los beneficios económicos y ambientales que se alcanzarían al reemplazar la fertilización nitrogenada por la inoculación con cepas de rizobias para cultivos de leguminosas (Hungria et al., 2006; Ghosh et al., 2007; Russelle et al., 2007). Sin embargo, si la SN inicia muy pronto, esto tendría como consecuencia la disminución de la fijación biológica de nitrógeno y la merma en el rendimiento y la calidad de la semilla (Clement et al., 2006).
Variación en la Senescencia Nodular
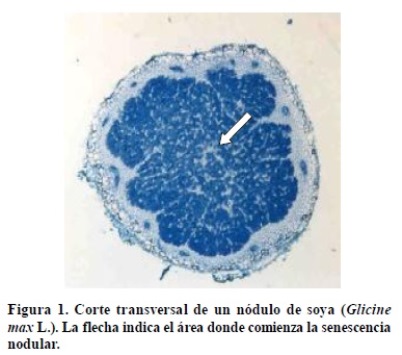
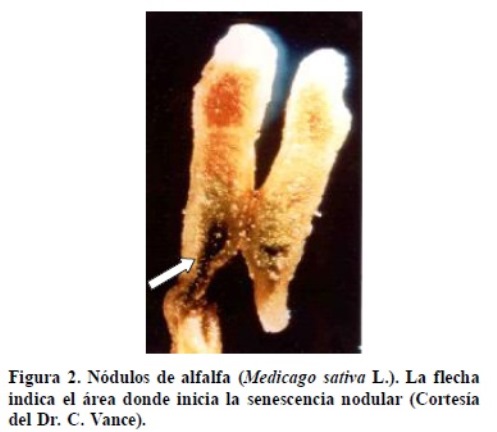
Durante el proceso de SN se presentan cambios morfológicos, bioquímicos y fisiológicos (Noodén et al., 1997; Fujihara et al., 2006) que pueden variar entre los nódulos, dependiendo de su localización en el sistema radical (Vikman y Vessey, 1993b). Dichos cambios están estrechamente relacionados con la transición de la fase vegetativa a la fase reproductiva de la planta (Vance et al., 1986; Swaraj et al., 1995), así como con las condiciones ambientales (estrés) bajo las cuales se cultivan las leguminosas. Vance et al. (1986) reportaron diferencias entre los NCD y NCI en relación con la zona y periodos en los que se presenta la SN. En los NCD, la senescencia comienza en la zona central de la corteza (Figura 1) y se extiende hacia la periferia, hasta causar el deterioro total del nódulo (Puppo et al., 2005). En contraste, la zona de senescencia en los NCI, en particular los de leguminosas perennes, como la alfalfa (Medicago sativa L.), inicia en la región proximal (Figura 2) o base del nódulo y presenta varios periodos de senescencia y recuperación durante la vida de la planta (Vance, 1983).
Los NCI poseen una pequeña zona donde los bacteroides no están rodeados por la MPB (Timmers et al., 2000). Además, tales nódulos podrían sufrir ciclos consecutivos de senescencia y recuperación (Vance et al., 1986). En cambio, en los NCD, una vez que se inicia el proceso de senescencia éste es irreversible y los bacteroides mueren. Cuando los NCI inician el proceso de senescencia, a diferencia de los NCD, los bacteroides continúan vivos (Manen et al., 1991), salen del nódulo, vuelven a poblar el suelo, se reproducen (Muller et al., 2001b), e incluso tienen mayor posibilidad de sobrevivir que las rizobias nativas (Provorov, 1998).
Ocurrencia y Causas de la Senescencia Nodular
La senescencia del nódulo podría ser una reacción retardada de la planta hospedera contra el establecimiento de las rizobias (Manen et al., 1991; Staehelin et al., 1992; Puppo et al., 2005). La SN coincide con la senescencia de la raíz (Fisher et al., 2002) o con la senescencia de la planta completa (Timmers et al., 2000; Palma et al., 2006); sólo en algunas especies y bajo ciertas condiciones ambientales (Vikman y Vessey, 1992) ocurre de forma natural al inicio de la floración (Andreeva et al., 1998), por la síntesis de señales generadas en la parte aérea (Puppo et al., 2005) o bien durante el llenado de la vaina (Vikman y Vessey, 1993a; Andreeva et al., 1998). Los nódulos de las raíces de las leguminosas se caracterizan por una senescencia temprana, comparada con la senescencia del resto de los órganos de la planta (Evans et al., 1999). La SN se ha inducido y estudiado bajo diferentes condiciones ambientales adversas como la defoliación (Matamoros et al., 1999a; Muller et al., 2001a), oscuridad (Swaraj et al., 1994; Gogorcena et al., 1997), exceso de nitratos (Walsh, 1995; Voisin et al., 2002a, b), altas concentraciones de NaCl (Comba et al., 1998; Trinchant et al., 2004; Garcia et al., 2007), exceso de contaminantes como el cadmio (Balestrasse et al., 2004), altas concentraciones de CO2 (Erice et al., 2007), salinidad (Nandwal et al., 2007) y déficit de agua e inundación (Gogorcena et al., 1995).
Senescencia y Cambios Morfológicos en el Nódulo
El primer síntoma visible de SN es el cambio de color y la pérdida de turgencia en los primeros nódulos formados (Swaraj et al., 1995). El color rosado (debido a la presencia de la leghemoglobina) pasa a color oscuro (Vikman y Vessey, 1993c) o verde (Muller et al., 2001a), debido a la alteración que sufre esta proteína (Swaraj y Bishnoi, 1996).
Durante la senescencia, los lípidos de la membrana son degradados por peroxidación (Thompson et al., 1987), y las proteínas y ácidos nucleicos (Balestrasse et al., 2004), lo cual conlleva a la degradación de la MPB por radicales libres producidos por los bacteroides (Vincent y Brewin, 2000). Sin embargo, Hernández-Jiménez et al. (2002) observaron en nódulos de Lupinus sp. que la MPB no presentó daño hasta que el proceso de senescencia ya estaba muy avanzado. Por su parte, Muller et al. (2001a) encontraron trealosa acumulada en los bacteroides, la cual podría proteger su membrana, o bien, ser utilizada como reserva de energía. La trealosa es una molécula bioprotectora debido a su capacidad para estabilizar bioestructuras, como proteínas y lípidos de membranas (Pereira et al., 2004).
Cermola et al. (2000) y Puppo et al. (2005) observaron, en nódulos de frijol con diferente grado de senescencia, que la densidad de bacteroides en células no senescentes es mucho mayor respecto a las células senescentes. Sin embargo, Muller et al. (2001a) no encontraron diferencia en la cantidad de bacteroides al comparar nódulos senescentes con nódulos jóvenes. Por otra parte, Trinchant et al. (2004) observaron, en nódulos de alfalfa, que la densidad promedio de simbiosomas es menor en nódulos senescentes; además, detectaron que las mitocondrias de las células presentes en los nódulos senescentes se agrupan y su estructura interna es destruida. De Lorenzo et al. (1994) observaron, en nódulos senescentes de Lupinus albus L., cv. Multolupa, alteraciones ultraestructurales que consistieron en la pérdida de la capa externa del peroxisoma, mientras que en nódulos senescentes de lupinus blanco (Lupinus albus L., cv. Stara) y lupinus amarillo (Lupinus luteus L., cv. Fakel) se observó un decremento en el número de ribosomas y contenido de cromatina del núcleo, así como cambios en el retículo endoplásmico rugoso, los dictiosomas del aparato de Golgi, la mitocondria y el citoplasma (Andreeva et al., 1998). Las vacuolas, más que cualquier otro organelo, sintetizan y liberan endoproteasas, las cuales son las principales responsables de la degradación de proteínas del citoplasma y de los organelos durante la senescencia (Huffaker, 1990). En el proceso de SN los plástidos son los últimos organelos que se destruyen (Lucas et al., 1998).
Cambios Bioquímicos y Fisiológicos
La senescencia nodular se caracteriza por alteraciones que involucran reguladores de crecimiento, especies de oxígeno reactivas, leghemoglobina, metabolismo del nitrógeno, nitrogenasa, fitoalexinas, poliaminas y ferritina.
Reguladores de crecimiento y senescencia nodular. Existen evidencias de que el proceso de senescencia podría ser inducido por una señal sistémica, como la reducción en el aporte de carbohidratos a la raíz (Lawn y Brun, 1974a), o bien, a través de un regulador hormonal producido en la parte aérea de la planta y transportado hacia la raíz (Noodén, 1984). Swaraj et al. (2001) sugieren que la disminución de la actividad de la nitrogenasa puede estar relacionada con un incremento en el balance de ácido indolacético, citoquininas, ácido absísico, o bien, con la presencia de glutamina en el floema (Hwee y Layzell, 1997). Por su parte, Ferguson y Mathesius (2003) sugieren que la SN podría ser favorecida por altas concentraciones en el nódulo de auxinas, citoquininas, etileno, ácido giberélico, ácido absísico y ácido ascórbico (Matamoros et al., 2006). El estudio de la SN arroja datos contradictorios debidos, probablemente, a que la investigación de las alteraciones bioquímicas se complica por la presencia de los bacteroides que continúan con su crecimiento como saprófitos durante el proceso de senescencia (Vance et al., 1986).
Especies de oxígeno reactivas (EOR). Las principales EOR incluyen radicales superóxidos (O2•, Becana y Klucas, 1992), radicales hidroxilo (•OH), oxígenos libres (O2), H2O2, radicales alcohoxil (RO•), radical peroxil (ROO•), ácidos grasos polinsaturados y radicales libres de simiquinonas (Groten et al., 2005; 2006); algunas de estas especies de oxígeno, en particular O2•, son fuertemente oxidativos (Mathieu et al., 1998; Becana et al., 2000). Dalton et al. (1991) reportaron que la formación de EOR ocurre como resultado de las fuertes condiciones de reducción requeridas para la fijación de nitrógeno y la acción de varias proteínas como la ferredoxina, uricasa e hidrogenasa. Sin embargo, de acuerdo con Rubio et al. (2007), para protegerse de condiciones ambientales extremas o de patógenos, las plantas poseen sistemas de defensa enzimáticos (superóxido dismutasa, peroxidasas y el ciclo ascorbato-glutatión) y no enzimáticos (ascorbato, alfa tocoferol, beta-caroteno y flavonoides) (Subramanian et al., 2007) distribuidos en organelos celulares como cloroplastos, mitocondrias y peroxisomas (Klapheck, 1988, Dalton et al., 1998; Matamoros et al., 1999b). El estrés oxidativo daña al ADN y ARN (Corpas et al., 1997; Moran et al., 1997). En los nódulos, las EOR son de gran importancia para el establecimiento y mantenimiento de la relación simbiótica rizobia-leguminosa (Shaw y Long, 2003). En plantas senescentes, las EOR son abundantes (Thompson et al., 1987) y son producidas principalmente en mitocondrias (Moller, 2001), cloroplastos (Apel y Hirt, 2004) y nódulos (Becana et al., 2000). El daño que causan las EOR se debe a un incremento en la síntesis de tales compuestos, más que a una disminución en la defensa de los antioxidantes (Evans et al., 1999). Sin embargo, para Swaraj et al. (2001) la senescencia se presenta por un incremento de las EOR acompañado de una disminución de los mecanismos de defensa contra las EOR, las cuales son los mediadores primarios del daño oxidativo en plantas senescentes (Swaraj et al., 1993). Por otra parte, el proceso de SN ha sido correlacionado con un aumento en la concentración del oxígeno reactivo (Porcel et al., 2003). Esto es importante porque el daño oxidativo a los lípidos de membranas, proteínas y ácidos nucleicos ha sido propuesto como uno de los principales mecanismos de activación de la SN en nódulos sometidos a estrés (Balestrasse et al., 2004; Barloy-Hubler et al., 2004).
Oxidación de la leghemoglobina y senescencia nodular. La principal fuente de oxígeno reactivo en los nódulos es la leghemoglobina (Puppo y Halliwell, 1988), la cual se encuentra en concentraciones de 1 a 5 mM en el citosol de las células infectadas (Dalton et al., 1991) y se autooxida (Günther et al., 2007), debido a que ésta facilita el transporte de O2 a los bacteroides a flujo bajo (10 nM) pero constante (Long, 2001) para prevenir la inactivación de la nitrogenasa (Layzell y Hunt, 1990). Lee et al. (1995) encontraron que en los nódulos senescentes predomina la leghemoglobina oxidada, mientras que los nódulos jóvenes y sanos contienen leghemoglobina reducida y flavinas (Ji et al., 1991). Aunque durante la SN se sintetizan inhibidores de proteasas (Manen et al., 1991), altos niveles de enzimas proteolíticas podrían promover la degradación de células infectadas y la disminución de la concentración de la leghemoglobina (Espinosa-Victoria et al., 2000; Fedorova y Brown, 2007). Hernández-Jiménez et al. (2002) observaron en nódulos de soya, chícharo y lupinus disminución de la concentración de leghemoglobina cuando los nódulos comenzaron a senescer; Pladys y Rigaud (1985) encontraron datos similares en nódulos de frijol común. Un complejo de leghemoglobina-óxido nítrico (Lg-ON) ocurre en los nódulos de la raíz como resultado de la reducción de nitrato exógeno, debido a las fuertes condiciones de reducción necesarias para la fijación de nitrógeno (Kanayama y Yamamoto, 1990). Mathieu et al. (1998) observaron que a medida que los nódulos senescen, la concentración de Lg-ON decrece considerablemente. En nódulos de plantas sometidas a estrés se observó la disminución de la actividad fijadora de nitrógeno seguida de un decremento en la concentración de leghemoglobina (Gonzalez et al., 2001; Palma et al., 2002) y de un cambio de pH de 6.4 en nódulos jóvenes y funcionales a 5.5 en nódulos senescentes (Pladys et al., 1988).
Metabolismo del nitrógeno y senescencia nodular. Matamoros et al. (1999a) encontraron, luego de tratar plantas de frijol común con 10 mM de nitrato durante cuatro días, que la SN se induce progresivamente, debido a que el nitrato disminuye la concentración de sacarosa (Minchin et al., 1986) y de la actividad de la nitrogenasa, ya que se restringe el acceso de oxígeno hacia los bacteroides (Vessey et al., 1988b). El tratamiento con nitrato está caracterizado por una importante disminución en las defensas antioxidantes y por una acumulación moderada de proteínas oxidadas (Escuredo et al., 1996). Pladys y Rigaud (1985) reportaron que la alteración que sufren los nódulos senescentes no permite la translocación de aminoácidos por lo que son liberados en la rizosfera mejorando la fertilidad del suelo.
Modificación de la actividad nitrogenasa. La nitrogenasa es la enzima que cataliza la fijación de nitrógeno atmosférico (Christiansen et al., 2001), cuya síntesis y actividad pueden ser afectadas irreversiblemente si se modifica la concentración de O2 dentro del nódulo (Millar et al., 1995; Dalton et al., 1998). En frijol común, el llenado de la vaina coincide con el incremento de la actividad proteolítica y la disminución de tanto la actividad de la nitrogenasa como de la concentración de leghemoglobina (Vikman y Vessey, 1993a, b), lo cual concuerda con datos presentados por Muller et al. (2001a). Sin embargo, en experimentos similares Rennie y Kemp (1984) y Vikman y Vessey (1992) no observaron reducción significativa de la nitrogenasa. Por otra parte, en plantas de soya la SN se presentó aun antes del inicio del llenado de la vaina (Schweitzer y Harper, 1985). Wolyn et al. (1989) y McDermott y Graham (1989) observaron en plantas de frijol común y soya que la actividad de la nitrogenasa está relacionada con la posición de los nódulos en relación con la distancia con la raíz principal. Minchin et al. (1989) reportaron que en plantas de frijol común se presentó la disminución en 85% de la actividad de la nitrogenasa luego de tratarlas durante cuatro días con 10 mM de nitrato. Sin embargo, con los mismos tratamientos, Vessey et al. (1988a) observaron la disminución de sólo el 65% de la actividad de la nitrogenasa en nódulos de soya, mientras que Minchin et al. (1986) reportaron una pérdida de sólo 60% en nódulos de trébol blanco.
Fitoalexinas, poliaminas y otros compuestos. Espinosa-Victoria et al. (2000) reportaron que el retardo de la SN en dos cultivares de soya, Hardin y Hodgson 78, estuvo asociado con bajos niveles de la fitoalexina gliceolina I, y de las poliaminas putrescina y espermidina. Por su parte, Boydston et al. (1983) reportaron que altos niveles de gliceolina afectan la mitocondria y la membrana celular del hospedero. Por otro lado, Parniske et al. (1991) y Osawa y Tsuji (1992) reportaron que la gliceolina I y las poliaminas tienen efecto antibiótico sobre B. japonicum en medio de cultivo, por lo tanto, es probable que estos compuestos afecten la función nodular y la actividad de la nitrogenasa. Krylova et al. (2007a, b) reportaron que durante todo el proceso de desarrollo de Vicia faba L., en particular durante la senescencia nodular, se modifica el transporte de malato, sucinato y glutamato a través de la MPB.
En nódulos maduros de soya se han encontrado isoformas de quitinasa susceptibles a la actividad de las lisoenzimas (Staehelin et al., 1992; Xie et al., 1999). La tilo-proteasa es la enzima proteolítica más importante capaz de inducir la senescencia en células vegetales (Palma et al., 2002). Esta enzima se ha identificado en nódulos senescentes de soya (Malik et al., 1981), frijol común (Pladys et al., 1991) y alfalfa (Pladys y Vance, 1993).
Ferritina. La ferritina es una proteína antioxidante con la capacidad de secuestrar y almacenar hasta 4500 átomos de Fe por molécula en una forma catalíticamente inactiva (Hernández-Jiménez et al., 2002). El principal tráfico de hierro entre el hospedero y los microsimbiontes es la forma ferrosa (Moreau et al., 1998), por lo que podrían existir compuestos capaces de quelatar la forma ferrosa en el espacio peribacteroidal (Evans et al., 1999). Lucas et al. (1998) observaron que los plástidos acumulan ferritina en función del desarrollo de los nódulos senescentes. Strozycki et al. (2007) observaron que al inicio de la SN esta molécula se transloca hacia nódulos de menor edad. En nódulos jóvenes la ferritina es abundante; sin embargo, su concentración declina posteriormente conforme aumenta la nitrogenasa y la leghemoglobina, sugiriendo esto que la ferritina sede Fe a tales proteínas (Regland y Theil, 1993; Kimata y Theil, 1994). Por otro lado, Ko et al. (1987) encontraron que la concentración de ferritina en los nódulos de soya está correlacionada positivamente con la efectividad de los nódulos. Contrariamente, Matamoros et al. (1999a) identificaron acumulación de ferritina en nódulos senescentes de plantas de frijol tratadas con nitrato. Balestrasse et al. (2004) observaron, en plantas de soya tratadas con cadmio, que un alto contenido de hierro precede a una disminución de leghemoglobina y un incremento de ferritina en el nódulo.
Mecanismos Moleculares de la Senescencia Nodular
Fedorova et al. (2002) identificaron 340 genes que son exclusivamente expresados en el nódulo y algunos de los cuales podrían estar directamente involucrados en el proceso de SN. Para identificar los genes se extrajo ARN total de nódulos jóvenes, nódulos senescentes, raíces, hojas, flores y vainas. El ARN total fue separado por electroforesis e hibridizado con sondas de 32P. Las sondas se hicieron con insertos de cADN de diversos clones. El análisis de bases de datos, secuenciación y análisis de secuencias se realizó a través de los programas BLAST, INTER-PRO y PSORT. Estudios adicionales para secuencias consecutivas se realizaron en un 3100 Genetic Analyzer (Applied Biosystems, Foster City, CA, EE. UU.) en el Centro de Análisis de Genética Avanzada de la Universidad de Minnesota.
Las plantas en general, mediante mecanismos comunes de regulación genética, reprimen los genes activados por estrés vía un promotor negativo (Thirkettle-Watts et al., 2003). Alesandrini et al. (2003) observaron que en nódulos de soya con 10 semanas de edad, los cuales se encontraban en senescencia, expresaban un gen de proteasas dependientes de cisteína en todo el tejido central infectado por Bradyrhizobium. La presencia del gen estuvo asociada con una gran cantidad de peróxido de hidrógeno y la existencia de una zona necrótica. Por otra parte, se ha detectado la expresión de genes de proteasas dependientes de cisteína en nódulos senescentes de chícharo (Kardailsky y Brewin, 1996), vicia china (Naito et al., 2000) y soya (Alesandrini et al., 2003), así como la expresión de los genes de la chalcona sintasa en nódulos senescentes de chícharo (Yang et al., 1991). Por su parte, Espinosa-Victoria et al. (2000) observaron, en nódulos senescentes de soya, que el retardo de la senescencia nodular está asociado con la reducción de la expresión de los genes de la fenilalanina amonio-liasa (PAL) y la chalcona sintasa (CHS).
El reconocimiento y la modificación de algunos factores genéticos, los cuales predisponen a los nódulos a una senescencia temprana y a una pérdida de leghemoglobina podrían favorecer un considerable aumento en la eficiencia de la fijación biológica de nitrógeno (Appleby, 1984). Van de Velde et al. (2006) reportaron que los transcriptomas de la senescencia nodular y de la senescencia de la hoja tiene un alto grado de superposición, lo que hace suponer que ambos mecanismos de senescencia inician a través de vías similares. No obstante, aún es necesario identificar las señales que activan la formación de zonas senescentes en el nódulo para que sea posible controlar la longevidad de este órgano. Por ahora se ha demostrado, a través de técnicas moleculares, que genes que controlan el desarrollo de la planta, la resistencia a enfermedades y la respuesta a estrés (APS/ARF) participan en la activación de la SN (Van de Velde et al., 2006).
CONCLUSIONES
- Los estudios de senescencia nodular (SN) en leguminosas tienen por objeto entender el fenómeno y posiblemente permitan prolongar el tiempo de la fijación biológica de nitrógeno. El retardo en el proceso de SN tendría implicaciones favorables tanto ambientales, reduciendo riesgos por eutrificación causada por el uso inadecuado de fertilizante nitrogenado, como agronómicas, evitando que la limitación de nitrógeno en el momento del llenado de la vaina afecte la formación de la semilla y, en consecuencia, el rendimiento.
- Básicamente todos los resultados presentados hasta ahora se basan en observar qué metabolitos o cambios morfológicos coinciden con la SN. Sin embargo, aún no se conoce ni el papel fundamental que cada metabolito tiene en el proceso de SN, ni la interacción entre ellos.
- Quizá el silenciamiento de genes permita reducir la síntesis de proteasas y de especies de oxígeno reactivas (EOR), o bien, a través de la manipulación genética se pueda incrementar la síntesis de inhibidores de proteasas y de EOR, algunos de los cuales ya se han identificado. La identificación y el aislamiento de promotores involucrados en uno o más estadios de la SN sería de gran utilidad para entender este importante proceso en las leguminosas.
- La senescencia de hojas, flores y frutos ha sido bien documentada a nivel bioquímico y genético; no obstante, a pesar de que un buen número de experimentos han sido diseñados para estudiar el proceso de SN, se requiere desarrollar más investigación a nivel bioquímico, molecular y celular.
LITERATURA CITADA
Abdoulaye, S. Y., E. Giraud, P. Jourand, N. Garcia, A. Willems, P. Lajulie, Y. Prim, M. Neyra, M. Gillis, C. Boivin-Masson, and B. Dreyfus. 2001. Methylotrophic Methylobacterium bacteria nodulate and fix nitrogen in symbiosis with legumes. J. Bacteriol. 183: 214-220. [ Links ]
Alesandrini, F., R. Mathis, G. van de Sype, D. Herouart, and A. Puppo. 2003. Possible roles of a cysteine protease and hydrogen peroxide in soybean nodule development and senescence. New Phytol. 158: 131-138. [ Links ]
Andreeva, N. I., G. M. Kozharinova, and S. F. Izmailov. 1998. Senescence of legume nodules. Russian J. Plant Physiol. 45: 101-112. [ Links ]
Apel, K. and H. Hirt. 2004. Reactive oxygen species: metabolism, oxidative stree, and signal transduction. Annu. Rev. Plant Biol. 55: 373-399. [ Links ]
Appleby, C. A. 1984. Leghemoglobin and Rhizobium respiration. Annu. Rev. Plant Physiol. 35: 443-478. [ Links ]
Bala, A. and K. E. Giller. 2006. Relationships between rhizobial diversity and host legume nodulation and nitrogen fixation in tropical ecosystems. Nutr. Cycling Agroecosyst. 76: 319-330. [ Links ]
Balestrasse, K. B., S. M. Gallego, and M. L. Tomaro. 2004. Cadmium-induced senescence in nodules of soybean (Glycine max L.) plants. Plant Soil 262: 373-381. [ Links ]
Barloy-Hubler, F., A. Chéron, A. Hellégouarch, and F. Galibert. 2004. Smc01944, a secreted peroxidase induced by oxidative stresses in Sinorhizobium meliloti 1021. Microbiology 150: 657-664. [ Links ]
Barsch, A., V. Tellstrom, T. Patschkowski, H. Kuster, and K. Niehaus. 2006. Metabolite profiles of nodulated alfalfa plants indicate that distinct stages of nodule organogenesis are accompanied by global physiological adaptations. Mol. Plant-Microbe Interact. 19: 998-1013. [ Links ]
Becana, M. and R. V. Klucas. 1992. Transition metals in legume root nodules: iron-dependent free radical production increases during nodule senescence. Proc. Natl. Acad. Sci. USA 89: 8958-8962. [ Links ]
Becana, M., A. D. Dalton, F. J. Moran, I. Iturbe-Ormaetxe, A. M. Matamoros, and C. M. Rubio. 2000. Reactive oxygen species and antioxidants in legume nodules. Physiol. Plant. 109: 372-381. [ Links ]
Berkum, P. V. and B. D. Eardly. 2002. The aquatic budding bacterium Blastobacter denitrificans is a nitrogen-fixing symbiont of Aeschynomene indica. Appl. Environ. Microbiol. 68: 1132-1136. [ Links ]
Boydston, R., J. D. Paxton, and D. E. Koeppe. 1983. Glyceollin: a site specific inhibitor of electron transport in isolated soybean mitochondria. Plant Physiol. 72: 151-155. [ Links ]
Brewin, N. J. 2002. Pods and nods: a new look at symbiotic nitrogen fixing bacteria. Biologist 49: 113-117. [ Links ]
Brewin, N. J. 2004. Plant cell wall remodeling in the Rhizobium-legume symbiosis. Crit. Rev. Plant Sci. 23: 293-316. [ Links ]
Broughton, W. J. 2003. Roses by other names: taxonomy of the Rhizobiaceae. J. Bacteriol. 185: 2975-2979. [ Links ]
Catalano, C. M., W. S. Lane, and D. J. Sherrier. 2004. Biochemical characterization of symbiosome membrane proteins from Medicago truncatula root nodules. Electrophoresis 25: 519-531. [ Links ]
Cermola, M., E. Fedorova, R. Taté, A. Riccio, R. Favre, and E. J. Patriarca. 2000. Nodule invasion and symbiosome differentiation during Rhizobium etli - Phaseolus vulgaris simbiosis. Mol. Plant-Microbe Interact. 13: 733-741. [ Links ]
Chen, W. M., S. Laevens, T. M. Lee, T. Coenye, P. de Vos, M. Mergeay, and P. Bañadme. 2001. Ralstonia taiwanensis sp. nov., isolated from root nodules of Mimosa species and Sputumofa cystic fibrosis patient. Int. J. Systematic Evolutionary Microbiol. 51: 1729-1735. [ Links ]
Chou, Y. J., G. N. Elliott, E. K. James, K. Y. Lin, J. H. Chou, S. Y. Sheu, D. S. Sheu, J. I. Sprent, and W. M. Chen. 2007. Labrys neptuniae sp. nov., isolated from root nodules of the aquatic legume Neptunia oleracea. Int. J. Systematic Evolutionary Microbiol. 57: 577-581. [ Links ]
Christiansen, J., D. R. Dean, and L. C. Seefeldt. 2001. Mechanistic features of the Mo-containing nitrogenase. Annu. Rev. Plant Physiol. Plant Mol. Biol. 52: 269-295. [ Links ]
Clement, M., E. Boncompagni, J. de Almeida-Engler, and D. Herouart. 2006. Isolation of a novel nodulin: a molecular marker of osmotic stress in Glycine max/Bradyrhizobium japonicum nodule. Plant Cell Environ. 29: 1841-1852. [ Links ]
Comba, M. E., M. P. Benavides, and M. L. Tomaro. 1998. Effect of salt stress on antioxidant defense system in soybean nodules. Aust. J. Plant Physiol. 25: 665-671. [ Links ]
Corpas, F. J., C. de la Colina, F. Sánchez-Rasero, and L. A. del Rio. 1997. A role for leaf peroxisomes in the catabolism of purines. J. Plant Physiol. 151: 246-250. [ Links ]
Dakora, F. D. 2003. Defining new roles for plant and rhizobial molecules in sole and mixed plant cultures involving symbiotic legumes. New Phytol. 158: 39-49. [ Links ]
Dalton, D. A., C. J. Post, and L. Langeberg. 1991. Effects of ambient oxygen and of fixed nitrogen on concentration of glutathione, ascorbate and associated enzymes in soybean root nodules. Plant Physiol. 96: 812-818. [ Links ]
Dalton, D. A., S. L. Joyner, M. Becana, I. Iturbe-Ormaetxe, and J. M. Chatfield. 1998. Antioxidant defenses in the peripheral cell layers of legume root nodules. Plant Physiol. 116: 37-43. [ Links ]
Day, D. A., B. N. Kaiser, R. Thomson, M. K. Udvardi, S. Moreau, and A. Puppo. 2001. Nutrient transport across symbiotic membranes from legume nodules. Aust. J. Plant Physiol. 28: 667-674. [ Links ]
De Lorenzo, C., M. M. Fernández-Pascual, and M. R. de Felipe. 1994. Protective enzymes against active oxygen species during nitrate-induced senescence of Lupinus albus nodules. J. Plant Physiol. 144: 633-640. [ Links ]
Denison, F. R. 2000. Legume sanctions and the evolution of symbiotic cooperation by rhizobia. The Am. Nat. 156: 567-576. [ Links ]
Erice, G., I. Aranjuelo, J. J. Irigoyen, and M. Sanchez-Diaz. 2007. Effect of elevated CO2, temperature and limited water supply on antioxidant status during regrowth of nodulated alfalfa. Physiol. Plant. 130: 33-45. [ Links ]
Escuredo, R. P., F. R. Minchin, Y. Gogorcena, I. Iturbe-Ormaetxe, R. V. Klucas, and M. Becana. 1996. Involvement of activated oxygen in nitrate-induced senescence of pea root nodules. Plant Physiol. 110: 1187-1195. [ Links ]
Espinosa-Victoria, D., C. P. Vance, and P. H. Graham. 2000. Host variation in traits associated with crown nodule senescence in soybean. Crop Sci. 40: 103-109. [ Links ]
Evans, J. P., D. Gallesi, C. Mathieu, M. J. Hernández, M. de Felipe, B. Halliwell, and A. Puppo. 1999. Oxidative stress occurs during soybean nodule senescence. Planta 208: 73-79. [ Links ]
Fedorova, E. E. and S. Brown. 2007. Cytochemistry of proteolytic activity and pH status of vacuoles in Medicago truncatula root nodules. Russian J. Plant Physiol. 54: 25-31. [ Links ]
Fedorova, M., J. van de Mortel, P. A. Matsumoto, J. Cho, C. D. Town, K. A. VandenBosch, J. S. Gantt, and C. P. Vance. 2002. Genome-wide identification of nodule-specific transcripts in the model legume Medicago truncatula. Plant Physiol. 130: 519-537. [ Links ]
Ferguson, B. J. and U. Mathesius. 2003. Signaling interactions during nodule development. J. Plant Growth Regul. 22: 47-72. [ Links ]
Fisher, M. C. T., D. M. Eissenstat, and J. P. Lynch. 2002. Lack of evidence for programmed root senescence in common bean (Phaseolus vulgaris) grown at different levels of phosphorus supply. New Phytol. 153: 63-71. [ Links ]
Fujihara, S., J. Terakado, and N. Nishibori. 2006. Accumulation of an aromatic amine, beta-phenethylamine, in root nodules of adzuki bean Vigna angularis. Plant Soil 280: 229-237. [ Links ]
Garcia, N. A. T., C. Iribarne, F. Palma, and C. Lluch. 2007. Inhibition of the catalase activity from Phaseolus vulgaris and Medicago sativa by sodium chloride. Plant Physiol. Biochem. 45: 535-541. [ Links ]
Garg, N. y Geetanjali. 2007. Symbiotic nitrogen fixation in legume nodules: process and signaling. A review. Agron. Sustainable Dev. 27: 59-68. [ Links ]
Ghosh, P. K., K. K. Bandyopadhyay, R. H. Wanjari, M. C. Manna, A. K. Misra, M. Mohanty, and A. S. Rao. 2007. Legume effect for enhancing productivity and nutrient use-efficiency in major cropping systems - An Indian perspective: a review. J. Sustainable Agric. 30: 59-86. [ Links ]
Gogorcena, Y., I. Iturbe-Ormaetxe, P. R. Escuredo, and M. Becana. 1995. Antioxidant defenses against activated oxygen in pea nodules subjected to water stress. Plant Physiol. 108: 753-759. [ Links ]
Gogorcena, Y., J. A. Gordon, R. P. Escuredo, R. F. Minchin, J. F. Witty, J. F. Moran, and M. Becana. 1997. N2 fixation, carbon metabolism, and oxidative damage in nodules of dark-stressed common bean plants. Plant Physiol. 113: 1193-1201. [ Links ]
Gonzalez, E. M., L. Galvez, C. Arrese-Igor, and C. Gonzalez. 2001. Abscisic acid induces a decline in nitrogen fixation that involves leghaemoglobin, but is independent of sucrose synthase activity. J. Exp. Bot. 52: 285-293. [ Links ]
Groten, K., H. Vanacker, C. Dutilleul, F. Bastían, S. Bernard, R. Carzaniga, and C. H. Foyer. 2005. The roles of redox processes in pea nodule development and senescence. Plant Cell Environ. 28: 1293-1304. [ Links ]
Groten, K., C. Dutilleul, P. D. R. van Heerden, N. Vanacker, S. Bernard, I. Finkemeier, K. J. Dietz, and C. H. Foyer. 2006. Redox regulation of peroxiredoxin and proteinases by ascorbate and thiols during pea root nodule senescence. FEBS Lett. 580: 1269-1276. [ Links ]
Gualtieri, G. and T. Bisseling. 2000. The evolution of nodulation. Plant Mol. Biol. 42: 181-194. [ Links ]
Günther, C., A. Schlereth, M. Udvardi, and T. Ott. 2007. Metabolism of reactive oxygen species is attenuated in leghemoglobin-deficient nodules of Lotus japonicus. Mol. Plant-Microbe Interact. 20: 1596-1603. [ Links ]
Hernández-Jiménez, M. J., M. M. Lucas, and M. R. de Felipe. 2002. Antioxidant defense and damage in senescing lupin nodules. Plant Physiol. Biochem. 40: 645-657. [ Links ]
Hossain, M. S., Y. Umehara, and H. Kouchi. 2006. A novel Fix(-) symbiotic mutant of Lotus japonicus, Ljsym105, shows impaired development and premature deterioration of nodule infected cells and symbiosomes. Mol. Plant-Microbe Interact. 19: 780-788. [ Links ]
Howard, T., H. J. Ougham, C. Wagstaff, and A. D. Stead. 2003. Defining senescence and death. J. Exp. Bot. 54: 1127-1132. [ Links ]
Huffaker, R. C. 1990. Proteolytic activity during senescence of plants. New Phytol. 116: 199-231. [ Links ]
Hungria, M., J. C. Franchini, R. J. Campo, C. C. Crispino, J. Z. Moraes, R. N. R. Sibaldelli, I. C. Mendes, and J. Arihara. 2006. Nitrogen nutrition of soybean in Brazil: contributions of biological N2 fixation and N fertilizer to grain yield. Can. J. Plant Sci. 86: 927-939. [ Links ]
Hwee, H. N. and D. B. Layzell. 1997. Phloem glutamine and the regulation of O2 diffusion in legume nodules. Plant Physiol. 113: 259-267. [ Links ]
Ji, L., S. Wood, M. Becana, and R. V. Klucas. 1991. Purification and characterization of soybean root nodule ferric leghemoglobin reductase. Plant Physiol. 96: 32-37. [ Links ]
Kanayama, Y. and Y. Yamamoto. 1990. Inhibition of nitrogen fixation in soybean plants supplied with nitrato. II. Acumulation and properties of nitrosylleghemoglobin in nodules. Plant Cell Physiol. 31: 207-214. [ Links ]
Kardailsky, I. V. and N. J. Brewin. 1996. Expression of cysteine protease genes in pea nodule development and senescence. Mol. Plant-Microbe Interact. 9: 689-695. [ Links ]
Kiers, T. E., A. R. Rousseau, A. S. West, and F. R. Denison. 2003. Host sanctions and the legume-Rhizobium mutualism. Nature 425: 78-81. [ Links ]
Kimata, Y. and E. C. Theil. 1994. Posttranscriptional regulation of ferritin during nodule development in soybean. Plant Physiol. 104: 263-270. [ Links ]
Klapheck, S. 1988. Homoglutathione: isolation, quantification and occurrence in legumes. Physiol. Plant. 74: 727-732. [ Links ]
Ko, M. P., P. Y. Huang, J. S. Huang, and K. R. Barrer. 1987. The occurrence of phytoferritin and its relationship to effectiveness of soybean nodules. Plant Physiol. 83: 299-305. [ Links ]
Krylova, V. V., N. P. Dubrovo, and S. F. Izmailov. 2007a. The effect of metabolites on the pH gradient and membrane potential of the bean peribacteroid membrane. Appl. Biochem. Microbiol. 43: 292-297. [ Links ]
Krylova, V. V., P. N. Dubrovo, and S. F. Izmailov. 2007b. Metabolite transport across the peribacteroid membrane during broad bean development. Russian J. Plant Physiol. 54: 184-190. [ Links ]
Lawn, R. J. and W. A. Brun. 1974a. Symbiotic nitrogen fixation in soybean. I. Effect of photosynthetic source-sink manipulation. Crop Sci. 14: 11-16. [ Links ]
Lawn, R. J. and W. A. Brun. 1974b. Symbiotic nitrogen fixation in soybean. III. Effect of supplemental nitrogen and intervarietal grafting. Crop Sci. 14: 22-25. [ Links ]
Layzell, D. B. and S. Hunt. 1990. Oxygen and the regulation of nitrogen fixation in legume nodules. Physiol. Plant. 80: 322-327. [ Links ]
Lee, K. K., L. L. Shearman, B. K. Erickson, and R. V. Klucas. 1995. Ferric leghemoglobin in plant-attached leguminous nodules. Plant Physiol. 109: 261-267. [ Links ]
Lodwig, E. M., A. H. Hosle, A. Bourdes, K. Findlay, D. Allaway, R. Karunakaran, J. A. Downie, and P. S. Poole. 2003. Amino acid cycling drives nitrogen fixation in the legume - Rhizobium symbiosis. Nature 422: 722-726. [ Links ]
Long, S. R. 2001. Genes and signals in the Rhizobium-legume symbiosis. Plant Physiol. 125: 69-72. [ Links ]
Lucas, M. M., G. van de Sype, D. Hérouart, M. J. D. Hernández, A. Puppo, and M. R. de Felipe. 1998. Immunolocalización of ferritin in determinate and indeterminate legume root nodules. Protoplasma 204: 61-70. [ Links ]
Malik, N. S. A., N. E. Pfeiffer, D. R. Williams, and F. W. Wagner. 1981. Peptidohydrolases of soybean root nodules. Identification, separation and partial characterization of enzymes from bacteroid-free extracts. Plant Physiol. 68: 386-392. [ Links ]
Manen, J. F., P. Simon, J. C. van Slooten, M. Odteras, S. Frutiger, and G. Hughs. 1991. A nodulin specifically expressed in senescent nodules of winged bean is a protease inhibitor. Plant Cell 3: 259-270. [ Links ]
Martínez-Romero, E. 2003. Diversity of Rhizobium-Phaseolus vulgaris simbiosis: overview and perspectives. Plant Soil 252: 11-23. [ Links ]
Matamoros, M. A., L. M. Baird, P. R. Escuredo, D. A. Dalton, F. R., Minchin, I. Iturbe-Ormaetxe, M. C. Rubio, J. F. Moran, A. J. Gordon, and M. Becana. 1999a. Stress-induced legume root nodule senescence. Physiological, biochemical, and structural alterations. Plant Physiol. 121: 97-111. [ Links ]
Matamoros, M. A., J. F. Moran, I. Iturbe-Ormaetxe, M. C. Rubio, and M. Becana. 1999b. Glutathione and homoglutathione synthesis in legume root nodules. Plant Physiol. 121: 879-888. [ Links ]
Matamoros, M. A., J. Loscos, M. J. Coronado, J. Ramos, S. Sato, P. S. Testillano, S. Tabata, and M. Becana. 2006. Biosynthesis of ascorbic acid in legume root nodules. Plant Physiol. 141: 1068-1077. [ Links ]
Mathieu, C., S. Moreau, P. Frendo, A. Puppo, and M. J. Davies. 1998. Direct direction of radicals in intact soybean nodules: presence of nitric oxide-leghemoglobin complexes. Free Radical Biol. Medicine 24: 1242-1249. [ Links ]
McDermott, T. R. and P. H. Graham. 1989. Bradyrhizobium japonicum inoculant mobility, nodule occupancy, and acetylene reduction in the soybean root system. Appl. Environ. Microbiol. 55: 2493-2498. [ Links ]
Millar, A. H., D. A. Day, and F. J. Bergersen. 1995. Microaerobic respiration and oxidative phosphorylation by soybean nodule mitochondria: implications for nitrogen fixation. Plant Cell Environ. 18: 715-726. [ Links ]
Minchin, F. R., M. I. Minguez, J. E. Sheehy, J. F. Witty, and L. Skot. 1986. Relationship between nitrate and oxygen supply in symbiotic nitrogen fixation by white clover. J. Exp. Bot. 37: 1103-1113. [ Links ]
Minchin, F. R., M. Becana, and J. I. Sprent. 1989. Short-term inhibition of legume N2 fixation by nitrate. II. Nitrate effects on nodule oxygen diffusion. Planta 180: 46-52. [ Links ]
Møller, M. I. 2001. Plant mitochondria and oxidative stress: electron transport, NADPH turnover, and metabolism of reactive oxygen species. Annu. Rev. Plant Physiol. Plant Mol. Biol. 52: 561-591. [ Links ]
Moran, J. F., R. V. Klucas, R. J. Grayer, J. Abian, and M. Becana. 1997. Complexes of iron with phenolic compounds from soybean nodules and other legume tissues: prooxidant and entioxidant properties. Free Radical Biol. Medicine 22: 861-870. [ Links ]
Moreau, S., D. A. Day, and A. Puppo. 1998. Ferrous iron is transported across the peribacteroid membrane of soybean nodules. Planta 207: 83-87. [ Links ]
Muller, J., T. Boller, and A. Wiemken. 2001a. Trehalose becomes the most abundant non-structural carbohydrate during senescence of soybean nodules. J. Exp. Bot. 52: 943-947. [ Links ]
Muller, J., A. Wiemken, and T. Boller. 2001b. Redifferentiation of bacteria isolated from Lotus japonicus root nodules colonized by Rhizobium sp. NGR234. J. Exp. Bot. 52: 2181-2186. [ Links ]
Naito, Y., M. Fujic, S. Usami, Y. Murooka, and T. Yamada. 2000. The involvement of a cysteine proteinase in the nodule development in Chinese milk vetch infected with Mesorhizobium huakuii subsp. rengei. Plant Physiol. 124: 1087-1095. [ Links ]
Nandwal, A. S., S. Kukreja, N. Kumar, P. K. Sharma, M. Jain, A. Mann, and S. Singh. 2007. Plant water, status, ethylene evolution, N2-fixing efficiency, antioxidant activity and lipid peroxidation in Cicer arietinum L. nodules as affected by short-term salinization and desalinization. J. Plant Physiol. 164: 1161-1169. [ Links ]
Noodén, L. D. 1984. Integration of soybean pod development and monocarpic senescence. Physiol. Plant. 62: 273-284. [ Links ]
Noodén, L. D., J. J. Guiament, and I. John. 1997. Senescence mechanisms. Physiol. Plant. 101: 746-753. [ Links ]
Nosengo, N. 2003. Fertilized to dead. Nature 425: 894-895. [ Links ]
Osawa, T. and T. Tsuji. 1992. Inhibition of growth of Bradyrhizobium japonicum bacteroide by spermidine and spermine in yeast extract. Soil Sci. Plant Nutr. 38: 375-379. [ Links ]
Palma, J. M., L. M. Sandalio, F. J. Corpas, M. C. Romero-Puertas, I. McCarthy, and L. A. del Río. 2002. Plant proteases, protein degradation, and oxidative stress: role of peroxisomes. Plant Physiol. Biochem. 40: 521-530. [ Links ]
Palma, J. M., A. Jimenez, L. M. Sandallo, F. J. Corpas, M. Lundqvist, M. Gomez, F. Sevilla, and L. A. del Rio. 2006. Antioxidative enzymes from chloroplasts, mitochondria, and peroxisomes during leaf senescence of nodulated pea plants. J. Exp. Bot. 57: 1747-1758. [ Links ]
Parniske, M., B. Ahlborn, and D. Werner. 1991. Isoflavonoid-inducible resistance to the phytoalexin glyceollin in soybean rhizobia. J. Bacteriol. 173: 3432-3439. [ Links ]
Pereira, C. S., R. D. Lins, I. Chandrasekhar, L. C. G. Freitas, and P. H. Hunenberger. 2004. Interaction of the disaccharide trehalose with a phospholipid bilayer: a molecular dynamics study. Biophys. J. 86: 2273-2285. [ Links ]
Perret, X., C. Staehelin, and J. W. Broughton. 2000. Molecular basis of symbiotic promiscuity. Microbial Mol. Biol. Rev. 64: 180-201. [ Links ]
Pfeiffer, N. E., C. M. Torres, and F. W. Wagner. 1983. Proteolytic activity in soybean root nodules. Activity in host cell citosol and bacteroids throughout physiological development and senescence. Plant Physiol. 71: 797-802. [ Links ]
Pladys, D. and J. Rigaud. 1985. Senescence in French-bean nodules: occurrence of different proteolytic activities. Physiol. Plant. 63: 43-48. [ Links ]
Pladys, D. and C. P. Vance. 1993. Proteolysis during development and senescence of effective and plant gene-controlled ineffective alfalfa nodules. Plant Physiol. 103: 379-384. [ Links ]
Pladys, D., P. Barthe, and J. Rigaud. 1988. Changes in intracellular pH in French-bean nodules induced by senescence and nitrate treatment. Plant Sci. 56: 99-106. [ Links ]
Pladys, D., L. Dimitrijevic, and J. Rigaud. 1991. Localization of a protease in protoplast preparations in infected cells of French bean nodules. Plant Physiol. 97: 1174-1180. [ Links ]
Porcel, R., J. M. Barea, and J. M. Ruíz-Lozano. 2003. Antioxidant activities in mycorrhizal soybean plants under drought stress and their possible relationship to the process of nodule senescence. New Phytol. 157: 135-143. [ Links ]
Provorov, N. 1998. Coevolution of rhizobia with legumes: facts and hypotheses. Symbiosis 24: 337-367. [ Links ]
Pueppke, S. G. and W. J. Broughton. 1999. Rhizobium sp. NGR234 and R. fredii USDA257 share exceptionally broad, nested host ranges. Mol. Plant-Microbe Interact. 12: 293-318. [ Links ]
Puppo, A. and B. Halliwell. 1988. Generation of hydroxyl radicals by soybean nodule leghaemoglobin. Planta 173: 405-410. [ Links ]
Puppo, A., K. Groten, F. Bastian, R. Carzaniga, M. Soussi, M. M. Lucas, M. R. de Felipe, J. Harrison, H. Vanacker, and C. F. Foyer. 2005. Legume nodule senescence: roles for redox and hormone signaling in the orchestration of the natural aging process. New Phytol. 165: 683-701. [ Links ]
Regland, M. and E. C. Theil. 1993. Ferritin (mRNA, protein) and iron concentration during soybean nodule development. Plant Mol. Biol. 21: 555-560. [ Links ]
Rennie, R. J. and G. A. Kemp. 1984. 15N-determined time-course for N2 fixation in two cultivars of field bean. Agron. J. 76: 146-154. [ Links ]
Rivas, R., A. Willems, N. S. Subba-Rao, P. F. Mateos, F. B. Dazzo, R. M. Kroppenstedt, E. Martinez-Molina, M. Gillis, and E. Velazquez. 2003. Description of Devosia neptuniae sp. nov. that nodulates and fixes nitrogen in symbiosis with Neptunia natans, an aquatic legume from India. Syst. Appl. Microbiol. 26: 47-53. [ Links ]
Rubio, M. C., M. Becana, S. Sato, E. K. James, S. Tabata, and H. P. Spaink. 2007. Characterization of genomic clones and expression analysis of the three types of superoxide dismutases during nodule development in Lotus japonicus. Mol. Plant-Microbe Interact. 20: 262-275. [ Links ]
Russelle, M. P., J. F. S. Lamb, N. B. Turyk, B. H. Shaw, and B. Pearson. 2007. Managing nitrogen contaminated soils: benefits of N2-fixing alfalfa. Agron. J. 99: 738-746. [ Links ]
Schweitzer, L. E. and J. E. Harper. 1985. Leaf nitrate reductase, D-ribulose-1,5-bisphosphate carboxylase, and root nodule development of genetic male-sterile and fertile soybean isolines. Plant Physiol. 78: 61-65. [ Links ]
Shaw, S. L. and S. R. Long. 2003. Nod factor inhibition of reactive oxygen efflux in a host legume. Plant Physiol. 132: 2196-2204. [ Links ]
Staehelin, C., J. Muller, R. B. Mellor, A. Wiemken, and T. Boller. 1992. Chitinase and peroxidase in effective (fix+) and ineffective (fix-) soybean nodules. Planta 187: 295-300. [ Links ]
Strozycki, P. M., A. Szczurek, B. Lotocka, M. Figlerowicz, and A. B. Legocki. 2007. Ferritins and nodulation in Lupinus luteus: iron management in indeterminate type nodules. Exp. Bot. 58: 3145-3153. [ Links ]
Subramanian, S., G. Stacey, and O. Yu. 2007. Distinct, crucial roles of flavonoids during legume nodulation. Trends Plant Sci. 12: 282-285. [ Links ]
Swaraj, K. and N. R. Bishnoi. 1996. Physiological and biochemical basis of nodule senescence in legumes: a review. Plant Physiol. Biochem. 23: 105-116. [ Links ]
Swaraj, K., J. Laura, and N. Bishnoi. 1993. Nitrate induced nodule senescence and changes in activities of enzymes scavenging H2O2 in clusterbean (Cyamopsis tetragonaloba Taub.). J. Plant Physiol. 141: 202-205. [ Links ]
Swaraj, K., J. S. Laura, and N. R. Bishnoi. 1994. Dark treatment effects on nitrogen fixation and enzymes associated with scavenging hydrogen peroxide in clusterbean nodules. Plant Physiol. Biochem. 32: 115-119. [ Links ]
Swaraj, K., S. Dhandi, and S. Sheokand. 1995. Relationship between defense mechanism against activated oxygen species and nodule functioning with progress in plant and nodule development in Cajanus cajan L., Millsp. Plant Sci. 112: 65-74. [ Links ]
Swaraj, K., S. Sheokand, M. M. Fernandez-Pascual, and M. R. de Felipe. 2001. Dark-induced changes in legume nodule functioning. Aust. J. Plant Physiol. 28: 429-438. [ Links ]
Szczyglowski, K. and L. Amyot. 2003. Symbiosis, inventiveness by recruitment? Plant Physiol. 131: 935-940. [ Links ]
Thirkettle-Watts, D., T. C. McCabe, R. Clifton, C. Moore, P. M. Finnegan, D. A. Day, and J. Whelan. 2003. Analysis of the alternative oxidase promoters from soybean. Plant Physiol. 133: 1158-1169. [ Links ]
Thompson, J. E., R. L. Legge, and R. F. Barber. 1987. The role of free radicals in senescence and wounding. New Phytol. 105: 317-344. [ Links ]
Timmers, A. C. J., E. Soupene, M. C. Auriac, F. de Billy, J. Vasse, P. Boistard, and G. Truchet. 2000. Saprophytic intracellular rhizobia in alfalfa nodules. Mol. Plant-Microbe Interact. 13: 1204-1213. [ Links ]
Trinchant, J. C., A. Boscari, G. Spennato, G. V. de Sype, and D. L. Rudulier. 2004. Proline betaine accumulation and metabolism in alfalfa plants under sodium chloride stress. Exploring its compartmentalization in nodules. Plant Physiol. 135: 1583-1594. [ Links ]
Trujillo, M. E., A. Willems, A. Abril, A. M. Planchuelo, R. Rivas, D. Ludena, P. F. Mateos, E. Martinez-Molina, and E. Velásquez. 2005. Nodulation of Lupinus albus by strains of Ochrobactrum lupini sp. nov. Appl. Environ. Microbiol. 71: 1318-1327. [ Links ]
Van de Velde, W., J. C. P. Guerra, A. de Keyser, R. de Rycke, S. Rombauts, N. Maunoury, P. Mergaert, E. Kondorosi, M. Holsters, and S. Goormachtig. 2006. Aging in legume symbiosis. A molecular view on nodule senescence in Medicago truncatula. Plant Physiol. 141: 711-720. [ Links ]
Vance, C. P. 1983. Rhizobium infection and nodulation: a beneficial plant disease? Annu. Rev. Microbiol. 37: 399-424. [ Links ]
Vance, C. P., P. H. Reibach, and W. R. Ellis. 1986. Proteolytic enzymes of legume nodules and their possible role during nodule senescence. pp. 103-124. In: M. J. Dalling (ed.). Plant proteolytic enzymes. Vol. 2. CRC Press. Boca Raton, FL, USA. [ Links ]
Vandamme, P., J. Goris, W. M. Chen, P. Vos, and A. Willems. 2002. Burkholderia tuberum sp. nov. and Burkholderia phymatum sp. nov., nodulate the roots of tropical legumes. Syst. Appl. Microbiol. 25: 507-512. [ Links ]
Vessey, J. K., K. B. Walsh, and D. B. Layzell. 1988a. Oxygen limitation of N2 fixation in stem-girdled and nitrate-treated soybean. Physiol. Plant. 73: 113-121. [ Links ]
Vessey, J. K., K. B. Walsh, and D. B. Layzell. 1988b. Can a limitation in phloem supply to nodules account for the inhibitory effect of nitrate on nitrogenase activity in soybean? Physiol. Plant. 74: 137-146. [ Links ]
Vikman, P. and J. K. Vessey. 1992. The decline in N2 fixation rate in common bean with the onset of pod filling: fact or artifact. Plant Soil 147: 95-105. [ Links ]
Vikman, P. and J. K. Vessey. 1993a. Ontogenetic changes in root nodule subpopulations of common bean (Phaseolus vulgaris L.). I. Nitrogenase activity and respiration during pod-filling. J. Exp. Bot. 44: 563-569. [ Links ]
Vikman, P. and J. K. Vessey. 1993b. Ontogenetic changes in root nodule subpopulations of common bean (Phaseolus vulgaris L.). II. Protein content and carbohydrate pools. J. Exp. Bot. 44: 571-577. [ Links ]
Vikman, P. and J. K. Vessey. 1993c. Ontogenetic changes in root nodule subpopulations of common bean (Phaseolus vulgaris L.). III. Nodule formation, growth and degradation. J. Exp. Bot. 44: 579-586. [ Links ]
Vincent, J. L. and N. J. Brewin. 2000. Immunolocalization of a cysteine protease in vacuoles, vesicles, and symbiosomes of pea nodule cells. Plant Physiol. 123: 521-530. [ Links ]
Voisin, A. S., C. Salon, N. G. Munier-Jolain, and B. Ney. 2002a. Effect of mineral nitrogen on nitrogen nutrition and biomass partitioning between the shoot and roots of pea (Pisum sativum L.). Plant Soil 242: 251-262. [ Links ]
Voisin, A. S., C. Salon, N. G. Munier-Jolain, and B. Ney. 2002b. Quantitative effect of soil nitrate, growth potential and phenology on symbiotic nitrogen fixation of pea (Pisum sativum L.). Plant Soil 243: 31-42. [ Links ]
Walsh, K. B. 1995. Physiology of the legume nodule and its response to stress. Soil Biol. Biochem. 4/5: 637-655. [ Links ]
Whitehead, L. F., S. D. Tyerman, and D. A. Day. 2001. Polyamines as potential regulators of nutrient exchange across the peribacteroid membrane in soybean root nodules. Aust. J. Plant Physiol. 28: 675-681. [ Links ]
Wittenberg, J. B., B. A. Wittenberg, D. A. Day, M. K. Udvardi, and C. A. Appleby. 1996. Siderophore-bound iron in the peribacteroid space of soybean root nodules. Plant Soil 178: 161-169. [ Links ]
Wolyn, D. J., J. Attewell, P. W. Ludden, and F. A. Bliss. 1989. Indirect measures of N2 fixation in common bean (Phaseolus vulgaris L.) under field conditions: the role of lateral root nodules. Plant Soil 113: 181-187. [ Links ]
Xie, Z. P., C. Staehelin, A. Wiemken, W. Broughton, J. Muller, and T. Boller. 1999. Symbiosis-stimulated chinase isoenzimes of soybean (Glicine max (L.) Merr.). J. Exp. Bot. 50: 327-333. [ Links ]
Yang, W. C., H. C. J. Canter-Cremers, P. Hodendijk, P. Katinakis, C. A. Wijffelman, H. Franssen, A. van Kammen, and Bisseling. 1991. In situ localization of chalcone synthase mRNA in pea root nodule development. Plant J. 2: 143-151. [ Links ]
Young, J. P. W., L. A. Mutch, D. A. Ashford, A. Zézé, and K. E. Mutch. 2003. The molecular evolution of host specificity in the Rhizobium-legume symbiosis. pp. 245-257. In: R. Hails, H. C. J. Godfray, and J. Beringer (eds.). Genes in the environment. Blackwell Science. Oxford, UK. [ Links ]
Zakhia, F. and P. de Lajudie. 2001. Taxonomy of rhizobia. Agronomie 21: 569-576. [ Links ]
* Publicado como ensayo en Terra Latinoamericana 26: 133–144.