Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Terra Latinoamericana
versión On-line ISSN 2395-8030versión impresa ISSN 0187-5779
Terra Latinoam vol.26 no.1 Chapingo ene./mar. 2008
División II
Patrones de descomposición de estiércoles en el suelo*
Decomposition Patterns of Manures in Soil
Amabelia del Pino1‡, Carlos Repetto1, Cristina Mori1 y Carlos Perdomo1
1 Departamento de Suelos y Aguas, Facultad de Agronomía, Universidad de la República Oriental del Uruguay. Garzón 780, 12900 Montevideo, Uruguay. ‡Autor responsable (Amabelia@fagro.edu.uy)
Recibido: abril de 2005.
Aceptado: junio de 2007.
RESUMEN
Debido a la difusión del uso de estiércol para la producción hortícola en Uruguay es necesario conocer la capacidad de liberación de nutrientes, en especial nitrógeno de los materiales utilizados. El objetivo de este estudio fue determinar y comparar los patrones de mineralización de estiércol de gallina (EG), estiércol de vaca (EV) y cama de pollo (CP, mezcla de estiércol de pollo y cáscara de arroz), incorporados al suelo, para evaluar su aporte de N y su efecto sobre las características del suelo y actividad de los microorganismos. Se realizó una incubación aerobia de suelo con los materiales (estiércoles, dos niveles de KNO3 y un testigo sin agregados) por 11 semanas. En todos los tratamientos hubo mineralización neta de N, lo cual estuvo asociada a la relación C:N de los estiércoles. Los estiércoles de ave (EG y CP) mineralizaron más N que EV y el testigo en los primeros 35 días. El testigo y EV no difirieron entre sí hasta los últimos muestreos (58 y 79 días), cuando EV fue superior. Las tasas de respiración de los estiércoles fueron mayores que las del testigo y KNO3, debido al aporte de C de los estiércoles. Los estiércoles incrementaron C y N en la biomasa microbiana. El EG promovió las condiciones más favorables para los microorganismos debido al aumento de pH; en cambio, KNO3 creó condiciones desfavorables con disminución de pH y alta conductividad eléctrica. Hubo una tendencia al descenso de C y N en la biomasa microbiana durante la incubación, salvo con EV. El estiércol de ave realizó su principal aporte de N disponible inmediatamente después del agregado, con una mineralización posterior restringida. El EV, que no realizó un aporte significativo de N en los primeros 25 días, promovió en cambio la posterior actividad microbiana en el suelo.
Palabras clave: mineralización de N, C en biomasa microbiana, N en biomasa microbiana.
ABSTRACT
In Uruguay manures are extensively used in horticultural production. It is therefore necessary to characterize the nitrogen release capacity of the different materials to be used. The objective of this study was to determine and to compare mineralization patterns of poultry manure, dairy cow manure, and chicken manure (chicken manure and rice hull mixture), added to the soil, evaluating their contribution of N as well as their influence on soil properties and on soil microorganism activity. Soils were incubated for 11 weeks with the tested materials (manure, two levels of KNO3 and a control without aggregates). All treatments resulted in net N mineralization, which was related to C:N ratio of the manures. Chicken and poultry manures produced more mineral N than cow manure the control in the first 35 days of incubation. The control did not differ from cow manure until the last sampling (58 and 79 days) when cow manure was superior. Manure respiration rates were higher than those of the control or KNO3, because of the contribution of C by the manures. Manures increased C and N in the microbial biomass. Poultry manure promoted better conditions for microbial growth due to an increase in pH, while KNO3 created unfavorable conditions (low pH and high electrical conductivity). C and N tended to decrease in soil microbial biomass during incubation except in cow manure. Poultry manure made an important contribution of mineral N shortly after application, with relatively low mineralization rates afterwards. In contrast, cow manure, which did not significantly increase available N during the first 25 days, promoted soil microbial activity on the long term.
Keywords: N mineralization, biomass C, biomass N.
INTRODUCCIÓN
El uso de estiércol como fertilizante es una de las prácticas más antiguas utilizadas en la agricultura por el hombre. Su aplicación al suelo determina un aumento de la fertilidad, como también la mejoría de las propiedades físicas. Si bien el uso del estiércol es indiscutiblemente beneficioso, existen grandes dificultades para predecir su efecto en cada situación debido a la gran variabilidad de materiales que abarca y las diferencias creadas por el manejo previo (Helgason et al., 2005). En este contexto se hace necesaria la caracterización de los diferentes materiales para predecir su aporte de nutrientes (Bitzer y Sims, 1988; Griffin et al., 2005). Esta necesidad de predecir su efecto se acentúa además debido a que pueden provocar contaminación ambiental al aplicar dosis excesivas, ya sea por pérdidas gaseosas de N (procesos de desnitrificación y volatilización de amoníaco) como por la posibilidad de pérdidas por lixiviación de NO3–(Sims, 1987; Rochette et al., 2000b).
La dosis óptima a aplicar depende de la composición química del estiércol, de la disponibilidad de nutrientes del suelo, del crecimiento del cultivo y de las condiciones ambientales (Eghball et al., 2002). En Uruguay se ha extendido el uso de cama de pollo (estiércol de pollo mezclado con cáscara de arroz) como enmienda; esto determina un material heterogéneo, conteniendo un elemento rico en C y de difícil descomposición como la cáscara de arroz y una porción rica en nutrientes proveniente del estiércol de pollo. Este material se aplica en la producción hortícola del sur del país en cantidades muy altas y en forma frecuente, lo que evidencia la necesidad de conocer sus características y patrones de mineralización para poder hacer un uso adecuado del mismo.
El N del estiércol se encuentra principalmente bajo forma orgánica y el proceso de mineralización realizado por los microorganismos determina su efectividad como fuente de N disponible. La relación C:N es uno de los principales factores que afectan la tasa de mineralización del estiércol (Qian y Schoenau, 2002). Estos autores reportan una alta mineralización neta de N en los estiércoles con relaciones C:N menores de 13, mientras que relaciones mayores de 15 provocaban inmovilización neta del N mineral, teniendo poco impacto en la disponibilidad de N mineral los estiércoles con relaciones C:N entre 13 y 15. Por otra parte, Calderón et al. (2004), comparando estiércoles de vaca de diferente origen, reportan mineralización neta de N en materiales que tenían C:N de 16 en promedio e inmovilización neta en materiales de 19 en promedio. Otros autores, quienes estudiaron la descomposición de diferentes enmiendas orgánicas, sugieren que la relación C:N no es suficiente para predecir el resultado de la mineralización, habiendo otros factores a considerar como C y N solubles para predecir su comportamiento (Helgason et al., 2005). En el caso de productos con base en estiércol de ave Fijiwara y Murakami (2007) encontraron mayor correlación del N mineralizado con el contenido de ácido úrico que con el contenido de N total.
Otro aspecto positivo relacionado al agregado de estiércol es el aporte de C para la materia orgánica del suelo, así como su efecto promotor de la biomasa microbiana (Eghball, 2000; Flavel y Murphy, 2006), aunque la mayor liberación de CO2 a la atmósfera, resultado de esta mayor actividad microbiana, puede tener su aspecto negativo por aumentar la concentración de este gas en la atmósfera (Dao y Cavigelli, 2003).
El objetivo del presente estudio fue determinar y comparar los patrones de mineralización de estiércol de gallina, estiércol de vaca y cama de pollo (mezcla de estiércol de pollo y cáscara de arroz), incorporados al suelo. Se evaluó la capacidad de aporte de N de los materiales orgánicos, así como su influencia sobre las propiedades del suelo y la actividad de los microorganismos.
MATERIALES Y MÉTODOS
El suelo utilizado fue un Typic Argiudoll con las siguientes características: pH (H2O), 5.7; carbono orgánico, 29.1 g kg–1; nitrógeno total, 1.9 g kg–1; arcilla, 28.9%; limo, 43.7%; arena, 27.3%, el cual luego de colectado se pasó por un tamiz de 5 mm, eliminando raíces y piedras y se mantuvo a capacidad de campo hasta el inicio del experimento.
Los materiales evaluados fueron estiércol de gallina (EG), estiércol de vaca (EV) y cama de pollo (CP); una selección de sus características químicas se presenta en el Cuadro 1. El fertilizante utilizado para comparación fue KNO3 en solución acuosa de 100 mg L–1, al cual se le agregó Na3PO4 (10% en agua) hasta llevarlo a pH 7.2.
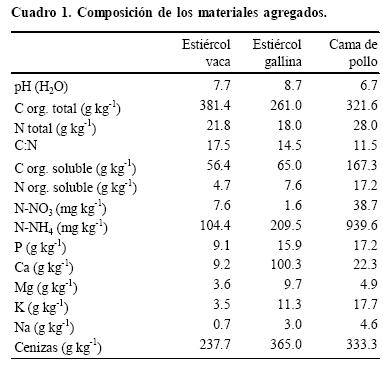
Los estiércoles, provenientes de las unidades de producción de la Facultad de Agronomía (EG y EV) y de producción comercial (CP), se secaron a 60 ºC y se molieron. El contenido de N total de los estiércoles se determinó por Kjeldahl (mineralización con H2SO4 concentrado a 370 ºC y posterior destilación con NaOH 10 M recogiendo el destilado en H3BO3 y titulando con HCl 0.1 M. El C orgánico total se determinó por oxidación con K2Cr2O7 en H2SO4 durante 1 h a 150 ºC (Nelson y Sommers, 1996) y determinación colorimétrica (600 nm). Se realizó la extracción de las formas orgánicas solubles de C y N con agua (relación 1:100) a 100 ºC durante 20 min. La determinación de N orgánico soluble se realizó en forma análoga a N total, realizando la mineralización de 20 mL de extracto seguido por destilación y titulación usando HCl 0.01 M, sustrayendo el contenido de N–NH4+. El C orgánico soluble se determinó en forma análoga al C orgánico total tomando 5 mL de extracto. El contenido de cenizas se realizó por gravimentría luego de la calcinación de los materiales a 550 ºC por 5 h. Luego de solubilizar las cenizas con HCl a 20% y filtrar se determinaron los contenidos de Ca, Mg, K y Na con un espectrómetro de absorción atómica Perkin Elmer 373.
Se estudiaron los patrones de mineralización de EV, EG y CP agregados al suelo mediante incubación aeróbica, en condiciones controladas de temperatura y humedad durante 11 semanas. El largo de la incubación se definió considerando el efecto de los tratamientos sobre el primer cultivo luego de su aplicación. La temperatura de incubación elegida (21 ºC) es ligeramente superior a la temperatura media anual en Uruguay (16 ºC en el sur y 19 ºC en el norte), en tanto que el contenido de agua corresponde aproximadamente a 80% de la máxima capacidad de retención de agua del suelo (0.27 g g–1).
El experimento consistió de seis tratamientos: un testigo, tres estiércoles y dos dosis de KNO3. En cada caso, las dosis de estiércol y KNO3 se establecieron tratando de evaluar dosis utilizadas comúnmente en producción hortícola. La dosis de cada tipo de estiércol se determinó en función de su contenido total de N, para llegar a una dosis de 225 kg ha–1 de N (90 mg kg–1), equivalentes en base seca a 10 263 kg ha–1 de EV, 12 496 kg ha–1 de EG, y 8014 kg ha–1 de CP (considerando una densidad aparente de 1.25 g cm–3 y profundidad de 20 cm de suelo). Las dosis de KNO3 equivalían a 125 y 250 kg ha–1 correspondientes a 50 mg kg–1 (N50) y 100 mg kg–1 de N (N100), respectivamente. Los tratamientos se dispusieron en forma totalmente aleatorizada con tres repeticiones.
Luego de tamizado el suelo se extendió sobre una superficie lisa, formando una delgada capa y se agregó agua en forma homogénea mediante aspersión, hasta llevar el contenido de agua al nivel deseado (0.27 g g–1). A continuación se incorporaron los estiércoles y se colocó el suelo con su respectiva enmienda en un recipiente de plástico tapado, con un orificio en la parte superior para asegurar el intercambio de gases con la atmósfera. Todos los tratamientos se incubaron a 21 ºC, ajustándose el contenido de agua semanalmente. En los tratamientos de KNO3 (N50 y N100) la dosis se agregó diluida en agua.
Para análisis de N mineral se tomaron muestras de los suelos incubados a 1, 4, 11, 20, 35, 58 y 79 días. Para determinación de pH se tomaron muestras a 1, 3, 7, 10 y 35 días en tanto que la conductividad eléctrica (CE) se determinó a 1, 7, 10, 16 y 35 días. Las mediciones de respiración se llevaron a cabo los días 1, 3, 6, 10, 13, 17, 20, 24, 28, 31, 35, 49, 56, 66 y 73.
Para el análisis de N mineral en suelo la extracción se realizó agitando 20 g de suelo secado a la sombra a temperatura ambiente (este mismo suelo se utilizó para las demás determinaciones) con 100 mL de KCl 2M, por 1 h. Se determinó N–NO3–por colorimetría (540 nm); luego de la reducción de NO3 a NO2 a través de una columna de cadmio [Reacción de Griess–Ilosvay (Mulvaney, 1996)]. El N–NH4+ se determinó colorimétricamente (660 nm) según el método de Berthelot (Rhine et al., 1998). Los cálculos de mineralización e inmovilización neta de N se realizaron en cada muestreo sustrayendo, a la cantidad total de N mineral del tratamiento con enmienda, el N mineral presente en el tratamiento testigo; resultados positivos indican mineralización neta y valores negativos indican inmovilización neta de N.
Para la determinación de la evolución de CO2 al inicio de la incubación se pesaron 50 g de suelo en vasos de 50 mL; éstos se ubicaron en frascos de 1 L cerrados herméticamente, con un recipiente con 5 mL de NaOH 0.25 M. El exceso de NaOH se tituló con HCl 0.1 M (Hassink, 1994). Las mediciones de respiración no implicaban toma de muestras, ya que se realizaban de manera secuencial sobre las mismas muestras. En cada medición se controló el contenido de humedad y se colocó un recipiente con 5 mL de NaOH 0.25 M para la medición siguiente. Se calculó el CO2 liberado por diferencia respecto al CO2 atrapado en frascos control sin suelo.
El pH del suelo se midió en suspensión en agua con electrodo de pH Orion Research 701A. Se utilizó la relación suelo:agua 1:2.5 para la medida de pH dado que es la proporción históricamente utilizada en Uruguay, cuyos valores están calibrados para la clasificación de los suelos. La conductividad eléctrica (CE) (relación suelo:agua 1:2.5) se midió con un conductímetro Orion 122. El hecho de que las mediciones de pH y CE se realizaron con una relación suelo:agua mayor que la utilizada en otros países impide la comparación de los resultados en términos absolutos con bibliografía internacional, de todos modos es posible comparar el efecto de los diferentes tratamientos sobre estos parámetros de suelo.
La evaluación del contenido de C y N en la biomasa microbiana se realizó a 4, 11 y 35 días. La biomasa microbiana se determinó por fumigación extracción (Brookes et al., 1985). Submuestras de 25 g de suelo se dispusieron en un desecador, cubriendo las paredes con toallas de papel húmedas y colocando un recipiente con cloroformo en el centro. Se provocó vacío, dejando hervir el cloroformo por 3 min. Se mantuvo el desecador en la oscuridad 3 días, luego se evacuó el cloroformo y se realizó la extracción con K2SO4 0.5 M (relación suelo: solución 1:5). Paralelamente, se realizó la extracción en muestras sin fumigar. Se determinó C y N en los extractos de la forma descrita para C y N soluble. Se calculó C y N en la biomasa por substracción de los resultados sin y con fumigante, usando un factor (k) de 0.45.
Los resultados se analizaron estadísticamente siguiendo un diseño totalmente aleatorizado con tres repeticiones. Se compararon los resultados en cada muestreo por separación de medias de acuerdo con el método de Tukey. Para el análisis estadístico se usó el procedimiento GLM de SAS (SAS Institute, 1985).
Los resultados se presentaron como el promedio de las tres repeticiones. En la mayoría de los casos, los resultados del tratamiento N50 y N100 fueron similares por lo cual en las figuras, a fin de facilitar su comprensión, se presenta solamente el tratamiento N100.
RESULTADOS Y DISCUSIÓN
Patrones de Mineralización de Nitrógeno
Ningún tratamiento produjo inmovilización neta de N mineral, medida como diferencia respecto al testigo (Figura 1). La fertilización con KNO3 (N50 y N100) promovió la mayor concentración de N mineral en el suelo (principalmente NO3–), siendo significativas las diferencias entre ambos y con respecto a los estiércoles y al testigo durante toda la incubación. En el promedio de los muestreos el aporte de N mineral del fertilizante, medido como diferencia respecto al testigo, fue 48 y 99 mg kg–1 para N50 y N100, respectivamente, lo que representa prácticamente la cantidad agregada.

Al inicio de la incubación CP y EG presentaban cantidades mayores de NH4+ que de NO3 (19.4 y 26.4 mg N–NH4+ en CP y EG, respectivamente, y 18.5 y 18.9 mg N–NO3 en CP y EG, respectivamente). A partir de la segunda semana de incubación no se detectaron cantidades importantes de NH4+; por esa razón, los resultados presentados corresponden a N mineral total (suma de N mineral como NO3– + NH4+).
Entre los días 1 y 4 de incubación se observó una caída de N mineral, en especial en CP y EG. Esto podría ser explicado por el alto contenido de NH4+; forma mineral utilizada preferentemente por los microorganismos del suelo; es posible que parte de éste haya sido rápidamente inmovilizado. Por otra parte, podrían haber ocurrido otro tipo de pérdidas de N como desnitrificación o volatilización de amonio.
La mineralización neta de N (medida como diferencia respecto al testigo) al final de la incubación correspondió a 19.5, 24.3 y 29.4 mg kg–1 para EV, EG y CP, respectivamente. Los valores de N mineral de EG y CP no mostraron diferencias significativas en la mayoría de los muestreos, con una leve superioridad de CP en la última fecha. Ambos fueron significativamente superiores a EV y el testigo, manteniendo las diferencias durante todo el experimento, salvo en el día 79 cuando no hubo diferencias significativas entre EV y EG. Durante la mayor parte de la incubación no se presentó diferencia significativa entre EV y el testigo, excepto a los 58 y 79 días, cuando los valores de EV fueron mayores a los del testigo.
La mayor mineralización neta provocada por la incorporación de los estiércoles de ave (EG y CP) se manifestó tempranamente, ya que luego de sólo un día de incubación se observaron valores de N mineral mayores en los estiércoles de ave respecto a EV y el testigo. En coincidencia Cabrera et al. (1993) reportan notables aumentos en N mineral después de 1 y 3 ó 4 días de incubación de estiércol de pollo, que atribuyen a la mineralización de compuestos orgánicos lábiles. Dado que gran parte del N del estiércol de ave se elimina como ácido úrico, es posible que el N mineral encontrado fuera principalmente producto de la degradación de este compuesto, debido a que N mineral original representaba solamente 0.5, 1.1 y 3.4% del N total agregado en EV, EG y CP, respectivamente; por lo tanto, no puede atribuirse este resultado al N mineral agregado con el estiércol. El N orgánico soluble, que engloba la mayor parte de los compuestos de N considerados lábiles, correspondía a 42.3 y 61.7% del N total en EG y CP, respectivamente, en cambio solamente a 21.6% del N total de EV (Cuadro 1). En coincidencia Fujiwara y Murakami (2007), en suelos con agregados de estiércoles de ave frescos y de compost, observaron que el N mineralizado durante 28 días de incubación se correlacionaba más estrechamente con el contenido de ácido úrico que con el contenido total de N de los diferentes materiales.
Mineralización de Carbono
La tasa de respiración disminuyó durante la incubación en todos los tratamientos, con un rango de variación entre 26.1 y 2.3 mg kg–1 d–1 de C–CO2 entre el muestreo inicial y el día 73, para el promedio de los tres tratamientos con estiércol; y entre 11.3 y 1.0 mg kg–1 d–1 de C–CO2 en el mismo período para el promedio de los tratamiento con KNO3. Si bien esos datos no se presentan, esta tendencia puede observarse en la pendiente de las curvas de C respirado acumulado (Figura 2). Este patrón de descomposición, que muestra un rápido decrecimiento en la tasa de respiración luego de agregado el estiércol se ha observado en otros estudios (Calderón et al., 2004; Helgason et al., 2005). La causa de este patrón de descomposición radica en el agotamiento de las fuentes de C solubles disponibles para los microorganismos (Ghani et al., 2005).
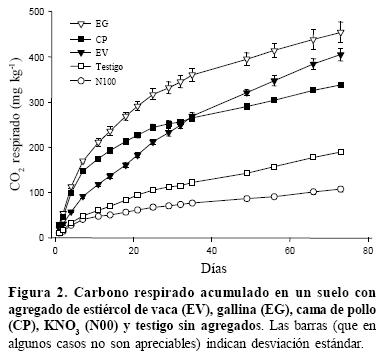
Los estiércoles presentaron durante todo el experimento tasas de respiración significativamente mayores que el testigo y los tratamientos fertilizados con KNO3, mientras que N50 y N100 presentaron tasas menores que el testigo, siendo significativas las diferencias en la mayoría de los muestreos. Al inicio de la incubación las tasas de evolución de CO2 del EG fueron mayores que las de la CP y ésta superior, a su vez, a la de EV, existiendo diferencias significativas entre los tres. Durante la incubación las tasas de respiración de los dos primeros disminuyeron en mayor medida que la de EV, que alcanzó tasas similares a la de la CP a 11 días. A partir del día 25 hubo mayores tasas de respiración de EV y EG respecto a CP, y hacia el fin del experimento las mayores tasas correspondieron a EV. Como consecuencia de estos patrones de respiración, existieron diferencias de C respirado acumulado entre los estiércoles, N50, N100 y el testigo, siendo superiores los estiércoles y entre ellos los mayores valores de C acumulado corresponden a EG, seguido de EV y CP (Figura 2). Coincidentemente, el porcentaje del C inicial de los estiércoles respirado por la microflora del suelo (calculado por diferencia respecto al testigo) fue mayor en EG seguido por CP y EV, respectivamente (Cuadro 2).

En términos de actividad de la biomasa microbiana, los suelos con estiércol presentaron las mayores tasas de respiración y mayor cantidad de C en biomasa, lo que indica que promueven una mayor actividad de la microflora del suelo. Flavel y Murphy (2006) reportan proporciones de C respirado en 70 días de incubación cercanas a 7% para varias enmiendas producto de compostaje de estiércoles y residuos de poda, y de 36% en estiércol de pollo peleteado. Estos valores, si bien están en un rango similar al del presente experimento, muestran la amplia variabilidad en tasas de descomposición de los materiales orgánicos. Esta mayor actividad microbiana en comparación con el testigo se debe en primer término al aporte de C de las enmiendas, estimándose luego de 73 días de incubación una mineralización de 21% del C de EV, 22% de CP y 31% de EG (considerando una relación de asimilación de 1/3). Griffin et al. (2005), trabajando con una gran variedad de estiércoles de vacas lecheras estimaron en promedio una descomposición de 10% durante una estación de crecimiento, resultado sensiblemente menor que el de EV en nuestro estudio. La evolución de C–CO2 como proporción del C agregado indica que al principio de la incubación no hubo diferencias entre EG y CP, en tanto que el CO2 desprendido de EV era escaso. A partir de la tercera semana CP se separó de EG, el cual también presentó tasas de respiración decrecientes, aunque de forma menos acentuada, en tanto que la descomposición de EV continuó a ritmo estable.
La cantidad total de N mineralizada en 11 semanas, que representaba 22, 27 y 33% de lo agregado inicialmente en EV, EG y CP, respectivamente, estuvo asociada a la relación C:N de los estiércoles dado que los de ave, que produjeron mayor mineralización, presentaban una relación C:N más baja (14.5 en EG y 11.5 en CP) respecto a EV (17.5). Por otra parte, no existieron diferencias entre los estiércoles de ave durante la mayor parte de la incubación, a pesar de que CP tenía menor relación C:N. Este comportamiento, contradictorio con lo reportado por otros autores (Serna y Pomares, 1991; Qian y Schoenau, 2002), puede estar relacionado a otros aspectos de la composición de los materiales. A fin de ahondar en este punto, se calculó la mineralización neta de N a partir de la cantidad de C respirado. Para este cálculo se consideró una relación de asimilación de 1/3 y una relación C:N de los microorganismos de 10:1, tomándose esos valores de bibliografía (Van Veen et al., 1984) ya que, si bien se midió la relación C:N de la biomasa microbiana, no se tiene total seguridad acerca del valor del factor de eficiencia de la fumigación, el cual afecta la relación C:N. Se estimó así para 73 días de incubación una mineralización neta de N de 7.9, 14.3 y 12.3 mg kg–1 de suelo para EV, EG y CP, respectivamente, suponiendo que el material tuviera una composición homogénea. Por el contrario, la mineralización neta efectivamente medida fue mucho mayor (19.5, 24.3 y 29.4 mg kg–1 para EV, EG y CP, respectivamente). Estos resultados indican que la mineralización de N fue proporcionalmente mayor que la del C, lo que sugiere que durante la descomposición del estiércol se mineralizaron primero los compuestos lábiles de mayor contenido de N, mientras que los compuestos más resistentes a la degradación, y más ricos en C, se degradaron lentamente. Bitzer y Sims (1988) plantean la mineralización de N del estiércol de pollo en dos o tres fases: la primera muy rápida, seguida por una o dos fases más lentas de mineralización, lo que explicaría los resultados obtenidos en el presente estudio, considerando que se estima que menos de dos tercios del C agregado como enmienda se mineralizaron durante el periodo evaluado. Este comportamiento fue confirmado en estudios detallados de los componentes del estiércol realizados por Van Kessel et al. (2000). Similares patrones de mineralización inicial rápida del estiércol de ave en comparación con el de vaca, que presentó tasas de mineralización más bajas y estables a lo largo de las 10 semanas de incubación, fueron reportados por Castellanos y Pratt (1981), quienes observaron que las diferencias en aporte de N entre los diferentes materiales se originaron fundamentalmente en la primera semana de incubación. Este patrón de temprana liberación de N de los estiércoles de ave cobra importancia en términos de estrategia de fertilización. En ese sentido, Bitzer y Sims (1988) concluyen que, dadas las características del aporte de nutrientes que realizan, estos materiales deben manejarse de modo similar a los fertilizantes sintéticos. De acuerdo con estos autores, una vez aplicados los estiércoles corren el riesgo de sufrir el mismo tipo de pérdidas de N que los fertilizantes sintéticos o incluso mayores, dados los grandes volúmenes agregados.
La relativamente baja proporción de C mineralizado proveniente de los materiales orgánicos agregados (Cuadro 2) es comparable con la observada en otros estudios de mineralización (Rochette et al., 2000a; Helgason et al., 2005). Esta resistencia a la degradación de los materiales no es necesariamente negativa, ya que de esta forma su adición promueve el enriquecimiento en materia orgánica de los suelos. En experimentos a largo plazo, Mooleki et al. (2004) observaron un efecto acumulativo de la aplicación de estiércol de vaca que permitió aumentar los rendimientos de grano luego de varias aplicaciones consecutivas. Estos autores atribuyen los rendimientos mayores con estiércol, respecto a fertilizantes sintéticos, a la paulatina liberación de N de los estiércoles, adecuando la oferta de N a las demandas de los cultivos.
En cuanto a los patrones de mineralización de la cama de pollo, se espera que la presencia de cáscara de arroz produzca inmovilización neta de N, por su alta relación C:N. Por el contrario, este material presentó tendencias similares a EG, lo que sugiere que la influencia de la cáscara de arroz en la mineralización fue mínima. En coincidencia, Thomsen (2004) reporta rendimientos similares de cebada con aplicación de estiércol de pollo puro o con cama de paja o residuos de poda. En su estudio tampoco se observaron diferencias debidas al material acompañante del estiércol cuando se midió el N absorbido por el cultivo. El escaso efecto de la cáscara de arroz puede explicarse considerando el alto contenido de sílice y cubierta cerosa de este material, que impide el humedecimiento, características que le confieren resistencia al ataque microbiano.
pH y Conductividad Eeléctrica
Los suelos con EG presentaron valores significativamente mayores de pH respecto a los demás durante toda la incubación (Figura 3a), lo que concuerda con el pH original del material (Cuadro 1), explicado por su alto contenido en Ca, Mg, K y Na, mientras EV, con un aporte de bases menor que el de los estiércoles de ave, no mostró diferencias con el testigo. En los suelos con KNO3 se observaron los menores valores de pH. Si bien en todos los suelos hubo decrecimientos de pH durante la incubación; este descenso fue más acentuado con CP variando desde pH 5.74, superior al testigo en el primer muestreo, hasta 5.36, a 35 días. Esta tendencia decreciente en pH en los suelos con agregado de CP puede explicarse por su alto contenido de N–NH4+, el cual al nitrificarse produce acidificación del suelo, en tanto que presentaba menor contenido de bases que EG (Cuadro 1).

En los suelos con KNO3 la CE fue mayor que en el resto (Figura 3b). Estiércol de gallina y CP presentaron un comportamiento intermedio, no existiendo diferencias significativas entre ambos. No hubo diferencias entre EV y el testigo con valores significativamente menores que los demás. En coincidencia, Assefa et al. (2004) no observaron cambios en el pH y la CE en suelos que habían recibido aplicaciones de estiércol de vaca durante cuatro años. En cambio, Eghball et al. (2004) reportan mayores valores de pH y CE en los primeros 15 cm de suelos que habían recibido durante cuatro años estiércol de vaca puro o compostado en comparación con los que recibieron fertilizantes (nitrato de amonio, sulfato de amonio y superfosfato).
Las diferencias entre materiales se mantuvieron, con una tendencia general a aumentar ligeramente la conductividad durante la incubación. Debe destacarse que existió una correlación significativa y positiva entre CE y N mineral en los suelos (r = 0.96) que explica la alta CE observada en los tratamientos con KNO3 y estiércoles de ave, siendo significativamente superior N100 respecto a N50. Esta relación entre CE y contenido de N mineral se ha observado en otros experimentos, proponiéndose incluso la medida de la CE como forma de estimación de N mineral de los suelos (Eigenberg et al., 2006).
Cuando se agregó KNO3, las tasas de respiración fueron menores, incluso que las del testigo, lo que indica una actividad microbiana restringida. Si tenemos en cuenta que la solución amortiguadora adicionada a las soluciones de KNO3 contenía P, se espera que también actuara como promotor de la actividad microbiana, resulta difícil explicar este comportamiento. Efectos negativos de la fertilización nitrogenada sobre la biomasa microbiana del suelo fueron reportados por Kowalenko et al. (1978) y Green et al. (1995) en experimentos de campo y laboratorio; por el contrario, Yang et al. (2003) no encontraron efecto del agregado de N en la respiración del suelo testigo. Debe recordarse que existió una relación positiva entre la cantidad de fertilizante agregada y CE, y una relación inversa con el pH. Estos dos factores afectan la actividad microbiana, lo que refleja en una menor tasa de respiración y un menor contenido de C en biomasa en los suelos con KNO3. Por el contrario, luego de la adición e incorporación de EG hubo un aumento en el pH de los suelos, promoviendo un ambiente más favorable al desarrollo de los microorganismos; coincidentemente se han reportado efectos positivos del encalado sobre la actividad microbiana (Curtin et al., 1998).
La disminución en la tasa de respiración al final de la incubación fue más marcada en CP, comparado con los otros estiércoles, lo que se puede relacionar con la gradual disminución del pH, junto con el agotamiento de las fuentes de C lábil. Por otro lado, EV, que inicialmente presentó menores tasas de respiración, mostró una menor disminución durante la incubación, lo que probablemente se debió a una mayor disponibilidad de C asociado a condiciones favorables de pH y al bajo contenido salino de la solución del suelo. A pesar de esta mayor actividad microbiana, la mineralización de N en los suelos con EV fue escasa hasta los dos meses de agregado, lo que concuerda con resultados obtenidos por Paul y Beauchamp (1996) quienes, comparando estiércol de vaca y urea en la producción de maíz, observaron que la mayor población microbiana en los suelos con estiércol de vaca no se tradujo en mayor mineralización neta de N. Estos autores concluyen que el N de la fracción orgánica del estiércol de vaca no es más disponible que el N orgánico del suelo.
Carbono y Nitrógeno en la Biomasa Microbiana
El factor de eficiencia de la fumigación, utilizado para calcular los contenidos de C y N en la biomasa microbiana, fue el propuesto por Jenkinson et al. (2004). Debe tenerse en cuenta que sobrevalorar o subvalorar este factor puede llevar a errores en las cantidades absolutas implicadas y en la relación C:N. En general, las cantidades de C en la biomasa microbiana aumentaron entre los días 4 y 11, sufriendo un ligero descenso el día 35 (Cuadro 3). Los suelos con estiércol presentaron valores significativamente superiores a KNO3 y al testigo. Dentro de los estiércoles, EG mostró un contenido mayor de C en biomasa microbiana, seguido por CP, siendo significativas las diferencias entre EG y las otras enmiendas a 11 y 35 días. Si bien al inicio EV presentó un comportamiento similar a KNO3 y al testigo, para el día 35 éste fue el único tratamiento que fue similar a CP en su C en la biomasa microbiana.
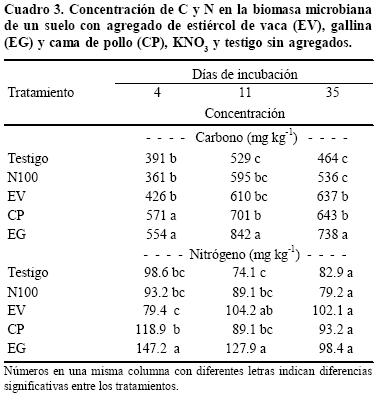
Durante la incubación los valores de N en la biomasa microbiana disminuyeron en todos los casos, salvo en EV (Cuadro 3). Los mayores valores corresponden a los tratamientos de estiércol, siendo mayores al principio los contenidos de N de EG y CP respecto al resto. Los suelos fertilizados con KNO3 mostraron, en general, menores valores de N en biomasa microbiana, similares al testigo.
Al inicio de la incubación, la relación C:N de la biomasa microbiana de todos los tratamientos fue baja (promedio 4.5 – 0.6) y aumentó en la segunda semana (promedio 6.7 – 0.7) y, posteriormente, no se registraron mayores cambios (promedio 6.6 – 1.0, el día 35). Los cambios en el tiempo de la relación C:N de la biomasa microbiana pueden explicarse por cambios en los integrantes de la misma (Spedding et al., 2004). En general, los hongos presentan C:N mayores que las bacterias (Paul y Clark, 1996), por lo que es probable que a medida que los materiales perdieron sus componentes más lábiles hubo una predominancia de hongos entre los microorganismos del suelo.
Los altos contenidos de N en la biomasa microbiana de EG y CP, al principio de la incubación, pueden ser parcialmente explicados por la inmovilización de NH4+. En los suelos con KNO3 agregado no hubo clara inmovilización del N agregado (el N en la biomasa microbiana de N50 y N100 fue similar al N del testigo y diferencia de N mineral respecto al testigo igual a la dosis agregada). Esta falta de efecto positivo del agregado de una fuente de N mineral sobre el contenido de N de la biomasa microbiana fue inesperada, ya que es contradictoria con lo reportado por otros autores (Shi et al., 2004; Spedding et al., 2004). El hecho de haber retirado los restos frescos del suelo previo a la incubación provocó una escasez de C en el medio, lo que sumado a las condiciones negativas para el desarrollo microbiano (evidenciadas en las bajas tasas de respiración de N50 y N100) impidió la inmovilización del N agregado como KNO3.
CONCLUSIONES
Los patrones de mineralización de estiércol mostraron diferencias importantes entre los materiales. El estiércol de ave, como cama de pollo o estiércol de gallina, aportó la mayor cantidad de nitrógeno disponible después de su agregado, aumentando los valores de nitrógeno mineral en el suelo, con una mineralización posterior restringida. Todos los materiales agregados produjeron un aumento en la actividad biológica del suelo, medido tanto en la respiración, como en los contenidos de carbono y nitrógeno de la biomasa microbiana del suelo. El estiércol de vaca, que no realizó inicialmente un aporte significativo a la disponibilidad de nitrógeno, promovió, en cambio, la actividad microbiana en el suelo a mediano plazo, aumentando la mineralización de nitrógeno en el último tercio de la incubación. Por el contrario, el agregado de fertilizante nitrogenado no fomentó la actividad microbiana, sino una caída de pH y aumento de salinidad que la restringieron.
LITERATURA CITADA
Assefa, B. A., J. J. Schoenau, and M. C. J. Grevers. 2004. Effects of four annual applications of manure on Black Chernozemic soils. Can. Biosyst. Eng. 46: 6.39–6.46. [ Links ]
Bitzer, C. C. and J. T. Sims. 1988. Estimating the availability of nitrogen in poultry manure through laboratory and field studies. J. Environ. Qual. 17: 47–54. [ Links ]
Brookes, P. C., A. Landman, G. Pruden, and D. S. Jenkinson. 1985. Chloroform fumigation and the release of soil nitrogen; a rapid direct extraction method for measuring microbial biomass nitrogen in soil. Soil Biol. Biochem. 17: 837–842. [ Links ]
Cabrera, M. L., S. C. Chiang, W. C. Merka, S. A. Thompson, and O. C. Pancorbo. 1993. Nitrogen transformations in surface applied poultry litter: effect of litter physical characteristics. Soil Sci. Soc. Am. J. 57: 1519–1525. [ Links ]
Calderón, F. J., G. W. McCarty, J. A. S. van Kessel, and J. B. Reeves III. 2004. Carbon and nitrogen dynamics during incubation of manured soil. Soil Sci. Soc. Am. J. 68: 1592–1599. [ Links ]
Castellanos, J. Z. and P. F. Pratt. 1981. Mineralization of manure nitrogen: correlation with laboratory indexes. Soil Sci. Soc. Am. J. 45: 354–357. [ Links ]
Curtin, D., C. A. Campbell, and A. Jalil. 1998. Effects of acidity on mineralization: pH dependence of organic matter mineralization in weakly acidic soils. Soil Biol. Biochem. 30: 57–64. [ Links ]
Dao, T. H. and T. H. Cavigelli. 2003. Mineralizable carbon, nitrogen and water extractable phosphorus release from stockpiled and composted manure and manure amended soils. Agron. J. 95: 405–413. [ Links ]
Eghball, B. J. 2000. Nitrogen mineralization from field applied beef cattle feedlot manure or compost. Soil Sci. Soc. Am. J. 64: 2024–2030. [ Links ]
Eghball, B. J., J. E. Wienhold, J. E. Gilley, and R. A. Eigenberg. 2002. Mineralization of manure nutrients. J. Soil Water Conserv. 57: 470–473. [ Links ]
Eghball, B. J., D. Ginting, and J. E. Gilley. 2004. Residual effects of manure and compost applications on corn production and soil properties. Agron. J. 96: 442–447. [ Links ]
Eigenberg, R. A., J. A. Nienaber, B. L. Woodbury, and R. B. Ferguson. 2006. Soil conductivity as a measure of soil and crop status. A four year summary. Soil Sci. Soc. Am. J. 70: 1600–1611. [ Links ]
Flavel, T. C. and D. V. Murphy. 2006. Carbon and nitrogen mineralization rates after application of organic amendments to soil. J. Environ. Qual. 35: 183–193. [ Links ]
Fujiwara, T. and K. Murakami. 2007. Application of near infrared spectroscopy for estimating available nitrogen in poultry manure compost. Soil Sci. Plant Nutr. 53: 102–107. [ Links ]
Ghani, A., M. Dexter, U Sarathchandra, and J. Waller. 2005. Effects of dairy factory effluent application on nutrient transformation in soil. N. Z. J. Agric. Res. 48: 241–253. [ Links ]
Green, C. J., A. M. Blackmer, and R. Horton. 1995. Nitrogen effects on conservation of carbon during corn residue decomposition in soil. Soil Sci. Soc. Am. J. 59: 453–459. [ Links ]
Griffin, T. S., Z. He, and C. W. Honeycutt. 2005. Manure composition affects net transformation of nitrogen from dairy manures. Plant Soil. 273: 29–38. [ Links ]
Hassink, J. 1994. Effects of soil texture and grassland management on soil organic matter carbon and nitrogen and rates of carbon and nitrogen mineralization. Soil Biol. Biochem. 26: 1221–1231. [ Links ]
Helgason, B. L., F. J. Larney, and H. H. Janzen. 2005. Estimating carbon retention in soils amended with composted beef cattle manure. Can. J. Soil Sci. 85: 39–46. [ Links ]
Jenkinson, D. S., P. C. Brookes, and D. S. Powlson. 2004. Measuring soil microbial biomass. Soil Biol. Biochem. 36: 5–7. [ Links ]
Kowalenko, C. G., D. C. Ivarson, and D. R. Cameron. 1978. Effect of moisture content, temperature and nitrogen fertilization on carbon dioxide evolution from field soils. Soil Biol. Biochem. 10: 417–423. [ Links ]
Mooleki, S. P., J. J. Schoenau, J. L. Charles, and G. Wen. 2004. Effect of rate, frequency and incorporation of feedlot cattle manure on soil nitrogen availability, crop performance and nitrogen use efficiency in east–central Saskatchewan. Can. J. Soil Sci. 84: 199–210. [ Links ]
Mulvaney, R. L. 1996. Nitrogen–inorganic forms. pp. 1123–1184. In: D. L. Sparks, A. L. Page, P. A. Helmke, R. H. Loeppert, P. N. Soltanpour, M. A. Tabatabai, C. T. Johnson, and M. E. Summer (eds.). Methods of Soil Analysis. Part 3. Chemical Methods. Soil Science Society of America. Madison, WI, USA. [ Links ]
Nelson, D. W. and L. E. Sommers. 1996. Total carbon, organic carbon, and organic matter. pp. 961–1010. In: D. L. Sparks, A. L. Page, P. A. Helmke, R. H. Loeppert, P. N. Soltanpour, M. A. Tabatabai, C. T. Johnson, and M. E. Summer (eds.). Chemical methods. Soil Science Society of America. Madison, WI, USA. [ Links ]
Paul, E. A. and F. E. Clark. 1996. Soil microbiology and biochemistry. 2nd ed. Academic Press. San Diego, CA, USA. [ Links ]
Paul, J. W. and E. G. Beauchamp. 1996. Soil microbial biomass C, N mineralization and uptake by corn in dairy cattle slurry–and urea amended soils. Can. J. Soil Sci. 76: 469–472. [ Links ]
Qian, P. and J. J. Schoenau. 2002. Availability of nitrogen in solid manure amendments with different C:N ratio. Can. J. Soil Sci. 82: 219–225. [ Links ]
Rhine, E. D., G. H. Sims, R. L. Mulvaney, and E. J. Pratt. 1998. Improving the Berthelot reaction for determining ammonium in soil extracts and water. Soil Sci. Soc. Am. J. 62: 473–480. [ Links ]
Rochette, P., D. A. Angers, and D. Côté. 2000a. Soil carbon and nitrogen dynamics following application of pig slurry for the 19th consecutive year. I. Carbon dioxide fluxes and microbial biomass carbon. Soil Sci. Soc. Am. J. 64: 1389–1395. [ Links ]
Rochette, P., E. van Bochove, D. Prévost, D. A. Angers, D. Côté, and N. Bertrand. 2000b. Soil carbon and nitrogen dynamics following application of pig slurry for the 19th consecutive year. II. Nitrous oxide fluxes and mineral N. Soil Sci. Soc. Am. J. 64: 1396–1403. [ Links ]
SAS Institute. 1985. SAS user's guide: Statistics. Version 5. SAS Institute. Cary, NC, USA. [ Links ]
Serna, M. D. and F. Pomares. 1991. Comparison of biological and chemical methods to predict nitrogen mineralization in animal wastes. Biol. Fertil. Soils 12: 89–94. [ Links ]
Shi, W., B. E. Miller, J. M. Stark, and J. M. Norton. 2004. Microbial nitrogen transformations in response to treated dairy waste in agricultural soils. Soil Sci. Soc. Am. J. 68: 1867–1874. [ Links ]
Sims, J. T. 1987. Agronomic evaluation of poultry manure as nitrogen source for conventional and no tillage corn. Agron. J. 79: 563–570. [ Links ]
Spedding, T. A., C. Hamel, G. R. Mehus, and C. A. Madramootoo. 2004. Soil microbial dynamics in maize growing soil under different tillage and residue management systems. Soil Biol. Biochem. 36: 499–512. [ Links ]
Thomsen, I. K. 2004. Nitrogen use efficiency of 15N labeled poultry manure. Soil Sci. Soc. Am. J. 68: 538–544. [ Links ]
Van Kessel, J. S., J. B. Reeves III, and J. J. Meisinger. 2000. Nitrogen and carbon mineralization of potential manure components. J. Environ. Qual. 29: 1669–1677. [ Links ]
Van Veen, J. A., J. N. Ladd, and M. J. Frissel. 1984. Modelling C and N turnover through the microbial biomass in soil. Plant Soil 76: 257–284. [ Links ]
Yang, X. M., C. F. Drury, W. D. Reynolds, C. S. Tan, and D. J. McKenney. 2003. Interactive effects of composts and liquid pig manure with added nitrate on soil carbon dioxide and nitrous oxide emissions from soil under aerobic and anaerobic conditions. Can. J. Soil Sci. 83: 343–352. [ Links ]
* Publicado en Terra Latinoamericana 26: 43–52.














