Introducción
La diversidad del microbioma vaginal es esencial para establecer el bienestar reproductivo y desarrollar un periodo gestacional saludable. Las modificaciones en el microbioma genitourinario pueden conducir a la disbiosis y a procesos inflamatorios locales y sistémicos, lo que representa un riesgo para la salud de las mujeres durante su etapa sexual y reproductiva1. La vaginosis bacteriana (VB) es una condición de disbiosis vaginal, caracterizada por un decremento en la proporción de bacterias productoras de ácido láctico y el incremento en la proporción de algunas o varias de estas bacterias: Gardnerella vaginalis, Megasphaera spp., Atopobium vaginae, Dialister spp., Mobiluncus spp., Sneathia amnii, Sneathia sanguinegens, Porphyromonas spp. y Prevotella spp.
La VB es la infección vaginal más prevalente en el mundo, y las tasas de prevalencia estimadas mediante métodos microbiológicos (criterios de Amsel y puntuación de Nugent) van entre el 7 y 48% de mujeres sanas no embarazadas y el 61% en mujeres con VIH o con infecciones de transmisión sexual (ITS)2. En EE.UU., el 29% de las mujeres en edad reproductiva cursa con este padecimiento. En México se informa entre el 2 y 8.5% de las pacientes que asisten a alguna inspección ginecológica3,4.
El agente etiológico más frecuentemente identificado es G. vaginalis, una bacteria con aspecto de bacilo pleomórfico y de gramnegativo a gramvariable5. Es una bacteria de crecimiento fastidioso en medios artificiales, por lo que se utilizan los criterios de Amsel para el diagnóstico de VB, incluso la puntuación de Nugent es considerada un método de referencia por la Organización Mundial de la Salud, pero esto tiene algunos engaños. La flora intermedia es hasta ahora una categoría no caracterizada y un desafío en el diagnóstico de la VB. Además, la identificación de morfotipos es subjetiva y dependiente del evaluador; por lo tanto, el diagnóstico puede estar influenciado por las habilidades y la experiencia de cada técnico6,7. Por lo que el propósito de esta investigación fue identificar la frecuencia de infección por G. vaginalis mediante la reacción en cadena de la polimerasa (PCR) en muestran vaginales de pacientes con vaginitis y compararlo con los resultados microbiológicos que generalmente se utilizan en esta institución (cultivo microbiológico, criterios de Amsel y puntuación de Nugent).
Material y métodos
Diseño del estudio
Se realizó un estudio transversal, descriptivo y observacional de noviembre de 2022 a enero de 2023. Todas las participantes firmaron su consentimiento informado.
Población de estudio
La población estuvo conformada por mujeres de edades entre 15 y 56 años que mostraran datos clínicos de cervicitis, flujo vaginal o prurito y que asistieron a una institución de tercer nivel por embarazo, infertilidad u otra condición médica. Los criterios de inclusión fueron: pacientes que no hubieran tomado antibiótico 20 días antes de la toma de la muestra y abstinencia sexual de al menos 72 h al momento de la toma de la muestra. Se excluyeron a aquellas pacientes con expediente clínico incompleto.
Obtención de la muestra
Las muestras cervicovaginales fueron obtenidas mediante hisopado vaginal y endocervical. Los hisopos fueron depositados en el medio de transporte (Medio UTM-RT, COPAN, Brescia, Italia) para posterior extracción de ADN en el laboratorio de bioinmunología molecular y celular.
Cultivo microbiológico
Para el cultivo cervicovaginal se tomaron tres hisopos: el primero para cultivo en medios artificiales, el segundo para un frotis para tinción de Gram, y el tercero para un examen en fresco. Para el examen en fresco, la muestra se homogenizó en un tubo con solución salina, y después se colocó una gota de esta suspensión entre un portaobjetos y cubreobjetos. La observación se realizó en un microscopio Karl-Zeiss con objetivo de 40X, haciendo la búsqueda de células clave, levaduras, pseudohifas y Trichomonas vaginalis. El frotis teñido con la tinción de Gram y observación con el objetivo de 100X se empleó para la evaluación de los criterios de Nugent.
Los medios de cultivo artificiales empleados fueron: agar gelosa chocolate (agar columbia CNA suplementado con sangre de caballo o sangre humana al 5%). La muestra fue sembrada por la técnica de estría cruzada e incubada a 37 °C al 5% CO2 por 48 h. La presencia de colonias de 1 mm de diámetro, betahemolíticas y de color grisáceo fue considerada como de posibles G. vaginalis; para confirmar su identificación se realizaron las pruebas bioquímicas correspondientes en el sistema automatizado Vitek Compat 2, usando la tarjeta NH.
Criterios de Amsel y puntuación de Nugent
Los criterios de Amsel analizados fueron: pH mayor a 4.5, presencia de flujo vaginal gris, homogéneo y adherente, liberación de olor a pescado al adicionar hidróxido de potasio al 10% a la secreción y presencia de células clave. La presencia de tres de los parámetros anteriores se considera como VB.
Para los criterios de Nugent se realiza la cuenta de los diferentes morfotipos y dependiendo de la cantidad que se observe se da un valor y finalmente se suma el puntaje, si la suma es de 7-10 el diagnóstico es VB (Tabla 1).
Tabla 1 Morfotipos de acuerdo con los criterios de Nugent para el diagnóstico de vaginosis bacteriana
| Morfotipos observados por campo | |||
|---|---|---|---|
| Puntaje | Lactobacilos BGP | BCGV Gardnerella vaginalis/Bacteroides | Bacilos curvos gramvariables (Mobiluncus sp.) |
| 0 | > 30 | 0 | 0 |
| 1 | 1-30 | < 1 | 1-4 |
| 2 | 1-4 | 1-4 | > 5 |
| 3 | < 1 | 5-30 | |
| 4 | 0 | > 30 | |
BCGV: bacilo corto gramvariable; BGP: bacilo grampositivo.
Extracción de ADN
A cada tubo le adicionaron 200 µl de regulador de lisis de células blancas, (Tris-HCl 50 nM, pH 8, EDTA 50 mM, NaCl 50 nM, SDS al 2%) con proteinasa K (15 mg) y se incubaron por 1 h a 56 °C; pasado el tiempo de incubación se adicionaron 200 µl de fenol (equilibrado con Tris-HCl 10 mM, pH 8, Sigma®) y 200 µl de cloroformo (Chloroform-isoamyl alcohol mixture, Fluka Analytical), se homogenizaron en el agitador por 15 s y enseguida se centrifugaron a temperatura ambiente por 10 min a 450 x g (High Speed Centrifuge Mini-15, ALLSHENG, Hangzhou, China). Una vez terminado el tiempo de centrifugación, se recuperó el sobrenadante (fase acuosa) en un nuevo tubo Eppendorf, se le adicionaron 200 µl de cloroformo y se agitaron en vórtex (Mixal Multimixer, Lab-Line Instruments, Kerala, India) por 15 min a temperatura ambiente. Posteriormente se centrifugaron a 450 x g por 10 min a temperatura ambiente. Pasado el tiempo de centrifugación, se tomó la fase acuosa (sobrenadante) y se pasó a un tubo nuevo, se le adicionó 1 ml de etanol absoluto (KARAL) frío a 4 °C y 35 µl de NaCl 1 M. Se dejó reposar por 10 minutos a temperatura ambiente y se procedió a centrifugar a 11.000 x g por 15 min, a 4 °C (Microfuge® 22R Centrifuge Beckman Coulter, California, EE.UU.). Posteriormente se eliminó el etanol por inversión y se procedió a evaporar el resto del etanol en un concentrador (Vacufuge plus, Eppendorf, Hamburgo, Alemania) durante 8 min. Finalmente, el ADN se resuspendió en 40 μl de agua Mili-Q o agua grado biología molecular. Las muestras se mantuvieron en congelación (-20 °C) hasta el momento de su uso.
La integridad del ADN se evidenció mediante electroforesis (EC Apparatus Corporation, California, EE.UU.) en un gel de agarosa (UltraPureTM Agarose, InvitrogenTM by Life technologiesTM) al 1% en regulador TAE 1X (TRIS, Acetona, EDTA), a 100 V por 30 min (EC Apparatus Corporation, California, EE.UU.). Una vez terminado el corrimiento electroforético se pasó el gel a una solución de bromuro de etidio al 1% (para la tinción del ADN) durante 8 min; después se colocó el gel al chorro del agua para eliminar el excedente del bromuro de etidio. Enseguida se colocó el gel en un analizador de imágenes (Transiluminador Light Cabinet Hood Alpha Innotech, California, EE.UU.) para ver la integridad del material genético.
Amplificación del ARN ribosomal 16S de Gardnerella vaginalis
Se amplificó el gen ARN ribosomal 16S (ARNr 16S) específico de G. vaginalis. usando los iniciadores: forward 5'-TTCGATTCTGGCTCAGG y reverse 5'-CCATCCCAAAAGGGTTAGGC. Los iniciadores fueron sintetizados con base en sus secuencias publicadas y descritas por Pillay et al9. La PCR se realizó en un volumen final de 25 μl bajo las siguientes condiciones: 0.2 μM de cada iniciador, 1 μl de ADN genómico, 12.5 μl de máster mix 2X (PCR Master Mix. Thermo ScientificTM) y el resto de agua grado biología molecular. La mezcla de reacción se sometió a 28 ciclos de desnaturalización a 94 °C durante 30 segundos, hibridación a 52 °C durante 45 segundos, extensión a 72 °C durante 1 minuto y 25 segundos (Mastercycler gradient Eppendorf, Hamburgo, Alemania). Las condiciones de PCR se llevaron de acuerdo con lo publicado por Pillay et al9. El control negativo fue agua grado biología molecular, y el control positivo fue la cepa de G. vaginalis (14018 ATCC, lote 70045056).
Los productos de la PCR fueron separados en gel de agarosa (UltraPureTM Agarose, InvitrogenTM by Life technologiesTM) al 2% en TAE 1X, a 100 V por 30 min (EC Apparatus Corporation, California, EE.UU.). En uno de los carriles se adicionaron 1.5 ml de marcador de tamaño molecular de 50 pb (Accuris Instruments, Nueva Jersey, EE.UU.) para identificar el tamaño de la banda. Una vez terminado el corrimiento electroforético se pasó el gel a una solución de bromuro de etidio al 1% (para la tinción del ADN) durante 8 min; después se colocó el gel al chorro del agua para eliminar el excedente del bromuro de etidio. Enseguida se colocó el gel en un analizador de imágenes (Transiluminador Light Cabinet Hood. Alpha Innotech, California, EE.UU.) para ver la separación de los productos de la PCR.
Resultados
Se analizaron 121 muestras cervicovaginales mediante la técnica de PCR para la detección de G. vaginalis. Sin embargo, de acuerdo con los resultados obtenidos por los criterios de Nugent solamente se analizaron para cultivo microbiológico 89 muestras para la búsqueda de esta bacteria. Los resultados obtenidos por cultivo fueron 27/89 (30.3%) muestras positivas y mediante la técnica de PCR se identificaron 34/121 (28%) muestras analizadas. La sensibilidad y especificidad del cultivo microbiológico se evidenció del 48.1 y 95.2% respectivamente, cuando se compara con la prueba de PCR (Tabla 2). El análisis estadístico también mostró que la PCR para la detección de G. vaginalis fue 10 veces más sensible que el cultivo microbiológico para identificar dicha bacteria (IC95%: 3.09-32) (p < 0.001).
Tabla 2 Sensibilidad y especificidad del cultivo microbiológico para la detección de Gardnerella vaginalis con respecto a la técnica de PCR
| Cultivo microbiológico | Total | ||
|---|---|---|---|
| Positivo | Negativo | ||
| Técnica de PCR | |||
| Positivo | |||
| Recuento | 13 | 14 | 27 |
| % | 48.1% | 51.9% | 100.0% |
| Negativo | |||
| Recuento | 3 | 59 | 62 |
| % | 4.8% | 95.2% | 100.0% |
| Total | |||
| Recuento | 16 | 73 | 89 |
| % | 18.0% | 82.0% | 100.0% |
PCR: reacción en cadena de la polimerasa.
La edad promedio de las pacientes estudiadas fue de 31.59 ± 6.59 años. El rango de edad de las participantes fue de 15 a 56 años, y el rango de edad de la población que mayormente participó fue entre los 31 y 35 años. En la Figura 1 se muestra la frecuencia de edades de las pacientes examinadas, con y sin detección de G. vaginalis mediante la técnica de PCR.
Los resultados mostraron que la edad promedio de las mujeres infectadas por G. vaginalis fue 30.9 ± 6.6 y dentro de un rango de edad de 20 a 49 años, las adolescentes menores a 20 años y las adultas mayores de 50 años no mostraron infección por esta bacteria.
De las 121 pacientes analizadas, 79 (65.3%) se encontraban embarazadas en el momento del estudio y 42 (34.7%) no lo estaban. En la Figura 2 se muestra el total de pacientes analizadas con y sin infección por G. vaginalis. Las mujeres embarazadas mostraron un mayor porcentaje de infección (19.8%) por este germen en comparación con las no embarazadas (8.3%).

Figura 2 Número de mujeres embarazadas y no embarazadas que mostraron colonización por Gardnerella vaginalis.
Como las pacientes analizadas mostraban datos de cervicitis, se realizó la búsqueda de otros patógenos causantes de esta patología. Los microorganismos identificados durante este estudio mediante el análisis microbiológico se muestran en la tabla 3. Ureaplasma urealyticum (48.7%) fue la bacteria que se identificó más frecuentemente y que se asoció con diferentes microrganismos. En cuanto a G. vaginalis, identificada por PCR, mostró coinfección con diferentes especies de Candida, con Leptothrix, Mycoplasma, Ureaplasma y VPH (Fig. 3).
Tabla 3 Géneros y especies de bacterias y protozoos identificados mediante análisis microbiológico y reporte citológico del virus de papiloma humano en mujeres que mostraron datos de cervicitis*
| Género y especie | Candida albicans | Candida glabrata | Gardnerella vaginalis | Leptothrix | Mycoplasma hominis | Ureaplasma urealyticum | VPH | Microbioma Normal |
|---|---|---|---|---|---|---|---|---|
| Candida albicans | 5 | 3 | 3 | 0 | ||||
| Candida dubliniensis | 1 | 0 | ||||||
| Candida glabrata | 2 | 1 | 1 | 1 | 0 | |||
| Gardnerella vaginalis | 3 | 6 | 5 | 0 | ||||
| Leptothrix | 2 | 0 | ||||||
| Mycoplasma hominis | 5 | 0 | ||||||
| Trichomonas vaginalis | 2 | 2 | 0 | |||||
| Ureaplasma urealyticum | 37 | 2 | 0 | |||||
| Virus del papiloma humano | 3 | 2 | 0 | |||||
| Microbioma normal | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 39 |
*Los números representan el número de casos en donde se asoció o no con otro microorganismo y los números en rojo con más de dos microorganismos involucrados.
 Microorganismos que no mostraron asociación con otro germen.
Microorganismos que no mostraron asociación con otro germen.
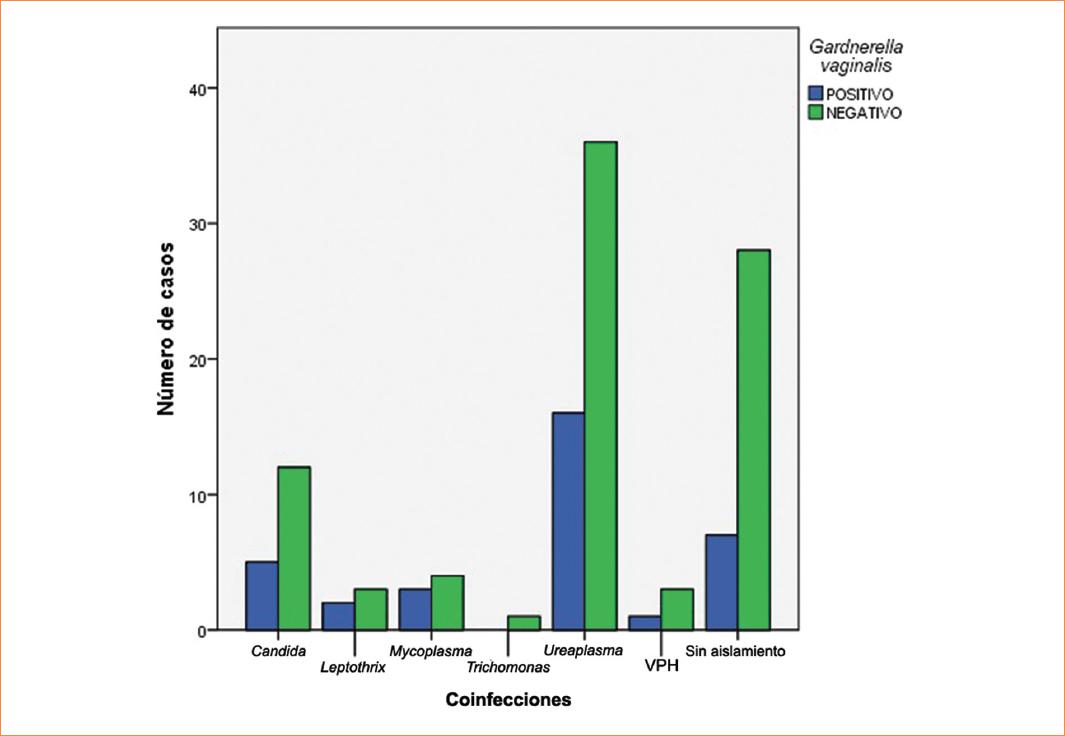
Figura 3 Número de casos de mujeres con infección por Gardnerella vaginalis en coinfección con bacterias, protozoos y virus. La detección de G. vaginalis se realizó mediante la técnica de PCR, la identificación de las bacterias y protozoos se realizó mediante análisis microbiológico y el virus mediante estudio citológico. PCR: reacción en cadena de la polimerasa.
Discusión
La VB es un problema de salud pública que afecta a más del 50% de mujeres en edad fértil, la principal causa se debe a un desajuste en el ecosistema vaginal, donde la población de lactobacilos predominante pasa hacia una colonización de bacterias anaeróbicas principalmente, G. vaginalis, Mycoplasma hominis, Mobiluncus, Prevotella sp. y A. vaginae, entre otros microorganismos gramnegativos (todos ellos pueden ser transmitidos sexualmente). Esta condición presenta un espectro clínico que usualmente suele pasar inadvertido para la paciente, las únicas molestias suelen ser prurito y una secreción blanquecina mal oliente. Ese espectro clínico leve, unido al hecho de que la notificación de la VB no es obligatoria, hace que se desconozca su frecuencia real y que existan dudas en relación con esta condición, tal como ha sido señalado por el Centro de Control de Enfermedades de EE.UU. (CDC)10,11.
En varios laboratorios de diagnóstico la vaginitis se inicia con la observación microscópica tanto en fresco como en Gram. De acuerdo con esta observación, se realizan los criterios de Amsel, Nugent y se realiza el cultivo microbiológico en medio Casman para la búsqueda intencionada de G. vaginalis12, considerados como los métodos de referencia para la identificación de la VB. En este estudio, bajo el empleo de estas pruebas solo se logró identificar a G. vaginalis en el 14.6% de las muestras, mientras que mediante PCR se detectó G. vaginalis en el 30.3% de las muestras vaginales de las pacientes con cervicitis. Ambos resultados se encuentran dentro de los reportados en la literatura mundial, sin embargo la técnica de PCR fue 9.5 veces mayor y mejor para detectar la infección por este patógeno.
La VB puede presentarse en mujeres en etapa prepúber, púber, en edad reproductiva y posmenopáusica. Aproximadamente un 4-15% de las adolescentes con vida sexual activa pueden cursar con esta enfermedad; en mujeres embarazadas se ha detectado una cifra del 25% y en mujeres con enfermedades de transmisión sexual entre un 30 y 37% según lo reportado por Zúñiga y Tobar-Tosse11.
En este estudio solamente hubo nueve (7.4%) adolescentes, y en ninguna de ellas se detectó G. vaginalis, cinco de ellas tuvieron Ureaplasma, dos presentaron Candida albicans, y en dos no se detectó ningún microorganismo. Por lo anterior, la población de adolescentes en este estudio no se encuentra dentro de los parámetros reportados por Zúñiga y Tobar-Tosse11.
Aunque el agente etiológico de la VB más frecuentemente aislado es G. vaginalis, existen otros microorganismos que pueden provocar este padecimiento, una condición bastante prevalente, ocurriendo hasta en un 30% de la población11. En este trabajo se encontró que 15 de las 34 muestras positivas para G. vaginalis, presentaron también Ureaplasma, representando el 44.1% de coinfección entre ambos microorganismos, hecho también reportado por Morris et al13.
Aun cuando la VB no depende exclusivamente de la presencia de G. vaginalis, se puede ver en los resultados que está presente en todos los grupos de edad contemplados en este estudio, predominando en el grupo de mujeres embarazadas, siendo sumamente importante en este grupo de pacientes, pues de acuerdo con lo reportado por Juliana et al.14, al principio del embarazo los cambios en los niveles hormonales afectan la composición del microbioma vaginal: las especies de Lactobacillus aumentan y G. vaginalis y otras bacterias anaeróbicas (facultativas) disminuyen progresivamente del primer al tercer trimestre. Siguiendo estos cambios, el microbioma vaginal permanece relativamente estable durante la mayor parte del embarazo. En el transcurso del embarazo, los cambios comúnmente implican transiciones entre diversas especies de lactobacilos. Diferentes especies del género Lactobacillus interactúan de manera diferente con el ambiente vaginal, lo que puede sugerir que cada especie puede contribuir al desarrollo de BV por medio de un mecanismo diferente15.
La disbiosis vaginal se ha relacionado con varios resultados adversos del embarazo, incluido el parto prematuro y una mayor susceptibilidad a las ITS.
Menard et al.16 investigaron el valor de la cuantificación molecular en el diagnóstico de VB. En dicho estudio, la cuantificación molecular también permitió la caracterización de una microflora intermedia correspondiente a una microflora vaginal tipo BV con altos niveles de G. vaginalis y A. vaginae16,17, misma situación se presentó en este trabajo, donde la bacteria identificada en el mayor número de pacientes fue G. vaginalis.
Autores, como Riganelli et al.18, encontraron que el microbioma de la vagina es diferente al del endometrio, y que el ecosistema microbiano de la vagina es más estable cuando se encuentra en mayor cantidad Lactobacillus crispatus que Lactobacillus iners o una mezcla de lactobacilos. En este trabajo, en 55 de las 121 muestras cervicovaginales el microbioma encontrado consistió en lactobacilos o biota habitual.
Derivado de este trabajo se puede concluir que: a) aunque la tinción de Gram tiene un costo menor que cualquier prueba molecular, la interpretación de los frotis vaginales está sesgada por la subjetividad. Por el contrario, las pruebas moleculares evitan este problema y pueden ser muy útiles por sus valores predictivos de recaída de VB, pudiendo detectar cantidades muy bajas y coinfecciones; b) la posibilidad de obtener del hisopado vaginal, la información cuantitativa y cualitativa sobre el microbioma vaginal; c) la PCR punto final con iniciadores específicos es de mayor sensibilidad para detectar G. vaginalis, (entre el 91.7 y 100%) y una especificidad diagnóstica del 86.28 al 97.05% según algunos estudios que utilizan el Kit PCR GeneProof Gardnerella vaginalis, y d) las diferencias genotípicas entre cepas de G. vaginalis podrían explicar diferentes fenotipos clínicos, tales como BV asintomática o la colonización de G. vaginalis en mujeres sanas. Las mujeres con evidencia de laboratorio de VB, pero sin síntomas, aún pueden tener un mayor riesgo de resultados adversos para la salud19.
Según lo anterior, es importante mencionar que en este trabajo hubo muestras con desarrollo de biota habitual, pero por PCR fueron positivas para G. vaginalis. De acuerdo con esto, es necesaria la continuidad de este trabajo: ampliando el número de muestras cervicovaginales, hacer la detección de factores de virulencia (como la sialidasa y la vaginolisina) de las muestras positivas para G. vaginalis y detectar cuántas cepas diferentes se tienen.











 nueva página del texto (beta)
nueva página del texto (beta)




