Introducción
La preeclampsia es una enfermedad propia del embarazo, parto y puerperio. Se presenta como un trastorno hipertensivo inducido por el embarazo que se manifiesta clínicamente después de las 20 semanas de gestación, tiene repercusiones tanto en la madre como en el feto1. Los trastornos hipertensivos del embarazo son una causa importante de morbilidad grave, discapacidad crónica y muerte entre las madres, los fetos y los recién nacidos2.
En África y Asia, una décima parte de las defunciones maternas está relacionada con estos trastornos, mientras que en América Latina una cuarta parte de las defunciones maternas se relaciona con esas complicaciones2. En México la preeclampsia representa el 34% del total de las muertes maternas, por lo que constituye la segunda causa de muerte asociada a complicaciones del embarazo, y las mujeres embarazadas de 25 a 29 años reportan la tasa más alta de morbilidad hospitalaria por hipertensión gestacional2-4.
Parte fundamental en la fisiopatología de la preeclampsia es provocada por la hipoxia placentaria, lo cual ocasiona estrés oxidativo materno, disfunción endotelial e inmunitaria, así como incremento de las citocinas proinflamatorias y activación de la cascada de la coagulación5. Además, se ha demostrado alteración de la variabilidad en los genes del sistema inmunitario que codifican las moléculas del complejo de histocompatibilidad y de los receptores de las células asesinas naturales que puede afectar la placentación6.
Las manifestaciones clínicas de la preeclampsia pueden ser heterogéneas, por lo que a menudo el diagnóstico puede no ser del todo claro. Un gran número de casos son detectados mediante un cribado de cifras tensionales y perfil preeclámpsico ordinario7. Actualmente, el diagnóstico de la preeclampsia se lleva a cabo de acuerdo con los criterios del Colegio Americano de Ginecología y Obstetricia8.
La preeclampsia con criterios de severidad se define como la presencia de uno de los siguientes síntomas o signos: a) presión arterial sistólica de 160 mmHg o mayor, o presión arterial diastólica de 110 o mayor en dos ocasiones con al menos cuatro horas de diferencia con paciente en reposo; b) función hepática dañada, indicada por niveles anormalmente elevados de enzimas hepáticas séricas, dolor epigástrico o en el hipocondrio derecho grave que no responde a la farmacoterapia y que no se explica por diagnósticos diferenciales; c) concentración sérica de creatinina mayor a 1.1 mg/dl o el doble de la concentración sérica de creatinina; d) alteraciones neuronales de nuevo inicio; e) edema agudo de pulmón, y f) trombocitopenia (recuento < 100, 000/ml). Sin embargo por el momento no contamos con marcadores que puedan predecir el estado de severidad en la preeclampsia9,10.
Actualmente se han descrito valores en la biometría hemática que nos pueden orientar sobre estados proinflamatorios y de daño tisular, como son el índice neutrófilo/linfocito (INL), el volumen plaquetario medio (VPM) y la amplitud de redistribución eritrocitaria (RDW)11,12.
Estos marcadores hematológicos (INL, RDW y VPM) han sido descritos como predictores en diferentes escenarios: patologías cardiacas, patologías oncológicas y en pacientes con sepsis; en pacientes con preeclampsia se ha observado que podrían ser útiles como posibles predictores de severidad, aunque los resultados aun son variables13,14.
Por lo tanto, el objetivo principal del estudio es evaluar la utilidad de marcadores hematológicos como predictores de preeclampsia severa.
Material y métodos
Una vez que el protocolo fue aceptado por el comité de ética y de investigación local, se realizó un estudio transversal retrospectivo y comparativo en la Unidad de Tococirugía del Hospital General León durante el periodo de enero de 2021 a enero de 2022.
Se incluyeron todas aquellas pacientes embarazadas mayores de 18 años que cumplían criterios de preeclampsia al ingreso a tococirugía, se excluyeron y/o eliminaron en caso de presentar patologías hematológicas, oncológicas, infecciones previamente conocidas, o aquellas que no tenían determinaciones de biometría hemática al momento de su ingreso.
Se realizó un muestreo no probabilístico intencional por cuotas hasta alcanzar el tamaño de muestra calculado de 120 pacientes (60 pacientes con diagnóstico de preeclampsia con criterios de severidad y 60 sin criterios de severidad) buscando área bajo la curva mínima esperada de 0.6 de acuerdo con lo encontrado en el estudio de Kurtoglu15, considerando un riesgo alfa del 95% y un poder estadístico (riesgo beta) del 80%.
En todos los casos se midió al ingreso: niveles de linfocitos, neutrófilos,
plaquetas, INL, VPM y RDW; se calculó el INL con la formula 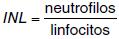 con los valores absolutos de la
biometría hemática, además se tomaron las mediciones otros valores que típicamente
se usan para evaluar severidad en preeclampsia (AST, ALT y DHL). Se establece tiempo
de estancia hospitalaria, complicaciones y desenlace de las pacientes.
con los valores absolutos de la
biometría hemática, además se tomaron las mediciones otros valores que típicamente
se usan para evaluar severidad en preeclampsia (AST, ALT y DHL). Se establece tiempo
de estancia hospitalaria, complicaciones y desenlace de las pacientes.
Análisis estadístico
Para el objetivo principal se analizaron las diferencias en las medias o medianas del INL, RDW y VPM entre las pacientes con o sin datos de severidad con prueba t de Student o U de Mann-Whitney, se realizó un análisis de curva ROC de los marcadores hematológicos para observar cuál poseía la mejor capacidad pronóstica para la presencia de preeclampsia con criterios de severidad (área bajo la curva [AUC] con intervalos de confianza del 95%), se calculó la sensibilidad y especificidad para cada uno de los marcadores; además se calculó el índice de Youden para establecer el mejor punto de corte de cada uno de los marcadores. Se realizó un análisis de asociación con prueba de regresión logística binaria multivariante, obteniendo razón de momios (RM) con intervalos de confianza al 95% (IC95%) para la presencia de preeclampsia con criterios de severidad.
Para los objetivos secundarios, se realizaron estadísticos de acuerdo con el tipo de variable: para variables cualitativas se usaron prueba chi cuadrada o prueba exacta de Fisher, y para variables cuantitativas, prueba t de Student (grupos independientes) o prueba U de Mann-Whitney.
Se consideró la p menor de 0.05 como valor estadísticamente significativo.
Resultados
Se analizaron un total de 120 pacientes (60 pacientes con preeclampsia con criterios de severidad y 60 sin criterios de severidad) en el periodo de enero de 2021 al diciembre de 2022. De forma general, la media (± desviación estándar) de edad fue de 26 años (± 7.9 años), el 35% tenía antecedentes de preeclampsia; el 47.5% tenía el antecedente de 2 gestaciones, el 42.5% tenía el antecedente de una cesárea y el 20% tenía el antecedente de un aborto. De los parámetros hematológicos tomados al ingreso llama la atención un VPM de 11.61 (± 1.13) y una mediana de INL de 4 (3-6); el 13.3% presentó complicaciones asociadas a la preeclampsia y no se registraron defunciones durante el estudio (Tabla 1).
Tabla 1 Descripción general de la población estudiada*
| n = 120 | |
|---|---|
| Edad, años | 26 (± 7.9) |
| Gestaciones | 2.1 (1.08) |
| Antecedentes de preeclampsia, n (%) | 42 (35) |
| Presión arterial sistólica, mmHg | 146 (± 27) |
| Presión arterial diastólica, mmHg | 100 (± 14.5) |
| AST, U/l | 18 (12-25) |
| ALT, U/l | 24.5 (18-39) |
| DHL, U/l | 229.5 (181-289) |
| Plaquetas, miles/ml | 225 (187-271) |
| Neutrófilos, miles/ml | 7.9 (5.9-10.2) |
| Linfocitos, miles/ml | 1.97 (± 0.67) |
| INL | 4 (3-6) |
| RDW, % | 14.3 (± 2.3) |
| VPM | 11.61 (± 1.13) |
| Estancia hospitalaria, días | 2.65 (± 0.9) |
| Complicaciones por preeclampsia, n (%) | 16 (13.3) |
| Egresos, n (%) | 120 (100) |
*Se describe como media (± desviación estándar) o mediana (rango intercuartílico).
AST: aspartato aminotransferasa; ALT alanina aminotransferasa; DHL: deshidrogenasa láctica; INL: índice neutrófilos/linfocitos; RDW: ancho de distribución eritrocitaria; VPM: volumen plaquetario medio.
Al momento de analizar a la población de acuerdo con presencia o no de los criterios de severidad, se observó que el 6.7% de las pacientes con criterios de severidad presentó cinco o más embarazos en comparación con el 1.7% en las pacientes sin criterios de severidad (p = 0.012) y fue mayor el porcentaje de antecedentes de preeclampsia en las pacientes con criterios de severidad (p < 0.001), además, la edad fue menor en la población con criterios de severidad (27.4 vs. 38.2 años; p = 0.047). Se observó una diferencia en el VPM entre los grupos (11.9 vs. 11.3; p = 0.009), así como en los niveles de aspartato aminotransferasa (AST) y alanina aminotransferasa (ALT) (Tabla 2).
Tabla 2 Comparación de la población entre la presentación o no de criterios de severidad en preeclampsia (PE)*
| PE criterios de severidad (n = 60) | PE sin criterios de severidad (n = 60) | Significancia (p) | |
|---|---|---|---|
| Edad, años | 27.4 (± 8.8) | 38.2 (± 6.7) | 0.047 |
| Antecedentes de preeclampsia, n (%) | 27 (45) | 15 (25) | < 0.001 |
| AST, U/l | 21.5 (13-51.2) | 17 (11-21) | 0.03 |
| ALT, U/l | 27 (20.8-45) | 22.5 (17-29) | 0.05 |
| DHL, U/l | 219 (178-271) | 249 (185-299) | 0.194 |
| Plaquetas, miles/ml | 220 (181-266) | 237 (190-272) | 0.404 |
| Neutrófilos, miles/ml | 8.15 (6-10.9) | 7.7 (5.2-9.8) | 0.147 |
| Linfocitos, miles/ml | 2.04 (± 0.68) | 1.9 (± 0.66) | 0.587 |
| INL | 4.14 (3-6) | 3.7 (2.72-5.38) | 0.257 |
| RDW, % | 14.37 (± 3.04) | 14.31 (± 2.07) | 0.888 |
| VPM | 11.9 (± 1.71) | 11.3 (± 1.03) | 0.009 |
| Estancia hospitalaria, días | 3.3 (± 0.89) | 2 (± 0.6) | 0.060 |
| Complicaciones por preeclampsia, n (%) | 16 (26.7) | 0 | < 0.001 |
*Se describe como media (± desviación estándar) o mediana (rango intercuartílico).
AST: aspartato aminotransferasa; ALT alanina aminotransferasa; DHL: deshidrogenasa láctica; INL: índice neutrófilos/linfocitos; RDW: ancho de distribución eritrocitaria; VPM: volumen plaquetario medio.
Para el objetivo principal se realizó un análisis curva ROC, obteniendo que AST, ALT y VPM fueron los marcadores que obtuvieron un AUC mayor de 0.600 (Fig. 1), se calculó el índice de Youden para estas tres variables con los siguientes puntos de cortes para la presencia de preeclampsia con criterios de severidad: AST de 21 U/l (sensibilidad 50% y especificidad 83%), ALT de 30 U/l (sensibilidad 48% y especificidad 53%) y VPM de 11.25 (sensibilidad 78% y especificidad 50%).
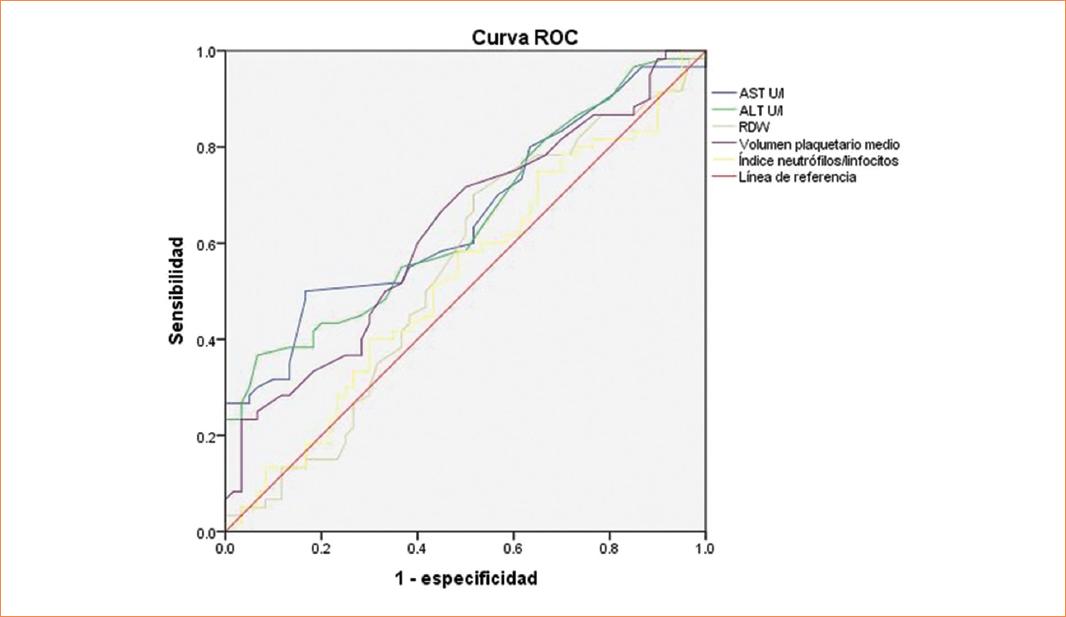
Figura 1 Análisis del rendimiento pronóstico de marcadores hematológicos para la presencia de preeclampsia con criterios de severidad. Curva ROC (AUC; IC al 95%; p) que demuestra que AST (0.655; 0.577-0.753; p = 0.03), ALT (0.648; 0.550-0.746; p = 0.005) y VPM (0.629; 0.530-0.729; p = 0.015) tuvieron significancia estadística en la predicción de criterios de severidad en preeclampsia. AST: aspartato aminotransferasa; ALT alanina aminotransferasa; AUC: área bajo la curva; VPM: volumen plaquetario medio.
Se realizó prueba de regresión logística binaria multivariante para observar el nivel de asociación de las variables (edad, antecedentes de preeclampsia, AST, ALT y VPM) con la preeclampsia con criterios de severidad, encontrando que el VPM fue la variable que mantuvo una mayor asociación positiva con la presencia de preeclampsia con criterios de severidad (RM: 2.584; IC95%: 1.17-5.66) (Tabla 2), seguida por el antecedente de preeclampsia previa (RM: 2.139; IC95%: 1.02-4.98).
El total de las complicaciones asociadas a la preeclampsia se observaron en el grupo de datos de severidad, por lo que analizándolas de forma separada se describió un incremento en los niveles de AST (86 vs. 15; p < 0.001), ALT (72.5 vs. 22; p < 0.001) y cuenta absoluta de plaquetas (161,000 vs. 225,000; p = 0.042) en aquellas pacientes que presentaron complicaciones (Tabla 3).
Tabla 3 Comparación de las pacientes que presentaron o no complicaciones asociadas a la preeclampsia con criterios de severidad*
| Complicaciones por preeclampsia | Sin complicaciones por preeclampsia | Significancia (p) | |
|---|---|---|---|
| Edad, años | 24.6 ( ± 5) | 28.4 (± 9) | 0.133 |
| Presión arterial sistólica, mmHg | 171 (± 21.4) | 168 (± 15) | 0.534 |
| Presión arterial diastólica, mmHg | 116 (± 17) | 111 (± 3.4) | 0.078 |
| AST, U/l | 86 (30-112) | 15.5 (12-113) | < 0.001 |
| ALT, U/l | 72.5 (41-110) | 22 (19-36.7) | < 0.001 |
| DHL, U/l | 232 (178-286) | 208 (176-273) | 0.841 |
| Plaquetas, miles/ml | 161 (105-277) | 225 (198-271) | 0.042 |
| Neutrófilos, miles/ml | 8.4 (6-11.5) | 7.9 (5.9-10.8) | 0.861 |
| Linfocitos, miles/ml | 2.11 (± 0.67) | 2 (± 0.68) | 0.967 |
| INL | 3.8 (2.83-6.64) | 4.22 (2.9-6.3) | 0.967 |
| RDW, % | 15.4 (± 4.3) | 13.9 (± 13.3-15) | 0.110 |
| VPM | 11.9 (± 1.38) | 11.8 (± 1.09) | 0.691 |
*Se describe como media (± desviación estándar) o mediana (rango intercuartílico).
AST: aspartato aminotransferasa; ALT alanina aminotransferasa; DHL: deshidrogenasa láctica; INL: índice neutrófilos/linfocitos; RDW: ancho de distribución eritrocitaria; VPM: volumen plaquetario medio.
Discusión
La preeclampsia es una enfermedad del embarazo y puerperio con gran morbimortalidad a nivel mundial, por lo que es necesario buscar herramientas que nos ayuden a predecir si presentará datos de severidad, históricamente se han establecido criterios bioquímicos como ALT, AST, creatinina, plaquetas o DHL que cumplen dicha función, sin embargo continúa la búsqueda para encontrar nuevos parámetros, donde el tiempo, el costo y la disponibilidad de dichas pruebas sean factores determinantes. Dentro de la biometría hemática se encuentran parámetros como el INL, el RDW o el VPM, en los que pocas veces fijamos nuestra atención, sin embargo estos parámetros se utilizan como marcadores para evaluar el estado de inflamación del sujeto, un estudio que es rápido, barato y al alcance de la mayoría de todos nosotros.
En nuestro estudio de 120 pacientes, la edad fue menor en la población con criterios de severidad, en comparación con el estudio de Çintesun et al., donde no hubo diferencias estadísticamente significativas entre las mujeres embarazadas sanas y las mujeres preeclámpsicas en términos de mediana de edad16 o como muestran Serin et al., quienes reportan que la edad, el índice de masa corporal y las semanas de gestación fueron similares en los grupos de preeclampsia con y sin datos de severidad17.
En el INL, en nuestro medio, no hubo diferencia significativa entre pacientes con o sin datos de severidad (p = 0.748), sin embargo hay estudios donde se encontró con valor significativo como el de Kurtoglu et al. (p = 0.023)15, Yavuzcan et al. (p = 0.000)18 y Oylumlu et al. (p < 0.001)19.
Acerca del RDW, existe literatura donde se asocian dicho parámetro y la severidad de la preeclampsia, como el estudio de Viana-Rojas et al., obteniendo un p = 0.0320, mientras que Kurt et al. obtuvieron una p < 0.00121, reportando ambos que los niveles de RDW aumentaron significativamente en las pacientes con preeclampsia severa en comparación con las pacientes sin datos21, nuestro estudio reporta una p = 0.888, por lo que no se encuentra significativo.
Sin embargo, el VPM en nuestro estudio tuvo un valor significativo (p = 0.009) con un AUC mayor de 0.600 para pacientes con preeclampsia con datos de severidad, comparando nuestros datos con el estudio de Sachan et al., quienes realizaron un estudio prospectivo de casos y controles con el objetivo de evaluar el papel del VPM, donde se incrementó con la severidad de la preeclampsia, la precisión diagnóstica fue del 69.4%, con un valor de corte ≥ 9.05 fl y controles discriminados de VPM y preeclampsia sin datos de severidad con un 50.0% de sensibilidad y un 82.4% de especificidad22.
Las transaminasemias juegan un papel importante en preeclampsia con datos de severidad, así como sus complicaciones, como el síndrome HELLP (hemólisis, aumento enzimas hepáticas y trombocitopenia), el cual se desarrolla hasta en el 10% de los casos23. En nuestro estudio las transaminasas tuvieron un valor significativo (p < 0.001), aunado al estudio de García et al., quienes demuestran que para ALT, AST y GGT tienen un valor de p < 0.000124.
El siguiente estudio tiene importantes limitaciones: a) el diseño transversal y la temporalidad retrospectiva del estudio hace que sea difícil generalizar los resultados del estudio, y un estudio prospectivo y longitudinal ayudaría a evaluar de mejor forma la causalidad de las variables hematológicas con la presencia de criterios de severidad en la preeclampsia; b) el no descartar pacientes con proceso infeccioso asintomático (infecciones de las vías urinarias, vaginitis) al momento de la selección de la muestra puede provocar alteraciones en las variables hematológicas, y c) el tamaño de la muestra se calculó en búsqueda de una mínima AUC, y la fuerza de asociación entre la VPM y la preeclampsia con criterios de severidad puede verse afectada, por lo que un estudio de asociación (casos y controles, cohorte) podría dar mejores resultados en la asociación de la VPM y la preeclampsia con criterios de severidad. (p = 0.023)15, Yavuzcan et al. (p = 0.000)18 y Oylumlu et al. (p < 0.001)19.
Acerca del RDW, existe literatura donde se asocian dicho parámetro y la severidad de la preeclampsia, como el estudio de Viana-Rojas et al., obteniendo un p = 0.0320, mientras que Kurt et al. obtuvieron una p < 0.00121, reportando ambos que los niveles de RDW aumentaron significativamente en las pacientes con preeclampsia severa en comparación con las pacientes sin datos21, nuestro estudio reporta una p = 0.888, por lo que no se encuentra significativo.
Sin embargo, el VPM en nuestro estudio tuvo un valor significativo (p = 0.009) con un AUC mayor de 0.600 para pacientes con preeclampsia con datos de severidad, comparando nuestros datos con el estudio de Sachan et al., quienes realizaron un estudio prospectivo de casos y controles con el objetivo de evaluar el papel del VPM, donde se incrementó con la severidad de la preeclampsia, la precisión diagnóstica fue del 69.4%, con un valor de corte ≥ 9.05 fl y controles discriminados de VPM y preeclampsia sin datos de severidad con un 50.0% de sensibilidad y un 82.4% de especificidad22.
Las transaminasemias juegan un papel importante en preeclampsia con datos de severidad, así como sus complicaciones, como el síndrome HELLP (hemólisis, aumento enzimas hepáticas y trombocitopenia), el cual se desarrolla hasta en el 10% de los casos23. En nuestro estudio las transaminasas tuvieron un valor significativo (p < 0.001), aunado al estudio de García et al., quienes demuestran que para ALT, AST y GGT tienen un valor de p < 0.000124.
El siguiente estudio tiene importantes limitaciones: a) el diseño transversal y la temporalidad retrospectiva del estudio hace que sea difícil generalizar los resultados del estudio, y un estudio prospectivo y longitudinal ayudaría a evaluar de mejor forma la causalidad de las variables hematológicas con la presencia de criterios de severidad en la preeclampsia; b) el no descartar pacientes con proceso infeccioso asintomático (infecciones de las vías urinarias, vaginitis) al momento de la selección de la muestra puede provocar alteraciones en las variables hematológicas, y c) el tamaño de la muestra se calculó en búsqueda de una mínima AUC, y la fuerza de asociación entre la VPM y la preeclampsia con criterios de severidad puede verse afectada, por lo que un estudio de asociación (casos y controles, cohorte) podría dar mejores resultados en la asociación de la VPM y la preeclampsia con criterios de severidad.
Sin embargo también cuenta con fortalezas como: a) se pudo obtener que incrementos leves en las transaminasas (AST y ALT) tienen capacidad pronóstica como prueba de cribado para la presencia de preeclampsia con criterios de severidad, y b) se observó que el incremento de AST y ALT, así como la disminución de la cuenta de plaquetas, en pacientes con preeclampsia con criterios de severidad pueden ser factores asociados con complicaciones intrahospitalarias.
Conclusiones
El VPM es un posible predictor y se asocia con la presencia de criterios de severidad en pacientes con preeclampsia. Además, el incremento de la AST y la ALT, y la disminución de la cuenta total de plaquetas pueden ser factores pronóstico de complicaciones en pacientes que presentan criterios de severidad en la preeclampsia.











 nueva página del texto (beta)
nueva página del texto (beta)


