Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Perinatología y reproducción humana
versão On-line ISSN 2524-1710versão impressa ISSN 0187-5337
Perinatol. Reprod. Hum. vol.28 no.3 Ciudad de México Jul./Set. 2014
Artículo de revisión
Los microRNA: una herramienta que podría ser usada como biomarcadores de la corticogénesis fetal
MicroRNA: a tool that can be used as a fetal corticogenesis biomarker
Mario Lamadrid-Romero,*,‡ Fabián Díaz-Martínez,* Anayansi Molina-Hernández*
* Instituto Nacional de Perinatología Isidro Espinosa de los Reyes.
‡ Postgrado en Ciencias Biológicas, Facultad de Ciencias, UNAM.
Correspondencia:
Anayansi Molina-Hernández
Departamento de Biología Celular,
Instituto Nacional de Perinatología
Isidro Espinosa de los Reyes.
Montes Urales Núm. 800,
Col. Lomas de Virreyes, 11000,
Del. Miguel Hidalgo, México, Distrito Federal.
Tel: 55209900, ext. 447 o 338.
E-mail: anayansimolina@gmail.com
Recibido: 10 de octubre de 2013
Aceptado: 03 de diciembre de 2013
RESUMEN
Los microRNA son RNA pequeños no codificantes que regulan la traducción de RNA mensajeros. En el tejido cerebral de mamífero, existe una regulación temporal de los niveles de estas moléculas durante el desarrollo, los cuales están relacionados directamente con momentos específicos en la formación del sistema nervioso central y tienen un papel trascendental en la citoarquitectura cerebral. Existe una gran cantidad de deficiencias y/o alteraciones de las funciones cerebrales que no pueden ser explicadas por causas genéticas o detectadas por los métodos convencionales, por lo que es de gran importancia identificar marcadores moleculares no invasivos de problemas sutiles relacionados con alteraciones en la diferenciación, proliferación, muerte celular u organización del tejido nervioso que puedan tener consecuencias negativas en la vida postnatal del producto, principalmente en el área cognitiva, motora y social. Una alternativa es la búsqueda y determinación de los niveles de microRNA involucrados en la corticogénesis fetal en suero materno. Aquí revisaremos algunas de las características de estas moléculas que las hacen buenas candidatas para ser consideradas como biomarcadores del desarrollo cerebral fetal, entre las que se encuentran la forma en que se sintetizan y llegan al torrente sanguíneo, su estabilidad, su patrón de expresión durante la corticogénesis y su presencia en el suero materno.
Palabras clave: MicroRNA, biomarcador, corticogénesis fetal, suero materno.
ABSTRACT
MicroRNAs are small non-coding RNAs that regulate the translation of messenger RNA into proteins. During the development of the mammalian brain tissue, there is a temporal regulation of the levels of these molecules, which are directly related to specific stages in the formation of the central nervous system; microRNAs play a major role in brain cytoarchitecture. There are multiple alterations in brain function that cannot be explained by genetic causes or detected by conventional methods; for this reason, it is very important to identify molecules that can be proposed as biomarkers in a noninvasive way for pathologies related to alterations upon cell differentiation, proliferation and death or brain tissue organization that may have negative consequences in postnatal life and that can potentially lead to cognitive, motor and social deficits. An alternative is determining the microRNA levels involved in fetal corticogenesis in the maternal serum. In this article, we review some characteristics of these molecules that make them candidates to be proposed as biomarkers of fetal brain development, such as the pathway throught which they are synthesized and released into the bloodstream, their stability, their expression pattern during corticogenesis and their presence in the maternal serum.
Key words: MicroRNA, biomarker, fetal corticogenesis, maternal serum.
Biosíntesis de microRNA y su presencia en la sangre
Los microRNA son una clase de RNA pequeños de entre 19 y 25 nucleótidos de longitud con un grupo fosfato en el extremo 5' y un grupo hidroxilo en el extremo 3'. Juegan un papel regulador en la síntesis de proteínas uniéndose a los mensajeros (RNAm).1,2
Una característica general de los microRNA de mamífero es su apareamiento imperfecto o perfecto con el RNA blanco, el cual determinará la manera en la que realiza su función. La función de los microRNA, cuando el apareamiento es imperfecto, se efectúa en el RNAm reprimiendo su traducción mediante tres mecanismos probables: 1) represión postranscripcional, 2) reprimiendo el inicio de la traducción y 3) por desestabilización del RNAm blanco a través de un proceso de desadenilación. En los tres mecanismos, los RNAm blancos son secuestrados en los cuerpos-P para almacenamiento o degradación, para que bajo condiciones de estrés los RNAm almacenados se liberen y se traduzcan.
Los microRNA maduros derivan del procesamiento que se inicia en el núcleo de la célula y termina en el citoplasma, donde realizan su función. Son transcritos por la RNA polimerasa II, que produce una larga molécula de RNA que puede ser de hasta un kilo base, conocida con el nombre de microRNA primario (pri-RNA).3,4 Ésta forma una estructura en "hairping-stem-loop" (horquilla-tallo-bucle), la cual es cortada en el núcleo por la endonucleasa RNAsa III -conocida con el nombre de Drosha-, que está asociada con la proteína DGCR8 (en mamíferos) o Pasha (en Drosophila y C. elegans). Drosha corta de forma asimétrica ambas cadenas en los sitios cercanos a la base de la estructura primaria en forma de horquilla, generando un producto de 60-70 nucleótidos denominado pre-microRNA.5,6 El pre-microRNA es exportado al citoplasma de forma activa a través del complejo dependiente de RAN-GTP, exportina-5.7 En el citoplasma, la molécula de GTP es hidrolizada a GDP y el pre-microRNA es liberado del complejo exportador. Una vez en el citoplasma, esta molécula es cortada por la endonucleasa RNAsa III conocida como Dicer, asociada a las proteínas TRBP y PACT en mamíferos, dando lugar a una molécula de doble cadena conocida como microRNA dúplex.8 Al separarse las dos cadenas, una de ellas da lugar al microRNA maduro que se incorporará al complejo ribonucleoproteico conocido como "complejo de silenciamiento de RNA" (RISC, del inglés RNA induced silencing complex), que es la maquinaria catalítica responsable de la degradación del RNAm blanco y/o de la inhibición de la traducción. Otra vía de síntesis es la denominada "no canónica", que implica la síntesis de miRNA maduros sin la participación de Drosha (Figura 1A).9
Estas moléculas han sido encontradas en diferentes fluidos corporales como plasma, suero y orina. En algunos casos, se ha validado que sus niveles en los fluidos corporales son capaces de reflejar condiciones fisiológicas o patológicas como el embarazo o la presencia de tumores. La manera en la que éstas son incorporadas a la circulación o son eliminadas a través de la orina aún no está del todo clara. Se ha propuesto que los pre-microRNA o los microRNA maduros se unen a los cuerpos multivesiculares (MVB, del inglés multivesicular bodies) para ser incorporados a vesículas de exocitosis que, al unirse a la membrana, liberan a los MVB para ser endocitados por otras células o liberar su contenido al espacio extracelular, de donde pueden incorporarse al torrente sanguíneo. Es importante mencionar que también se ha reportado la presencia de pre-miRNA y miRNA maduros en estado libre (Figura 1B).
El descubrimiento de moléculas fetales en el plasma de mujeres embarazadas ha llevado a desarrollar pruebas diagnósticas prenatales no invasivas. El DNA fetal en plasma circulante materno ha sido útil para investigar el estado prenatal de, por ejemplo, la enfermedad hemolítica del recién nacido (enfermedades ligadas al sexo y la β-talasemia mayor).10-13
En los últimos años, diversos grupos de investigación han realizado estudios en donde han analizado la expresión de los miRNA a través de diferentes estadios fisiológicos y su relación con cambios en la expresión de genes. Por ejemplo, se ha demostrado que los miRNA pueden ser extraídos a partir de suero y que es posible medir sus niveles y perfiles de expresión en pacientes con patologías como el cáncer e, inclusive, llegar a distinguir a mujeres embarazadas de las que no lo están por la presencia de microRNA placentarios (Cuadro I).14
Desarrollo de la corteza cerebral y los microRNA
La corteza cerebral contiene los centros cerebrales superiores que controlan las funciones intelectuales, sensoriales y motoras. Esta estructura es generada a partir del prosencéfalo. En la corteza cerebral de los seres humanos se encuentra el 70% de las neuronas del sistema nervioso central (SNC).
Desde el desarrollo temprano, un número elevado de tipos neuronales distintos a nivel morfológico y funcional se organiza en diferentes láminas para controlar de manera coordinada las funciones cerebrales. Estas neuronas son producidas durante el desarrollo embrionario y el número exacto de cada tipo neuronal se regula de manera precisa por mecanismos de proliferación, migración, diferenciación y muerte celular. En el humano, la neurogénesis se inicia durante la etapa proliferativa, entre el segundo y cuarto mes (primero y segundo trimestre), tiene su pico cuando las neuronas migran desde las zonas centrales hasta la periferia para formar la corteza cerebral, entre el tercero y quinto mes (segundo trimestre), y el proceso de organización inicia en el sexto mes (final del segundo trimestre). Al finalizar el segundo mes, las células migran desde la zona intermedia hacia la zona marginal, donde forman la corteza cerebral; para finales del primer trimestre de gestación, la zona cortical tiene gran cantidad de neuroblastos procedentes de las capas profundas a causa de la migración; éstos se organizan en varias capas horizontales hasta un número de seis para los meses sexto al octavo (Figura 2). En las primeras semanas de gestación, la superficie de la corteza es lisa, pero a partir del sexto y séptimo mes se desarrollan las circunvoluciones, separadas por surcos.15,16

Entre las moléculas que participan en la regulación de la formación de la corteza cerebral están los microRNA (miRNA). Los miRNA son RNA pequeños no codificantes de entre 19 y 25 nucleótidos que se unen a uno o más RNA mensajeros (RNAm) blanco; esta unión promueve la degradación o inhibición de la traducción del RNAm. Los miRNA se expresan en todos los tejidos, en particular, el cerebro presenta una alta diversidad de expresión de estas moléculas. Y se sabe que pueden estar regulando la expresión de factores de transcripción implicados en el desarrollo de la corteza cerebral.17
Un dato importante es que los microRNA que se expresan en el tejido cerebral de mamífero presentan una regulación temporal que está relacionada directamente con momentos específicos del desarrollo del sistema nervioso central, actuando como represores de la síntesis de proteínas.17-20
Diversos investigadores han reportado en modelos animales que cambios en los niveles de ciertos microRNA en el tejido cerebral durante el desarrollo provocan eventos negativos.21 Un ejemplo es el ratón knockout (KO) para presenilina-1(PS1), una proteína que forma parte de un complejo multiproteico que media la proteolisis y liberación del fragmento activo de Notch, molécula relacionada con la diferenciación celular. En estos ratones, la expresión de mir-131 y mir-9 se encuentra disminuida en el prosencéfalo, lo que sugiere que estos microRNA están participando en la formación del complejo proteico, la activación de Notch y los defectos de la diferenciación celular durante el desarrollo del SNC. Esto es confirmado por los defectos graves del SNC y las malformaciones del esqueleto axial presentes en los KO para PS1.18
Otros estudios han evidenciado la importancia de los microRNA durante el desarrollo del SNC. Al estudiar la función global de los microRNA en peces cebra por medio del bloqueo del gen que codifica para Dicer (enzima involucrada en la maduración de los microRNA), mostraron que después del día ocho larvario sufren arresto en el crecimiento y la mayoría muere entre los días 14-15 postfertilización.22
Nielsen y colaboradores demostraron que durante la corticogénesis de la rata existen microRNA que son regulados hacia arriba o hacia abajo en la etapa neurogénica y que participan en la red que está involucrada en la corticogénesis (Cuadro II). Al realizar el análisis experimental y bioinformático de los posibles blancos de algunos de los microRNA que presentaron cambios en su expresión durante el desarrollo, interesantemente encontraron que éstos se asocian con factores de transcripción que promueven la diferenciación neuronal; por ejemplo, la disminución en el nivel de mir-291-3p está relacionada con un aumento en los niveles de la proteína de NeuroD1.
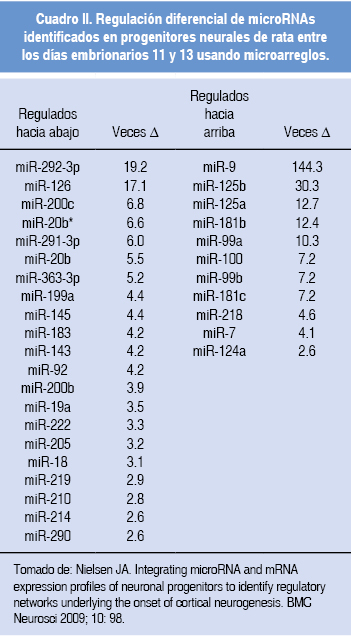
Otros ejemplos claros son el miR-183 -que tiene como blanco factores de transcripción que promueven la diferenciación neuronal (17)-, miR-92 y miR-222 -tiene como blanco al inhibidor de la ciclina dependiente de cinasa 1c (Cdkn1c), la cual regula de manera negativa la proliferación de progenitores corticales inhibiendo el ciclo celular,23 por lo que la disminución de este par de microRNA provocaría un aumento de la Cdkn1c y una disminución en la proliferación-, miR-9 y miR-124a -se han relacionado con promover la transición de progenitores hacia neuronas-,24,25 miR-125a -promueve la migración celular (un fenómeno importante para la laminación cortical)-26 y miR-125b -está relacionado con la represión de lin-28, promoviendo la diferenciación neuronal-.27
La diabetes durante la gestación y el desarrollo del sistema nervioso central
La diabetes durante el embarazo es considerada un factor de riesgo que afecta el neurodesarrollo fetal. La hiperglucemia materna se ha relacionado con defectos durante el desarrollo del sistema nervioso central que pueden dar como resultado el deficiente desarrollo de las capacidades cognitivas, entre otros (Cuadro III).21,28,29 El estudio de cómo esta patología afecta la expresión de microRNA durante el desarrollo no se conoce.
Estudios epidemiológicos han mostrado que el riesgo de presentar malformaciones y abortos espontáneos se incrementa en la diabetes gestacional. La incidencia de malformaciones congénitas reportadas en modelos animales para diabetes gestacional inducida con estreptozotocina se ha estimado de entre 4 y 10%. Otros estudios han mostrado que estas malformaciones están relacionadas con una desregulación de la expresión de un gran número de genes, entre los que se encuentran Pax3, Sox10, ciclinas, etcétera.30-32 Sin embargo, el estudio en modelos animales utilizando a la estreptozotocina para eliminar las células beta pancreáticas, aunque de gran utilidad, promueve fenotipos extremos durante el cierre del tubo neural en el desarrollo temprano, dependiendo de la dosis utilizada y no representa la patología de diabetes gestacional. Por ello, es necesario buscar estrategias para el estudio de lo que podría estar ocurriendo durante el desarrollo fetal, en donde el cierre del tubo neural en apariencia no está afectado, pero que probablemente otros procesos posteriores al cierre del tubo neural si lo están.
Diagnóstico prenatal y el posible uso de los microRNA como biomarcadores
Para el diagnóstico prenatal se utilizan técnicas como 1) la ecografía, 2) el tamizaje prenatal y postnatal, 3) la embriofetoscopia, 4) la amniocentesis, 5) la biopsia corial y 6) la biopsia de vellosidad coriónica, por citar sólo algunas. Sin embargo, los defectos no evidentes y que no son de origen genético escapan a este tipo de diagnósticos. Entre las anomalías que no logran ser relacionadas con la adecuada diferenciación celular y, en particular, con la diferenciación neuronal en un espacio y tiempo adecuados para el desarrollo neurológico, es importante proponer nuevos biomarcadores prenatales para este tipo de alteraciones, ya que podrían estar relacionadas con diversos grados de retraso mental, problemas de aprendizaje y de desarrollo intelectual postnatal.
En este sentido, la identificación de microRNA fetales en suero materno -que están asociados al desarrollo de la corteza cerebral y, en general, al SNC- mediante el uso de técnicas moleculares podría ser una herramienta útil para detectar problemas que hasta el momento no somos capaces de detectar.
Un instrumento provechoso puede ser la identificación de microRNA fetales asociados al desarrollo cortical en suero materno mediante el uso de técnicas moleculares. Existe una gran cantidad de deficiencias y/o alteraciones de las funciones cerebrales que no pueden ser explicadas por causas genéticas; por ejemplo el 20% de los casos de síndrome de déficit de atención con hiperactividad. Se ha propuesto que durante el desarrollo fetal existe una "programación fetal" debida, principalmente, a las condiciones ambientales intrauterinas, como puede ser el caso de las condiciones fetales debidas a la diabetes gestacional.
Los procesos por los cuales se da la diferenciación neuronal y la migración son de gran importancia para la formación de la corteza cerebral, entre otras estructuras del SNC, y están relacionados con un amplio rango de desórdenes neurológicos, entre los que se encuentran la epilepsia, la esquizofrenia y problemas de aprendizaje. Por otro lado, la identificación prenatal de desórdenes conductuales (DC) no ligados al sexo o a genes específicos en la formación del SNC es prácticamente imposible en la actualidad, por lo que son evidentes hasta el desarrollo postnatal, cuando el individuo inicia el desarrollo de las capacidades motoras e intelectuales (edad preescolar y escolar) y durante la edad adulta.
Por ejemplo, el cerebro de los individuos con déficit de atención e hiperactividad (DAHA) muestra una actividad atípica, presentando una disminución significativa del metabolismo en regiones de la corteza premotora y somatosensorial.33 A nivel de la corteza prefrontal y cuerpo estriado, se observa un déficit en la acción reguladora de la dopamina, la noradrenalina y la serotonina.34
Se ha relacionado a los desórdenes conductuales con logros académicos pobres, con el nivel socioeconómico y el desempleo, problemas familiares, conducta antisocial y problemas del estado de ánimo en el adulto,35 pero ¿cuál es el origen biológico de estos problemas?, ¿tiene, acaso, un origen prenatal?, ¿es inherente a las capacidades individuales o es un problema exclusivamente social?36 Nosotros pensamos que los logros académicos pobres, la conducta antisocial y los problemas en el estado de ánimo están relacionados, además de los problemas sociales, con la manera en que la citoarquitectura cerebral es generada durante el desarrollo intrauterino, procesos en los que están involucrados los microRNA.
REFERENCIAS
1. Mehler MF, Mattick JS. Non-coding RNAs in the nervous system. J Physiol. 2006; 575: 333-41. [ Links ]
2. Cortez MA, Calin GA. MicroRNA identification in plasma and serum: a new tool to diagnose and monitor diseases. Expert Op Biol Ther. 2009; 9: 703-11. [ Links ]
3. Cai X, Hagedorn CH, Cullen BR. Human microRNAs are processed from capped, polyadenylated transcripts that can also function as mRNAs. RNA. 2004; 10: 1957-66. [ Links ]
4. Lee Y. MicroRNA genes are transcribed by RNA polymerase II. EMBO J. 2004; 23: 4051-60. [ Links ]
5. Lee Y. The nuclear RNase III Drosha initiates microRNA processing. Nature. 2003; 425: 415-9. [ Links ]
6. Denli AM. Processing of primary microRNAs by the microprocessor complex. Nature. 2004; 432: 231-5. [ Links ]
7. Lund E. Nuclear export of microRNA precursors. Science. 2004; 303: 95-8. [ Links ]
8. Hutvagner G. A cellular function for the RNA-interference enzyme Dicer in the maturation of the let-7 small temporal RNA. Science. 2001; 293: 834-8. [ Links ]
9. Khvorova AA, Reynolds A, Jayasena SD. Functional siRNAs and miRNAs exhibit strand bias. Cell. 2003; 115: 209-16. [ Links ]
10. Lo YM. Presence of fetal DNA in maternal plasma and serum. Lancet. 1997; 350: 485-7. [ Links ]
11. Ng EK. mRNA of placental origin is readily detectable in maternal plasma. Proc Nat Acad Sci. 2003; 100: 4748-53. [ Links ]
12. Wray AM. Prenatal diagnosis of supernumerary ring chromosome 1: case report and review of the literature. Genet Couns. 2007; 18: 233-41. [ Links ]
13. Chiu RW. Prenatal exclusion of beta thalassaemia major by examination of maternal plasma. Lancet. 2002; 360: 998-1000. [ Links ]
14. Chen X. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases. Cell Res. 2008; 18: 997-1006. [ Links ]
15. Nadarajah B. Ventricle-directed migration in the developing cerebral cortex. Nature Neurosci. 2002; 5: 218-24. [ Links ]
16. Nadarajah B. Parnavelas Gj. Modes of neuronal migration in the developing cerebral cortex. Nature Rev Neurosci. 2002; 3: 423-32. [ Links ]
17. Nielsen JA. Integrating microRNA and mRNA expression profiles of neuronal progenitors to identify regulatory networks underlying the onset of cortical neurogenesis. BMC Neurosci. 2009; 10: 98. [ Links ]
18. Krichevsky AM. A microRNA array reveals extensive regulation of microRNAs during brain development. RNA. 2003; 9: 1274-81. [ Links ]
19. Miska EA. Microarray analysis of microRNA expression in the developing mammalian brain. Genome Biol. 2004; 5: 68. [ Links ]
20. De Pietri Tonelli D. miRNAs are essential for survival and differentiation of newborn neurons but not for expansion of neural progenitors during early neurogenesis in the mouse embryonic neocortex. Development. 2008; 135: 3911-21. [ Links ]
21. Wu L, Belasco GJ. Micro-RNA regulation of the mammalian lin-28 gene during neuronal differentiation of embryonal carcinoma cells. Mol Cel Biol. 2005; 25: 9198-208. [ Links ]
22. Wienholds E. The microRNA-producing enzyme Dicer1 is essential for zebrafish development. Nature Gen. 2003; 35: 217-8. [ Links ]
23. Carey RG, Li B, DiCicco-Bloom E. Pituitary adenylate cyclase activating polypeptide anti-mitogenic signaling in cerebral cortical progenitors is regulated by p57Kip2-dependent CDK2 activity. J Neurosci. 2002; 22: 1583-91. [ Links ]
24. Visvanathan J. The microRNA miR-124 antagonizes the anti-neural REST/SCP1 pathway during embryonic CNS development. Genes Dev. 2007; 21: 744-9. [ Links ]
25. Krichevsky AM. Specific microRNAs modulate embryonic stem cell-derived neurogenesis. Stem Cells. 2006; 24: 857-64. [ Links ]
26. Jiang L. Hsa-miR-125a-3p and hsa-miR-125a-5p are downregulated in non-small cell lung cancer and have inverse effects on invasion and migration of lung cancer cells. BMC Cancer. 2010; 10: 318-21. [ Links ]
27. Botto LD. Neural-tube defects. N Engl J Med. 1999; 341: 1509-19. [ Links ]
28. Becerra JE. Diabetes mellitus during pregnancy and the risks for specific birth defects: a population-based case-control study. Pediatrics. 1990; 85: 1-9. [ Links ]
29. Dionne G. Gestational diabetes hinders language development in offspring. Pediatrics. 2008; 122: e1073-9. [ Links ]
30. Phelan SA, Ito M, Loeken MR. Neural tube defects in embryos of diabetic mice: role of the Pax-3 gene and apoptosis. Diabetes. 1997; 46: 1189-97. [ Links ]
31. Sato N. Identification of genes differentially expressed in mouse fetuses from streptozotocin-induced diabetic pregnancy by cDNA subtraction. Endocrinol J. 2008; 55: 317-23. [ Links ]
32. Loeken MR. Advances in understanding the molecular causes of diabetes-induced birth defects. J Soc Gynecol Investig. 2006; 13: 2-10. [ Links ]
33. Zametkin AJ. Cerebral glucose metabolism in adults with hyperactivity of childhood onset. N Engl J Med. 1990; 323: 1361-6. [ Links ]
34. Ernst M. High midbrain [18F]DOPA accumulation in children with attention deficit hyperactivity disorder. Am J Psychiat. 1999; 156: 1209-15. [ Links ]
35. Waschbusch DA. A meta-analytic examination of comorbid hyperactive-impulsive-attention problems and conduct problems. Psychol Bull. 2002; 128: 118-50. [ Links ]
36. Chan WY. Proliferation and apoptosis in the developing human neocortex. Anatomical Record. 2002; 267: 261-76. [ Links ]
Nota
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/inper














