Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Perinatología y reproducción humana
versión On-line ISSN 2524-1710versión impresa ISSN 0187-5337
Perinatol. Reprod. Hum. vol.26 no.4 Ciudad de México oct./dic. 2012
Artículo original
Revisión sistemática de la seguridad y eficacia de la combinación de doxilamina + piridoxina para el tratamiento de la náusea y el vómito durante el embarazo
Systematic review of the safety and efficacy of the combination of doxylamine + pyridoxine for the treatment of nausea and vomiting during pregnancy
Pedro Gutiérrez-Castrellón,* Ignacio Mora-Magaña,* Luisa Díaz-García,* Carlos Jiménez-Gutiérrez,* Angélica Arzola-Paniagua**
* Centro de Análisis de la Evidencia. COCHRANE-INPer. Instituto Nacional de Perinatología, Secretaría de Salud.
** Instituto Biosen, México.
Correspondencia:
Dr. Pedro Gutiérrez Castrellón
Dirección de Investigación
5o piso, Torre de Investigación,
Instituto Nacional de Perinatología
México, D.F.
Recibido: 04 de septiembre de 2012
Aceptado: 28 de septiembre de 2012
RESUMEN
Justificación: Más del 80% de las mujeres embarazadas experimentan en algún momento del embarazo náusea y vómito de magnitud variable que puede producir complicaciones importantes, tales como la deshidratación, el incremento de la frecuencia de hospitalizaciones y la alteración de la calidad de vida. Existe controversia sobre la seguridad de la combinación doxilamina + piridoxina para el tratamiento de la náusea y vómito durante el embarazo. Objetivos: A través de una revisión sistemática de la evidencia con metaanálisis, evaluar la seguridad y eficacia de la combinación de doxilamina + piridoxina para el tratamiento de la náusea y el vómito durante el embarazo. Material y métodos: Se incluyeron estudios de casos y controles, estudios de cohorte, ensayos clínicos o ensayos clínicos controlados, de adecuada calidad metodológica, realizados en mujeres embarazadas con náusea y vómito en quienes, dada la frecuencia y gravedad de la sintomatología, se hubiera decidido el tratamiento con doxilamina + piridoxina, al menos en una de las ramas de inclusión al estudio. Se consideraron como variables de desenlace el número de malformaciones congénitas totales observadas, así como el número de malformaciones congénitas ajustadas por tipo. Se efectuó revisión de las bases de datos PubMed (1966 a mayo de 2009), Embase (1988 a mayo 2009), LILACS (1990 a mayo 2009), ARTEMISA (Revisión de la 11a edición hasta diciembre de 2004), Cochrane controlled trials register, Bandolier y DARE. Estadísticamente, se efectuó el cálculo de riesgo relativo a través de un modelo de efectos fijos de Mantel-Hanezel, en el caso de desenlaces binarios, y diferencia estandarizada de los promedios (SMD), en el caso de desenlaces continuos. Para todos los estimados se efectuó cálculo del intervalo de confianza al 95% (IC95%); se realizó en todos los casos prueba de heterogeneidad, utilizando prueba de Chi cuadrada de Pearson, con un valor de p < 0.05 como sinónimo de significancia. Resultados: No identificamos incremento del riesgo con el uso combinado de doxilamina + piridoxina en mujeres embarazadas con NVP para malformaciones globales con un RR ponderado de 0.97 (IC95% de 0.92 a 1.02), p 0.168, ni para malformaciones cardiovasculares [RR 0.92 (IC95% 0.80 a 1.05), p no significativa (NS)], del sistema nervioso central [RR 1.0 (IC95% 0.87 a 1.15), p NS)], defectos del tubo neural [RR 0.99 (IC95% 0.78 a 1.26), p NS)], alteraciones de extremidades [RR 1.10 (IC95% 0.88 a 1.37), p NS)], labio y paladar hendido [RR 0.85 (IC95% 0.70 a 1.03), p NS)] o malformaciones de la vía urogenital [RR 0.99 (IC95% 0.82 a 1.20), p NS)]. Desde el punto de vista de eficacia, la administración de doxilamina + piridoxina redujo significativamente el riesgo de persistir con náusea y vómito durante el embarazo [RR 0.55 (IC95% 0.41 a 0.74), p 0.0001)]. Conclusiones: Los resultados obtenidos en la actual revisión sistemática señalan un efecto significativamente benéfico de la doxilamina + piridoxina para la reducción de la náusea y el vómito del embarazo (NAVP). Al correlacionar el beneficio del medicamento con su elevado perfil de seguridad (como lo demuestran los cinco metaanálisis en donde el desarrollo de defectos cardiovasculares, del sistema nervioso central, del tubo neural, de las extremidades y genitourinario es similar al del grupo control), permite establecerlo como una alternativa farmacológica eficaz para el tratamiento de la náusea y el vómito presentes durante el embarazo y con riesgo no significativo de teratogenicidad.
Palabras clave: Doxilamina + piridoxina, embarazo, malformaciones congénitas.
ABSTRACT
More than 80% of the pregnant women, in one moment of the gestation have nausea and vomiting, than can produce important complications like deshydratation, hospital internment, and affectation of the quality of life. There are controversies about the safety of the combination of doxylamine + pyridoxine for the treatment of the nausea and vomiting of pregnancy (NVP). Objective: To evaluate the efficacy and safety of the combination of doxylamine + pyridoxine for the treatment of NVP using the methodological tool of a systematic review. Materials and methods: For the systematic review we include case-control studies, cohort's studies, and controlled trials, performed in pregnant women with NVP and that were treatment with doxylamine + pyridoxine. We considered the number of congenital defects as the principal outcome variable. We made the systematic review using the following data bases: PubMed (1966 to may 2009), Embase (1988 to may 2009), LILACS (1990 to may 2009), ARTEMISA (review of the 11a edition to December 2004), Cochrane controlled trials register, Bandolier y DARE. The statistical analysis was made with the calculation of relative risk (RR) and 95% confidence interval (CI 95%) with the Mantel-Hanezel model. Results: There was no risk increase of congenital defects in children born of women with NVP treated with the combination of doxylamine + pyridoxine. The RR identified for all congenital defects was 0.97(IC95% de 0.92 a 1.02), p = 0.168; for cardiovascular defects the RR was 0.92 (CI95% 0.80-1.05), for neural tube defects the RR was 0.99 (CI95% 0.78-1.26), and for urinary defects the RR was 0.99 (CI95% 0.8-1.20). The administration of doxylamine + pyridoxine reduced the risk of NVP persistence with a RR of 0.55 (CI95% 0.41-0.74), p < 0.01). Conclusions: The systematic review showed that the administration of doxylamine + pyridoxine has a beneficial effect on the reduction of NVP manifestations, with a high safety to be used during pregnancy.
Key words: Doxylamine + pyridoxine, pregnancy, congenital defects.
INTRODUCCIÓN
El concepto "náusea y vómito durante el embarazo" (NVP) fue utilizado desde los papiros egipcios hace más de 2,000 años; éste describe un grupo de condiciones clínicas presentes desde las etapas tempranas del embarazo -hasta en el 80% de las mujeres embarazadas- que van desde la náusea leve hasta el vómito grave y frecuente, sumado a esto el rechazo casi total a la ingesta de sólidos y, en ocasiones, de líquidos por vía oral. Si bien es una de las condiciones más frecuentemente observadas durante el embarazo, su etiología permanece poco clara, por esto se ha establecido una diversidad de hipótesis al respecto: la existencia de alteraciones endocrinológicas, factores fisiológicos, deficiencias vitamínicas o disritmias gástricas.1
Por otro lado, si bien se han descrito desde hace más de 50 años una diversidad de agentes farmacológicas con eficacia diversa como antiheméticos, existe un número reducido de ellos con estudios lo suficientemente válidos desde el punto de vista de eficacia, seguridad y costo-beneficio para ser empleados durante el embarazo. Entre estos medicamentos utilizados para el tratamiento de la NVP, desde 1956 se utilizó ampliamente en Estados Unidos de Norteamérica la combinación de succinato de doxilamina y clorhidrato de piridoxina. Este medicamento fue tan popular, que diversos estudios, en su momento, reportaron una tasa de uso de hasta el 40% en las mujeres embarazadas en el primer trimestre entre 1970 y 1980.2
Farmacología de la doxilamina + piridoxina
El succinato de doxilamina es un compuesto íntimamente relacionado con la histamina que ejerce su efecto bloqueando las acciones de la misma en los receptores H1. Se trata de una etanolamina perteneciente a la primera generación de antihistamínicos, con efectos antimuscarinos muy importantes y con mínimos efectos gastrointestinales. Posee efectos antiheméticos y antialérgicos significativos y su efecto sedante se debe primordialmente a su elevada afinidad con los receptores H1 a nivel central, ya que cruza en forma significativa la barrera hematoencefálica.3 Si se ingiere en grandes cantidades puede producir efectos anticolinérgicos muy importantes como los observados con cualquier otro bloqueador H1. Se absorbe en forma adecuada en el sistema digestivo y después de 2 a 3 horas postingesta se alcanza el pico máximo de concentración plasmática con un efecto clínico que puede durar de 4 a 6 horas, lo cual es distinto en el caso de la preparación de efecto prolongado en la cual el pico máximo de acción y la duración de la misma son mayormente prolongados.4 Es transformada a nivel hepático por N-dealquilación a sus principales metabolitos N-desmetil y N-N-didesmetilhildroxilamina, los cuales se excretan primordialmente a nivel renal.5,6
Los estudios de farmacocinética realizados en mujeres no embarazadas, voluntarias sanas, en 1989, demostraron que posterior al uso de 25 mg de doxilamina se alcanza un pico máximo de 103 ± 8 mg/mL, 2.4 ± 0.4 horas después de su ingesta. La vida media fue de 10.1 ± 1.1 horas y la tasa de aclaramiento aparente fue de 3.0 ± 0.4 seg/mL/min/kg de peso.7
Por otro lado, aunque los estudios de farmacocinética en mujeres embarazadas no son posibles desde el punto de vista ético, se efectuaron diferentes investigaciones en varias especies de primates hembras embarazadas sin observarse cambios entre las especies y sin diferencias al compararse con los estudios reportados en mujeres voluntarias sanas no embarazadas.8,9
En relación con la piridoxina, el piridoxal y la piridoxamina son compuestos naturales con las mismas propiedades biológicas, y por lo tanto, a todos se les conoce colectivamente como vitamina B6.3 Si bien en la mayoría de los preparados farmacéuticos se utiliza en forma de clorhidrato de piridoxina, al ser ingerida se convierte a piridoxal-5-fosfato10,11 y como coenzima participa en al menos 100 reacciones metabólicas en el organismo.11
Es rápidamente absorbida en el aparato digestivo; principalmente en el yeyuno es metabolizada a nivel hepático, convirtiéndose en piridoxal-5-fosfato, el cual se une fuertemente a las proteínas.4 Su metabolito inactivo, el ácido-4-piridóxico, es inactivo y se elimina por vía renal.12,13 Finalmente, cabe destacar que este compuesto posee una vida media de excreción de 20 a 46 horas.14
Seguridad de la doxilamina + piridoxina
La doxilamina + piridoxina se utilizaron ampliamente para el tratamiento de la náusea y el vómito asociados con el embarazo (NVP) en Europa y Estados Unidos de Norteamérica (EUA), desde 1957 a 1983, llegándose a reportar cómo hasta el 40% de las mujeres en EUA consumían el medicamento durante el primer trimestre del embarazo. A fines de 1983, secundario a una serie de demandas por la aparente asociación con el desarrollo de malformaciones congénitas, el medicamento fue retirado del mercado. En su momento se preparó un análisis científico para la Corte, de los estudios epidemiológicos disponibles sobre el uso de la combinación durante el embarazo y el riesgo de malformaciones al nacimiento y a pesar de la falta de asociación, demostrada a través de 11 estudios de cohorte y dos de casos y controles, se decidió retirarlo definitivamente del mercado, dejando a miles de mujeres embarazadas con el problema de la NVP y sus comorbilidades asociadas.
En 1988, en Toronto, se preparó un análisis ponderado de todos los estudios existentes hasta el momento, que hubieran analizado el riesgo de malformaciones congénitas, logrando reunir la experiencia de aproximadamente 200,000 prescripciones en las cuales la razón de momios (OR) (se reportan RR) con su correspondiente intervalo de confianza al 95% (IC95%) fue de 1.01 (0.66 a 1.55), sin significancia clínica ni bioestadística (p = 0.81). Cuando los estudios fueron estratificados de acuerdo con el diseño metodológico, el OR para los estudios de cohorte fue de 0.95 [0.6 a a 1.45, p no significativa (NS)] y para los estudios de casos y controles de 1.27 (0.83 a 1.94, p NS), con lo que se descartaba la existencia de una asociación significativa entre el uso del medicamento y el desarrollo de malformaciones congénitas.15
Seis años después, en 1994, Paul M. McKeigue y colaboradores, ante el rechazo gubernamental para permitir la utilización del medicamento, publicaron los resultados de un segundo análisis ponderado (pooled analysis) de los 16 estudios de cohorte y de los 11 estudios de casos y controles disponibles hasta ese momento que reportaban la presencia de defectos al nacimiento aparentemente asociados a la ingesta de doxilamina + piridoxina, identificándose un riesgo relativo ponderado de 0.95 con un intervalo de confianza al 95% de 0.88 a 1.04, sin valor clínico ni estadísticamente significativo, concluyendo sobre la existencia de no diferencias en cuanto al riesgo de desarrollo de malformaciones congénitas entre los productos de madres con historia de uso de doxilamina + piridoxina y aquellas mujeres que no habían utilizado dicho medicamento.16 A pesar de ello, en EUA se continuó sin permitir el uso del medicamento, mientras que en países como Canadá continuó indicándose como un medicamento seguro y efectivo para el tratamiento de la NVP.
En 1999 se publicó un artículo por Roumiana S. Bonevau y colaboradores, con la finalidad de evaluar la posible asociación entre la NVP y el riesgo del producto para el desarrollo de malformaciones cardiacas congénitas. Para tal fin se utilizó el estudio de casos y controles sobre defectos al nacimiento, conducido en Atlanta, Georgia, EUA, entre 1982 y 1983, el cual incluyó 998 casos de defectos cardiacos no sindromáticos y 3,209 controles, clasificándose la NVP en ocho niveles de gravedad. En forma global, se identificó que los casos de NVP presentes desde etapas tempranas del embarazo, pero tratados con medicamentos antiheméticos, particularmente con la combinación de doxilamina + piridoxina, presentaron un riesgo menor de defectos cardiacos con un OR de 0.67 (IC95% 0.50 a 0.94), p = 0.02, lo cual sugirió nuevas aéreas de investigación futuras potenciales.17 En 2000, Mazzotta y colaboradores desarrollaron un estudio de costo-beneficio sobre el uso de medicamentos antiheméticos para el tratamiento de la NVP. Con tal objetivo, se dan a la tarea de evaluar en forma exhaustiva la evidencia disponible en Medline (1966 a 1998), utilizando las palabras claves nausea, vomiting, emesis, hyperemesis gravidarum, morning sickness, pregnancy, pregnancy complications, treatment, efficacy, effectiveness, teratogens, abnormalities drug-induced, placenta, embryo, fetus, maternal fetal exchange, toxicology; Pregnancy and Childbirth Module of Cochrane Database of Systematic Reviews, bibliografía de artículos rechazados, un libro de toxicología estándar, registros de comunicaciones personales o de compañías farmacéuticas y encuestas directas a investigadores y clínicos en el campo de la farmacología, toxicología, obstetricia y pediatría, identificándose en relación con la seguridad para el uso de doxilamina + piridoxina los dos metaanálisis previamente reportados (1994 y 1996), los cuales al analizarse el riesgo para el desarrollo de malformaciones congénitas en forma global, dieron como resultado un riesgo relativo (RR) ponderado de 0.98 (IC95% de 0.93 a 1.03), sin diferencias clínicas ni bioestadísticamente significativas.2
En 2001, Atanackovic y colaboradores publican un estudio de cohorte, nivel 2 de evidencia, con la finalidad de evaluar la seguridad fetal y maternal del uso de dosis mayores a las recomendadas de doxilamina + piridoxina en mujeres con NVP de difícil control. Se incluyeron en el estudio 225 mujeres con NVP, quienes recibieron la formulación de acción prolongada de 10 mg de doxilamina + 10 mg de clorhidrato de piridoxina a la dosis de una a cuatro tabletas al día (n = 123) o 5 a 12 tabletas al día (n = 102), con seguimiento durante 2 a 4 semanas, registrándose la presencia de eventos adversos relacionados, así como registro de los desenlaces en el momento del parto o cesárea en búsqueda de potencial desarrollo de malformaciones congénitas. En relación con los resultados, el peso promedio de los productos fue de 3,400 ± 581 g y la edad gestacional de 39 ± 2.2 semanas. La dosis promedio para el grupo de cuatro tabletas promedio al día fue de 0.5 ± 0.15 mg/kg/d, mientras que la dosis promedio para el grupo que recibió mayor número de tabletas fue de 0.9 ± 0.2 mg/kg/d, p < 0.001. Se inició el tratamiento en promedio a las 8 ± 2.4 semanas de gestación en ambos grupos y fue administrado en promedio durante 17.2 ± 10.3 semanas. El reporte de somnolencia fue de 32% en el grupo de dosis habitual y 35% en el de supradosis. Se observaron sólo dos casos de malformaciones congénitas, ambos en el grupo de dosis estándar (un caso de microcefalia y otro de malformación cardiovascular) y que al dividirse entre el número de pacientes incluidas (2/225 = 0.009) produce un número similar al observado en embarazos sin uso de medicamentos antiheméticos.18
En 2002, Laura Magee y Paolo Mazzotta publican un análisis de la evidencia sobre la eficacia y seguridad de los agentes farmacológicos utilizados para el tratamiento de la NVP, incluyendo en su estudio el análisis de los fármacos antihistamínicos, entre ellos el uso de doxilamina y piridoxina, volviendo a citar los dos metaanálisis previamente reportados, así como el metaanálisis publicado por Seto y colaboradores en 1997, quienes encuentran un riesgo para el uso de antihistamínicos y desarrollo de malformaciones congénitas de 0.76 (IC95% de 0.60 a 0.94).19
En 2003, Jewell & Young publican una revisión sistemática de la evidencia en la biblioteca Cochrane, con la finalidad de identificar en forma exhaustiva todos los ensayos clínicos publicados sobre la eficacia y seguridad de los diferentes tratamientos existentes para la náusea y el vómito en las fases tempranas del embarazo. Para el caso de la doxilamina y la piridoxina identifican sólo un total de tres ensayos clínicos (Greiger 1959, McGuiness 1971 y Wheatley 1977) de calidad metodológica aceptable, en donde no se identifican desenlaces fetales desfavorables.20
Finalmente, en 2004, Boskovic y colaboradores publicaron el último estudio de cohorte, identificado en la literatura como artículo original hasta el 31 de mayo de 2009, en el que se incluyeron 246 mujeres embarazadas quienes ingirieron doxilamina + piridoxina para el control de la NVP y 130 mujeres control quienes no tomaron medicamentos. Se identificaron dos casos de malformaciones congénitas en el grupo de mujeres que ingirieron el medicamento con un OR de 2.67, pero con un intervalo de confianza al 95% de 0.72 a 3.4, sin diferencias clínicas ni estadísticamente significativas (p = 0.27).21
Con base en las evidencias referidas, el objetivo de revisión sistemática con metaanálisis, fue evaluar la seguridad y eficacia de la combinación de doxilamina + piridoxina para el tratamiento de la náusea y el vómito durante el embarazo.
MATERIAL Y MÉTODOS
Estudios incluidos y sus características
Se incluyeron en la presente revisión todos aquellos estudios de casos y controles, estudios de cohorte, ensayos clínicos o ensayos clínicos controlados en quienes se haya evaluado la seguridad y eficacia de la combinación de doxilamina + piridoxina para el tratamiento de la náusea y vómito durante el embarazo.
En relación con el tipo de pacientes, se decidió incluir en la revisión, exclusivamente, todos aquellos estudios realizados en mujeres embarazadas con náusea y vómito durante el embarazo, en quienes por la frecuencia y gravedad de la sintomatología se hubiera decidido el tratamiento con doxilamina + piridoxina, en al menos una de las ramas de inclusión al estudio.
Desde el punto de vista metodológico, se incluyeron sólo aquellos artículos que presentaran el mínimo de requisitos fundamentales de acuerdo con su diseño para poder ser evaluados en la calidad metodológica de los mismos y en quienes fuera claro el número de pacientes totales, por subgrupos, el seguimiento, así como las variables de desenlace de interés.
Variables de desenlace primario
Se consideraron como variables de desenlace a tener en cuenta en la revisión y en el metaanálisis, el número de malformaciones congénitas totales observadas en el grupo de pacientes tratados versus los grupos control, el número de malformaciones congénitas ajustado por el tipo de malformación específica y la persistencia de la NVP posterior al inicio de la ingesta del medicamento.
Estrategias de búsqueda
Se utilizó la estrategia de búsqueda altamente sensible para la identificación de estudios de casos y controles, cohortes o ensayos clínicos descrita por Karen A. Robinson y Kay Dickersin en 2002, adicionando a dicha estrategia las palabras clave nausea, vomiting, emesis, hyperemesis gravidarum, morning sickness, pregnancy, pregnancy complications, treatment, efficacy, effectiveness, teratogens, abnormalities drug-induced, placenta, embryo, fetus, maternal fetal exchange, toxicology, limitando la estrategia de búsqueda a estudios en seres humanos y sin límites por lenguaje de publicación.
Se efectuó revisión de las bases de datos PubMed (1966 a mayo de 2009), Embase (1988 a mayo 2009), LILACS (1990 a mayo 2009), ARTEMISA (Revisión de la 11a edición hasta diciembre de 2004), Cochrane Controlled Trials Register, Bandolier y DARE.
Obtención de la información, síntesis y análisis
Utilizamos los métodos estandarizados descritos por la colaboración Cochrane Ibero América para preparar el protocolo, aplicar los criterios de inclusión, evaluar la calidad de las publicaciones y extraer la información. Se efectuó evaluación de la calidad de las publicaciones a través del sistema de puntuación STROBE para estudios de casos y controles o de cohorte, y a través de CONSORT para el caso de los ensayos clínicos y los ensayos clínicos controlados. Dos de los autores en forma ciega e independiente (PGC, IMM) extrajeron la información relevante en formatos diseñados a priori para tal objetivo. Cualquier desacuerdo se resolvió a través de la discusión y el análisis de la información.
Análisis estadístico
Estadísticamente se efectuó el análisis estadístico a través del paquete STATA 9.0 para Mac, con las subrutinas para desarrollo del metaanálisis a través del cual se calculó el riesgo relativo (RR) por medio de un modelo de efectos fijos de Mantel-Hanezel en el caso de desenlaces binarios, y diferencia estandarizada de los promedios (SMD) en el caso de desenlaces continuos. Para todos los estimados se efectuó cálculo del intervalo de confianza al 95% (IC95%). Se efectuó en todos los casos prueba de heterogeneidad utilizando prueba de χ2 de Pearson, con un valor de p < 0.05 como sinónimo de significancia. En el caso de sospechar sesgo de publicación, se estableció gráfico de Funnel (Funnel plot), y en el caso necesario, se efectuó análisis de sensibilidad para evaluar lo adecuado de la asignación de la maniobra (allocation concealment).
RESULTADOS
Descripción y calidad de los estudios
Nuestra estrategia de búsqueda inicial generó un total de 161 potenciales estudios de casos y controles, estudios de cohorte o ensayos clínicos relacionados con el análisis de seguridad de la combinación de doxilamina + piridoxina para el tratamiento de la náusea y vómito durante el embarazo.
En un primer análisis se excluyeron 131 artículos que correspondían a descripciones de laboratorio para la cuantificación de los fármacos o sus metabolitos, revisiones narrativas de la evidencia, encuestas de opinión o información global para pacientes y sus familiares.
De los 30 artículos restantes, al aplicarles los sistemas de evaluación de la calidad STROBE y CONSORT, 12 de los artículos tenían una calidad inferior a la mínima aceptada para ser considerados en el desarrollo de la revisión sistemática, por lo que se incluyeron en la presente revisión 18 artículos sobre seguridad, publicados entre 1963 y 2004 (Cuadro I).
Síntesis cuantitativa de los resultados
De los 18 artículos evaluados, publicados entre 1963 y 2004, una proporción significativa de ellos incluidos en los dos análisis ponderados efectuados en 1988 y 1994, permitieron identificar la ausencia significativa de riesgo global para la presencia de malformaciones congénitas entre el grupo de mujeres que recibieron diferentes dosis de la combinación de doxilamina + piridoxina para el tratamiento de la náusea y el vómito durante el embarazo, en comparación con el grupo de mujeres en el grupo control, con un RR ponderado de 0.97 (IC95% de 0.92 a 1.02), sin diferencias clínicas o estadísticamente significativas entre los grupos (p = 0.168) (Figura 1).

Al efectuar el análisis estratificado por tipo de malformaciones, no identificamos incremento del riesgo con el uso combinado de doxilamina + piridoxina en mujeres embarazadas con NVP para malformaciones cardiovasculares [RR 0.92 (IC95% 0.80 a 1.05), p NS)], malformaciones del sistema nervioso central [RR 1.0 (IC95% 0.87 a 1.15), p NS)], defectos del tubo neural [RR 0.99 (IC95% 0.78 a 1.26), p NS)], alteraciones de extremidades [RR 1.10 (IC95% 0.88 a 1.37), p NS)], labio y paladar hendidos [RR 0.85 (IC95% 0.70 a 1.03), p NS)] o malformaciones de la vía urogenital [RR 0.99 (IC95% 0.82 a 1.20), p NS)] (Figuras 1, 2, 3, 4, 5, 6, 7).




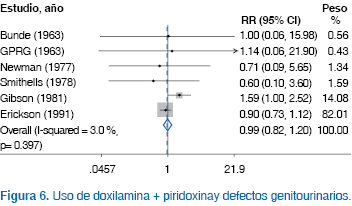
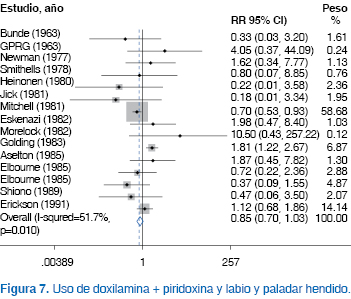
Desde el punto de vista de eficacia, la administración de doxilamina + piridoxina redujo significativamente el riesgo de persistir con náusea y vómito durante el embarazo [RR 0.55 (IC95% 0.41 a 0.74), p 0.0001)] (Figura 8).

DISCUSIÓN Y CONCLUSIONES
La náusea y el vómito son los síntomas más comunes y consistentemente experimentados en las fases tempranas del embarazo (NVP). Diversas encuestas elaboradas con alto rigor metodológico señalan que la náusea afecta a entre 70 y 85% de las mujeres embarazadas,22 mientras que el vómito se encuentra presente hasta en el 50%.23 A pesar del nombre popular de "enfermedad matutina", sólo 17% de las mujeres con NAVP lo presentan únicamente por la mañana; en el resto persiste durante todo el día24, y en el 13% de las mujeres puede persistir más allá de la semana 20 de gestación. Desde el punto de vista de impacto, la NAVP genera impactos negativos en la tasa de empleo, ya que el 35% de estas mujeres ven afectadas significativamente sus jornadas laborales. La etiología es desconocida, aunque se ha sugerido que es resultado de niveles elevados de hormonas gonadotrofinas coriónicas humanas.
Desde el punto de vista terapéutico, una gran cantidad de tratamientos se han intentado. Así, Fairweather en 1968 identificó 30 diferentes modalidades en adición a diversas intervenciones dietéticas. El análisis de antiheméticos recientemente realizado (12 ECCAs) señala, que si bien existe evidencia a favor de la reducción de la incidencia de náusea [OR 0.16, (0.08 a 0.33)], el riesgo de eventos adversos asociados como la presencia de somnolencia y otros, los vuelven opciones cautelosas de uso bajo el concepto de riesgo-beneficio.
A diferencia de lo anterior, cuando se analiza por separado la eficacia y la seguridad de la doxilamina + piridoxina, los resultados obtenidos en la actual revisión sistemática señalan un efecto significativamente benéfico para la reducción de la NAVP [0.55, (0.41 a 0.74), p 0.01] a pesar de la presencia de cierto grado de heterogeneidad entre los estudios, muy seguramente secundaria a las diferentes dosis empleadas entre los grupos, lo cual no afecta significativamente el resultado ponderado de los tres estudios. Adicionalmente, al comparar el beneficio del medicamento en relación con su elevado perfil de seguridad, como lo demuestran los cinco metaanálisis realizados en el presente estudio en donde se demuestra el riesgo similar en relación con el desarrollo de defectos cardiovasculares, del sistema nervioso central, del tubo neural, de las extremidades y genitourinario, permite establecer a la doxilamina + piridoxina como una alternativa farmacológica segura y eficaz para el tratamiento de la náusea y el vómito presentes durante el embarazo.
REFERENCIAS
1. Bishai R, Mazzotta P, Atanackovic G, Levichek Z, Pole M, Magee LA et al. Critical appraisal of drug therapy for nausea and vomiting of pregnancy: II. Efficacy and safety of diclectin (doxylamine-B6). Can J Clin Pharmacol 2000; 7: 138-43. [ Links ]
2. Mazzotta P, Magee LA. A risk-benefit assessment of pharmacological and nonpharmacological treatments for nausea and vomiting of pregnancy. Drugs 2000; 59: 781-800. [ Links ]
3. Serafin WE, Babe KS. H1-receptors antagonists. In: Gilman AG, Hardman JG, Limbrid LE, eds. Goodman & Gilman's the pharmacology bases of therapeutics. 14o Ed. New York: McGraw-Hill companies 1996; pag:586-592. [ Links ]
4. Tani AS. Antihistamines. In: Olson KR, ed. Poisoning & Drug overdose. Norway: Appleton & Lange 1998: 78-9. [ Links ]
5. Gielsdorf W, Schubert K. Biotransformation of doxylamine: isolation, identification and synthesis of some metabolites. J Clin Chem Clin Biochem 1981; 19: 485-90. [ Links ]
6. Ganes DA, Midha KK. Identification in in vivo acetylation pathway for N-dealkylated metabolites of doxylamine in humans. Xenobiotica 1987; 17: 993-9. [ Links ]
7. Friedman H, Greenblatt DJ. The pharmacokinetics of doxylamine: use of automated gas chromatography with nitrogen-phosphorus detection. J Clin Pharmacol 1985; 25: 448-51. [ Links ]
8. Rowland JM, Slikker W Jr, Holder CL, Denton R, Prahalada S, Young JF et al. Pharmacokinetics of doxylamine given as Bendectin in the pregnant monkey and baboon. Reprod Toxicol 1989; 3: 197-202. [ Links ]
9. Slikker W Jr, Holder CL, Lipe GW, Bailey JR, Young JF. Pharmacokinetics of doxylamine, a component of Bendectin, in the rhesus monkey. Reprod Toxicol 1989; 3: 187-96. [ Links ]
10. Shideler CE. Vitamin B6: an overview. Am J Med Technol 1983; 49: 17-22. [ Links ]
11. Gregory JF 3rd. Bioavailability of vitamin B-6. Eur J Clin Nutr 1997; 51: S43-8. [ Links ]
12. Shideler CE. Vitamin B6: an overview. Am J Med Technol 1983;49: 17-22. [ Links ]
13. Merrill AH Jr, Henderson JM. Vitamin B6 metabolism by human liver. Ann N.Y. Acad Sci 1990;585:110-7. [ Links ]
14. Bender DA. Vitamin B6 requirements and recommendations. Eur J Clin Nutr 1989; 43: 289-309. [ Links ]
15. Zempleni J, Kübler W. The utilization of intravenously infused pyridoxine in humans. Clin Chim Acta 1994; 229: 27-36. [ Links ]
16. Einarson TR, Leeder JS, Koren G. A method for meta-analysis of epidemiological studies. Drug Intell Clin Pharm 1988; 22: 813-24. [ Links ]
17. McKeigue PM, Lamm SH, Linn S, Kutcher JS. Bendectin and birth defects: I. A meta-analysis of the epidemiologic studies. Teratology 1994; 50: 27-37. [ Links ]
18. Roumiana S, Bonevau CA, Moore LB, Lee-Yang Wong, Erickson JD. Nausea during pregnancy and congenital heart defects: a population-based case-control study. Am J Epidemiol 1999; 149: 717-25. [ Links ]
19. Atanackovic G, Navioz Y, Moretti ME, Koren G. The safety of higher than standard dose of doxylamine-pyridoxine (Diclectin) for nausea and vomiting of pregnancy. J Clin Pharmacol 2001; 41: 842-5. [ Links ]
20. Laura A. Magee, MD, Mazzotta P, Gideon K. Evidence-based view of safety and effectiveness of pharmacologic therapy for nausea and vomiting of pregnancy (NVP). Am J Obstet Gynecol 2002; 186: S256-61. [ Links ]
21. Jewell D, Young G. Interventions for nausea and vomiting in early pregnancy. Cochrane Database Sys Rev 2003; 4: CD000145. DOI: 10.1002/14651858.CD000145 [ Links ]
22. Boskovic R, Rudic N, Danieliewska-Nikiel B, Navioz Y, Koren G. Is lack of morning sickness teratogenic? A prospective controlled study. Birth Defects Res A Clin Mol Teratol (Part A) 2004; 70: 528-30. [ Links ]
23. Medalie JH. Relationship between nausea and/or vomiting in early pregnancy and abortion. Lancet 1957; 273: 117-9. [ Links ]
24. Gasdby R, Barnie-Adshead AM, Jagger C. A prospective study of nausea and vomiting during pregnancy. Br J Gen Pract 1993; 43: 245-8. [ Links ]
25. Whitehead SA, Andrews PL, Chamberlain GV. Characterization of nausea and vomiting in early pregnancy: a survey of 1,000 women. J Obstet Gynaecol 1992;12: 364-9. [ Links ]
Nota
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/inper














