Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Perinatología y reproducción humana
On-line version ISSN 2524-1710Print version ISSN 0187-5337
Perinatol. Reprod. Hum. vol.26 n.2 Ciudad de México Apr./Jun. 2012
ARTÍCULOS ORIGINALES
Abordaje diagnóstico del cáncer de mama en el Instituto Nacional de Perinatología
Diagnostic approach of breast cancer in the National Institute of Perinatology
Brenda Sánchez-Ramírez,* Tomás Herrerías-Canedo,§ Emilio José Olaya-Guzmán,II Karina Arlen Sequeira-Alvarado¶
* Médico Residente de la Especialización Médica en Ginecología y Obstetricia. Generación 2008-2012.
§ Profesor Titular de la Especialización Médica en Ginecología y Obstetricia.
II Médico Adscrito a la Coordinación de Oncología.
¶ Médico Residente de la Especialización Médica en Biología de la Reproducción Humana. Generación 2011-2013.
Instituto Nacional de Perinatología Isidro Espinosa de los Reyes.
Recibido: 18 de abril de 2012
Aceptado: 25 de mayo de 2012
RESUMEN
El cáncer de mama en la mujer ocupa el primer lugar como causa de muerte por cáncer en México, desde 2006. El diagnóstico tardío implica que el tratamiento sea más costoso, doloroso y con menor posibilidad de curación. Objetivo: Analizar el abordaje diagnóstico utilizado en el Instituto Nacional de Perinatología Isidro Espinosa de los Reyes, en pacientes con diagnóstico de cáncer de mama. Material y métodos: Se realizó un estudio observacional, retrolectivo, transversal y descriptivo, de enero de 2004 a diciembre de 2010. Se incluyeron 54 pacientes de entre 29 y 85 años de edad; el motivo de la consulta fue presentar algún síntoma. El principal síntoma fue la tumoración mamaria, con un promedio de evolución de 8.4 meses; 84% presentaba lesión palpable; en 82.4% de los casos se realizó mastografía, y en 80.4%, ultrasonido. El diagnóstico definitivo de cáncer de mama se realizó mediante biopsia, en un tiempo promedio de 3.8 meses; en el 37% de los casos se realizó examen transoperatorio, el tipo histológico más frecuente fue el ductal infiltrante en 67.4%; se realizó el diagnóstico en estadio II en 46.3%. Al comparar la estadificación clínica con la patológica, el tamaño tumoral y ganglionar coincidieron en 64.7 y 59.5%, respectivamente. Conclusiones: El cáncer de mama constituye hoy una gran amenaza, y es uno de los desafíos más importantes para los profesionales de la salud de la mujer. Por lo tanto, el ginecoobstetra tiene un papel fundamental en la atención, diagnóstico y tratamiento de las enfermedades de la mama en la mujer.
Palabras clave: Cáncer de mama, mastografía.
ABSTRACT
The breast cancer is the first cause of death among cancers in Mexico, since 2006. Late diagnosis means that treatment is more expensive, painful, and has less chance of cure. Objective: Analyze the diagnostic approach done by the Instituto Nacional de Perinatología Isidro Espinosa de los Reyes. Material and methods: A retrolective, observational, descriptive, cross sectional study was done, from January 2004 to December 2010. 54 patients, between 29 to 85 years of age were studied. The most important symptom to request consultation was tumor of the mammary gland, with an evolution of 8.4 months. 84% of the cases had a palpable lesion. Mastography was done in 82.4% of the cases and ultrasound in 80.4%. The final diagnosis of breast cancer, was done through biopsy in an average of 3.8 months, and in 37% of the cases an intraoperatory study was done. The histological type most seen was the ductal infiltrative, in 67.4% of the cases. The stage at the time of diagnosis was II, in 46.3% of the cases. Comparing clinical staging with pathological tumor size and nodal agreed 64.7 and 59.5% respectively. Conclusions: Therefore the OB-GYN has a key role in addressing the diagnosis and treatment of breast diseases in women.
Key words: Breast cancer, mastography.
Introducción
México ha registrado cambios sustanciales en la estructura de su población, situación que ha desembocado en una transición demográfica y epidemiológica.1,2 En los últimos 10 años, las mujeres mexicanas presentan los mayores porcentajes de muerte por neoplasias en comparación con los hombres, las cuales son la tercera causa de muerte; desde 1998 hasta 2005, el cáncer cervicouterino ocupó el primer lugar de causa de muerte por cáncer; a partir de 2006, es el cáncer de mama, que ha presentado un incremento constante en los últimos 10 años.3
Con el fin de detectar el cáncer de mama en estadios tempranos, se han implementado múltiples medidas. El tamizaje es una prueba que se utiliza para examinar a las personas que no tienen síntomas de una enfermedad particular, para identificar a las personas que quizá tengan esa enfermedad, y para permitir que la misma sea tratada en un estadio inicial, cuando hay más probabilidades de lograr la curación. Desde hace muchos años se han promovido el autoexamen y el examen clínico de mama como métodos generales de tamizaje para un diagnóstico precoz del cáncer de mama, a fin de disminuir la morbilidad o la mortalidad; pero aún no están claros los posibles beneficios y daños.4 A estos exámenes se ha agregado un método de gabinete: la mastografía, que utiliza radiografías, para intentar descubrir los cánceres de mama en forma temprana, aun antes de percibir algún nódulo.5
La presencia o ausencia de carcinoma ante una sospecha clínica o mastográfica únicamente puede ser revelada a través de una muestra de tejido. La biopsia continúa siendo la técnica estándar para el diagnóstico, tanto en lesiones palpables como en lesiones no palpables, y es el método de evaluación inicial preferido.6 Estudios han demostrado que la combinación del examen físico, imágenes radiográficas y la confirmación cito/histopatológica, referidos como el ''triple test'', pueden producir niveles de exactitud mayores al 90% cuando los tres componentes son concordantes para benignidad o malignidad.7 El objetivo de este estudio fue analizar el abordaje diagnóstico en pacientes con cáncer de mama que se utiliza en el Instituto Nacional de Perinatología Isidro Espinosa de los Reyes (INPer).
Material y métodos
Se realizó un estudio observacional, retrolectivo, transversal y descriptivo, con datos recopilados entre el 1º de enero de 2004 y el 31 de diciembre de 2010, mediante la revisión de historias clínicas de todas las pacientes que ingresaron al INPer con diagnóstico de cáncer de mama, realizando el análisis descriptivo de las siguientes variables: características sociodemográficas (edad, origen, residencia, ocupación, escolaridad, estado civil), abordaje diagnóstico (motivo de consulta, tiempo de evolución, sintomatología, tiempo en realizar diagnóstico, estadificación, mastografía, ultrasonido, biopsia, diagnóstico histopatológico).
Los datos obtenidos se capturaron en una base de datos en Microsoft Office Excel 2007®, y se utilizó el programa estadístico PASW Statistics 18® para el análisis descriptivo de las frecuencias con medidas de tendencia central (media, mediana, moda) y las de dispersión (máximo, mínimo y rango).
Resultados
Se obtuvo un registro total de 56 pacientes, de las cuales se eliminaron dos por no contar con expediente clínico; de las 54 historias clínicas restantes en las que se llevó a cabo el análisis descriptivo, se obtuvieron los siguientes datos: rango de edad de 29 a 85 años, con un promedio de 49, moda de 35 y mediana de 48 años (Cuadro I).

El motivo de consulta a la Coordinación de Oncología del INPer: en el 50.1% de los casos fue presentar algún síntoma, 24.1% por haber sido diagnosticada con cáncer de mama fuera del Instituto, 14.8% debido a los hallazgos mastográficos, 9.3%, por interconsulta solicitada por otros servicios del instituto y 1.9% por hallazgos ultrasonográficos. El tiempo de evolución del síntoma en promedio fue de 8.4 meses, con un tiempo máximo de 60 meses y un tiempo mínimo menor a un mes. El síntoma que motivó con mayor frecuencia la búsqueda de atención médica fue el tumor mamario, en el 59.5% de los casos; hallazgos mastográficos, 23.8%; retracción cutánea, 4.8%, y 2.4% respectivamente para los siguientes: telorrea, induración asociada a retracción cutánea, induración asociada a red venosa, telorrea asociada a retracción cutánea y hallazgos ultrasonográficos. Los síntomas más frecuentes referidos por las pacientes en el interrogatorio dirigido fueron dolor en el 46.3%, nódulo mamario en el 61.1%, telorrea en 3.7% y tumoración axilar 3.8%. A la exploración clínica, el 84% presentaba una lesión palpable.
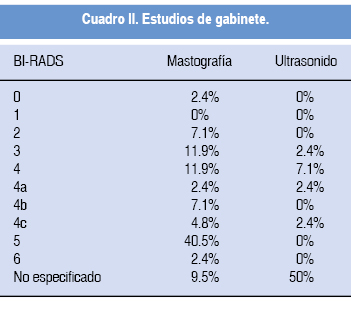
La evaluación con estudios de gabinete fue apoyada en el 82.4% por mastografía (sólo el 11.1% fue un estudio de tamizaje) y en el 80.4% por ultrasonido mamario (Cuadro II).
El tiempo en el que se realizó el diagnóstico de cáncer de mama en promedio fue de 3.8 meses, mediana de un mes, moda menor a un mes y un máximo de 66 meses; el diagnóstico se realizó mediante biopsia de acuerdo con las características de cada paciente (Cuadro III).

Se realizó examen transoperatorio en 37% de las pacientes, reportándose positivo a malignidad, 85%; negativo a malignidad en 10%, e indeterminado, 5%; al comparar el resultado del examen transoperatorio con el resultado definitivo de esa misma muestra, resultó no ser igual en 22.2%. El tipo histológico más frecuente fue el ductal infiltrante (Cuadro IV).
El 49.1% de los casos de cáncer de mama fue en la glándula mamaria derecha; 49.1%, en la izquierda, y en un caso se presentó en forma bilateral (1.9%).
Se hizo la estadificación clínica según el tumor, el nódulo y la metástasis (TNM), al momento del diagnóstico, y se comparó con la estadificación patológica después de la cirugía (TNMp). Los datos comparados fueron el tamaño tumoral y el estado ganglionar; el primero coincidió en el 64.7% y el último en el 59.5% (Cuadro V).
Discusión
A lo largo de su vida, una mujer corre el 12.5% de riesgo de desarrollar cáncer de mama (aproximadamente 1 en 8), y el 2.9% fallece a causa de esta patología (aproximadamente 1 en 35).1,2
El cáncer de mama en los países en desarrollo (en muchos, hasta 50%) ocurre en mujeres de 54 años y menos.8 La mortalidad por esta patología ha tenido una tendencia ascendente en los últimos años. El cáncer de mama en México ha mostrado relativa estabilidad en cuanto a los grupos de edad que impacta, el grupo de 60 años y más concentra las mayores tasas de defunciones por esta enfermedad, seguido por el grupo de 50 a 59 y el de 40 a 49 años.9 En el año de 1998 ocurrieron 3,389 defunciones, con una tasa de mortalidad de 15.1 por 100,000 mujeres de 25 años y más. Esto significa que diariamente mueren nueve mujeres en edad reproductiva por esta causa. Las mayores tasas de mortalidad en nuestro país son observadas en los estados del norte de la república y el Distrito Federal.9-11 Llama la atención que encontramos que el pico máximo se presenta en el grupo de 31 a 40 años, correspondiendo a 29.62%, seguido del grupo entre 41 a 50 y 51 a 60, con 24.07%, respectivamente; el 57.37% fueron menores de 50 años, y el 33.3% eran menores de 40 años. En ellas, la escolaridad mínima fue media en el 80%. La presencia de tumoración mamaria fue la causa por la cual buscaron atención médica, realizándose el diagnóstico en estadio I y II, en 63.1%; estadio III, 21%, y no clasificable, 15.8%. Es importante mencionar que en el INPer actualmente reciben atención únicamente pacientes en estadios clínicos que no requieren tratamiento sistémico neoadyuvante, debido a que no se cuenta con oncología médica ni radiooncología, lo cual modifica la distribución de la estadificación. Posiblemente, esta distribución de la incidencia de cáncer de mama en mujeres menores de 40 años, en el INPer, se deba a que es un hospital de tercer nivel, cuya misión es la resolución de los problemas nacionales de salud reproductiva y perinatal de alta complejidad, por lo que se convierte en hospital de referencia para este tipo de pacientes.
En un estudio retrospectivo que se realizó en Jordania, en el cual se incluyeron 838 pacientes con diagnóstico inicial de cáncer de mama, entre 1997 y 1998, encontraron que la mitad de ellas fueron diagnosticadas en el grupo etario de entre 40 a 59 años.12 Si obtenemos la comparativa con los resultados que arrojó este estudio, el 50% de las pacientes se encuentra en el mismo grupo. En los países más desarrollados, el cáncer de mama ha mostrado una tendencia al alza en los últimos años en mujeres postmenopáusicas; mientras que en las mujeres más jóvenes ha permanecido estable; sin embargo, en España, al igual que en las pacientes de este estudio, se ha mostrado un incremento en el grupo de mujeres de 45 años y menos, lo cual se relaciona con los notables cambios en el estilo de vida de la mujeres que nacieron en la segunda mitad del siglo XX.13 En un artículo de la American Cancer Society en el que se proporcionan estimaciones de los nuevos casos y de la mortalidad por cáncer de mama en los Estados Unidos en 2006, encontraron que las tasas de incidencia son sustancialmente más altas para la edad de las mujeres mayores de 50 años (375 por 100,000 mujeres), en comparación con las mujeres menores de 50 años (42.5 por 100,000 mujeres).14
Las mujeres que han recibido tratamiento para cáncer de mama tienen un riesgo de desarrollar cáncer de mama contralateral; varios estudios han mostrado un riesgo, entre 0.5 y 1% por año; y pacientes que se han sometido a cirugía conservadora (lumpectomía y radioterapia) tienen un riesgo de recurrencia en la mama tratada, de 10% o más, a los 10 años postratamiento.15 Una de nuestras pacientes presentó cáncer de mama bilateral, con un año de diferencia en el diagnóstico, y fue sometida, inicialmente, a manejo con cirugía conservadora; posteriormente, al diagnosticarse cáncer de mama en la mama contralateral, se realizó mastectomía bilateral con reconstrucción.
En la mitad de las pacientes en este estudio, el motivo que orilló a buscar consulta fue presentar algún síntoma, siendo el principal, tumor mamario en 46.3% de ellas; en un estudio que se realizó en Inglaterra, en el año 2000,16 que incluyó a 692 mujeres con algún síntoma mamario, solamente el 12.6% tuvo cáncer, de ellas, 68.8% presentaba una tumoración (20.7% dolorosa, 40.2% no dolorosa, 10.3% tumoración mamaria acompañada de otro síntoma, y 28.7%, otro síntoma. El tiempo promedio de evolución fue de 8.4 meses en nuestro estudio, comparado con lo encontrado en un metaanálisis17 de 12 estudios en donde el tiempo fue mayor a tres meses en el 34.2%, y mayor a cuatro semanas en el estudio de cohorte realizado por Nosarti C y cols.,16 donde retrasaron la atención médica porque pensaron que no era importante o que era pasajero en 12.3%, respectivamente.
Cerca de una tercera parte de los casos de cáncer son prevenibles y otro tercio es tratable, si se detecta en una fase temprana y es atendido con los recursos necesarios.17 En términos del financiamiento y la provisión de tratamiento para casos detectados, los sistemas de seguridad social de México cubren alrededor de 40 a 45% de la población, el resto depende de servicios públicos de la Secretaría de Salud.18 Uno de los principales temas en México, igual que en otros lugares, es el mejoramiento y ampliación del tamizaje encaminado a promover la detección temprana. Los datos disponibles sugieren que sólo entre 5 y 10% de los casos en México se detectan en sus primeras etapas, localizadas en la mama,19 en comparación con 50% en Estados Unidos.20 Un estudio de 256 mujeres mexicanas con diagnóstico de cáncer de mama reveló que en 90% de los casos fueron ellas mismas las que identificaron su padecimiento, y sólo el 10% se diagnosticó en etapa I.7 En una población de mujeres derechohabientes del Instituto Mexicano del Seguro Social, se encontró que en 58% de las mujeres, el hallazgo del tumor fue casual, y 90% ocurrió mientras se bañaban.21
En este estudio, la mayoría de las pacientes se diagnosticó en estadio clínico l, con 37%, seguido de estadio clínico IIa, en 33.3%.
La Encuesta Nacional de Salud incluye una pregunta para saber si las mujeres habían acudido a un centro de salud para hacerse cualquier tipo de estudio de cáncer de mama en el año anterior a la encuesta. Estos datos muestran que sólo 12% de las mujeres de 40 a 69 años de edad se había sometido a un examen clínico (incluida la mamografía) en el año 2000, y para el año 2006 el porcentaje incremento al 22%.22,23 En este contexto, la promoción del autoexamen y el examen clínico de las mamas adquieren relevancia en la prevención y control del cáncer de mama en países como México, que no cuentan con la infraestructura suficiente para el tamizaje poblacional por mastografía,11 aun cuando ésta es la herramienta diagnóstica más utilizada en los programas de tamizaje y diagnóstico de cáncer de mama.24 En Estados Unidos y otros países industrializados, la mortalidad por cáncer de mama está disminuyendo debido al incremento en el uso de la mastografía de tamizaje y la detección temprana,25 de tal manera que las mujeres podrían potencialmente beneficiarse con el diagnóstico precoz del cáncer de mama mediante el tamizaje. La supervivencia de mujeres con cáncer detectado mediante tamizaje con mastografía es muy alta, tanto como el 97% en Malmö, Suecia, luego de 10 años de seguimiento.26 Aun dentro del mismo estadio del cáncer, la supervivencia es más alta en los cánceres detectados por tamizaje que en los cánceres detectados clínicamente,27 y en el INPer, del total de pacientes con cáncer de mama, sólo el 11.1% de los diagnósticos se realizó a través de mastografía de tamizaje, en estos casos la escolaridad mínima de todas ellas fue la educación secundaria. El Colegio Americano de Radiología utiliza un sistema de terminología llamado ''BI-RADS'' que corresponde con el acrónimo en inglés ''Breast Imaging Reporting and Data System'' (BI-RADS®), que se traduce como Sistema de Informes y Registro de Datos de Imagen de la Mama.28 Éste fue desarrollado en 1995 como una respuesta a la falta de uniformidad en la terminología de la mastografía, y la confusión respecto a la probabilidad de un resultado maligno. Las anomalías observadas en la mastografía se reportan con un sistema de información estandarizado que lleva a una evaluación fija y las recomendaciones específicas de manejo.29 La predicción de malignidad de las categorías de BI-RADS son 0-2% para la categoría 3, y aproximadamente el 98% o más para la categoría 5, mientras que la categoría 4 es aproximadamente de 30% (4a: 6%, 4b: 15% y 4c: 53%).29 La biopsia se recomienda para las categorías 4 y 5.30 En el estudio mastográfico de las pacientes de este estudio, es importante mencionar que el 7.1% tenía BI-RADS 2 y el 11.9%, BI-RADS 3; por tal motivo, no se recomendó la toma de biopsia, de acuerdo con el Colegio Americano de Radiología, y el 66.7% tenía un BI-RADS 4 o 5; de acuerdo con el ultrasonido, ninguna paciente tenía BI-RADS 2, y únicamente 2.4% tenía BI-RADS 3 y el 11.9%, BI-RADS 4 o 5. A ninguna de las pacientes se le realizó resonancia magnética.
Los cánceres detectados mediante tamizaje pueden constituir un subgrupo de pacientes con un pronóstico generalmente favorable, podrían ser de crecimiento lento e incluso podrían no derivar en un cáncer invasor, aun sin tratamiento; por lo tanto, parece que el sobrediagnóstico y el sobretratamiento son una consecuencia inevitable del tamizaje, y el principio intuitivamente atractivo de diagnosticar el cáncer precozmente debe ser probado en revisiones sistemáticas de ensayos aleatorios llevados a cabo en forma rigurosa.3 El tamizaje probablemente reduce la mortalidad por cáncer de mama. Sobre la base de todos los ensayos, la reducción es de un 20%, pero como el efecto es menor en los ensayos de calidad más alta, una estimación más razonable es de una reducción del 15% en el riesgo relativo. Basado en el nivel de riesgo de las mujeres en estos ensayos, la reducción del riesgo absoluto fue del 0.05%. El tamizaje también provoca sobrediagnóstico y sobretratamiento, con un aumento del 30% en la estimación o un aumento del 0.5% en el riesgo absoluto. Lo anterior significa que por cada 2,000 mujeres a las que se les recomienda realizarse el tamizaje durante diez años, una prolongará su vida. Además, diez mujeres sanas, las cuales no se hubieran diagnosticado si no se hubiera realizado el tamizaje, se diagnosticarán como pacientes con cáncer de mama y recibirán tratamiento de forma innecesaria. Así pues, no está claro si el tamizaje presenta más beneficios que daños; por este motivo, las mujeres a las que se les recomienda realizar el tamizaje deben estar completamente informadas sobre los beneficios y los daños potenciales.4
Existen varias modalidades para el estudio del cáncer de mama, incluidas la mastografía, el ultrasonido y la resonancia magnética; otras son la biopsia percutánea guiada por imagen, biopsia por aguja de corte, marcaje y biopsias quirúrgicas (incisionales y escisionales).15 En las pacientes incluidas en el estudio, el diagnóstico definitivo de cáncer de mama se realizó mediante biopsia, este fue el procedimiento quirúrgico más común y considerado el estándar de oro para el diagnóstico de anormalidades palpables o radiológicas.31 En el INPer, el 25.9% de las biopsias fueron apoyadas por imagenología, 63.6% fueron biopsia de mínima invasión (aspiración con aguja fina, aguja de corte). El manejo adecuado de las pacientes sometidas a biopsia de mama requiere de la plena participación de un equipo interdisciplinario que incluya principalmente médicos radiólogos, patólogos, cirujanos y médicos oncólogos. La comunicación continua entre los miembros del equipo, a través de las distintas fases del diagnóstico y el proceso terapéutico, es fundamental para obtener el éxito.32 Entender el valor y las limitaciones de las diversas formas diagnósticas fomenta la eficiencia en la determinación del manejo óptimo de la paciente. Actualmente en los Estados Unidos, la mayoría de los procedimientos de biopsia inicial son realizados por radiólogos o cirujanos, utilizando tecnología mínimamente invasiva.30 En un estudio que se realizó en Estados Unidos entre 1988 y 1992, todas las biopsias de mama fueron procedimientos quirúrgicos, compuestos por biopsias por escisión, biopsia por incisión o biopsias intraoperatorias con aguja. La tasa de utilización de las biopsias quirúrgicas de mama se redujo de 58.8 por 10,000 (IC 95% 51.2-66.5) en 1988 a 26 por 10,000 (IC 95% 21.4-30.7), en 1999. Después de la introducción de las biopsias guiadas por imagen con aguja de corte en 1992, la utilización aumentó de 0.2 por 10,000 (IC 95% 0-0.7) en 1992 a 27.7 (IC 95%, 23.0-32.6) por cada 10,000 en 1999. Al final del periodo de estudio, el 52% de las biopsias fueron guiadas por imagen y el 48% fueron biopsias operativas. De las biopsias realizadas cada año, el 44% (rango 35%-51%) se realizaron en lesiones palpables, 3% (rango, 2-4%) para las anomalías del pezón y el 53% (rango 46-60%) guiadas por imagen.33
El tipo histológico más frecuente de cáncer de mama es el ductal seguido del lobulillar en la población del INPer, al igual que lo reportado en otras series en diversas partes del mundo33-36 como Noruega, Estados Unidos, Francia y otros estudios mexicanos:37,38 entre el 70 y 80% corresponden a carcinoma ductal, seguido del lobulillar que varía en diferentes series entre 6 y 18%; sin embargo, en nuestra población, únicamente el 2.2% correspondió a lobulillar.
Conclusiones
El cáncer de mama es, hoy por hoy, uno de los desafíos más importantes y una grave amenaza para la salud de la mujer adulta y el bienestar de las familias, así como para los sistemas de salud y la sociedad en su conjunto. El ginecoobstetra tiene un rol fundamental en la atención de la salud de la mujer para el diagnóstico de las enfermedades de la mama, así como la educación de las mujeres en la autoexploración mamaria y su referencia para el tamizaje mastográfico. Considerando que nuestro Instituto maneja únicamente población femenina, en sus diferentes grupos etarios, el cáncer de mama debería ser considerado como parte de los programas educativos en todos los servicios (tanto para las pacientes, como para el personal médico y paramédico), y el tamizaje correspondiente al grupo etario deberá ser estandarizado de manera prioritaria, ofertado a todas las pacientes en forma independiente, según el padecimiento por el cual estén siendo tratadas; también se debe considerar como parte de los servicios de salud ofrecidos en el marco de la salud sexual y reproductiva, asegurando de esta forma la educación para la prevención y detección oportuna, con las siguientes recomendaciones: autoexploración mamaria a partir de los 20 años de edad, examen clínico anual a partir de los 25 años y cada dos años mastografía a las mujeres entre 40 y los 69 años.39 Por ello, se debe alentar a las mujeres a buscar atención, y a las instituciones a ampliar sus capacidades para ofrecer servicios adecuados; además, el tercer nivel de atención debe contar con el equipamiento adecuado y convertirse en centros regionales de excelencia.16 Es importante fomentar la autoexploración mamaria y el examen clínico de rutina, debido a que nosotros encontramos que en nuestra población el 30% de los casos se presentó en mujeres de 40 años y menos.
Resulta prioritario recabar más y mejores datos en el abordaje de cada paciente para determinar y mantener una vigilancia estrecha en los grupos con mayor riesgo. Debemos acortar el tiempo diagnóstico, aumentar la toma de biopsias de mínima invasión, apegarnos a la normatividad para el reporte de estudios cito/histopatológicos, incrementar el tamizaje, reportar los estudios de gabinete de acuerdo al BI-RADS. Todo lo anterior, con el único fin de estandarizar, mejorar y apresurar el proceso de diagnóstico del cáncer mamario para ofrecer a las pacientes mejores posibilidades de tratamiento y permitir que participen en forma activa en la toma de decisiones. En conclusión, el cáncer de mama es un reto en la salud de la mujer, pero, sobre todo, un desafío para el sistema de salud, incluido el INPer.
REFERENCIAS
1. Maza-Fernández ME, Vecchi-Martini E. El cáncer de mama en México: evolución, panorama actual y retos de la sociedad civil. Salud Publica Mex 2009; 51: S329-34. [ Links ]
2. López-Carrillo L, Torres-Sánchez L, López-Cervantes M, Rueda-Neria C. Identification of malignant breast lesions in Mexico. Salud Pública Mex 2001; 43: 199-202 [ Links ]
3. Instituto Nacional de Estadística y Geografía. Estadísticas a propósito del Día Mundial Contra el Cáncer. Datos nacionales. http://www.inegi.org.mx/inegi/contenidos/espanol/ [ Links ]
4. Kösters JP, Gøtzsche PC. Autoexamen o examen clínico regular para la detección precoz del cáncer de mama (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus. Número 2. Oxford: Update Software Ltd; 2008. Disponible en: http://www.update-software.com (Traducida de The Cochrane Library; 2008. Issue 2. Chichester, UK: John Wiley & Sons, Ltd. [ Links ]).
5. Gøtzsche PC, Nielsen M. Cribaje (screening) con mamografía para el cáncer de mama (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus. Número 4. Oxford: Update Software Ltd; 2008. Disponible en: http://www.update-software.com (Traducida de The Cochrane Library; 2008. Issue 3. Chichester, UK: John Wiley & Sons, Ltd. [ Links ]).
6. Conzen SD, Grushko TA, Olopade OI. Cancer of the breast. In: DeVita VT, Lawrence TS, Rosenberg S, editors. DeVita, Hellman & Rosenberg's Cancer: Principles & Practices of Oncology. 8th ed. Philadelphia, PA: Lippincott, Williams & Wilkins; 2008:1595-1605. [ Links ]
7. Singhal H, Lai LM, Teh W, Lewin JM, Coombs BD, Azavedo E et al. Breast, stereotactic core biopsy/fine needle aspiration. Updated Apr 22, 2010. Accessed Sep 9, 2010. Available at URL address: http://www.emedicine.com/radio/topic768.htm [ Links ]
8. Porter P. Westernizing women's risk? Breast cancer in lower-income countries. N Engl J Med 2008; 358: 213-216. [ Links ]
9. Dirección General de Salud Reproductiva. Secretaría de Salud. Detección Oportuna de Cáncer Mamario. México, 2000. [ Links ]
10. Dirección General de Estadística e Informática/Instituto Nacional de Estadística, Geografía e Informática (INEGI). Estadísticas vitales, series históricas. México, D.F. Secretaría de Salud, 1999. Disponible en: http://www.ssa.gob.mx/ [ Links ]
11. López-Ríos O, Lazcano-Ponce EC, Tovar-Guzmán V, Hernández-Ávila M. La epidemia de cáncer de mama en México. ¿Consecuencia de la transición demográfica? Salud Pública Mex 1997; 39: 259-265. [ Links ]
12. Arkoob K, Al-Nsour M, Al-Nemry O, Al-Hajawi B. Epidemiology of breast Cancer in Jordan: patient characteristics and survival analysis. East Mediterr Health J 2010; 16: 1032-1038. [ Links ]
13. Pollán M. Epidemiology of breast cancer in young women. Breast Cancer Res Treat 2010; 123S1: 3-6. [ Links ]
14. Smigal C, Jemal A, Ward E, Cokkinides V, Smith R, Howe H, Thun M. Trends in Breast Cancer by Race and Ethnicity: Update 2006. CA Cancer J Clin 2006; 56: 168-183. [ Links ]
15. The American College of Obstetricians and Gynecologist. Clinical Updates in Women's Health Care. Continuing care for women with breast cancer. ACOG 2010; 2: 3-4. [ Links ]
16. Nosarti C, Crayford T, Roberts J, Elias E, McKenzie K, David A. Delay in presentation of symptomatic referrals to a breast clinic: patient and system factors. Br J Cancer 2000; 82: 742-748. [ Links ]
17. Facione N. Delay versus help seeking for breast cancer symptoms: a critical review of the literature on patient and provider delay. Soc Sci Med 1993; 36: 1521-1534. [ Links ]
18. Knaul F, Nigenda G, Lozano R, Arreola H, Langer A, Frenk J. Cáncer de mama en México: una prioridad apremiante. Salud Pública Mex 2009; 51: S335-344. [ Links ]
19. Secretaría de Salud. Programa de Acción: Cáncer de Mama. México: SS, 2002. [ Links ]
20. American Cancer Society. Breast Cancer Facts & Figures 2007-2008. Atlanta; American Cancer Society, 2008. [Consultado el 20 de Febrero de 2011]. Disponible en: http://209.135.47.118/downloads/STT/BCFF-Final.pdf [ Links ]
21. Calderón-Garcidueñas AL, Parás-Barrientos FU, Cárdenas-Ibarra L, González-Guerrero JF, Villarreal-Ríos E, Staines-Boone T et al. Risk factors of breast cancer in Mexican women. Salud Pública Mex 2000; 42: 26-33. [ Links ]
22. Instituto Nacional de Salud Pública y Secretaría de Salud. Encuesta Nacional de Salud, ENSANUT2000. Vivienda, población y utilización de servicios de salud. Cuernavaca: INSP, 2003. [ Links ]
23. Instituto Nacional de Salud Pública. Encuesta Nacional de Salud y Nutrición, ENSANUT 2006. Cuernavaca: INSP, 2007. [ Links ]
24. López-Carrillo L, Suárez-López L, Torres-Sánchez L. Detección del cáncer de mama en México: síntesis de los resultados de la Encuesta Nacional de Salud Reproductiva. Salud Pública Mex 2009; 51: S345-349. [ Links ]
25. American Cancer Society. Breast cancer facts & figures 2009-2010. Dallas (TX): ACS; 2009. Disponible en: http://www.cancer.org/downloads/STT/F861009_final%209-08-09.pdf. Retrieved: October 23, 2009. [ Links ]
26. Janzon L, Andersson I. The Malmo mammographic screening trial. In: Miller AB: Chamberlain J, Day NE et al, eds. Cancer Screening. Cambridge: Cambridge University Press, 1991: 37-44. [ Links ]
27. Moody-Ayers SY, Wells CK, Feinstein AR. ''Benign'' tumors and ''early detection'' in mammography-screened patients of a natural cohort with breast cancer. Arch Intern Med 2000; 160: 1109-1115. [ Links ]
28. American College of Radiology. BI-RADS- mammography: assessment categories. En: ACR breast imaging reporting and data systems, breast imaging atlas. 4 ed. Reston (VA): American College of Radiology; 2003: 193-198. [ Links ]
29. Lazarus E, Mainiero M, Schepps B, Koelliker S, Livingston L. BI-RADS lexicon for US and mammography: interobserver variability and positive predictive value. Radiology 2006; 239: 385-391. [ Links ]
30. Ghosh K, Melton III J, Suman V, Grant C, Sterioff S. Brandt K et al. Breast biopsy utilization. Arch Intern Med 2005; 165: 1593-1598. [ Links ]
31. Rogers L. Breast Biopsy: A Pathologist's Perspective on Biopsy Acquisition Techniques and Devices with Mammographic-Pathologic Correlation. Semin Breast Dis 2005; 8: 127-137. [ Links ]
32. Silverstein MJ, Lagios MD, Recht A, Allred DC, Harms SE, Holland R et al. Image-detected breast cancer: state of the art diagnosis and treatment. J Am Coll Surg 2005; 201: 586-597. [ Links ]
33. Albrektsen G, Heuch I, Thoresen SO. Histological type and grade of breast cancer tumors by parity, age at birth, and time since birth: a register-based study in Norway. Cancer 2010; 10: 226-236. [ Links ]
34. Li C, Moe R, Daling JR. Risk of mortality by histologic type of breast cancer among women aged 50 to 79 years. Arch Intern Med 2003; 163: 2149-2153. [ Links ]
35. Feig SA. Ductal carcinoma in situ . Radiol Clin N Am 2000; 38: 653-668. [ Links ]
36. Vamesu S. Angiogenesis and tumor histologic type in primary breast cancer patients: an analysis of 155 needle core biopsies. Rom J Morphol Embryol 2008; 49: 181-188. [ Links ]
37. Rizo P, Sierra M, Vázquez G, Cano M, Meneses A, Mohar A. Registro hospitalario de cáncer 2000-2004. Cancerología 2007; 2: 203-287. [ Links ]
38. Mainero RFE, Aguilar GUI, Bernechea MA, Vargas SJM, Burgos PI. Edad, etapa clínica y tipo histológico del carcinoma mamario en la Gineco 4. IMSS. Rev Mex Mastol 2008; 3: 57-60. [ Links ]
39. Norma Oficial Mexicana NOM-041-SSA2-2011, para la prevención, diagnóstico, tratamiento, control y vigilancia epidemiológica del cáncer de mama. [ Links ]














