Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Perinatología y reproducción humana
On-line version ISSN 2524-1710Print version ISSN 0187-5337
Perinatol. Reprod. Hum. vol.20 n.1-3 Ciudad de México Sep. 2006
Artículo original
Difusión de cotrimoxazol a través de un expansor tisular. Estudio in vitro
Cotrimoxazole diffusion through a tissue expanders. In vitro study
José Francisco Gónzalez–Zamora,a Alejandra Toledo–López,b Humberto Anduaga–Domínguez,c Hugo Juárez–Olguín,b Beatriz Eugenia Pérez–Guillé,a Rosa Eugenia Soriano–Rosales,a Fernando Villegas–Álvarez.a,d
a Laboratorio de Cirugía Experimental. Instituto Nacional de Pediatría.
b Laboratorio de Farmacología. Instituto Nacional de Pediatría.
c Servicio de Cirugía Plástica. Instituto Nacional de Pediatría.
d Departamento de Cirugía. Facultad de Medicina. Universidad Nacional Autónoma de México.
Correspondencia:
Dr. Fernando Villegas Álvarez, Laboratorio de Cirugía Experimental, Torre de Investigación Dr. Joaquín Cravioto.
Instituto Nacional de Pediatría–SSA, Av. Imán No. 1, Col. Insurgentes Cuicuilco,
México, D.F. C.P. 04530.
Tel.: (55) 1084–0900. Exts.: 1451–1452, Fax: (55) 5550–9386.
Correo electrónico: fvadiaz@prodigy.net.mx
Recibido: 8 septiembre de 2006.
Aceptado: 9 de octubre de 2006.
RESUMEN
Introducción: La principal complicación del uso de los expansores titulares (ET) son las infecciones. Una alternativa para evitarla, es agregar antibióticos que se difundan a través de la pared de un ET y eviten la colonización bacteriana. El objetivo de este trabajo fue evaluar la eficacia de una presentación nacional de cotrimoxazol, para difundirse a través de un ET en diferentes volúmenes de expansión.
Material y método: Se realizó un experimento longitudinal con 12 ET, llenados a 50,100, 150 o 200% de su capacidad nominal, con solución fisiológica y cotrimoxazol a una concentración de 800/4000 ug/mL de trimetoprin/sulfametoxazol (TMX/SMX), sumergidos posteriormente en un sistema cerrado. Se midió la presión en el interior del ET, al inicio y al final del experimento. En los cuatro grupos se cuantificó la concentración de cotrimoxazol en la solución del contenedor, durante nueve días consecutivos. Los resultados se compararon mediante ANOVA de dos vías.
Resultados: El SMX se precipitó dentro del ET. Las concentraciones de TMX en la solución del contenedor fueron diferentes en función del tiempo y el porcentaje de expansión. No hubo correlación entre el porcentaje de expansión y la presión dentro del ET.
Conclusiones: La sinergia de cotrimoxazol de uso endovenoso disponible en nuestro país, no es una buena opción a emplearse en un ET a las dosis utilizadas, ya que el coeficiente de solubilidad de SMX se saturó y se formaron cristales. El incremento de difusión de TMX estuvo asociado con un mayor porcentaje de expansión, lo que es una ventaja, considerando que las infecciones son más frecuentes al final del proceso de expansión.
PALABRAS GUÍA: Cotrimoxazol, expansor tisular, difusión de antibióticos, infecciones.
ABSTRACT
Introduction: Infection associated with tissue expansion is one of the main complications and force to take away the tissue expander. An alternative to avoid this action is to dilute antibiotics inside it. The aim of this experiment was to quantify the concentration of cotrimoxazole diffused through a tissue expander at different expansion and pressure volumes.
Material and methods: A test was performed with 12 tissue expanders immersed in a closed system. These were divided in 4 sets according to the introduced expansion rate. Three independent variables were considered: percentage of lumen volume introduced into the expander, pressure inside the expander, and experiment duration. The concentration of the drug diffused through the expander was taken as dependent variable. The solution in which the expander was immersed was continuously sampled and drug concentration was determined by High Performance Liquid Chromatography (HPLC). ANOVA was used to determine differences between concentrations measured of every variable applied.
Results: Only trimethoprim (TMX) diffused. No lineal correlation was observed between expansion rate and pressure inside the expander. The difference with respect to time and concentration of the drug outside the expander was statistically significant among the 4 sets of expanders (p = 0.0000).
Conclusion: Sulfametoxazole (SMX) did not diffuse and crystallized inside the expander because of the different pk of the two drugs (SMX–TMX) respect to pH of dilution which was similar to pK of trimethoprim. The expansion rate had a proportional effect on TMX concentration outside the expander: an over–expansion of the system greater than 200% increases diffusion highly.
KEY WORDS: Cotrimoxazole, tissue expanders, antibiotics diffusion, infections.
INTRODUCCIÓN
Desde que en 1976 Radován propuso la utilización de los ET como una opción para logra cubrir grandes superficies cutáneas,1 su uso en pacientes pediátricos se extendió con rapidez.2 La ventaja de esta técnica para crear una cobertura cutánea con una textura y coloración muy similar a la zona afectada, la coloca como una de las principales opciones estéticas y funcionales.3 Los primeros informes sobre su uso en niños, fueron relativos a su capacidad para cubrir grandes zonas quemadas y nevos gigantes.4 Actualmente, han cobrado importancia en padecimientos congénitos, entre los que destacan: los grandes defectos de la pared abdominal, los mielomeningoceles gigantes, la separación de gemelos siameses, las plastias de pene y la aplasia cutis.5–10
En estudios de series de casos en edad pediátrica se ha documentado que entre 13 a 30% de los casos presentan complicaciones asociadas con el uso de ET. Cabe señalar que en los adultos el porcentaje de complicaciones es superior (7 a 24%), por lo que la edad debe ser un factor de riesgo a considerar.11–15 La complicación más frecuente es la colonización bacteriana, la que está asociada con el dolor regional, expansión incompleta o retiro de los ET.12,16
Para evitar complicaciones, se ha propuesto el uso profiláctico de antibióticos sistémicos durante el proceso de expansión (de dos a ocho semanas), pero no se ha demostrado que su utilización elimine la colonización bacteriana in situ; por lo que su inserción se reserva, sólo cuando los ET han provocado signos de infección local, con resultados no siempre favorables.17
Una alternativa profiláctica para evitar la colonización in situ, es agregar antibióticos al líquido con el que se llena un ET, o bien fabricar un ET con paredes impregnadas de un antibiótico. Ambas estrategias tienen la finalidad de mantener una "autoesterilización" del ET.18,19 Al momento, no existe algún ensayo clínico que demuestre la superioridad de una u otra alternativa, pero a juicio de los autores, incluir antibióticos a la solución de expansión representaría una solución clínica más factible, por ser práctica y económica.
Los antibióticos utilizados para inhibir el crecimiento bacteriano en dispositivos protésicos o ET, son: cefalotina,11 gentamicina,11 metronidazol,20 cotrimoxazol –trimetoprin–sulfametoxazol (TMX/SMX)–,18 nafcicilina18 y minociclina/rifampicina.19 En pacientes pediátricos, el Staphylococcus aureus y epidermidis son los principales agentes asociados a infección por el uso de un ET; por lo que el cotrimoxazol y la minociclina/rifampicina son los mejores antimicrobianos que han probado alguna actividad profiláctica.19,20
Con base en su probada eficacia in vitro de cotrimoxazol,18 se decidió hacer un estudio de fase II, cuyo objetivo fue conocer el perfil de difusión de cotrimoxazol a través de un ET, considerando los diferentes porcentajes de expansión a los que se somete un ET en una situación clínica.
MATERIAL Y MÉTODOS
El estudio se llevó a cabo en los laboratorios de Cirugía Experimental y Farmacología del Instituto Nacional de Pediatría. Se incluyeron 12 ET marca Mentor U.S.® con una capacidad volumétrica de 100 mililitros (mL), de forma rectangular de 6.6 x 5.5 x 5.6 centímetros y válvula remota. De acuerdo con el volumen de expansión, se incluyeron cuatro grupos de tres ET, cada uno: Grupo I, con 50 mL; Grupo II, con 100 mL; Grupo III, con 150 mL; y, Grupo IV, con 200 mL. Todos los ET fueron llenados con solución salina (0.9%) y cotrimoxazol a una relación de 800/4000 µg/mL de TMX/SMX (lo doble de la dosis empleada por Kenna).18 Se utilizó la única presentación endovenosa comercial disponible en México (Trimexazol® intravenoso ICN Farmacéutica), en función de que sería la potencialmente utilizada en nuestro medio. La dilución final en la solución salina tuvo un pH de 9.17.
Cada ET (incluyendo su válvula remota) fue colocado en un recipiente cerrado de 1.5 litros de capacidad. A cada ET se le midió la presión intraluminal en mm Hg, con un transductor electrónico (DATASCOPE 870®). Los recipientes en donde fueron introducidos por completo los ET, contenían un litro de solución salina (0.9%). El sistema se mantuvo a una temperatura de 37 ± 1 grados centígrados, el cual se colocó sobre una plancha de agitación termomagnética marca Thermolyne®, para evitar la posible precipitación de las sales difundidas.
Se extrajeron muestras de 0.5 mililitros de la solución que bañó a los ET: a las 0, 6, 12 y 24 horas de iniciado el experimento. Posteriormente, cada 24 horas durante nueve días consecutivos, el volumen extraído se repuso con la misma cantidad de solución fisiológica. Al concluir la última toma, los ET fueron extraídos del recipiente y se registró nuevamente la presión intraluminal y se midió el volumen residual dentro del ET, de donde se tomó una muestra de 1 mL para medir la concentración final de cotrimoxazol. La cuantificación de la concentración de cotrimoxazol se llevó a cabo para cada uno de los componentes: TMXy SMX, por el método de cromatografía de líquidos de alta resolución (HPLC), descrito por TB Vree y cols.,21 cuya validación en nuestro laboratorio ha sido descrita en reportes previos.22
Para el análisis estadístico se consideraron como variables independientes a la presión intraluminal y al porcentaje de expansión (volumen nominal/volumen introducido). Las variables dependientes fueron los niveles de cotrimoxazol cuantificados fuera del ET. Para establecer las diferencias entre la concentración del fármaco en función del tiempo y el porcentaje de expansión, se realizó una prueba de ANOVA para muestras repetitivas, para encontrar diferencias estadísticamente significativas con un valor de p < 0.05. Para evaluar una posible correlación lineal entre la presión intraluminal y el porcentaje de expansión, se utilizó una prueba de Pearson.
RESULTADOS
A partir de la primera hora, posterior al montaje del experimento, se observaron cristales transparentes sedimentados en el interior de los 12 ET. Una vez terminado el experimento, el promedio de las concentraciones de TMX en el interior de los 12 ET, fue de 632 µg/mL y para SMX de 2842 µ/mL.
El promedio de presión intraluminal, al inicio y final del experimento, en todos los ET fue similar (20.4 vs. 19.9 mm Hg). La presión en el grupo III tuvo un promedio de 40.1 (39 a 42 mm Hg), discretamente mayor al grupo IV, donde el promedio fue de 38.5 (37 a 40 mm Hg). No se observó relación lineal entre la presión intraluminal y el porcentaje de expansión (r de Pearson = 0.22).
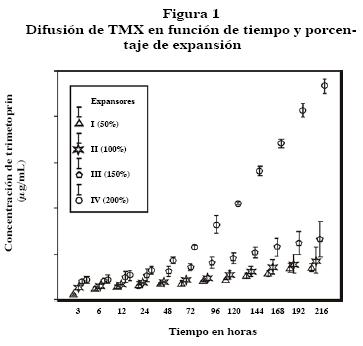
En la solución salina que bañaba los ET, no se detectó SMX; en cambio, se registraron diversas concentraciones de TMX en todos los tiempos. En los 12 ET, la concentración en la primera toma (tres horas), oscilaron entre 0.021 a 0.099 µg/mL y en la última cuantificación, (noveno día) entre 0.128 y 0.967 µg/mL. La concentración de TMX se incrementó en proporción directa al volumen de llenado.
Los niveles de TMX mostraron diferencias significativas entre los cuatro grupos de ET. Se demostró una mayor difusión del fármaco a mayor expansión y más tiempo transcurrido (correlación ínter grupos p < 0.000, F = 2093.31 y 1 gL; correlación intragrupo p < 0.000, F = 181.916 y 33 gL). La diferencia entre los grupos fue evidente posterior a las 48 horas de iniciado el experimento (Figura 1).
DISCUSIÓN
Las indicaciones para el uso de ET en pacientes pediátricos se han incrementado en los últimos años, principalmente en pacientes con malformaciones congénitas. Sin embargo, la frecuencia de complicaciones asociadas a la utilización de la maniobra, no parecen modificarse. Las infecciones, como principal complicación, representan un riesgo para no lograr el colgajo cutáneo ideal.
El principal mecanismo implicado en la colonización bacteriana es la contaminación externa del ET, dado que se ha demostrado la impermeabilidad de las paredes del ET a las bacterias.23 La contaminación externa puede ser explicada por la migración de bacterias a través de la los sitios de punción de la válvula remota, por migración bacteriana de la piel hacia el ET, o por colonización distal asociada a traslocación bacteriana proveniente de un foco infeccioso en otro sitio.23–25 En cualquiera de los casos, para evitar la colonización bacteriana, desde inicios de los ochentas, Burkhart propuso como medida profiláctica introducir antibióticos en los ET.26 Este efecto protector está en función de la difusión del antibiótico a través de las paredes del ET hacia el tejido que lo rodea; además de la fuga del contenido del ET, a través de las punciones hechas en la válvula remota, durante las sesiones de insuflación.25
En un estudio comparativo in vitro realizado por Kenna, donde evaluó la eficacia de tres diferentes antibióticos para inhibir el crecimiento bacteriano in vitro de Staphylococcus aureus y epidermidis, se demostró la superioridad de cotrimoxazol para inhibir el número de unidades formadoras de colonia; sin embargo, no se documentaron las concentraciones de antibióticos que se difundieron.18
En el presente estudio se cuantificaron niveles de TMX fuera del ET (pero no de SMX), por lo que la sinergia de la combinación del cotrimoxazol no se presentó. Por lo tanto, el hallazgo descrito por Kenna puede ser debido a la efectividad de TMX, ya que la concentración mínima inhibitoria de TMX para los gérmenes descritos está entre 0.019 a 0.156 µg/mL.27 Concentraciones que en este experimento documentamos desde las primeras tres horas.
La posible explicación de la falta de difusión de SMX está en las características fisicoquímicas de la mezcla realizada con la única presentación comercial de cotrimoxazol endovenoso disponible en México. El cotrimoxazole es la combinación de cinco partes de SMX por una de TMX, con pesos moleculares semejantes (TMX 290.32 y SMX 253.31). Ambos fármacos son muy poco solubles en agua, por lo que al diluirlos en solución salina a dosis de 800 µg/mL de TMX y 4,000 µg/mL de SMX, se saturó la dilución y se precipitó el fármaco más abundante, el SMX. Este hallazgo debe tomarse en cuenta al preparar una dilución a introducir en un ET.
Hay que tener en consideración no rebasar el coeficiente de dilución. Otra medida para mejorar la difusión de ambos fármacos, sería disminuir el pH de la dilución, maniobra descrita por McGuire28 y Derby29 para lidocaína: basada en igualar el pKa de la sal con el pH de la dilución. En nuestro experimento, el pH de la dilución fue de 9.1 y el pKa de cotrimoxazol de 6.6. Otras posibles soluciones serían introducir a los ET, otro tipo de diluyentes o quizá utilizar acarreadores lipofílicos para fármacos hidrosolubles, pero tendrían que demostrarse en futuras investigaciones.
Un aspecto importante que se demostró en este experimento, y del cual ya existe evidencia, fue que al incrementar el volumen dentro del ET,19 la difusión del fármaco se incrementa. Condición muy favorable dado que las infecciones aumentan al final de la maniobra de expansión. El incremento de la difusión es explicado por la Ley de Fick, que establece que si se disminuye el grosor de la membrana y aumenta el área de difusión, se obtiene una mayor concentración del otro lado de la membrana.30 Se ha mencionado que la presión externa continúa dentro del ET, puede ser un factor que impacte sobre la difusión del fármaco; no obstante, en el presente estudio no logramos establecer una correlación entre la presión y la difusión, lo que quizá pueda ser explicado porque las presiones que se cuantificaron fueron menores a las documentadas por Zhan (de hasta 110 mm Hg).31 Sin embargo, se debe considerar que la presión puede impactar las concentraciones fuera del ET, en función de la existencia de fugas del fármaco, a través de los sitios de punción de la válvula remota.25
Con los resultados obtenidos de este experimento concluimos que el cotrimoxazol, al no contar con difusión de sus dos componentes, no mantiene su sinergia antimicrobiana, por lo que no parece ser una buena opción para ser empleado en un ET (salvo que se consideren otras maniobras que permitan mejorar su coeficiente de dilución). El incremento de difusión de un fármaco a través de un ET, asociado con el incremento del volumen de expansión, representa una ventaja de esta maniobra, si tenemos en cuenta que las infecciones son más frecuentes al final del procedimiento de expansión. La realización de futuros estudios de fase II, que nos permitan analizar el papel de otros antibióticos en la inhibición de la colonización bacteriana de un ET, nos permitirá contar con opciones eficaces y seguras, dirigidas a disminuir el porcentaje de complicaciones cuando se emplea esta técnica, la que es cada día más utilizada en pacientes pediátricos.
REFERENCIAS
1. Radovan C. Tissue expansion in soft–tissue reconstruction. Plast Recons Surg 1984; 74: 482– 6. 90. [ Links ]
2. Rivera R, LoGiudice J, Gosain AK. Tissue expansion in pediatric patients. Clin Plast Surg 2005; 32: 35–44. [ Links ]
3. LoGiudice J, Gosain AK. Pediatric tissue expansion: indications and complications. J Craniofac Surg 2003; 14: 866–72. [ Links ]
4. Cohen M, Marschall M. Tissue expansion. An alternative technique in reconstructive surgery. Surg Annu 1990; 22: 343–62. [ Links ]
5. De Ugarte DA, Asch MJ, Hedrick MH, Atkinson JB. The use of tissue expanders in the closure of a giant omphalocele. J Pediatr Surg 2004; 39: 613–5. [ Links ]
6. Arnell K Primary and secondary tissue expansion gives high quality skin and subcutaneous coverage in children with a large myelomeningocele and kyphosis. Acta Neurochir 2006; 148: 293–7. [ Links ]
7. Goh KY. Separation surgery for total vertical craniopagus twins. Childs Nerv Syst 2004; 20: 567–75. [ Links ]
8. Snyder MC, Johnson PJ, Hollins RR. Congenital primary cutis verticis gyrate. Plast Reconstr Surg 2002; 110: 818–21. [ Links ]
9. Hata Y, Umeda T. Reconstruction of congenital microtia by using a tissue expander. J Med Dent Sci 2000; 47: 105–16. [ Links ]
10. Mathews R, Nelson CP, Gearhart JP, Vander Kolk CA. Tissue expansion in management of failed phallic reconstruction: initial report of clinical series. Urology 2005; 66: 180–4. [ Links ]
11. Burkhardt BR, Fried M, Schnur PL, Tofield JJ. Capsules, infection, and intraluminal antibiotics. Plast Reconstr Surg 1981; 68: 43–7. [ Links ]
12. Brown MD, Jonson TM. Complications of tissue expansion. J Dermatol Surg Oncol 1993; 19: 1120–2. [ Links ]
13. Nahabedian MY, Tsangaris T, Momen B, Manson PN. Infectious complications following breast reconstruction with expanders and implants. Plast Reconstr Surg 2003; 112: 467–76. [ Links ]
14. Iconomou TG, Michelow BJ, Zuker RM. Tissue expansion in the pediatric patient. Ann Plast Surg 1993; 31: 134–40. [ Links ]
15. Elias DL, Baird WL, Zubowicz VN. Applications and complications of tissue expansion in pediatric patients. J Pediatr Surg 1991; 26: 15–21. [ Links ]
16. Margiotta M, Kasabian A, Karp N. Complications of tissue expansion in a public hospital. Ann Plast Surg 1999; 42: 396–401. [ Links ]
17. Yii NW, Khoo CT. Salvage of infected expander prostheses in breast reconstruction. Plast Reconstr Surg 2003; 111: 1087–92. [ Links ]
18. Kenna DM, Robotti EB, Bocchiotti G, Blazek J, Grossman JA. Diffusion of antibiotics across tissue expanders: an in vitro study. Ann Plast Surg 1994; 32: 346–9. [ Links ]
19. Darouiche RO, Netscher DT, Mansouri MD, Meade R. Activity of antimicrobial–impregnated silicone tissue expanders. Ann Plast Surg 2002; 49: 567–71. [ Links ]
20. Wang Z. Research on soft–tissue expander permeability to metronidazol and procaine. Plast Reconstr Surg 1996; 97: 1416–9. [ Links ]
21. Vree TB, Hekster YA, Baar AM, Damsma JE, Kleijn EV. Determination of Trimethoprim and Sulfamethoxazole (CO–Trimoxazole) in body fluids of man by means of High–Performance Liquid Chromatography. J Chromatog 1978; 146: 103–12. [ Links ]
22. Lares–Asseff I, Villegas F, Pérez G, Toledo A. Kinetic effects of trimethoprim–sulfa–methoxazole in children with biliary atresia: a new dosing regimen. Arch Med Res 1996; 27: 183–90. [ Links ]
23. Liang MD, Narayanan K, Ravilochan K, Roche K. The permeability of tissue expanders to bacteria: an experimental study. Plast Recons Surg 1993; 92: 1294–7. [ Links ]
24. Gibstein LA, Abramson DL, Bartlett RA, Orgill DP, Upton J, Mulliken JB. Tissue expansion in children: a retrospective study of complications. Ann Plast Surg 1997; 38: 358–64. [ Links ]
25. Nordström REA, Pietilä JP, Voutilainen PEJ, Lilius GPS, Virkkunen PJ, Rintala AE. Tissue expander injection dome leakage. Plast Recons Surg 1981; 1: 26–9. [ Links ]
26. Burkhardt BR, Dempsey PD, Schnur PL, Tofield JJ. Capsular contracture: a prospective study of the effect of local antibacterial agents. Plast Reconstr Surg 1986; 77: 919–23. [ Links ]
27. Havas L, Fernex, Lenox–Smith I. The clinical efficacy and tolerance of Co–trimethoxazole (Bactrim–septrim) an analysis of 37,340 cases. Clin Trial J 1973; 10: 81–6. [ Links ]
28. McGuire JJ, Caffee HH. In vivo diffusion of lidocaine through tissue expanders. Plast Recons Surg 1992; 89: 675–7. [ Links ]
29. Derby LD, Jordan B Ch, Bowers LD. Quantitative analysis of lidocaine hydrochloride delivery by diffusion across tissue expander membranes. Plast Reconstr Surg 1991; 89: 900–7. [ Links ]
30. Garrett ER, Chemburkar PB. Evaluation, control, and prediction of drug diffusion through polymeric membranes III. J Pharm Scien 1968; 57: 1401–9. [ Links ]
31. Zhan W, Zhu F, Kuang LX, Chen G, Lu YD, Ning JL. Effect of the endoexpander pressure of continuous and constant pressure expansion on the drug permeability. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi 2002; 16: 39–41. [ Links ]














