Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Archivos de neurociencias (México, D.F.)
On-line version ISSN 1028-5938Print version ISSN 0187-4705
Arch. Neurocien. (Mex., D.F.) vol.10 n.2 Ciudad de México Apr. 2005
Artículo de revisión
Neuralgia del trigémino
Trigeminal neuralgia
Jorge Santos–Franco, Roberto Santos–Ditto, Rogelio Revuelta–Gutiérrez
Instituto Nacional de Neurología y Neurocirugía Manuel Velasco Suárez.
Correspondencia:
Jorge Santos Franco.
Instituto Nacional de Neurología y Neurocirugía Manuel Velasco Suárez.
Insurgentes Sur 3877. Col. La Fama.
14692 México D.F.
E–mail: jorge_santos@correo.unam.mx
Recibido: 18 de febrero 2005.
Aceptado: 28 de febrero 2005.
RESUMEN
La neuralgia del trigémino es una patología que puede llegar a ser altamente incapacitante. En la actualidad, cuando la terapia médica falla, su manejo se divide entre las técnicas que destruyen la porción sensitiva del nervio, denominadas ablativos, y la descompresión microvascular. Mediante la revisión de la literatura observamos que ambas tendencias han tenido resultados satisfactorios; sin embargo, la descompresión microvascular parece ofrecer un mejor y duradero alivio del dolor, además de la conservación de la fisiología del 5to. nervio craneal.
Palabras clave: neuralgia del trigémino, descompresión microvascular, dolor, nervio craneal.
ABSTRACT
Trigeminal neuralgia can induce high incapacity. Currently, when medical therapy fails, its management is debated between destructive and microvascular decompression techniques. Both have reach good results, nevertheless microvascular decompression seems to have better and longer pain relief with functional preservation of the V cranial nerve.
Key words: trigeminal neuralgia, microvascular decompression, pain, cranial nerves.
Breves consideraciones anatómicas del Vto par craneal: El nervio trigémino, Vto par craneal, el más grueso de todos los pares craneales, es un nervio mixto y tiene diferentes funciones 1. La más importante es la sensitiva que conduce la sensibilidad exteroceptiva; el tacto, el dolor y la temperatura de la cara, la mucosa orbitaria, nasal y oral; y la propioceptiva de los dientes, paladar y articulación temporomandibular. Estas funciones la realiza a través de sus ramas periféricas, la primera u oftálmica (V1) se encarga de la sensibilidad de la parte anterior de la piel cabelluda, frente, párpado superior, glándula lagrimal, dorso de la nariz, córnea, conjuntiva, mucosa nasal, mucosa pituitaria superior y senos frontal y etmoidal. La segunda rama o maxilar inferior (V2) inerva el párpado inferior y su mucosa, parte de la región temporal, labio superior y su mucosa, mejilla, ala nasal, arcada dentaria superior, amígdalas, úvula, paladar, oído medio, nasofaringe, mucosa pituitaria inferior y la cubierta meníngea de la fosa craneal media. La tercera rama o maxilar inferior (V3) se encarga de la sensibilidad de la piel de la porción posterior de la región temporal y anterior del pabellón auricular, del conducto auditivo externo y cara externa del tímpano, maxilar inferior (excepto el ángulo de la mandíbula que depende del plexo braquial), labio inferior y mentón, mucosa del piso de la boca, dientes de la arcada inferior y dos tercios anteriores de la lengua. La función motora del trigémino es ejercida por el nervio masticador, englobado en el nervio maxilar inferior, y se encarga de la motilidad de los músculos masticadores, también produce dilatación de trompa de Eustaquio e inerva el músculo del martillo en el tímpano.
El 5t0 par también tiene función sensorial ya que conduce estímulos gustativos de la lengua a través del nervio lingual, rama del maxilar inferior. Su función secretora la realiza a través de fibras vegetativas, sobre las glándulas lacrimales, salivales y la mucosa pituitaria.
La rama V1 ingresa a la cavidad craneal por la fisura orbitaria superior o hendidura esfenoidal, V2 lo hace a través del foramen redondo y V3 a través del foramen oval. De allí discurren en sentido caudal, de ellas las dos primeras presentan una estrecha relación con el seno cavernoso y la porción cavernosa de la arteria carótida interna. Las tres ramas convergen en el ganglio de Gasser dentro del cavum de Meckel, para después continuar su trayecto hacia el puente. En su origen aparente reunidas en una raíz gruesa y compacta. De allí los estímulos son conducidos a distintos núcleos: mesencefálico, motor, sensitivo principal y trigémino espinal, a lo largo del tronco cerebral y la porción más rostral de la médula espinal.
Etiología de la neuralgia del trigémino
Durante mucho tiempo se pensó que la neuralgia trigeminal esencial, anteriormente denominada idiopática, se debía a un síndrome talámico parcial secundario a infarto, o un proceso desmielinizante del tronco encefálico, o por lesiones neoplásicas incipientes de la fosa posterior2. Dandy en la década de los 20s, fue el primero en destacar que este padecimiento podría ser provocado por la compresión del 5to. nervio por un vaso, ya sea arterial o venoso. En la actualidad este concepto es el más aceptado, sobre todo a partir de los trabajos publicados por Jannetta, en los que se demuestra mejoría del cuadro al impedir quirúrgicamente el contacto vascular, sobre todo en la zona de entrada de la raíz (ZER), procedimiento denominado descompresión neurovascular, que será detallado más adelante2–9. La ZER, también denominada de Obersteiner–Redlich, es el límite donde la mielina central da paso a la periférica, y que en el 5to nervio abarca una longitud de 2.2 mm macroscópicamente, la compresión decolora e hidenta al nervio. Microscópicamente lleva a la desmielinización de la raíz nerviosa y esta a su vez, quizás, involucra a la excitación ectópica y transmisiones efápticas desde las fibras mielinizadas A hacia las fibras nocioceptivas pobremente mielinizadas A–delta y C, lo que podría explicar el dolor evocado por estímulos inocuos aplicados sobre las "áreas de gatillo"10-17. Sin embargo, en el 50% de las autopsias de sujetos que nunca padecieron de neuralgia del trigémino, se aprecia la compresión neurovascular. Una explicación probable a esta discrepancia es que en las necropsias se observa al tallo vertebral con el espacio subaracnoideo depletado y por ende, las estructuras vasculares adosadas al tallo encefálico.
La neuralgia del trigémino también puede ser desencadenada por alguna patología ya sea propia del sistema nervioso central (SNC) o no, y en este caso se denomina secundaria y en algunas series alcanza aproximadamente de entre 10 a 15%. Se debe siempre sospechar este tipo de neuralgia en pacientes jóvenes con un dolor atípico, y en casos de afección bilateral y es aquí cuando se hace imprescindible la RM 2,11,12; sin embargo, artículos recientes sugieren que este estudio de imagen debe ser rutinario aún en casos típicos sobretodo en quienes van a ser operados13,14. Los tumores epidermoides y meningiomas del ángulo pontocerebeloso, los tumores que involucran al seno cavernoso–meningiomas, adenomas de hipófisis –, los neurinomas del acústico y del Vto nervio pueden provocar neuralgia trigeminal12,13,15–17. Se puede observar neuralgia del trigémino en asociación con lesiones neoplásicas contralaterales17, e incluso como manifestación de la neurocisticercosis18 o de una fístula arteriovenosa del cavum de Meckel19. La esclerosis múltiple se acompaña de NT en 1 a 8% de los pacientes y en estos casos suele ser de presentación temprana y bilateral20. Menos frecuente es su asociación con amiloidosis, sífilis, enfermedad de Paget y pseudotumor cerebri2,21.
CLÍNICA
La neuralgia del trigémino es quizá el dolor agudo más intenso conocido. Presenta una prevalencia de 3 a 5 por cada 100,000 individuos, y se expresa como un dolor facial de carácter paroxístico, recurrente, de aproximadamente 2 a 10 segundos de duración, con característica de "toque o corriente eléctrica" que se localiza en una o más de las tres divisiones del nervio trigémino4,6,22,23. Esta sensación desagradable suele desencadenarse de manera espontánea, pero puede verse evocada por estímulos tales como el afeitarse, masticar, cepillarse los dientes, fumar, hablar o tocarse la cara en la zona de distribución del nervio trigémino2,11,21,22. Es común que estos paroxismos sucedan entre intervalos libres de dolor y que no dejen ningún tipo de déficit. Estos intervalos asintomáticos o "íntercríticos" pueden ser inicialmente de meses o años, pero suelen ir progresivamente acortándose hasta que los paroxismos sean muy frecuentes. En algunos pacientes puede instaurarse el raro "status trigeminalis"2,11. Es importante destacar que la neuralgia del trigémino, llamada también "tic doloroso", llega a ser incapacitante y lleva al paciente a padecer de una mala calidad de vida22. Suele tener un ligero predominio en mujeres sobre varones, con una edad frecuente de aparición desde la 6ta. década de la vida24 El lado derecho suele ser el más afectado –60% de los casos –, y el compromiso de V2 predomina sobre V3 y esta sobre V1, siendo frecuente la afección conjunta de V2 y V3 11,24. A la exploración física podemos evocar el dolor mediante el estímulo de áreas que se denominan de gatillo, tales como los labios, las mejillas, las encías. No es común el encontrar déficit; sin embargo, en pocos casos se puede encontrar ligera hipoestesia en la rama afectada22,25.
La neuralgia trigéminal atípica se caracteriza por ser un cuadro doloroso en una o más de las ramas del 5to. nervio craneal que, al contrario de paroxismos, suele ser constante y que además se acompaña de diversos grados de déficit sensitivo e incluso motor4,22. En general, en presencia de este cuadro clínico se debe sospechar de una causa secundaria, no obstante, algunos autores han manifestado, con escasa evidencia, que puede verse en casos "idiopáticos" con mucho tiempo de evolución a manera de evolución natural de enfermedad.
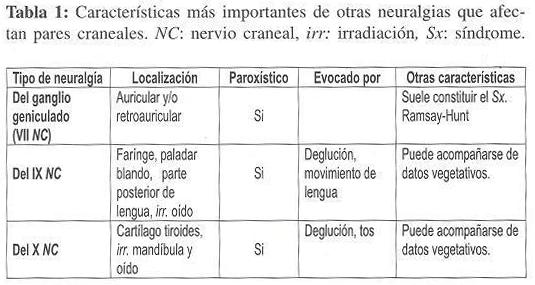
La neuralgia del trigémino debe ser distinguida principalmente de ciertos tipos de cefalea y de otras neuralgias faciales (tabla 1). Dentro de las cefaleas se destacan la migraña clásica, la cefalea en racimos (tipo Cluster), las hemicráneas nocturnas, la arteritis de la arteria temporal y las hemicráneas paroxísticas nocturnas. El dolor facial atípico constituye en un reto diagnóstico, es un cuadro doloroso severo que afecta a la piel cabelluda, cara, cuello, y en algunos casos hasta las extremidades superiores, que involucra a un territorio específico de un nervio craneal y están ausentes las zonas de gatillo21. En muchos pacientes con procesos inflamatorios de los senos paranasales y para–odontales, o disfunciones temporomandibulares, se desarrolla dolor trigeminal21.
MANEJO MEDICO
El tratamiento médico ha sido considerado como de primera instancia4,26–29. La farmacoterapia incluye: a. monoterapia con un solo antineurítico–antiepiléptico (AA), b. terapia combinada con mas de un AA, c. AA asociado a drogas analgésicas; y, d. politerapia, todas las drogas anteriores más antidepresivos y ansiolíticos.
La carbamazepina (CBZ) se ha considerado como el fármaco de elección, actúa bloqueando los canales de Na+ dependientes de voltaje y la dosis utilizada va desde 600 a 1600 mg diarios8,30. La difenilhidantoina (DFH) tiene un efecto similar pero con menor eficacia, y su dosis es de 300 a 500 mg diarios 8,30. La gabapentina, cuyo efecto es similar a la CBZ en lo que respecta a los canales de Na+, además potencializa la concentración y síntesis del GABA, ha sido utilizada en la NT, es mejor tolerada, aunque puede producir sedación y alteraciones cognitivas. La gabapentina no tiene interacciones medicamentosas conocidas por lo que puede ser considerada también como droga de primera línea en el tratamiento de la NT; las dosis pueden ser altas de acuerdo a la tolerancia y la eficacia en los distintos caso, de 300 a 3600 mg/día27,30,31. La oxcarbazepina, que es un cetoderivado de la CBZ ha sido empleada en los últimos años, principalmente en aquellos intolerantes a la CBZ. A dosis que por lo regular van desde 300 a 1800 mg a mostrando una eficacia similar a CBZ, pero con menor toxicidad28. El manejo médico adolece de dos grandes aspectos que limitan su uso: primero, la toxicidad importante, y segundo, que su efecto favorable antineurálgico, se va perdiendo a medida que progresa la enfermedad. En lo referente a la toxicidad, las dosis son muy sensibles de pasar del efecto deseado al indeseado con manifestaciones que en general se caracterizan por náusea, somnolencia, ataxia, dermatitis, alteraciones hepáticas y hematopoyéticas, destacando que la oxcarbazepina es mejor tolerada y con menor toxicidad29. Muchos autores han tratado de determinar de una manera científica cuanto dura el efecto favorable de los fármacos hasta la recaída, pero no existe un consenso28,29. Por lo tanto, se ha postulado y demostrado que el manejo quirúrgico temprano es beneficioso en vista que los fármacos en algún momento fracasarán, y que la enfermedad progresará hasta presentar una menor respuesta al procedimiento elegido2,4,6.
MANEJO QUIRÚRGICO
La cirugía ha sido un recurso utilizado toda vez que los fármacos fracasaron, tanto por su ausencia de efecto como por su toxicidad, pero este criterio encuentra cada vez menos adeptos, existiendo una tendencia actual a la cirugía temprana. El manejo de la NT esencial ha pasado desde las lisis periféricas con la utilización de sustancias neurolíticas (alcohol, fenol, glicerina), hasta la neurectomía ya sea ganglionar (ganglio de Gasser) o preganglionar. Sin embargo, en nuestros días podemos dividir al tratamiento quirúrgico en dos grandes grupos: 1. El manejo no destructivo, representado por la descompresión neurovascular, y 2. técnicas destructivas, que a su vez pueden agruparse en percutáneas – rizolisis por radiofrecuencia, compresión con balón, e inyección preganglionar de glicerol –, y la radiocirugía.
Descompresión microvascular (DMV). Este procedimiento, descrito por Jannetta en los años sesenta, motivado por lo enunciado por Dandy en 1925, consiste en desviar el asa vascular que comprime el trigémino, mediante la interposición de teflón, dacrón o silastic, y en algunos casos, músculo o goretex 1–3,5,14–15,20,23,32–50 Nosotros utilizamos la microcraniectomía asterional 14,51 ,cuya técnica consiste en colocar al paciente en decúbito tres/cuartos prono o en decúbito dorsal con un bulto bajo el hombro ipsilateral al sitio del dolor y la cabeza rotada hacia el lado contrario, fija en cabezal de fijación esquelética. La incisión es paramediana que pasa sobre el asterion, para luego realizar una craniectomía circular de aproximadamente 1.5 a 2.5 mm de diámetro, que tenga como límite rostral al seno sigmoideo y dorsal al seno transverso. Luego de la apertura de la duramadre, se procede a la depleción micro quirúrgica de la cisterna pontocerebelosa, paso necesario para permitir la "caída" del cerebelo para prescindir, lo más posible, de retractores, los que pueden llevar a efectos deletéreos, principalmente edema cerebeloso y tracción de los nervios craneales. Algunos autores prefieren la utilización del un drenaje espinal transoperatorio para la depleción de las cisternas 3A. Siempre bajo visión microscópica, se debe localizar el V NC, tomando como referencia a la fosa subarcuata del peñasco, la vena petrosa y el tentorio. La vena petrosa, que puede ser doble, debe ser coagulada y seccionada lo más distal posible a su desembocadura en el seno petroso superior, para observar ampliamente al trigémino. Entonces debemos visualizar su trayectoria desde la REZ y liberarlo de las bridas aracnoideas, además de identificar sus relaciones con los vasos vecinos. Debemos tener presente que la manipulación del nervio, por más delicada que esta sea, puede llevar a cambios autonómicos importantes, tales como bradicardia e incluso asistolia. El hallazgo más frecuente es un rizo caudal de la arteria cerebelosa superior (ACS) comprimiendo al nervio por lo general en su cara superior o superomedial – axila –4,6,52. Entonces se debe interponer delicadamente fibras humedecidas de teflón. No es infrecuente que la ACS de origen a ramas perforantes que discurren en la cara ventral del puente, deberán ser respetadas para evitar isquemia, situación que puede hacer difícil la colocación del teflón. Es importante verificar la cara medial del nervio para no obviar ninguna otra compresión. En algunas ocasiones una arteria cerebelosa anteroinferior (ACAI) de nacimiento alto o un rizo de esta, o una arteria basilar dolicoesctásica pueden ser las causantes de la compresión9,52. Se ha visto incluso que ambas, la ACS y la ACAI pueden ser las responsables s. En casos excepcionales es la arteria cerebelosa posteroinferior (ACPI) la que comprime al trigémino. Se realiza el cierre de la duramadre "a sello de agua" y se suturan las partes blandas hasta la piel.
En los casos en que no apreciamos una compresión neurovascular o esta es mínima o poco evidente, tenemos la posibilidad a realizar una neuropraxia, la que consiste en una compresión gentil del nervio. Algunos autores optan por la división longitudinal de la raíz mediante el uso microdisectores, mientras que otros prefieren la rizotomía sensitiva parcial, la que consiste en seccionar del tercio inferior de la raíz, respetando su división motora y los fascículos correspondientes a V1 34,42,53–56.
La descompresión neurovascular tiene la gran virtud de ser un procedimiento no destructivo, que provoca alivio del dolor en hasta un 98% de los casos, en un periodo medio de entre 2 a 7 años, con reportes de hasta un 30% a 20 años 34. Presenta una recidiva variable en años y de alrededor de aproximadamente 15%, muy por debajo de las técnicas destructivas, con escaso efecto sobre la función sensitiva y nula afección motora (tabla 2).
La falla de la DMV y la recidiva han sido atribuidas a varias causas: 1. Compresiones múltiples o mixtas – arterial y venosa – de una misma raíz; 2. neoformación y/o nuevas dilataciones venosas originando una nueva compresión; 3. antecedentes de procedimientos percutáneos previos; 4. ausencia de compresión vascular a la exploración; y 5. casos con una evolución prolongada, generalmente > de 8 años de evolución2,3,13–16,20,23,26,39–41,54,55,57,58. No existe un criterio definitivo en la decisión de cual es el mejor procedimiento en casos de recidiva. Janneta reporta hallazgos de hasta un 98% de nuevas compresiones en pacientes reintervenidos, por lo tanto justifica la reexploración de la fosa posterior con una nueva DMV. Otros autores; sin embargo, coinciden en que la compresión nueva es un hallazgo poco común, con un porcentaje que varía desde una 10 a 46%, en diversas series, por lo tanto es la tendencia en muchos centros el mundo el decidir por el manejo percutaneo en estos casos prescindiendo de la re–exploración quirúrgica 53. Nosotros estamos de acuerdo con la reintervención de los pacientes porque no solamente podemos tratar nuevas compresiones, si no que además podemos proceder a la neuropraxia o, como último recurso, a la rizotomía sensitiva parcial.
La morbilidad es más frecuente que en las técnicas percutáneas. El déficit auditivo, que por lo general es reversible, ocurre debido a errores en la técnica, generalmente por la utilización excesiva de retractores o manipulación innecesaria del complejo nervioso VII/VIII. Algunos autores aconsejan el registro de potenciales evocados de tallo durante el procedimiento quirúrgico, para tratar de disminuir esta última complicación34. La fístula de LCR debe evitarse con un cierre adecuado de la duramadre y de las partes blandas, y una vez que ocurre, se deberá tratar con antibióticoterapia profiláctica – para evitar la meningitis bacteriana –, colocación de un drenaje subaracnoideo lumbar y la administración de un diurético inhibidor de la anhidrasa carbónica o de asa.
Los hematomas ya sean subaracnoideos o intra parenquimatosos, los infartos y edema cerebeloso o del tallo son muy infrecuentes, y son consecuencia de una manipulación inadecuada. Una complicación también infrecuente es la presencia de neumoencéfalo, el que por lo general es leve o moderado y se trata con reposo estricto en decúbito dorsal, desapareciendo en 24 a 72 horas. La cefalea posoperatoria es transitoria y se puede deber a neumoencéfalo o hipolicuorraquia. Se ha descrito una mortalidad que va de 0 a 1.4% en distintas series (tabla 2); no obstante, en una extensa y adecuada revisión recientemente publicada por Ashkan y Marsh, la mortalidad oscila en un 0.4% 34 tabla 3.

En conclusión, la DNV es efectiva porque respeta la función nerviosa, trata la causa del problema, provee de un alivio inmediato y duradero con bajo índice de recaídas, y que a pesar de presentar un mayor porcentaje de complicaciones sobre las otras técnicas, en manos entrenadas estas disminuyen y son transitorias. Además, en casos de recidiva o de sospecha de movilización del material protector, el paciente puede ser reintervenido 2,3,6,7,14–16,23,36,39,41,53
Técnicas percutáneas. En general y en la actualidad, en muchos centros neuroquirúrgicos en el mundo se han dejado las técnicas percutáneas como elección en casos que el paciente no desee la técnica abierta, en tumores irresecables, en la esclerosis múltiple y bajo riesgo quirúrgico elevado o una expectativa de vida menor a 5 años 2.
Rizotomía trigéminal percutánea por radiofrecuencia (RTPR): desde los trabajos de Letcher y Goldrin, se postuló que las fibras nocioceptivas (A–delta y C) responden de manera selectiva al calor, más no las fibras mielínicas (A–alfa y A–beta). No obstante, que estudios histopatologicos han demostrado que este efecto no es realmente selectivo, las observaciones clínicas respaldan la teoría. Por lo tanto Kirshner, en 1932, inició la electrocoagulación del ganglio de Gasser, pero con el problema básico de una ausencia de control sobre la temperatura aplicada, hasta que White y Sweet perfeccionaron y retinaron la técnica con control mediante radiofrecuencia de la temperatura y una localización más precisa de la lesión2,59–64.
El procedimiento se realiza en la sala quirúrgica o de angiografía, con el paciente en decúbito dorsal, con la cabeza en posición neutra, sedado y premedicado con atropina a dosis de 0.4 mg aplicados IM para prevenir bradicardia. Se introduce una aguja hipodérmica conectada e un electrodo de referencia o tierra en la región deltoidea del paciente. Se toman como referencia tres puntos: 1. 3 cm anterior al conducto auditivo externo, 2. en el párpado inferior a altura de la línea medio pupilar, y 3. 2.5 a 3 cm lateral a la comisura labial. Los primeros dos puntos nos orientan respecto a la localización del foramen oval en la base del cráneo, y en el último es el punto por donde penetrará la aguja. El segundo y tercer dedos de la mano del cirujano se introducen en la boca del paciente y se colocan por debajo de la apófisis pterigoides del esfenoides y se dirige la aguja hacia la porción posterolateral del foramen oval, siempre bajo visualización fluoroscópica. En la mayoría de los casos esta penetración se acompaña de una ligera contracción del masetero. Se tomará una placa radiográfica lateral para visualizar la punta de la aguja. Se trazan dos líneas que se encuentran, una que sigue al piso de la silla turca y otra que sigue el borde del clivus, la punta de la aguja deberá localizarse a 5 o 10 mm de la intersección de ambas sobre la línea que sigue al clivus a nivel de la cisterna trigeminal. Se debe evitar la canulación de la hendidura esfenoidal en sentido antera superior y el foramen yugular en sentido infero posterior. La carótida interna también debe ser evitada. Después se introduce el electrodo, preferentemente de punta curva de Tew, que se proyecta de 5 a 8 mm más allá de la punta de la línea del clivus, una mayor proyección puede terminar en una lesión del 6to. nervio craneal. Por lo tanto el electrodo se localizará en la porción retrogasseriana y aquí se puede realizar un registro electrográfico que se demuestra como ondas cuadradas de 100 a 400 mV de 50 a 75 Hz y de 1 Ms de duración. La rotación medial del electrodo actúa sobre las fibras de V2 y la rotación lateral sobre V3.
Entonces se inicia la electrocoagulación a 60° C durante 60 segundos, y se evalúa con frecuencia la cercanía de la desaparición del dolor, realizando incrementos de temperatura de 5 grados con 90 segundos de duración. El éxito por lo general se alcanza cuando la rama afecta alcanza una hipoalgesia densa y que el tacto corneal o de las otras ramas del trigémino se hayan preservados. La función sensitiva y motora debe ser siempre evaluada y registrada. Una vez finalizado el procedimiento, el paciente puede ir a su casa.
En un análisis de algunas series de RTPR se puede observar que el > 90% de los pacientes alcanzan alivio excelente o bueno del dolor durante 9 años, pero la recidiva supera el 20%, con una afección sensitiva alta (un poco menor del 100%). Los efectos más desagradables son la anestesia corneal , la anestesia dolorosa y las alteraciones de la raíz motora (tablas 4 y 5)3–5,65–69. Entre las complicaciones infrecuentes se pueden apreciar meningitis, la fístula carótidocavernosa, e isquemia cerebral por punción y lesión de la carótida interna. Sweet reporta una mortalidad de 0.2% en una serie de 8 000 casos 45.


Microcompresión trigeminal percutánea con balón (MTPB): Mullan y Lichtor (1983) propusieron esta técnica basados en trabajos previos de Taarnhóf (1952) y Shelden (1955), quienes observaron que la compresión de la raíz o de sus ramas alivia el dolor con poca o sin pérdida sensitiva 65,67,70,71.
La MTPB se realiza en quirófano o en la sala de angiografía con el paciente orointubado y bajo anestesia general. Cabe anotar que, a diferencia de la RTPR, no se premédica con atropina, ya que esta droga bloquea el efecto depresor de la compresión trigeminal, que en este caso en un indicador de una compresión adecuada. Se coloca al paciente en decúbito dorsal con la cabeza extendida. Se introduce un trocar No. 14 con mandril hacia el foramen oval por la misma vía y técnica descrita para la RTPR, siempre bajo visión fluoroscópica y con toma de placas con proyección lateral, de Cadwell y de Waters para confirmar la situación precisa. El mandril se utiliza para evitar la canulación inadecuada de elementos vasculares de la fosa pterigomaxilar, principalmente de la arteria meníngea media. La punta del trocar no debe de sobrepasar la línea del clivus. Se retira el mandril, en ocasiones se obtiene LCR, cosa que no es muy recomendada, e inmediatamente se introduce un catéter de Fogarty No. 4 con su estilete, denotando cierta resistencia, se retira el estilete y mediante el uso de una jeringuilla de tuberculina se instila medio de contraste sin diluir, insuflando progresivamente el balón hasta su capacidad máxima (0.75 cc). Durante la insuflación se debe evitar el desplazamiento del catéter hacia el poro trigeminalisy por ende al ángulo ponto–cerebeloso. En este paso se deben realizar nuevas tomas radiográficas donde se apreciará una morfología típica a manera de "pera", además, se registrará bradicardia refleja. Se mantiene la compresión durante aproximadamente un minuto, luego se desuflará e insuflará nuevamente el balón varias veces hasta tener la sensación de haberse vencido la resistencia que inicialmente ofrece el ganglio de Gasser. Se retira el catéter desinflado, y posteriormente el trocar. Puede existir la salida de LCR a través del trocar. Una vez terminado el procedimiento se debe comprimir la zona de punción durante varios minutos para evitar hematomas retrofaríngeos. El paciente será despertado y permanecerá en vigilancia por lo menos durante 24 horas.
El alivio del dolor se encuentra alrededor del 90%; sin embargo, la recidiva supera el 20%, con trastornos sensitivos faciales perdurables que también superan ese porcentaje. Son secuelas importantes, la anestesia dolorosa y la anestesia corneal (tablas 4 y 5). La MTPB se acompaña de un porcentaje alto de alteraciones motoras (alrededor de un 60%) 65,67,70–72.
Rizolisis retrogasseriana percútame a con glicerol (RRPG): Hakanson introdujo esta modalidad terapéutica en 1981, sobre los conocimientos ya aplicados anteriormente de los efectos de desmielinización y axonolisis del glicerol inyectado de manera periférica en las ramas del 5to. nervio craneal para el manejo de la NT68'73'74.
El paciente es premedicado con atropina y anestesia local, y la técnica percutánea para llegar al foramen oval es similar a la que se describe para la RTPR y la MTPB. Se utiliza una aguja espinal # 20. Una vez que se obtiene LCR, se coloca al paciente en posición semisentada, e inmediatamente luego de confirmar mediante visión fluoroscópica la posición adecuada de la aguja se procede a la instilación de 0.5 cc de metrizamida en la cisterna trigeminal. Después se inyectan lentamente de 0.3 a 0.5 cc de glicerol puro estéril. Se debe mantener al paciente en la posición semisentada por un lapso de 3 a 4 horas. Aunque se llega a un alivio del dolor en aproximadamente 91% de los pacientes, la recidiva a 5 años se encuentra alrededor del 80%. Entre las secuelas sensitivas, es menester mencionar la anestesia dolorosa, anestesia corneal, y parestesias y disestesias faciales (tablas 4 y 5) 2,5,72–74. Además, se ha demostrado que el glicerol provoca disminución permanente de la cisterna trigeminal22.
Radiocirugía: Lekssell realizó el primer procedimiento radioquirúrgico para el tratamiento de la NT en 1951, pero no tuvo eco en el mundo hasta que desde 1995 hasta el presente son ya varios los centros que lo practican23,69,75–77. En la actualidad el procedimiento se realiza con el gamma knife o el acelerador lineal con marco de etereotaxia y se ha visto beneficiado por la RM y los avances tecnológicos para alcanzar una localización casi perfecta del isocentro. Aunque aún en discusión y bajo controversias, se tiende a localizar el isocentro de 4 mm en las fibras preganglionares del trigémino, de 3 a 4 mm anterior a la unión del 5to nervio con el puente, y la dosis utilizada en la mayoría de las series va de 50 hasta 90 Gy al primer procedimiento radioquirúrgico 23. Se demostró que dosis de 60 a 65 Gy se asociaron con resultados pobres en lo que respecta el control del dolor, por lo tanto en la actualidad se ha tomado la tendencia de proveer dosis media de 75.6 Gy75,76. Anteriormente se pensaba que la radiación presentaba un efecto selectivo de lesión sobre las fibras nocioceptivas, pero en la actualidad se reconoce que esta acción es no selectiva, por lo tanto actúa tanto sobre las fibras mielinizadas como las poco mielinizadas, provocando degenración axonal y edema 75–77. El tallo cerebral alcanza a recibir alrededor de un 20% del total de la dosis. Las dosis mayores a 90 Gy han demostrado ser contraproducentes, sobretodo en lo que respecta a la función trigeminal sin evocar una significante mejoría respecto a dosis menores 77.
La principal ventaja de la radiocirugía es ser un procedimiento no invasivo. Se ha logrado obtener alivio completo o por lo menos del 50% del dolor entre 75 a 96% de los pacientes; sin embargo, la recurrencia es relativamente alta; aproximadamente 50% a 3 años, con una recidiva a 2 años de 13.6% 23. Los expertos han practicado radiocirugía repetida en algunos casos con recidiva, pero requieren de dosis mayores, alcanzando alivio completo del dolor de apenas 35 a 85% de los casos con una recurrencia de hasta 21% a 2 años de seguimiento. Las complicaciones son los déficits sensitivos faciales tardíos, que pueden ocurrir hasta en un 60% 23,75–77.
Otra limitante importante que se encuentra con la radiocirugía es su costo y la dependencia de tecnología que no se logra en todas partes del mundo, en comparación con la accesibilidad que brindan la DMV y los procedimientos destructivos percutáneos.
Comparación de técnicas: son pocos los estudios metodológicamente correctos y similares unos con otros para poder realizar una adecuada y definitiva comparación de las técnicas en el tratamiento de la neuralgia del trigémino; no obstante, cabe destacar revisiones importantes que nos dan una idea bastante clara de los riesgos y beneficios entre uno u otro método. En la tabla 3 se destacan las complicaciones sensitivas y motoras de una revisión extensa hecha por Taha y Tew entre la DMV y las técnicas percutáneas 62, donde se hacen evidentes las pocas secuelas obtenidas por la primera (tabla 4). En una revisión exhaustiva y excelente, recientemente publicada, hecha por López et al, se concluye que la RTPR por radiofrecuencia alcanza cifras más altas y completas de mejoría, cuando se compara con las otras técnicas ablativas 72 (tabla 5); sin embargo, se subraya que son necesarios estudios metodológicamente bien realizados y con una población mayor para una comparación más fidedigna, sobretodo en lo que respecta a la MTPB y la radiocirugía.
REFERENCIAS
1. Truex RC, Carpenter MB, Mosovich A. La protuberancia. En: Truex RC, Carpenter MB. eds. Neuroanatomía Humana. Buenos Aires: El Ateneo, 1974. [ Links ]
2. Molina–Foncea A, García–Navarrete E, Calvo JC, Sola RG. La descompresión microvascular en el tratamiento de la neuralgia esencial del trigémino. Rev Neurol 1998;27:65–70. [ Links ]
3. Hitotsumatsu Tsutomu, Matsushima T, Inoue T. Microvascular decopression for treatment of trigeminal neuralgia, hemifacial spasm, and glosopharingeal neuralgia: three surgical approach variations: Technical note. Neursosurgery 2003;53:1436–43. [ Links ]
4. Lee SH, Levy El, Scarrow AM, Kassam A, Jannetta PJ. Recurrent trigeminal neuralgia attributable to veins after microvascular decompression. Neurosurgery 2000;46;356–62. [ Links ]
5. Lonser RR, Arthur AS, Apfelbaum RI. Neurosurgical decompression in surgical disorders of cranial nerves V, VII, IX y X. In Schmideck HH, Sweet WH (Eds). Operative neurosurgical techniques. W.B. Saunders Company, Philadelphia, 2000. [ Links ]
6. McLaughin M, Jannetta PJ, Clyde B, Subach B, Comey C, Resnick D. Microvascular decompression of cranial nerves: lessons learned after 4400 operations. J Neurosurg 1999; 90:1 –8. [ Links ]
7. Miles JB, Eldrige PR, Chir M, Haggett CE, Browsher D. Sensory effects of microvascular decompression in trigeminal neuralgia. J Neurosurg 1997;86:193–6. [ Links ]
8. Moller Adage, Verlooy J, Cornelissen M, De Ridder L. Is the root entry/exit zone important in microvascular compresión syndromes?. Neurosurgery 2002;51:427–34. [ Links ]
9. Sola RG, Escosa–Bagé. Descompresión neurovascular de la neuralgia del trigémino causada por dolicoectasia vertebro–basilar. Rev Neurol 2001 ;32:742–5. [ Links ]
10. Hilton D, Love S, Graddidge T, Coakham Hugh B. Pathological findings associated with trigeminal neuralgia caused by vascular compression. Neurosurgery 1994;35:299–303. [ Links ]
11. Greemberg MS. Trigeminal neuralgia. In Greemberg MS Thieme, New York. [ Links ]
12. Golby A, Norbash A, Silveberg G. trigeminal neuralgia resulting from infarction of the root entry zone of the trigeminal nerve: case report. Neurosurgery 1998; 43:620–3. [ Links ]
13. Goh BT, Poon CY, Peck RHL. The importance of rutine magnetic resonance imaging in trigeminal neuralgia diagnosis. Oral Surg Oral Med Oral Pathol 2001; 92:424–9. [ Links ]
14. Revuelta R, Beltran JA. Microcraniectomía asterional. Minima invasión en patología del ángulo pontocerebeloso. Arch Neurocien (Mex) 1996;1:213–5. [ Links ]
15. Barker II FG, Jannetta PJ, Bissonette DJ, Larkins MV, Jho HD. The long term outcome of microvascular decompression for trigeminal neuralgia. N Engl J Med 1996;334:1077–83. [ Links ]
16. Barker FG, Jannetta PJ, Babu RP, Pomonis S, Bissonette DJ, Jho HD. Long–term outcome after operation for trigeminal neuralgia in patients with posterior fossa tumors. J Neurosurg 1996; 84:818–25. [ Links ]
17. Matsuura N, Kondo A. Trigeminal neuralgia and hemifacial spasm as false localizing sings in patients with a contralateral mass of the posterior cranial fossa. J Neurosurg 1996; 84:1067–71. [ Links ]
18. Revuelta R, Juambelz P, Valderrama J, Texeira F. Contralateral trigeminal neuralgia: A new clinical manifestation of neurocysticercosis: case report. Neurosurgery 1995; 37:138–40. [ Links ]
19. Du R, Binder D, Halbach V, Fishbein N, Bárbaro N M. trigeminal neuralgia in a patient with a dural arteriovenous fistula in Meckel 's cave: case report. Neurosurgery 2003; 53:216–21. [ Links ]
20. Broggi G, Ferroli P, Franzini A, Servello D, Dones I. Microvascular decompression for trigeminal neuralgia. Comments on a series of 250 cases, including 10 patients with multiple sclerosis. J Neurol Neurosurg Psychiatry 2000; 68:59–64. [ Links ]
21. Kassian AA. Tratamiento invasivo de las algias faciales. En Clínica del dolor. Edimplas, México, 1999. [ Links ]
22. Burchiel KJ, Konstantin VS. On the natural history of trigeminal neuralgia. Neurosurgery 2000; 46:152–55. [ Links ]
23. Chen JCT, Girvigian M, Greathouse H, Miller M, Rahimian J. Treatment of trigeminal neuralgia with linear accelerator radiosurgery: initial results. J Neurosurg 2004; 101 (S3) :346–50. [ Links ]
24. Kassian A, Godinez N, Ramírez A. Frecuencia de la neuralgia del trigémino en el Hospital General de México. Dol Clin Ter 2004; ll(11):19–23. [ Links ]
25. Burchiel KJ. A new classification for facial pain. Neurosurgery 2003;53:1164–7. [ Links ]
26. Kitt CA, Gruber K, Davis M, Woolf CJ, Levine JD. Trigeminal neuralgia: Opportunities for research and treatment. Pain 2000; 85:3–7. [ Links ]
27. Nicholson B. Gabapentin use in neurophatic pain syndromes. Acta Neurol Scand 2000; 101:359–71. [ Links ]
28. Zakrzewska JM, Patsalos PN. Long. Term cohort study comparing medical (oxcarbazepine) and surgical management of intractable trigeminal neuralgia. Pain 2002;95:259–66. [ Links ]
29. Zakrzewska JM, Lopez BC. Quality of reporting in evaluations of surgical treatment of trigeminal neuralgia: recommendations for future reports. Neurosurgery 2003;53:110–22. [ Links ]
30. Caviedes BE, Herranz JL. Uso de los fármacos antiepilépticos en trastornos no epilépticos. Rev Neurol 2001 ;33:241–9. [ Links ]
31. William P, Cheshire, Jr. Defining the Role for Gabapentin in the Treatament of Trigeminal Neuralgia: A Retropestive Study. Pain 2002; 137–42. [ Links ]
32. Apelfelbaum RI. Surgery of tic doloreux. Clin Neurosurg 1983;31:351–68. [ Links ]
33. Apelfelbaum RI. Microvascular decompression for tic doloreux. Results, in Brackman DE (ed): Neurological Surgery of the Ear and Skull Base. New York, Raven Press, 1982. [ Links ]
34. Ashkan K, Marsh H. Microvascular decompression for trigeminal neuralgia in the elderly: A review of the safety and efficacy. Neurosurgery 2004;55:840–50. [ Links ]
35. Barba D, Alksne JF. Success of microvascular decompression with and without prior surgical therapy for trigeminal neuralgia. J Neurosurg 1984; 60:104–7. [ Links ]
36. Barker II F, Jannetta P, Bissonette D, Jho HD. Trigeminal numbness in tic relief after microvascular decompression for typical trigeminal neuralgia. Neurosurgery 1997; 40:39–45. [ Links ]
37. Bederson JB, Wilson CB. Evaluation of microvascular decompression and partial sensory rhizotomy in 252 cases of trigeminal neuralgia. J Neurosurg 1989; 71:359–67. [ Links ]
38. Breeze R, Ignelzi RJ. Microvascular decompression for trigeminal neuralgia: Results with special reference to the recurrence rate. J Neurosurg 1982; 57:487–90. [ Links ]
39. Cho DY, Chang CG, Wang Y. Failed Microvascular decompression for trigeminal neuralgia. In Schmideck HH, Sweet WH (Eds). Operative neurosurgical techniques. W.B. Saunders Company, Philadelphia, 2000. [ Links ]
40. Mendoza N, Illinwortrh RD. Trigeminal neuralgia treated by microvascular decompression. A long–term follow–up study. Br J Neurosurg 1995; 9:13–19. [ Links ]
41. Premsagar IC, Moss T, Coakham HB. Teflon–induced granuloma following treatment of trigeminal neuralgia by microvascular decompression. J Neurosurg 1997;87:454–7. [ Links ]
42. Sandoval–Balanzario MAS, López–Ortega SJ, Maldonado–León JA, Sandoval–Olivares L. Tratamiento quirúrgico de la neuralgia del nervio trigémino. Gac Méd Méx 2004; 140:405–10. [ Links ]
43. Sindou M, Amrani F, Mertens P. Microsurgical vascular decompression in trigeminal neuralgia: Comparison of 2 technical modalities and physiopathologic deductions–A study of 120 cases [in French]. Neurochirurgie 1990; 36:16–25. [ Links ]
44. Sun T, Saito S, Nakai O, Ando T. Long–term results of microvascular decompression for trigeminal neuralgia with reference to probability of recurrence. Acta Neurochir (Wien) 1994; 126:144–8. [ Links ]
45. Sweet WH, Poletti CE. Complications of percutaneous rhizotomy and microvascular decompression operations for facial pain. In Schmideck HH, Sweet WH (Eds). Operative neurosurgical techniques. W.B. Saunders Company, Philadelphia, 2000. [ Links ]
46. Taarnhoj P. Decompression of the posterior trigeminal root in trigeminal neuralgia: A 30–year follow–up review. J Neurosurgery 1982; 7:14–7. [ Links ]
47. Dahle L, Von Essen C, Kortopoulos H, Ridderheim PA, Vavruch L. Microvascular decompression for trigeminal neuralgia. Acta Neurochir (Wien) 1989; 99:109–12. [ Links ]
48. Kondo A. Follow–up results of microvascular decompression in trigeminal neuralgia and hemifacial spasms. Neurosurgery 1997; 40:46–51. [ Links ]
49. Kondo A. Microvascular decompression surgery for trigeminal neuralgia. Stereotact Funct Neurosurg 2001 ;77:187–9. [ Links ]
50. Piatt JH Jr, Wilkins RH. Treatment of tic doloureux and hemifacial spasm by posterior fossa exploration: Therapeutic implications of neurovascular relationships. Neurosurgery 1984; 14:462–71. [ Links ]
51. Wen KZ, Ting ZS, Gong YZ. Microvascular decompression by retrosigmoid approach for trigeminal neuralgia. Experience in 200 patients. Ann Otol Rhinol Laryngol 1990; 99:129–30. [ Links ]
52. Rhoton AL. The cerebellopontine angle and posterior fossa cranial nerves by the retrosigmoid approach. Neurosurgery 2000; 47:s93–s129. [ Links ]
53. Fernández–Carballal C, García–Salazar F, Pérez–Calvo J, García–Leal R, Gutiérrez FA, Carrillo R. Manejo de la recidiva de la neuralgia del trigémino tras la descompresión microvascular. Neurocirugía 2004; 15:345–52. [ Links ]
54. Kolluri S, Heros RC. Microvascular decompression for trigeminal neuralgia. A five–year follow–up study. Surg Neurol 1984; 22:235–40. [ Links ]
55. Walchembach R, Voormolen JH, Hermans J. Microvascular decompression for trigeminal neuralgia. A critical reappraisal. Clin Neurol Neurosurg 1994; 96:290–5. [ Links ]
56. Klun B. Microvascular decompression and partial sensory rizothomy in the treatment of trigeminal neuralgia: Personal experience with 220 patients. Neurosurgery 1992;30:49–52. [ Links ]
57. Szapiro J Jr, Sindou M, Szapiro J. Prognosis factors in microvascular decompression of trigeminal neuralgia. Neurosurgery 1985; 17:920–9. [ Links ]
58. Yamaki T, Hashi K, Niwa J, Nakagawa T, Nakamura T, Uede T, et al. Results of reoperation for failed microvascular decompression. Acta Neurochir (Wien) 1992;115–7. [ Links ]
59. Eide PK, Stubhaug A. relief of trigeminal neuralgia after percutaneous retrogasserian rhizolisis is dependant on normalization of abnormal temporal summation of pain, without general impairment of sensory perception. Neurosurgery 1998; 43:462–74. [ Links ]
60. Murali R, Rovit RL. Are peripheral neurectomies of value in the treatment of trigeminal neuralgia? An analysis of new cases and cases involving previous radiofrequency gasseriann thermocoagulation. J Neurosurg 1996;85:435–7. [ Links ]
61. Szapiro J Jr, Sindou M, Szapiro J. Prognostic factors in microvascular decompression for trigeminal neuralgia. Neurosurgery 1985;17:920–9. [ Links ]
62. Taha J, Tew JM. Comparision of surgical treatments for trigeminal neuralgia: Reevaluation of radiofrequency rhizotomy. Neurosurgery 1996;38:865–71. [ Links ]
63. Taha JM, Tew JM. Percutaneous rhizotomy in the treatment of intractable facial pain. In Schmideck HH, Sweet WH (Eds). Operative neurosurgical techniques. W.B. Saunders Company, Philadelphia. [ Links ]
64. Van Zundert J, Brabant S, Van de Kelft E, Vercruyssen A, van Buyten JP. Pulsed radiofrequency treatment of the gasserian ganglion in patients with idiopathic trigeminal neuralgia. Pain 2003; 104:449–52. [ Links ]
65. Brown JA, Mullan JF. Percutaneous trigeminal nerve compresión. In Schmideck HH, Sweet WH (Eds). Operative neurosurgical techniques. W.B. Saunders Company, Philadelphia 2000. [ Links ]
66. Jawahar A, Kondziolka D, Kanal E, Bissonette DJ, Lunsford LD. Imaging nerve and pons before and after surgical intervention for trigeminal neuralgia. Neurosurgery 2001; 48:101–7. [ Links ]
67. Lee ST, Chen JF. Percutaneous trigeminal ganglion balloon compression for treatment of trigeminal neuralgia, Part II: result related to compression duration. Surg Neurol 2003; 60:149–54. [ Links ]
68. Linderoth B, Hákanson S. retrogasserian glycerol rhizolysis in trigeminal nauralgia. In Schmideck HH, Sweet WH (Eds). Operative neurosurgical Techniques. W.B. Saunders Company, Philadelphia, 2000. [ Links ]
69. Lopez BC, Hamlyn PJ, Zakrzewska JM. Stereotactic radiosurgery for primary trigeminal neuralgia: state of evidence and recommendations for future reports. J Neurol Neurosurg Psychiatry 2004; 75:1019–24. [ Links ]
70. Brown J, Mcdaniel M, Weaver MT. Percutaneous trigeminal nerve compression for treatment of trigeminal neuralgia: results in 50 patients. Neurosurgery 1993; 32:570–3. [ Links ]
71. Urculo E, Arrazola M, Gereka L, Olasagati V, Olascoaga J, Urcola J, et al. Valoración de la técnica de Mullan en el tratamiento de la neuralgia del trigémino. Rev Neurol 1998; 27:477–84. [ Links ]
72. Lopez BC, Hamlyn PJ, Zakrzewska JM. Systematic review of ablative neurosurgical techniques for the treatment of trigeminal neuralgia. Neurosurgery 2004;54:973–83. [ Links ]
73. Erdem E, Alkan A. peripheral glycerol injections in the analysis of 157 cases. J Oral Maxillofac Surg 2001 ;59:1176–9. [ Links ]
74. Fujimaki T, FukushimaT, Miyazaki S. Percutaneous retrogasserian glycerol injection in the managemant of trigeminal neuralgia: long–term follow–up results. J Neurosurg 1990;73:212–6. [ Links ]
75. Hasegawa T, Kondziolka D, Spiro R, Flickinger JC, Lunsford LD. Repeat radiosurgery for refractory trigeminal neuralgia. Neurosurgery 2002; 50:494–502. [ Links ]
76. Petit JH, Herman JM, Nagda S, DiBiase SJ, Chin LS. Radiosurgical treatment of trigeminal neuralgia: Evaluating quality of life and treatment outcomes. J. Radiation Oncology Biol Phys 2003; 56:1147–53. [ Links ]
77. Pollock BE, Phuong LK, Foote RL, Stafford SL, Gorman DA. High–dose trigeminal neuralgia radiosurgery associated with increased risk of trigeminal nerve disfunction. Neurosurgery 2001; 49:58–64. [ Links ]














