Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de neurociencias (México, D.F.)
versión On-line ISSN 1028-5938versión impresa ISSN 0187-4705
Arch. Neurocien. (Mex., D.F.) vol.10 no.2 Ciudad de México abr. 2005
Artículo original
Activación del área motora primaria mediante RMf posrehabilitación en pacientes con miembro torácico parético, como secuela de enfermedad vascular cerebral
Motor area activation in the rehabilation of patients with arm paresis after stroke
Alfonso Cerrato–Cuadra, Roger Carrillo–Mezo
Instituto Nacional de Neurología y Neurocirugía Manuel Velasco Suárez.
Correspondencia:
Roger Carrillo–Mezo.
Instituto Nacional de Neurología y Neurocirugía.
Insurgentes Sur # 3877. Col. La Fama
14269 México, D.F.
Recibido: 11 febrero 2005.
Aceptado: 31 enero 2005.
RESUMEN
La rehabilitación es una parte básica en el tratamiento de las secuelas de un accidente vascular cerebral (AVC). Un 10% se recupera en su totalidad en forma espontánea y el 10 % no se recupera, 80 % se beneficia con el tratamiento. En el trabajo se presentan los resultados obtenidos en 20 pacientes tratados en el Instituto Nacional de Neurología y Neurocirugía con miembro torácico parético como secuela de un accidente vascular cerebral, usando distintos métodos de terapia.
Palabras clave: paresia pos AVC, métodos de rehabilitación, terapia, resultados.
ABSTRACT
The rehabilitation is a basic aspect of the motor deficit as result of a cerebrovascular disease (stroke). A spontaneous recovery occur in 10% and a 10% do not recover function so 80% are candidates for treatment. We present the techiniques empoyed and results obtained in 20 patients with motor impairment after a stroke. The different treatments and evaluations are presented.
Key words: stroke, motor déficit, evaluation, rehabilitation.
Una rehabilitación adecuada puede mejorar las capacidades funcionales de los supervivientes de EVC, a pesar de la edad y de los déficit neurológicos, disminuyendo el costo de los prolongados cuidados de estos enfermos. Aproximadamente un 80% de los pacientes con secuelas de EVC, puede beneficiarse de una rehabilitación específica. Un 10% de los enfermos consiguen una recuperación espontánea completa de 8 a 12 semanas, mientras que otro 10% no logra beneficio alguno de cualquier tratamiento1.
La mayoría de los pacientes enseñan un déficit motor más severo y persistente, la cual afecta sus actividades diarias en grado variable (Duncan et al, 1992).
La terapia de movimiento inducido forzadamente, ha sido expuesto a ser efectivo en el mejoramiento de la función en individuos con infarto crónico (Liepert et al, 1998, 2000, 2001; Levy, et al 2001). Esta terapia inmoviliza el miembro superior no parético para forzar al sujeto con infarto a usar el miembro superior parético intensivamente durante actividades funcionales. El entrenamiento enfatiza los principios de aprendizaje motor expuesto por Schmidt (1991).
El foco de entrenamiento es en el movimiento de los dedos porque la parálisis de la mano es uno de los más debilitantes problemas funcionales asociado con infarto. (Hummelsheim et al., 1997). La RMf ha sido usado extensivamente para investigar los cambios neuroplásticos en el cerebro siguiendo al infarto. (Cramer, et al 1997, 1999,2000; Cao. et al1998; Marshall, et al 2000).
Benson, et al, en 1997 estudiaron 10 pacientes con infartos corticales, subcorticales, a los que les realizaron tapping de dedos del miembro paretico afectado y después de su rehabilitación observaron que las áreas activadas fueron las mismas en los pacientes controles: área SMC contra lateral, cerebelo ipsilateral, area SMA ipsilateral y SMA contralateral. además de las áreas SMC y PMC ipsilateral y cerebelo contralateral al tapping de dedos. Estos resultados están acorde con trabajos previos de Chollet, et al, y Weiller et al. El más importante hallazgo en este estudio es que la tarea motora produjo una gran SMA y áreas de activación motora del hemisferio no afectado en pacientes infartados2,3.
Laxmi et al., en 1998, concluyeron que la activación ipsilateral es más pronunciada durante los movimientos de los dedos de la mano izquierda que con los de la derecha y que la activación ipsilateral es más prominente en el área premotora que en las regiones central y poscentral, sugiriendo que subregiones alrededor del surco central y en ambos hemisferios podrían tener diferentes roles durante las tareas motoras.
Cuando se usa la mano izquierda no afectada para ejecutar la tarea motora, un patrón unilateral normal de activación es visto en la corteza motora primaria derecha. Cuando se usa la mano derecha parética, para ejecutar la misma tarea motora, muestra un patrón anormal de activación en la corteza motora alrededor del sitio del infarto, como activación colateral anormal de la corteza motora suplementaria bilateral4–6.
Newton, et al en 2002 en un estudio piloto, observaron extensiva activación de M1 ipsitateral, un inicial conocimiento fue que este incremento podría sólo reflejar movimientos inadvertidos en el lado no parético, como también un incrementado envolvimiento de músculos proximales representado bilateralmente. Asimismo, la activación de áreas secundarias motoras en el proceso de recuperación, la SMA contribuye de manera importante al número de fibras directamente al tracto cortico–espinal, formando paralelamente vías descendentes en la cápsula interna, vías que podrían ser suficiente para el control de la función motora después de la lesión a M1.
La recuperación motora durante el periodo temprano después del infarto muestra cambios en la extensión de la activación en la corteza sensorimotora contralateral relativa a esa ipsilateral del movimiento de la mano afectada. En el periodo tardio revela un cambio posterior en el centro de la activación en la corteza sensorimotora contratateral e incrementada activación en la corteza sensorimotora ipsilateral, corteza prematora ipsilateral, área motora suplementaria bilateral y la región preinfarto en casos de infartos corticales7,9.
La activación durante el movimiento de la mano de los sujetos control y de la mano no afectada de los pacientes infartados fue predominantemente en el hemisferio contralateral (M1, PMC, SMA y corteza somatosensorial) y cerebelo ipsilateral. Kraft et al., estudiaron 4 pacientes con miembro parético posinfarto y un grupo control sano de 5 pacientes, en los que encontraron los hallazgos antes descritos10.
Jo Jang, et al en 2003", mostraron en 8 pacientes cambios de la activación cortical con significante recuperación motora durante un tiempo de 10 meses, cambios en SMC ocurrió en los 8 pacientes y cambios en áreas motoras secundarias en 5 pacientes que presentaban hemiparesia crónica, estos cambios en SMC fueron: activación bilateral cambió a contralateral en 6 pacientes, no hubo cambio de activación bilateral en un paciente y activación ipsilateral cambio a bilateral en un paciente12,15.
Otros investigadores y en diferentes fechas, han descrito activación del cerebro en recuperación de pacientes hemiparéticos, posterior a la ejecución de determinadas tareas, tales áreas fueron: corteza premotora y sensorimotora contralesional, cerebelo ¡psilateral, área motora suplementaria bilateral y corteza parietal (Chollet, et al 1991; Weiller, et al 1992, 993; Cramer, et al 1997; Seitz et al 1998)16,18.
Kim, et al, en 200319, concluyeron que la terapia de movimiento inducida forzadamente, produjo cambios en la organización funcional del sistema motor después de la lesión cerebral, pero el patrón y área de reorganización fueron dependiente del paciente. En 5 pacientes se les instruyó a una terapia de 7 horas diarias por 2 semanas, realizando tareas lanzando una bola y simulando jockey, actividades motoras finas usando clavija o masilla, actividades generales relacionadas con su vida diaria y tareas al realizar la RMf de cerrar la mano y oposición de los dedos de la mano20,22.
Todos estos resultados describen un considerable rango en el sitio normal de activación de cada tarea. Penfield y Boldrey, reportaron en 126 operaciones de pacientes con epilepsia o tumores, una distribución amplia en el área en la cual la estimulación indujo movimientos de los dedos, extendiéndose 55 mm a lo largo del sulcus central23,27.
Los pacientes con pobre resultado necesitan reclutar más partes del sistema motor primario y no primario, que los pacientes con buenos resultados. Más estudios son necesarios para revelar las condiciones que promueven tales adaptaciones y las condiciones no favorables que podrían impedir esta adaptación.
Es importante conocer si existe diferencia en el patrón de activación cerebral del área motora primaria mediante RMf en pacientes con paresia de un miembro torácico como secuela de infarto cerebral antes y después de recibir rehabilitación con limitación de movimiento inducido, biorretroalimentación y juego de video.
MATERIAL Y MÉTODOS
Los pacientes fueron referidos del departamento de rehabilitación del INNN, previa realización de pruebas para evaluar la recuperación motora entre las cuales están:
Índice de motricidad
Es una evaluación simple de la función motora en los pacientes con hemiparesia, toma en cuenta tres rangos de movimientos en el miembro toráxico que son: la abducción del hombro, flexión de codo y la prensión. En el miembro pélvico evalúa la flexión de la cadera, extensión de rodilla y de tobillo. Todos los rangos de movimientos se evalúan indiferentes a la gravedad y contra resistencia cuando sea posible, otorgándole diversas calificaciones y emitiendo un resultado final que se divide entre 2, en una persona normal la calificación es de 100.
Escala de Ashwort modificada
Evaluación simple de la espasticidad en los pacientes con miembro parético, valorando el tono muscular.
Mini – mental state examination
Se utiliza para detectar daño cognitivo, tiene un 87% de sensibilidad y un 82% de especificidad, para detectar demencia o delirium, evalúa orientación, recuerdo inmediato, atención y cálculo, recuerdo, denominación, repetición, lectura, escritura y la capacidad para copiar figuras.
Escala de Fugl– Meyer
Para evaluar la extremidad superior en cuanto a la actividad refleja, sinergia flexora, sinergia extensora, colocación de la mano a la región lumbar, abducción pura de hombro de 0 a 90a, la actividad refleja normal, movimientos de muñeca y mano, coordinación – velocidad. La calificación es de 66 puntos en una persona sin alteración.
Inventario de Beck de depresión
Prueba para valorar la presencia de depresión, así como la intensidad de depresión en pacientes con diagnóstico psiquiátrico y en población normal, valora tres dimensiones: a. actitudes negativas, b. alteraciones en el funcionamiento, c. quejas somáticas.
Al paciente se le realizó las siguientes tareas motoras (tabla 1):

Biorretroalimentación
Técnica que emplea un equipo electrónico para revelar al individuo, algunos de los eventos fisiológicos normales o anormales, en forma de señales auditivas o visuales, enseñándole a manejar los eventos involuntarios a través de la manipulación de señales desplegadas. Dicha técnica necesita que el paciente tenga un mínimo de comprensión y motivación, por lo que sus objetivos son la preeducación de la orden motora, preeducación de los trastornos cognitivos y luchar contra la espasticidad. Se usará biorretroalimentador U – control TM EMG Home Traiiner Kit fr Thought Tecnology Ltd., manejado con rango de X1.
Terapia de limitación inducida del movimiento:
Se aplicó en el miembro torácico no parético, utilizando un vendaje el 90% de las horas en vigilia (sólo se retiró para bañarse, usar el vendaje durante las horas de sueño), por un periodo de 30 días. El miembro toráxicos no afectado se ¡movilizó en rotación interna y aducción del hombro, flexión del codo de 90°, flexión del carpo, metacarpofalángicas e interfalángicas de 10°, posicionándolo sobre el abdomen del paciente con un vendaje para impedir el uso de la extremidad.
Juego de video
Se utilizó un juego de pong en la computadora, usando una paleta adaptada al mouse, que el paciente pudo sujetar y mover, dicha paleta estuvo fija con unas bandas en brazo, antebrazo, carpo y dedos del paciente. La silla en donde se coloco al paciente tenía una banda cruzada para sujetarlo a través del pecho al respaldo de la misma, evitando movimientos de sustitución con músculos de la cintura escapular o flexores y extensores del tronco. Los pacientes recibieron 12 sesiones de 10 minutos cada una, de 3 veces por semana, precedido de 10 minutos de relajación con el biorretroalimentador para la extremidad superior afectada.
Equipo y protocolos para la adquisición de imágenes
Los estudios de RMf se realizaron en el equipo General Electric Signa 3–0 T, utilizando la modalidad BOLD (blood oxigenation level–dependat), adquiridos en eco planar con técnica de eco de gradientes, potenciadas en T2. Tanto la prueba motora derecha e izquierda tienen los siguientes parámetros: TE de 40 ms., TR de 3000 ms, un FLIP de 90, con 28 cortes axiales continuos, un grosor y espacio de 5x0 mm con un FOV de 24x24, una matriz de 64x64 y un volumen de 100. La última secuencia es volumétrica, SPGR, que nos sirvió para realizar los planos sagital, coronal y axial, con los siguientes parámetros: un TE de 2.1, un TR de 9.2 ms, un TI de 300 ms, un FLIP de 30, un grosor y espacio de 3x0, con un FOV de 22x17, una matriz de 256x192, con 108 cortes y un volumen. El tiempo total de evaluación fue de 5 minutos, alternando periodos de activación (ejecución del paradigma) de 30s, seguidos por periodos de reposo, también de 30s. De esta manera, se tienen 5 periodos de activación y 5 de reposo. La secuencia funcional de 5 minutos está precedida de 12s de calibración del equipo. Las imágenes anatómicas se adquirieron en secuencia fase spin eco, cortes axiales con intervalos y colimación similares a los de la secuencia BOLD.
Paradigma o prueba de activación neuronal
El paciente al llegar al departamento de resonancia magnética, se le explicó ampliamente el procedimiento a seguir, orientándolo sobre el paradigma antes del examen, fuera del gantry.
Dicha prueba consistió en que el paciente realizó movimientos de oposición, tocándose la punta de los dedos con el dedo pulgar de forma consecutiva y en aquellos que no puedan ejecutar este movimiento se hizo tarea de intención del movimiento.
Las indicaciones se hicieron llegar al paciente vía auditiva a través del dispositivo de audio integrado al resonador y que permite la comunicación con el paciente.
Este estudio de RMf se hizo tanto pre y posrehabilitación, con un tiempo de intervalo de 4 semanas, previa firma de consentimiento informado.
Procesamiento de las imágenes de resonancia magnética
Para el análisis de los datos obtenidos durante el estudio de imagen utilizamos el programa Matlab (Math Works Inc. Sherborn MD, USA). Las primeras 4 imágenes adquiridas en cada serie fueron desechadas con el fin de evitar los llamados efectos de la saturación magnética. El programa mencionado permite corregir pequeños movimientos de la cabeza del paciente utilizando minimización no linear y un algoritmo de interpolación cúbica computarizado (Keys 1981). También convierte y rota las imágenes para minimizar la suma de los cuadrados entre cada una de ellas y su promedio, aplicando método de Levenberg–Marquardt (More 1977). Todas las series fueron normalizadas para cada voxel a un promedio de cero y se les aplicó filtro Gaussiano (FWHM= 1.5 voxeles) para suprimir el ruido térmico. Los voxeles fueron también suavizados (proceso llamado "smoothing"). Con máscaras especiales para evaluar cada hemisferio cerebral y determinar el número de voxeles.
El área motora primaria, se definió de acuerdo a las coordenadas de Tailarach, cuyos ejes fueron: x = +/–, 38, y = 26, z = 56.
RESULTADOS
Se incluyeron 26 sujetos, con miembro torácico parético como secuela de enfermedad vascular cerebral mayor de 12 meses de evolución, se excluyeron del estudio a 7 pacientes: 1 por ser de lateralidad zurda, con el fin de homogeneizar la muestra a sujetos solamente con lateralidad derecha, 2 no se realizaron el segundo estudio de RMf y 4 presentaron muchos movimientos durante el estudio, quedando nuestra muestra en 13 sujetos.
De los 13 pacientes estudiados, 4 fueron hombres y 9 fueron mujeres, de 23 a 78 años, una edad promedio de 50 ± 15 años. Todos estos pacientes fueron diestros, 6 (46%) con paresia torácica derecha (4 del territorio de la ACM izquierda y 2 de la ACP izquierda) y 7 (54%) con paresia torácica izquierda (todos del territorio de la ACM derecha), el tiempo de evolución del infarto al momento de realizar el primer estudio de RMf fue de 12 a 72 meses, con un promedio de 31 ± 16 meses, siendo 8 (62%) de tipo isquémico y 5 (38%) hemorrágico.
Del territorio de la ACM izquierda los lugares más frecuentes fueron: giro precentral, tálamo, núcleo lenticular, área temporal también se encontró el cerebelo del lado izquierdo afectado. En el territorio de la ACM derecha fueron: núcleo lenticular, área fronto–temporo–parietal, tálamo y brazo posterior de la cápsula interna.
Los 13 pacientes entendieron y ejecutaron el paradigma motor indicado: ya sea de intención para aquellos que no podían realizar movimientos de los dedos y tapping de dedos de la mano parética, en el primer estudio de RMf 9 pacientes realizaron paradigma de intención y 4 tapping de dedos, en el segundo estudio de RMf 4 pacientes hicieron paradigma de intención y 9 de tapping de dedos.
Con el índice de motricidad pre y posrehabilitación, se observó que 6 pacientes mostraron recuperación de su fuerza y 7 no presentaron variabilidad en el mismo, de los que presentaron mejoría, la mayoría eran infartos de tipo isquémico y solamente uno de tipo hemorrágico presentó cambios en su índice de motricidad, de los 6 pacientes paréticos derechos, 3 (50%) no presentaron mejoría y 3 (56%) pasaron a la siguiente escala de motricidad. Los 7 pacientes paréticos izquierdos, 4 (57%) no hubo mejoría y 3 (43%) avanzaron a la siguiente escala.
Los voxeles activados en el área motora primaria izquierda, al realizar el paradigma motor en los pacientes paréticos derechos fue de 175.33 en promedio, pretratamiento y de 194 en promedio después del tratamiento y de 1196 y 1334.5 voxeles en promedio en el hemisferio izquierdo, pre y postratamiento respectivamente.
Las activaciones en los pacientes con paresia torácica izquierda28, mostraron en el área motora primaria derecha 282 y 209 voxeles en los dos estudios y en el hemisferio del mismo lado fue de 3640 a 2518 voxeles en el pre y postratamiento.
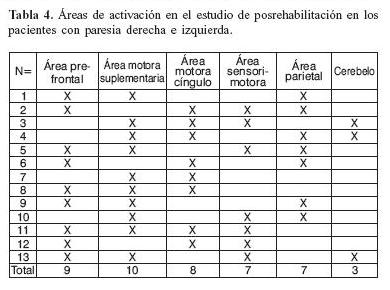
Cabe mencionar que además de la activación del área motora primaria que se estudió, los pacientes presentaron en el estudio postratamiento, activación de otras áreas, entre ellas: 9 pacientes activaron el área prefrontal, 10 el área motora suplementaria, 8 la corteza motora del cíngulo, 7 el área sensorimotora, 7 el área parietal y 3 pacientes el cerebelo.
De 6 pacientes paréticos derechos cuando realizaron el paradigma de tapping mano derecha se identificaron activaciones en el hemisferio izquierdo pero tres de ellos no presentaron activaciones en el área motora primaria. En estos también se identificó que a mayor activación en el hemisferio cerebr41 izquierdo mayor el número de voxeles activados en el área motora izquierda (tabla 2).

En el paradigma de tapping mano derecha no hubo un incremento significativo del número de voxeles activados después de la rehabilitación en el área motora primaria izquierda en el grupo general (gráfica 1).

En el paradigma de tapping mano derecha hubo un incremento del número de voxeles activados después de la rehabilitación en el hemisferio izquierdo
(gráfica 2).
Cuando se realizó el tapping con la mano derecha en pacientes con paresia derecha hubo un incremento significativo en el número de voxeles activados en el hemisferio cerebral izquierdo, esto puede ser explicado por que hubo activaciones del área

prefrontal, del área motora suplementaria, del cíngulo, del área parietal, que se activaron por reorganización de la actividad motora (gráfica 3).
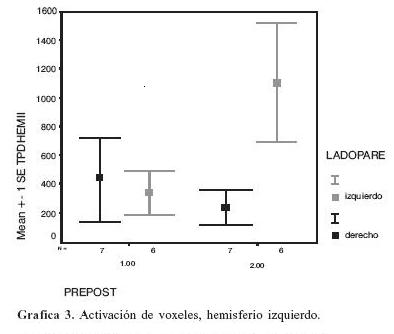
Cuando los pacientes paréticos derechos realizaron el paradigma de tapping mano derecha hubo un incremento significativo en el número de voxeles activados en el área motora primaria izquierda, a diferencia que en pacientes paréticos izquierdos no hubo significancia en la reducción en el número de voxeles activados (gráfica 4).

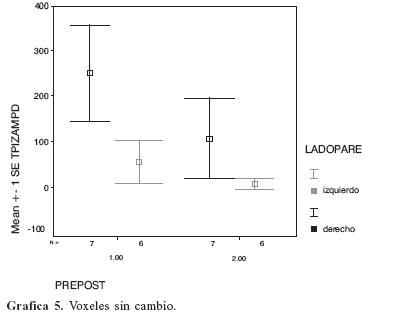
Cuando los pacientes paréticos derechos e izquierdos realizaron el paradigma del tapping mano izquierda no hubieron cambios significativos de incremento o decremento en el número de voxeles activados en el área motora primaria derecha (gráfica 5).
Cuando los pacientes paréticos derechos realizaron el tapping con la mano izquierda, el área motora primaria izquierda tuvo una reducción en el número de voxeles activados y no encontramos una explicación lógica a esto (gráfica 6).

Cuando los pacientes con hemiparesia izquierda realizaron el paradigma de tapping izquierdo no hubo cambios significativos en el número de voxeles activados en el hemisferio derecho después de recibir la rehabilitación (gráfica 7).

DISCUSIÓN
En los pacientes con paresia derecha, al realizar tapping con dicha mano, se observó un incremento en el número de voxeles activados, en el hemisferio cerebral izquierdo, por probable activación de otras áreas motoras secundarias, autores como Chollet, et al 1991; Weiller 1992; Cramer 1997; Seitz 1998, en estudios realizados en pacientes paréticos, mostraron un amplio rango de regiones activadas relacionadas a la tarea realizada (tapping), las cuales fueron: área prefrontal, del área motora suplementaria, del área motora suplementaria del cíngulo, del área parietal y cerebelo, demostrando que en pacientes que han sufrido de infarto hemiparetico, hay significante incremento en las activaciones relacionadas con la tarea, en un número de regiones del cerebro, que son vistas en la población normal ejecutando la misma tarea.
Los pacientes con pobres resultados, son propensos, a reclutar más partes del sistema motor primario y no primario, que pacientes con mejores resultados, Ward, et al, Brown, et al, Thompson, et al, (ADD Neurol 2004; 55:829 – 834 ), que podría sustentar el hecho del incremento significativo del número de voxeles activados en el área motora primaria, cuando los pacientes realizaron tapping del miembro torácico derecho, a diferencia que en pacientes paréticos izquierdos no hubo significancia en la reducción en el número de voxeles activados, hallazgo consistente con numerosos estudios, sugiriendo que la activación de áreas corticales ipsilateral a la mano paretica es importante en el proceso de recuperación después del infarto. (Weiller, et al 1993, Cao, et al 1998).
Después del infarto, hay una temprana y amplio reclutamiento de regiones del cerebro, durante la ejecución de tareas motoras, seguida por una progresiva reducción en este reclutamiento relacionado a la tarea en diferentes sesiones, que se correlacionan con recuperación de los scores en pacientes individuales, (Marshall, et al 2000; Calautti, et al 2001; Feydy, et al 2002). En nuestros pacientes no hubo cambios significativos en el número de voxeles activados en el hemisferio derecho después de recibir la rehabilitación al realizar el tapping con la mano paretica izquierda.
Hay disminución longitudinal en la activación relacionada a la tarea sobre sesiones como una función de recuperación en pacientes con infartos cerebrales. Hay diferencias en los reportes de patrones de activación cerebral relacionadas a tareas en pacientes con infartos tempranos y tardíos. Los primeros describen un incremento en el radio de activaciones de la corteza sensoria motora contralateral e ipsilateral, mientras que en infartos crónicos notaron una disminución en las activaciones de regiones motoras no primarias del hemisferio afectado. (Calautti et al., 2001).
Johansen–Berg (2002) reportó incremento en la activación cerebelar y corteza premotora, en tareas ejecutadas, en dos diferentes sesiones en pacientes con infartos crónicos, respondiendo a terapia modificada de limitación inducida del movimiento. Pacientes con déficit iniciales grandes, reclutan más número de regiones que aquellos con déficit temprano menores (Strick1988).
Hay dos diferentes formas de neuroplasticidad asociado con recuperación del infarto en la mano paretica. El primero es una migración de activación cortical del hemisferio infartado (contralateral) a colonias neurales en el hemisferio ipsilateral. El segundo parece ser una reversión a un control contralateral.
El primero podría estar asociado más con insulto neural y recuperación espontánea y no dependiente a uso intensivo. El segundo parece depender a uso intensivo, indicando que el tiempo desde el inicio del infarto no parece ser un firme factor limitante para la efectividad del tratamiento.
En las tablas 2, 3 y 4, muestra una correlación de la escala del Índice de motrícidad y los voxeles activados, donde hay una estadística significativa de p < 0.03, donde a mayor índice de motricidad, mayor número de voxeles activados en las áreas contralaterales al miembro parético, en este caso del miembro parético derecho con tapping derecho en activación del hemisferio y área motora primaria izquierda.

Al correlacionar el índice de motricidad con cada hemisferio contralateral al miembro parético, no fue estadísticamente significativa, cuando se llevó a cabo una relación de todos los pacientes antes y después del tratamiento; sin embargo, cuando estratificamos en pacientes con hemiparesia izquierda y derecha mediante la chi de Pearson encontramos una significancia de 0.03.
La reorganización cerebral contribuye a recuperación funcional después del infarto, pero esto esta claro que requerimos un detallado recordatorio del proceso y los factores que influencia esto, antes de poder utilizar tal información para racionalizar estrategias terapéuticas en grupos de pacientes individuales.
CONCLUSIONES
En estas pacientes paréticos derechos que únicamente recibieron 4 semanas de rehabilitación, con biorretroalimentación, limitación del movimiento inducido y juego de video, hubo un incremento en el número de voxeles activados en el hemisferio izquierdo, producido por una reorganización de la corteza cerebral.
En las tablas 2, 3 y 4, en la que hay una correlación entre el índice de motricidad y el número de voxeles activados en el hemisferio y area motora primaria izquierda, en pacientes con paresia derecha y que además realizaron tapping de la misma mano, pre y posrehabilitación de 4 semanas de duración, donde a mejor escala en el índice de motricidad, mayor número de voxeles activados.
El índice de motricidad no fue estadísticamente significativo, cuando llevaron a cabo una relación de todos los pacientes antes y después del tratamiento; sin embargo, cuando estratificamos en pacientes con hemiparesia izquierda y derecha, mediante la chi2 de Pearson, encontramos una significancia de 0.031.
Este estudio sirve de base para que se realicen otros estudios, donde se podría tomar una muestra homogénea de pacientes con paresia derecha o izquierda, aumentando los casos y tener una muestra con significancia estadística.
Además de que se podrían estudiar pacientes con lateralidad zurda y que presenten paresia izquierda, para hacer una correlación con los pacientes diestros y paresia derecha de nuestro estudio.
AGRADECIMIENTO
Se agradece el apoyo para la elaboración de este trabajo a: Eduardo Flores, José Gavito, Marisela Carrillo, Ron heder, Perla Salgado y Maritza Pacheco.
REFERENCIAS
1. Jang SH, Kim YH, Cho SH, Lee JR Park JW, Kwon YH. Cortical reorganization induced by task–oriented training in chronic hemiplegic stroke patients. Neuroreport 2003;20(14):137–41. [ Links ]
2. Hutchinson S, Kobayashi M, Horkan CM, Pascual–Leone A, Alexander MP, Schlaug G, Age–related differences in movement representation. Neuroimage 2002;17(4):1720–8. [ Links ]
3. Schaechter JD, Kraft E, Hilliard TS, Dijkhuizen RM, Benner T, Finklestein SR et al. Motor recovery and cortical reorganization after constraintinduced movement therapy in stroke patients: a preliminary study. Neurorehabil Neural Repair 2002;16(4):326–38. [ Links ]
4. Newton J, Sunderland A, Butterworth SE, Peters AM, Peck KK, Gowland PA. A pilot study of event–related functional magnetic resonance imaging of monitored wrist movements in patients with partial recovery. Stroke 2002;33(12):2881–7. [ Links ]
5. Jang SH, Han BS, Chang Y, Byun WM, Lee J, Ahn SH. Functional MRI evidence for motor cortex reorganization adjacent to a lesion in a primary motor cortex. Am J Phys Med Rehabil 2002;81 (11):844–7. [ Links ]
6. Cramer SC, Mark A, Barquist K, Nhan H, Stegbauer KC, Price R, Bell K. Motor cortex activations is preserved in patients with chronic hemiplegic stroke: Ann Neurol 2002:52(5):607–16. [ Links ]
7. Johansen–Berg H, Rushworth MF.Bogdanovic MD; Kischka U; Wimalaratna S, Matthews. The role of ipsilateral premotor cortex in hand movement after stroke. Proc Nati Acad Scie U.S.A. 2002:99(22):14518–23. [ Links ]
8. Thirumala P, Hier DB, Patel R Motor recovery after stroke: lessons from functional brain imaging. Neurol Res 2002:24(5):453–8. [ Links ]
9. Cramer DC, Nelles G, Schaechter JD, Kaplan JD, Finklestein SP, Rosen BR. A functional MRI study of three motor tasks in the evaluation of stroke recovery. Neurorehabil Neural Repair 2001;15(1):1–8. [ Links ]
10. Alkadhi H, Kollias SS, Crelier GR, Gotay X: Hepp–Reymond MC, Valavanis A. Plasticity of the human motor cortex in patients with arteriovenous, malformations: a functional MR imagining study. AJNR Am J Neuroradiol 2000:21(8):1423–33. [ Links ]
11. Miyai I, Suzuki T, Kang J, Kubota K, Volpe BT. Middle cerebral artery stroke that includes the premotor cortex reduces mobility outcomes. Stroke 1999:30(7): 1380–3. [ Links ]
12. Cramer SC, Finklestein SP, Schaechter JD, Bush G, Rosen BR. Activation of distinct motor cortex regions during ipsilateral and contralateral finger movements. J Neurophysiol 1999:8(1):383–7. [ Links ]
13. Beltramello A, Cerini R, Puppini G, El–Dalati G, Viola S, Martone E, et al. Motor representation of the hand in the human cortex: an f–MRI study with a conventional 1.5 T clinical unit. Ital J Neurol Scie 1998:19(5):277–84. [ Links ]
14. Seitz RJ, Hoflich P, Binkofski F, Tellmann L, Herzog H, Freud HJ. Role of the premotor cortex in recovery from middle cerebral artery infaction: Arch Neurol 1998:55(8):1081–8. [ Links ]
15. Kawashima R, Matsumura M, Sadato N, Naito E, Waki A, Nakamura S, et al. Regional cerebral blood flow changes in human brain related to ipsilateral and contralateral complex hand movements–a PET study. Eur J Neurosci 1998;10(7):2254–60. [ Links ]
16. Silvestrini M, Cupini LM, Placidi F, Diomedi M, Bernardi G. Bilateral hemispheric activation in the early recovery of motor function after stroke. Stroke 1998:29(7):1305–10. [ Links ]
17. Singh LN, Higano S, Takahashi S, Abe Y, Sakamoto M, Kurihara N, et al. Functional MR imaging of cortical activation of the cerebral hemispheres during motor tasks. AJNR Am J Neuroradiol 1998:19(2):275–80. [ Links ]
18. Kim YH, Jang SH, Chang Y, Byun WM, Son S, Ahn SH. Bilateral primary sensorimotor cortex activation of post–stroke mirror movements: an fMRI study. Neuroreport 2003:14(10):1329–32. [ Links ]
19. Cramer SC, Nelles G. Benson RR, Kaplan JD, Parker RA, Kwong KK, et al. A functional MRI study of subjects recovered from hemiparetic stroke. Stroke.1997:28(12):2518–27. [ Links ]
20. Scholosser MJ, McCarthy G, Fulbright RK, George JC, Awad IA. Cerebral vascular malformations adjacent to sensorimotor and visual cortex. Functional magnetic resonance imaging studies before and after therapeutic intervention. Stroke 1997:28(6):1130–7. [ Links ]
21. Pantano P, Formisano R, Rice M, Di Piero V, Sabatini U, Di Pofi B, et al. Motor recovery after stroke. Morphological and functional brain alterations. Brain 1996:199(6):1849–57. [ Links ]
22. Yelnik A, Bonan I, Debray M, Lo E, Gelbert F, Bussel B. Changes in the execution of a complex manual task after ipsilateral ischemic cerebral hemispheric stroke. Arch Phys Med Rehabil 1996:77(8):806–10. [ Links ]
23. Nudo RJ, Wise BM, SiFuentes F, Milliken GW. Neural substrates for the effects of rehabilitative training on motor recovery after ischemic infarct. Science 1996:272(5269):1791–4. [ Links ]
24. Lee RG, van Donkelaar P Mechanisms underlying funcional recovery following stroke. Can J Neurosci 1995:22(4):257–63. [ Links ]
25. Sabatini U, Toni D, Pantano P, Brughitta G, Padovani A, Bozzao L, et al. Motor recovery after early brain damage. A case of brain plasticity. Stroke 1994:25(2):514–7. [ Links ]
26. Bogousslavsky J. Frontal stroke syndrome. Eur Neurol 1994:34(6):306–15. [ Links ]
27. Luft AR, Waller S, Forrester L, Smith GV, Whitall J, Macko RF, et al. Lesion location alters brain activation in chronically impaires stroke Survivors. Neuroimage 2004:21 (3):924–35. [ Links ]
28. Gómez Fernández, L. Plasticidad cortical y restauración de funciones neurológicas: una actualización sobre el tema. Rev Neurología 2000:31 (8):749–56. [ Links ]














