Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Archivos de neurociencias (México, D.F.)
versão On-line ISSN 1028-5938versão impressa ISSN 0187-4705
Arch. Neurocien. (Mex., D.F.) vol.9 no.4 Ciudad de México Dez. 2004
Artículo original
Factores de risgo asociados a EVC en joven con foramen oval permeable
Risk factors of cerebrovascular event associated to peristent foramen ovale in young people
Yolanda Aburto Murrieta1, Antonio Araúz Góngora2, Luis Manuel Murillo Bonilla2
1 Departamento de Electrofisiología
2 Clínica de Enfermedad Vascular Cerebral Instituto Nacional de Neurología y Neurocirugía.
Correspondencia:
Antonio Araúz Góngora.
Instituto Nacional de Neurología y Neurocirugía.
Insurgentes Sur 3877. Col. La Fama.
14269 México, D.F.
Recibido: 9 marzo 2004
Aceptado: 26 marzo 2004
RESUMEN
Entre los factores de riesgo en personas jóvenes de sufrir un accidente cerebral ( EVC) vascular se encuentra la persistencia del agujero oval. En el Instituto Nacional de Neurología y Neurocirugía se han atendido a 2,870 pacientes con (EVC). La prevalencía del foramen oval es una causa de los EVC en jóvenes y puede ser detectado en un 30 a un 50% y puede variar con la edad de 3 a 5 mm y esta presente en un 10% de la población pero no siempre es sintomático o es detectado. En varios casos de existir con una trombosis venosa periférica en otros la explicación es difícil. Se analizan otros factores en el artículo. El tratamiento es aún no uniformemente aceptado.
Palabras clave: accidente vascular trombótico, agujero oval, enfermedad vascular, isquemia cerebral.
ABSTRACT
Among the factors to explain a cerebro vascular accident (CVA) in young people is the persistence of the foramen ovale. At the National Neurological and Neurosurgical Institut 2,870 patients of the this condition were studied. The foramen oval was detected en 30 to 50% of patientes depending of the studies. The size might vary from 3 to 5 mm. About 10% of the population has this condition however not always is detected. When is imptomatic usually is acompanied with peripheral venous thombosis however not all the causes cam be explained. In this article we made a summary of this studies. The tratment is discussed.
Key words: cerebrovascular infarct foramen ovale correlation–studies.
Se conoce como enfermedad vascular cerebral a todos los trastornos en los cuales se daña un área del cerebro en forma permanente o transitoria a causa de isquemia cerebral o hemorragia y en los cuales uno o más vasos sanguíneos cerebrales presentan una alteración primaria por algún proceso patológico.
La isquemia proviene de la disminución del aporte sanguíneo cerebral en forma total o parcial. El daño puede ser funcional; esto es que sólo se altera el metabolismo neuronal sin llegar a destrucción, como los eventos isquémicos transitonos, pero lo más frecuente es que la lesión tisular llegue al infarto cerebral. Del total de los eventos cerebro vasculares, 80 a 90% son infartos cerebrales y 10 al 15% son casos de hemorragia cerebral 1.
En general la enfermedad vascular cerebral (EVC) constituye una de las principales causas de muerte y la principal causa de incapacidad en sujetos mayores de 60 años. En México constituye la 5a causa de muerte después de la cardiopatía isquémica y del cáncer y representa la primera causa de incapacidad en individuos mayores de 40 años 2.
A diferencia de países desarrollados, en los que el control de los factores de riesgo en especial hipertensión arterial, ha influido en la disminución en la tasa de morbimortalidad por EVC; en México, de acuerdo con los registros de la SSA; de entre 1990 y 1998, la mortalidad por EVC ascendió en 27.8% 3.
En estos mismos registros, entre 1996 y 1997 se identificaron 9,705 nuevos casos de EVC, de los cuales 57% correspondió a infarto cerebral (IC), 14% a hemorragia cerebral, 21 % a EVC indeterminado, 6% a isquemia cerebral transitoria, y 2% a hemorragia subaracnoidea (HSA).
La población afectada va de 45 a más de 85 años, con un porcentaje de aproximadamente 28% de afección a población económicamente activa; es decir sujetos de entre 45 y 54 años de edad.
En nuestra Institución, según el registro de vascular cerebral; se ha atendido 2,870 casos de EVC, de los cuales 56% corresponden a infarto cerebral, con un porcentaje importante de casos con edad menor de 54 años lo cual, sugiere que en nuestra población la frecuencia de infarto cerebral en el joven es mayor a la reportada en otras series.
CLASIFICACIÓN DEL INFARTO CEREBRAL
La categorización de subtipos de isquemia cerebral ha tenido considerables estudios. Anteriormente, las clasificaciones han sido basadas primariamente en factores de riesgo, caracteristicas clínicas y datos de imagen cerebral por TC o RM 4 . Aún asi las características clinicas y de imagen no son especificas para algún subtipo en particular de isquemía cerebral.
Bramford et al, reportaron que el EVC recurrente diferia marcadamente por el subtipo del EVC, grandes ínfartos hemisféricos, usualmente secundarios de la oclusión de la arteria carótida interna o de la porción proximal de la arteria cerebral media, tenían peor pronóstico. Estos investigadores clasificaron los EVC basándose en caracteristicas clínicas, en el tamaño y en el sitio de la lesión isquémica, sin considerar la etiología 5 . Así mismo la recurrencia 6,7 es más común entre pacientes con EVC cardioembólico que entre pacíente con EVC de otras causas.
En 1993 se estableció un sistema de clasificación TOAST de EVC isquémico que incluye cinco categorías:
1. Aterosclerosis de grandes arterias.
2. Cardioembolismo.
3. Oclusión de pequeñas arterias (lacunar).
4. EVC de otra etiología determinada.
5. EVC de etiología no determinada.
El diagnóstico se basa en características clínicas y datos reunidos de estudios de imagen, ecocardiografía, doppler de arterias extracraneales, arteriografía y evaluación de laboratorio para estado protrombótico.
En lo que se refiere a cardioembolismo, esta categoría incluye pacientes con oclusiones arteriales secundarias a un émbolo proveniente del corazón. Las fuentes cardiacas potencialmente embolígenas se dividen, de acuerdo con su riesgo de embolismo, en alto y mediano riesgo.
Las fuentes con riesgo alto son; presencia de prótesis valvular mecánica, estenosis mltral con fibrilación auricular, fibrilación auricular no valvular, síndrome del seno enfermo, infarto al miocardio de menos de 4 semanas de evolución; trombo ventricular izquierdo, cardiomiopatia dilatada, segmento ventricular izquierdo acinético, mixoma auricular y endocarditis Infecciosa.
Mientras que las patologías cardiacas con riesgo moderado de embolismo son; prolapso de la válvula mitral, calcificación del anillo mitral, estenosis mitral sin fíbrilación auricular, turbulencia de auricular izquierda (fenómeno de smoke ), aneurisma septal auricular, foramen oval permeable, flutter auricular, doble prótesis biológica, endocarditis no bacteriana trombótica, falla cardiaca congestiva, segmento ventricular izquierdo hipocinétíco e infarto al miocardio de más de 4 semanas de evolución.
Los criterios utilizados actualmente para la identificación de mecanismo de producción cardioembólico, son los propuestos por TOAST, de acuerdo con los cuales se requiere de al menos identificar una fuente cardiaca por ecocardiografía, para establecer el diagnostico de EVC cardioembólico. En los casos de pacientes con fuente cardíaca con riesgo de embolismo intermedío y sin otra causa de EVC, se clasifica como EVC cardioembólico posible. Lo cual sucede en un gran número de casos de sujetos menores de 45 años y con foramen oval permeable 8.
INFARTO CEREBRAL EN JOVEN
La presentación de infarto cerebral en sujetos menores de 45 años, se ha denominado como EVC en joven, lo cual resulta de importancia ya que las causas difieren con respecto a los sujetos con EVC mayores de 60 años y con factores de riesgo identificados para la enfermedad. Aunque algunas causas pueden ser similares a las del paciente no joven, muchas más patologías necesitan ser consideradas en el diagnóstico diferencial.
El EVC Isquémico en adultos jóvenes ha sido considerado un evento relativamente raro, con una frecuencia del 5% 9 , de todos los infartos isquémicos que se presentan en menores de 45 años de edad, aunque más del 10% han sido reportados 10 . Las causas de isquemia entre adultos jóvenes son más diversas que en los no jóvenes y requiere un trabajo de diagnóstico extenso. Avances en tecnología, incluyendo ecocardiografía transesofágica y pruebas bioquímicas consideradas como nuevas, han introducido nuevas causas de isquemia cerebral.
Se ha determinado mediante varios estudios la epidemiología y las causas de ísquemia cerebral en el joven, describiéndose variaciones por grupos de poblaciones pero estableciéndose como principales causas disecciones arteriales, casos cardoembólicos y arteriosclerosis prematura.
La topografía de los infartos cerebrales en adultos jóvenes con isquemia cerebral ha sido ya detallada. La proporción de involucro de territorio vertebrobasilar ha variado del 25% al 34% 11 . La relativa alta proporción de involucro de territorio vertebrobasilar en otros estudios hasta el 41 %, podría ser al menos parcialmente debido al uso extenso de RM.
Los criterios para enfermedad aterosclerótica han variado considerablemente en varios estudios incluyen casos definidos solo por la coexistencia de factores de riesgo para aterosclerosis, lo cual podría explicar porque la aterosclerosis ha sido considerada ser la causa de isquemia del 5% al 50% 12,13.
Usando la clasificación de TOAST, se ha determinado como principales causas de isquemia cerebral en el joven: vasculopatía cervicocerebral, disección vertebrobasilar. aterosclerótica, disección arteria La prevalencia de foramen oval permeable y aneurisma del septo auricular se ha íncrementado en adultos Jóvenes con isquemia particularmente en aquellos pacientes con isquemia no explicada 14,15.
El mecanismo de eventos tromboembólicos en pacientes con alteraciones del septum interaurlcular, no es bien conocido 16. La deficiencia de anticoagulantes naturales como proteina S, proteina C, deficiencia de antitrombina III ha sido rara vez encontrada 17. Por otro lado existen dos recientes estudios prospectivos grandes en el cual la relevancia de anticardiolipinas (aCL) no acontece una proporción significativa como causa de isquemla cerebral en el joven en poblaciones no seleccionadas por lo que ha sido cuestionada 16,19.
Sin embargo, respecto a otras causas hematológicas de isquemia, es posible que el factor V de Leiden, podria ser de interés, aunque si la resistencia a la proteina C activada secundaria a esta mutación causa alteración vascular arterial es todavía contro–versial 20,21.
En resumen las principales etiologías de isquemia cerebral en joven de acuerdo con diferentes series son 22:
1. Enfermedad aterosclerótica de grandes arterias: 21–48%.
2. Arteriopatía no ateroscierótica de grandes arterias (disección arterial espontánea): 10–20%
3. Cardioembolismo: 10–35%
4. Enfermedad de arterias penetrantes: 3–18%
5. Estado protrombóticos: 8–15%
6. Causas mixtas: 4–15% 23
EVC CRIPTOGÉNICO
Aproximadamente el 40% de los infartos cerebrales en el joven no tienen una causa determinada por lo que son clasificados como criptogénicos. A pesar de este elevado porcentaje, la importancia de realizar un estudio completo en el sujeto joven con infarto cerebral, radica en el hecho de que los infartos catalogados como criptogénicos, tienen un riego bajo de recurrencia.
Estos infartos curiosamente comparten características clínicas y por imagen de infartos embólicos, por lo que se ha sospechado que pueden ser causados por estados hipercoagulables no identificados aún o fuentes cardiacas emboligenas, que no logran identificarse por métodos convencionales.
En los pacientes con EVC criptogénico el foramen oval permeable (PFO) puede ser detectado en más del 30 al 50%, este amplio rango de diferencia se debe a que la detección de FOP puede variar de acuerdo a si el estudio ecocardiográfico se realiza en reposo o mediante maniobras de Valsalva.
De acuerdo con los mismos criterios de TOAST, se cataloga como EVC de etiología no determinada cuando existe alguna de las tres condiciones siguientes:
1. Dos o más causas identificadas
2. Evaluación negativa
3. Evaluación incompleta
EVC Y FORAMEN OVAL PERMEABLE
En la población en general. sin infarto cerebral, la prevalencia de FOP, de acuerdo a estudios realizados a partir de 1988 es de entre 10–15% 24 . En estudios de autopsia se ha demostrado que la incidencia de FOP, declina conforme a la edad y el tamaño del mismo se incrementa conforme a la edad; de tal manera que su incidencia en las primeras tres décadas de la vida es del 34.3 % y disminuye al 25.4% de la cuarta a la octava década. El tamaño promedio encontrado fue de 3.4mm en la primera década de la vida, que ascendió a 5.8 mm en la 10° década de la vida 25.
Es evidente de acuerdo con estos datos, que el FOP es un fenómeno relativamente frecuente en población general. Sin embargo, el porque algunos individuos con esta anormalidad desarrollan infarto cerebral, no esta del todo claro. Se ha postulado embolismo paradójico, que puede aplicarse solo un número reducido de casos, en los que existen asociados trombosis venosa periférica, pero en la gran mayoría de casos de infarto cerebral y FOP es difícil explicar el mecanismo que produce el infarto cerebral, tomando como único hallazgo positivo, la presencia de FOP 26–28.
EMBOLlSMO PARADÓJICO
El estudio clásico de embolismo paradójico fue basado en estudios pos morten en 1930 por Thompson y Evans, en el cual se sugirió que el diagnóstico clínico presuntivo de embolismo cerebral paradójico debe ser considerado cuando un paciente tiene uno o más de las siguientes:
1. Evidencia de una fuente para trombosis venosa
2. Una lesión pulmonar que produce incremento en la presión de la aurícula derecha, tal como émbolo pulmonar.
3. Un émbolo arterial sin una fuente aparente izquierda
4. Defecto intracardiaco, que permite un corto circuito de derecha a Izquierda o una fístula arterio venosa pulmonar.
Los criterios actuales para el diagnóstico clínico de embolísmo paradójico son los siguientes:
1. Embolismo arterial cerebro y/o sistémico sin evidencia de fuente circulatoria de lado izquierdo.
2. Aumento de la presión de la auricula derecha aguda émbolo pulmonar y maniobra del valsalva.
3. Trombosis venosa, en especial en adultos jóvenes con causa predisponente: obesidad, reposo prolongado en cama, anaovulatorios y procesos malignos.
4. Corto circulatorio potencial de derecha a izquierda. Cardiaco: foramen oval permeable y defecto septal auricular pulmonar: fistula AV 29.
Sin embargo, debido a evidencia directa para embolismo paradójica es rara en la situación clínica individual, el papel del PFO es aún materia de debate. Esto es debido a que se han realizado diversos estudios en los cuales se ha debatido si el PFO implica ser un factor de riesgo de acuerdo a las características clínicas y de imagen de EVC criptogénico con y sin foramen oval permeable 30 .
Otros estudios no soportan la hipótesis que el embolismo paradójico es el mecanismo primario de EVC en pacientes con foramen oval permeable, aunque la prevalencia de PFO es alta en pacientes con EVC en joven, reportada hasta del 50% y que el EVC en PFO no está asociado con causas definitivas para EVC; lo cual sugiere que el embolismo paradójico podría no ser el mecanismo primario de EVC en pacientes con PFO.
Así como otros estudios han demostrado que el foramen oval permeable con aneurismas del septum auricular, prolapso de la válvula mitral y ausencia de corto circuito identificable de derecha a Izquierda o trombo venoso no se presenta como mecanismo de embolismo paradójico por lo que otro mecanismo podría estar involucrado.
Aunque los pacientes con EVC criptogénico tienen una prevalencia más alta de foramen oval que en paciente con EVC de causa determinada en todos los grupos de edad aun después de corregir la presencia de factores de riesgo reconocidos 31 . Asimismo, la asociación entre PFO e isquemia cerebral podría parcialmente ser explicado por otras anormalidades cardiacas o vasculares asociadas a PFO 32.
Con base en lo anterior, se han estudiado la presencia de otros cofactores, tales como el tamaño del PFO, lo cual podría incrementar la probabilidad de embolismo cerebral paradójico. El volumen del PFO podría ser un factor determinante de la formación de trombo local y tal vez podría afectar el porcentaje de embolismo. Esto podría ser que factores endoteliales cardiacos locales en relación al tamaño del PFO, así como factores hemostáticos locales, particularmente factores hemostáticos local en la superficie del endocardio, influyen en la propensión a formar un trombo inestable y tal vez afectando así el riesgo de EVC embólico 34.
Por tanto se ha establecido que el diámetro promedio de un PFO mayor de 4 mm lleva a un OR de 12 para isquemia cerebral 35 . El diámetro de PFO ha sido fuertemente asociado con el riesgo de tener evidencia de dos o más EVC, sugiriendo que un defecto grande podría facilitar el cruce de material trombótico a la circulación sistémica y cerebral.
La edad es un factor de riesgo para trombosis y el tamaño del foramen oval tiende a incrementar con la edad como ya se mencionó. Tal vez el riesgo de un infarto cerebral embólico podría incrementar sustancialmente con la edad y en asociación con un foramen permeable grande 36.
La coexistencia de aneurisma del septum auricular parece incrementar también, el riesgo de infartos cerebrales. La prevalencia de aneurisma septal auricular es aproximadamente de 1% en la población general y del 8 al 38% en los pacientes con EVC criptogénico, dependiendo de cómo el aneurisma es definido 37,38. Pacientes con PFO y aneurisma septal auricular quienes han tenido un EVC constituyen un subgrupo de riesgo sustancial para EVC recurrente.
Por otro lado, otros factores de riesgo venoso relevantes para tromboembolismo como son resistencia a la proteína C, deficiencia de proteína S, deficiencia de AIII, factor V de Leiden, como condición subclínica trombofílica no se han evaluado en coexistencia al foramen oval permeable y otras anormalidades cardiacas en pacientes con EVC en joven criptogénico.
En la detección del FOP el ecocardiograma transesofágico (ETE) es la prueba más sensible para detectar anormalidades en el septo auricular, principalmente PFO 39,40. El ETE detecta PFO no determinado por ecocardiografía transtorácica 41, puede además determinar el tamaño funcional, dirección del corto circuito y cuantificar el corto circuito interauricular.
Otros métodos útiles para la detección de FOP son, aunque con menor sensibilidad, el ecocardiograma transtorácico y el Doppler transcraneal (DTC), que es capaz de detectar aire o microbúrbujas de contraste que pasan a través de arterias intracraneales 42–48.
Asimismo; se ha estudiado cuando es el momento ideal para la Inyección del material de contraste, y se ha determinado antes de la maniobra de valsalva o tos para determinar las mlcroburbujas a través del PFO y subsecuentemente en las arterias cerebrales medias, ACMs 49.
No se ha establecido al momento la asociación de foramen oval permeable, aneurisma septal y otras anormalidades cardiacas, así como estado trombofílico subclínico en conjunto. La detección de los factores de riesgo asociados que incrementan la incidencia de isquemia cerebral en este grupo de pacientes, se determinará para reducir la recurrencia de EVC isquémico en este grupo de pacientes.
Por lo cual el presente estudio es diseñado para evaluar la frecuencia de otros factores de riesgo que estén significativamente asociados a foramen oval permeable en isquemla cerebral.
MATERIAL Y MÉTODOS
Estudio de casos y controles en el INNN que finalizará en diciembre del 2002. Los pacientes incluidos fueron aquellos estudiados en nuestra institución, con edad menor o igual a 45 años y con infarto cerebral confirmado, de acuerdo con los criterios clínicos y de imagen establecidos por el TOAST y sin evidencia clínica o paraclínica de enfermedad de grandes o pequeño vaso.
A todos los pacientes se les solicitó que acudieran al Instituto Nacional de Cardiología Ignacio Chávez INC para la realización de ETT y ETE, el lNC proporcionó el estudio ecocardiográfico transesofágico a todos los pacientes identifícados previamente con eco cardiografía transtorácica y foramen oval permeable.
Se identificaron además, la presencia de otras anormalidades tales con el ASA, fenómeno de smoke , red de Chiari, y se realizó determinación de procoagulantes, de acuerdo al protocolo establecido para el estudio de infarto cerebral en joven.
Se definieron a los casos como aquellos sujetos con isquemia cerebral y foramen oval permeable demostrado por media de ETT y ETE. Mientras que se tomaron como controles a los pacientes con isquemia cerebral y sin foramen oval permeable.
Asimismo se evaluó el estado trombofílico subclínico tanto en casos como en controles, mediante la determinación sérica de proteína C, proteína S, antitrombina III, factor V Leiden, resistencia a la proteína C activada, anticuerpos antifosfolípidos y anti B2 glicoproteína 1.
Se realizó seguimiento de los casos y controles tratando de determinar la frecuencia de recurrencia, la evolución clínica final, determinada por medio de la escala de Rankin modificada.
Criterios de inclusión
1. Sujetos menores de 45 años de edad con enfermedad vascular cerebral isquémica no atribuida a enfermedad vascular de pequeño y/o grandes vasos.
2. Confirmación de IC de acuerdo con criterios clínicos y de imagen.
3. Aceptación para participar en el estudio.
Definiciones operacionales:
Infarto cerebral: déficit neurológico mayor a 24 hs, sin recuperación y con evidencia con imagen TC de cráneo o RM de cráneo de lesión isquémica.
Síndrome antifosfolípidos: serología positiva, por determinación de IgG, IgM, o anti β 2 glicopo–proteína 1.
Criterios de exclusión
1. Sujetos con factores de riesgo vascular tradicionales (HT AS, DM, dislipidemia, etc.) y evidencia de enfermedad ateroesclerosa de grandes o pequeños vasos.
2. Otras causas de isquemia cerebral tales como disección arterial, o secundario a abuso de sustancias, uso de medicamentos o vasculopatía no atroesclerosa.
RESULTADOS
Se incluyeron 76 pacientes con diagnóstico de EVC y FOP, los cuales fueron comparados con 48 pacientes con diagnóstico de EVC y estenosis mitral (EM) y 46 pacientes con EVC y otras anormalidades cardiacas (OT). En la tabla 1 se enumeran las anormalidades cardiacas encontradas en el grupo de pacientes incluidos en otras anormalidades cardiacas (tabla1).

En la comparación de estos grupos se realizó como prueba estadística ANOVA, teniendo como resultados estadísticamente significativos los antecedentes personales de trombosis venas a y síndrome antifosfolípido en el grupo de EVC + FOP contra EVC + EM, sin diferencia significativa en el grupo de EVC +FOP contra EVC+OT cuadro 1.

En el antecedente de trombosis venosa periférica se obtuvo una significancia estadística con resultado de p= 0.028 para el grupo de FOP vs EM con un OR de 504 (IC95%0.76–33.30). Sin diferencia significativa en el grupo comparado de EVC FOP contra EVC OT. Con el antecedente personal de síndrome antifosfolípido hubo significancia estadística en el grupo de EVC FOP contra EVC EM con p=0.030 con un OR de 8.21 con (IC95% 1.11–60.77), sin significancia estadística en el grupo de FOP contra otras anormalidades cardiacas.
En cuanto a la localización del infarto hubo diferencia significativa en cuanto a la circulación anterior, en el grupo de FOP contra EM con p=0.011 con un OR de 0.32 (IC95% 0.13–0.79); sin diferencia significativa en el grupo de FOP contra otras anormalidades cardiacas.
El Rankin también compartió significancia estadística en el grupo de FOP y EM con una p= <0.001 un OR de 0.22 (IC95%0.10–0.48) en contra de FOP y OT p=0.035 OR 0.44 (IC95% 0.21–0.95). tabla 2.

En un segundo grupo de análisis se incluyeron pacientes sólo con foramen oval permeable FOP sin factor de riesgo asociado con un número de 40 pacientes y un grupo de FOP con factor de riesgo asociado con un número de 36 pacientes.
Los factores de riesgo incluyeron: aneurisma septal, síndrome antifosfolípido, resistencia a la proteína C activada, deficiencia de proteína C, deficiencia de proteína S, anti B2 glicoproteína 1. Sin encontrar diferencias significativas en todas las variables tabla 3.

Otro análisis incluyó EVC con FOP con n= 76 y EVC criptogénico n= 101, encontrando con diferencia estadísticamente significativa nuevamente el antecedente de síndrome antlfosfolípido para el grupo de EVC y FOP con una p= 0.018 con OR 3.27 (IC 95% 118–9.05) tabla 4.
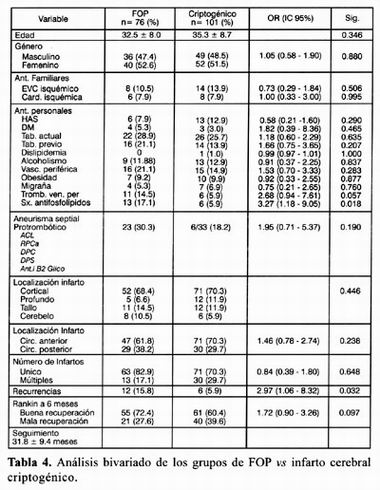
DISCUSIÓN
En la población general, sin infarto cerebral, la prevalencia de FOP es del 10 al 15% 23. La prevalencia de PFO es alta en pacientes con EVC en joven, reportada hasta del 50%.
Es evidente de acuerdo con estos datos, que el FOP es un fenómeno relativamente frecuente en población general. Han sido muy debatidos los factores asociados que podrían incrementar el riesgo en estos pacientes de desarrollar isquemia cerebral. Ya que como mecanismo; el embolismo paradójico, sólo se aplica en un número reducido de casos, en Ios que existen asociados trombosis venosa periférica, pero en la gran mayoría de casos de infarto cerebral y FOP es difícil explicar el mecanismo que produce el infarto cerebral tomando como único hallazgo positivo, la presencia de FOP 25,27. Sin embargo, en nuestro estudio el antecedente de trombosis venosa fue significativamente mayor en pacientes con EVC y FOP en comparación con EVC y estenosis mitral y EVC con otras anormalidades cardiacas con una p= 0,027. Lo que podría implicar la participación como mecanismo el embolismo paradójico.
No obstante, otros factores no se han podido determinar, por lo cual nuestro estudio fue llevado acabo para tratar de explicar algunos otros factores de riesgo asociados con FOP, como mecanismo trombofílico asocíado a deficiencia de anticoagulantes naturales como: deficiencia de proteína S (DPS), proteína C (DPC), resistencia a la proteína C (RPCa), deficiencia de antitrombina III (ATIII), así como mecanismos inmunológicos que indujeran un mecanismo protrombótico como el síndrome antifosfolípido (SAF).
De los 76 pacientes con EVC y FOP, 36 presentaron factor de riesgo asociado, como fue aneurisma septal y mecanismo trombofílico asociado.
En cuanto a la coincidencia de aneurisma del septum auricular parece incrementar también, el riesgo de infartos cerebrales. La prevalencia de aneurisma septal auricular es aproximadamente de 1 % en la población general y del 8 al 38% en los pacientes con EVC criptogénico, dependiendo de cómo el aneurisma es definido 28,29 y también se han definido otras anormalidades septal en pacientes con EVC criptogénico con rangos del 31 al 77% para pacientes con FOP y del 4–25% para aneurisma septal auricular.
Asimismo, otras alteraciones cardíacas asociadas, particularmente aneurisma septal (AS) estuvieron presentes en forma importante en el 44.4% de los 36 pacientes con EVC con FOP y otro factor de riesgo. De nuestros 76 pacientes con FOP y EVC, 36 presentaron FOP y otro factor de riesgo (tabla No. 3) que incluyeron el 44.4% aneurisma septal, 25 % SAF, 25% RPCa, 5.6% DPC, 5.6% DPS.
Concluyendo con este análisis que aunque no es significativo es un fenómeno relativamente frecuente que es necesario investigar en aquellos pacientes con EVC isquémico en joven asociado con FOP, al fin de determinar mecanismo trombofílico asociado.
Por otra parte, en cuanto a los grupos de FOP con y sin factores de riesgo, no hubo diferencias significativas en cuanto a la localización ni a la recurrencia; sin embargo, hubo predominio en circulación anterior para ambos grupos, así como la presentación de infartos fueron únicos, sin diferencia tampoco en recurrencia.
En nuestra serie 16 de 76 pacientes presentaron aneurisma septal y foramen oval permeable constituyendo el 21 %, cifra menor a la previamente citada para la asociación de ambas anormalidades cardiacas, explicada quizá por el número pequeño de pacientes incluidos y porque el grupo de pacientes incluidos en el estudio eran pacientes con el antecedente de EVC criptogénico y en el nuevo evento se determinaron estas anormalidades cardiacas.
Pacientes con PFO y aneurisma septal auricular quienes han tenido un EVC constituyen un subgrupo de riesgo sustancial para EVC recurrente, con un porcentaje anual de recurrencia del 4.4%. Estos datos generando implicaciones pronostícas y terapéuticas potenciales, pacientes jóvenes quienes han tenido un evento isquiémico podrían ser examinados para ambos desordenes septales.
La recurrencia en el grupo de FOP sin otro factor de riesgo fue del 15% y en el grupo de FOP más otro factor de riesgo fue del 16.7%, aunque mayor el porcentaje no hubo diferencia significativa con una p= 0.842 con OR 1.32 (IC 95% 0.33–3.89).
La localización del infarto fue más frecuente en territorio anterior para el grupo de FOP, sin embargo no hubo diferencias significativas en el grupo de FOP sin otro factor de riesgo con 65% contra 58.3% para el grupo de FOP y otro factor de riesgo asociado con una p=0.550 OR 1.33 (IC 95%0.52–336), datos no comparable en otras senes por no ser evaluadas.
En cuanto a la recuperación evaluada por la escala de Rankin a 6 meses, los pacientes con EVC y FOP tienen buena recuperación en contra de los pacientes con EVC y estenosis mitral y EVC y otras anormalidades cardiacas con una p significativa de <0.001; sin embargo, no hubo diferencia significativa en la recuperación en los grupos de EVC y FOP sin factor de riesgo asociado y el grupo de EVC y FOP con factor de riesgo asociada con una p=0.550.
En cuanto al número de infartos, si estos fueron únicos o múltiples tampoco se presentaron diferencias significativas en ninguno de los 4 grupos.
CONCLUSIONES
1. El antecedente de trombosis venosa periférica y síndrome antifosfolípido fue significativamente mayor en el grupo de pacientes con EVC y FOP, lo que sugiere embolismo paradójico como mecanismo de producción.
2. La circulación cerebral principalmente afectada fue la anterior.
3. Los pacientes con EVC y FOP tuvieron una buena recuperación, evaluada mediante la escala de Rankin.
4. El 4736% de los pacientes con EVC y FOP tuvieron algún factor de riesgo asociado.
5. No hubo diferencias significativas entre los grupos de EVC y FOP con y sin factor de nesgo asociado para la circulación afectada, número de infartos, recurrencias ni recuperación evaluada por la escala de Rankin.
6. El tratamiento con anticoagulantes, antiagregantes o cierre quirúrgico del defecto anatómico, no ha sido evaluado y dado a que no se presentan diferencias significativas en ambos grupos de EVC y FOP con y sin factores de riesgo asociado, aún es materia de debate. Se requieren de estudios prospectivos con grupo control de sujetos sanos y FOP.
REFERENCIAS
1. Barinagarrementería F, Cantú C. Enfermedad vascular cerebral. McGraw Hill Interamericana. [ Links ]
2. López–Pousa S, Sánchez E, Canela J. Introducción a la neuroepidemiolgia. Barcelona . 1992. [ Links ]
3. Whisnant JP. Changing incidence and mortalitiu rates for stroke. J Stroke Cerebrpvasc Dis 1992;242–4. [ Links ]
4. Welsberg LA Diagnostic classification of stroke, specially lacunes. Stroke 1988;19:107173. [ Links ]
5. Bamford J, Sandercock P, Dennis M, Burn J. Classrfication and natural history of clinical subtypes of cerebral infarction. Lancer 1991;337:1521–6. [ Links ]
6. Koller RL Recurrent embolic cerebral infarction and anticoagulatíon Neurology 1982;32:283–5. [ Links ]
7. Sage JI, Van Uiter RL, Risk of recurrent stroke in atrial fibrillation and nonvalvular heart disease. Stroke 1983; 14:668–76 [ Links ]
8. Harold P, Adams Jr, Birgitte H, Bendixen, PhD, LJaap Kappelle, José Biller, et al . Classification of Subtype of acute ischemic stroke. Stroke 1993;24:35–41. [ Links ]
9. Hart R, Sherman D, Miller V, Easton JD. Diagnosis and management of ischemic stroke selected controversies. Curr Probl Cardiol 1983;843–53. [ Links ]
10. Bogousslavsky J, Van Melle G, Regli F. The Lausanne Stroke Register: analysis of 1000 consecutive patients with first stroke. Stroke 1988;19:1083–92. [ Links ]
11. Barinagarrementeria F, Figueroa T, Huebe J, Cantu C. Cerebral infarction in people under 40 years etiologic analysis of 300 cases prospectively evaluated. Cerebrovasc Dis 1996;6:75–9. [ Links ]
12. Adams H Jr, Butler M, Biller J, Gilbert J. Nonhemorrhagic cerebral infarction in young adults. Arch Neurol 1986;43:793–6. [ Links ]
13. Hart RG, Miller VT. Cerebral infarction in young adults: a practical approach. Stroke 1983;14:110–4. [ Links ]
14. Cabanes L, Mas JL, Cohen A, Amarenco P, Cabanes PA, Oubary P, et al. Atrial septal aneurysm and patent foramen ovale as risk factors for cryto–genic stroke in patients less than 55 years of age. Stroke. 1993;24:186573. [ Links ]
15. Webster MWI, Chancellor AM, Smith HJ, Swíft DL, Sharpe DN, Bass NM. Patent foramen ovale. Lancet 1988;211–2. [ Links ]
16. Adams HP Jr, Kapelle LJ, Biller J. Gordon OL, Love BB, Gomez F, et al . Ischemic stroke in young adults: experience in 329 patients in the lowa registry of stroke in young adults. Arch Neurol 1995;52:491–5. [ Links ]
17. Muir KW, Squire lB, Alwan W, Lees KR. Anticardiolipin antibodies in an unselected stroke population. Lancet 1994;344:452–6. [ Links ]
18. Montalban J, Rio J, Khamastha M, Oavalos A, Codina M, Swana GT, et al. Value of immunologic testing in stroke patients: a prospective multicenter study. Stroke 1994;25:2412–5. [ Links ]
19. Markus HS, Zhang Y, Jeffery S. Screening for the factor–V arg 506 Gln mutation in patients with TIA and stroke. Cerebrovasc Dis 1996;6:360–2. [ Links ]
20. Van der Bom JG, Bots M, Haverkate F, Slagboom E. Meijer P, de Jong P, et al . Reduced response to activated protein C is associated with increased risk for cerebrovascular disease. Ann Intern Med 1996;125:265–9. [ Links ]
21. Barinagarrementería, Cantú–Brito, De la Peña Izaguirre. Prothrombotic States in young people with idiopathic stroke. A prospective study. Stroke 1994, 287–90. [ Links ]
22. Marc I, Chiowitz. Ischemic Stroke in young. Primer on Cerebro–vascular oisease. Academic Press 1997. [ Links ]
23 Jean–Louis Mas,Mo, Caroline Arquizan, Catherine Lamy, Mathleu Zuber, Laure Cabanes. N Engl J Med , Vol.345 No.24, 2001. [ Links ]
24. Philip T, Hagen, Scholz, William. Incidence and size of patent foramen ovale during the first 10 decades of life: Am aitp'su sitdu pf 965 normal hearts. Mayo Clin Proc 1984;591720. [ Links ]
25. Lechat Ph, Mas G, Lascault, Loron. Tirad, Klimczag Drobinski, Prevalence of patent foramen ovale in patients with stroke. N Engl J Med 1988;318:114852. [ Links ]
26. Webster, Smith, Sharpe, Chancellor, Swift, Bass. Patent foramen ovale in young stroke patients. The Lancet 1988. [ Links ]
27. InfhM, Paradoxical embolism. Am J Med Sci 1938; 196:201–7. [ Links ]
28. Royden Jones,Caplan LR, Swinton , Breslin: Cerebral emboli of paradoxical origen. Ann Neurol 1938;13:314–9. [ Links ]
29 C–Lamy, Giannesini, Arquizan, Meder, Trystram. Clinical and imaging findings in cryptogenic stroke patients with and without patent foramen ovale. Stroke 2002;33:70611. [ Links ]














