Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de neurociencias (México, D.F.)
versión On-line ISSN 1028-5938versión impresa ISSN 0187-4705
Arch. Neurocien. (Mex., D.F.) vol.9 no.4 Ciudad de México dic. 2004
Artículo original
Determinación de infecciones sistémicas por micoplasma en pacientes con esclerosis lateral amiotrófica clínicamente definida
Determination of systemic infections by mycoplasm in patients with amyotrophic lateral esclerosis
Luis Javier Flores Río de la Loza, Graciela Ordoñez Lozano,
Benjamín Pineda Olvera
Departamento de Patología. Instituto Nacional de Neurología y Neurocirugía Manuel Velasco Suárez.
Correspondencia:
Graciela Ordoñez–Lozano.
Departamento de Patología. Instituto Nacional de Neurología y Neurocirugía Manuel Velasco Suárez.
Insurgentes Sur 3877. Col. La Fama.
14269. México, D.F.
Recibido: 27 febrero 2004.
Aceptado: 22 marzo 2004.
RESUMEN
La esclerosis lateral amiotrófica es una enfermedad degenerativa con curso progresivo y fatal. Se estudiaron 75 pacientes en el curso de un año en el Instituto Nacional de Neurología y Neurocirugía usando los anteriores diagnósticos como el escorial. Se tomaron muestras sanguíneas y se práctico prueba de detección del micoplasmas plus. Se encontró una relación entre la infección crónica del micoplasma y la esclerosis lateral amiotrófica, como se ha demostrado en otros estudios. Sin embargo, no existe una relación de casualidad y debe estudiarse más esta situación que por el momento es sólo una asociación.
Palabras clave: esclerosis lateral amiotrófica, micoplasma plus , asociación, enfermedad degenerativa.
ABSTRACT
Amyotrophic lateral sclerosis is a degenerative disease and fatal. We studied 75 pacients in one year at the National Institute of Neurology and Neurosurgery following the escorial protocol. Blood somples were taken to study the prefence of mycoplasma sp. On relaction was foend betwen the infeccion and thi degenerative disease bout not couse effect be demostrated so this. Stuation should be further studied.
Key word: amyotrophic lateral sclerosis, mycoplasma sp, correlation, degenerative disease.
La esclerosis lateral amiotrófica (ELA) es una enfermedad neurodegenerativa caracteriza da por pérdida de las neuronas motoras superiores e inferiores que sigue un curso progresivo con pérdida de la función motora. La enfermedad es casi siempre fatal y, aproximadamente 50% de los pacientes mueren 3 a 4 años después de la presentación de los síntomas 1,2. La ELA es más común en el hombre que en la mujer hasta la edad de 70 años, cuando los rangos se igualan; no obstante, que el pico de presentación es en la quinta década de la vida, la enfermedad puede ocurrir a cualquier edad después de la adolescencia 2,3. La incidencia se calcula en 2.4 casos por 100 mil habitantes por año y se conoce una prevalencia de cinco casos por 100 mil habitantes. No se conoce predilección étnica y la prevalencia es la misma alrededor del mundo.
No existe una prueba sanguínea específica que brinde un diagnóstico inequívoco de ELA, el diagnóstico clínico está basado comúnmente en el resultado del examen físico y neurológico con los cuales se identifican los signos y síntomas de la enfermedad. Debido a que los signos de afectación de la neurona motora superior e inferior pueden estar asociados con otras enfermedades que semejan a la ELA, una parte integral del diagnóstico de ELA incluye el excluir otras posibles causas de la signosintomatología del paciente. De esta forma deben usarse algunas pruebas tales como la electromiografía (EMG), los estudios de neuroimagen, pruebas de sangre, orina, si está indicada, la biopsia de nervio y músculo 4.
Tipos de ELA: no obstante, que esta enfermedad fue descrita por primera vez en 1869 por Jean Martin Charcot en Francia 5 , continúa siendo una enfermedad enigmática. Sin embargo, recientemente como resultado de la intensa investigación durante la década pasada, se han realizado avances significativos que han ayudado a comprender la patogénesis y etiología de la ELA, así como a identificar potenciales estrategías de manejo para esta enfermedad.

Más del 90% de los casos de ELA son clasificados como "ELA clásica", un tipo esporádico de la enfermedad que está caracterizado por una combinación de daño a la neurona motora superior (NMS) y a la neurona motora inferior (NMI) 2 . En el siguiente cuadro se muestran los datos clínicos hallados comúnmente en los pacientes con ELA:
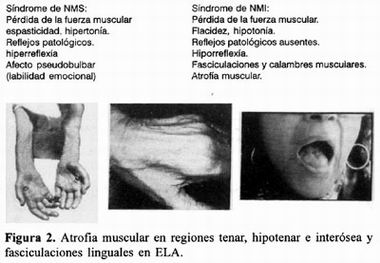
Entre los pacientes con ELA clásica, más de 2/3 inician con los síntomas en las extremidades, 25% tienen una presentación bulbar y entre el 8 y 10% de los casos predominan los datos de NMI. del 5 al 10% de los casos son clasificados como ELA familiar 6 . Una mutación en el Gen que codifica para la superóxido dismutasa de Cobre–Zinc (SOD1) ha sido identificada en 10 a 15% de los pacientes con ELA familiar 8.
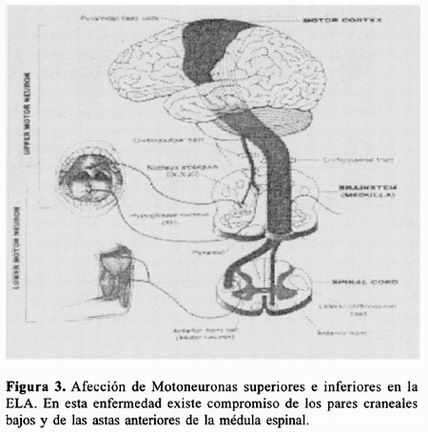
En 1990 se desarrolló El Escorial World Federation of Neurology Criteria for the Diagnosis of Amyotrophic Lateral Sclerosis, como un consenso para documentar de manera precisa el diagnóstico de la ELA y así poder ingresar a los pacientes a estudios clínicos y terapéuticos.
No obstante, estos criterios clínicos son usados también por los clínicos para evaluar a sus pacientes de manera individual, especialmente en aquellos que representan un problema diagnóstico 7.
Diseño del estudio: se realizó un estudio casos y controles durante el periodo de noviembre 2001 a Noviembre de 2002 en el Instituto Nacional de Neurología y Neurocirugía MVS, incluyendo a 75 participantes con las siguientes características:
A) Criterios de inclusión para participantes en el estudio
A1) Pacientes con esclerosis lateral amiotrófica clínicamente definida de acuerdo a los criterios diagnósticos de "El Escorial" World Federation of Neurology, presencia de signos de neurona motora superior e inferior en la región bulbar y en al menos dos regiones espinales o en tres regiones espinales. (12) n= 20 pacientes.
*Las edades deben fluctuar entre 18 a 65 años.
*Pacientes diagnosticados con apoyo en estudios de electrofisiología (EMG y VCN) y neuroimagen (RM de unión cráneo–cervical) que descarten la presencia de otros procesos como causantes de los síntomas, de acuerdo al mismo criterio diagnóstico 7.
*No hay límite en el tiempo de evolución del padecimiento.
A2) Sujetos control: clínicamente sanos, los cuales serán pareados de acuerdo a edad y sexo, y que se obtuvieron del personal del Instituto (académicos y administrativos). n= 55 controles.
B) Criterios de exclusión para participantes en el estudio.
1. Pacientes con ELA familiar.
2. Pacientes con complejo ELA–Parkinson–demencia.
3. Pacientes con ELA de posible origen paraneoplásico o tóxico (Plomo, Mercurio).
4. Pacientes con infección por VIH, SIDA.
5. Pacientes con ELA clínicamente definida que presenten algún proceso séptico activo, comprobado por clínica y estudios de laboratorio y gabinete, tales como neumonía intra o extra–hospitalaria, IVU, vulvovaginitis, gastroenteritis, etcétera.
PROCEDIMIENTOS
A) Toma de muestras: se extrajeron 5 a 10cc de sangre venosa en cada uno de los pacientes con ELA y controles sanos (previa firma de carta de consentimiento informado) los cuales se colocaron en tubos de vidrio con EDTA y se llevaron personalmente al departamento de neuroinmunología del INNN, donde se procesaron para la realización de la PCR.
B) Descripción de la técnica de extracción de DNA y reacción en cadena de la polimerasa.
*Separación de células mononucleares.
Las células mononucleares (CM) se separaron por centrifugación durante 20 minutos a 2000 rpm en gradiente conficol 2ml por cada 5ml de sangre periférica. Se tomó la interfase, se centrífugo 5 minutos a 10,000 rpm, se colectó el botón, se lavó con PBS y se congeló hasta la extracción de DNA.
*Extracción de DNA:
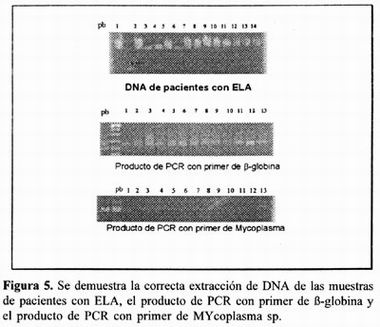
Se resuspendió el paquete de células mononucleares en 886 µl de NaCI 5mM, se le adicionó 46µl de SDS al 10% y se mezcló fuertemente (vortex) por 5 min, se le agregó 308µl de NaCI saturado (7M) y se centrífugo por 20 minutos a 11,000 rpm. Se colectó el sobrenadante y se lavó con: fenol saturado, fenol – cloroformo – alcohol isoamílico y cloroformo alcohol isoamílico independientemente v/v se centrífugo por 10 min a 11,000 rpm en cada caso. Se precipitó el DNA con un volumen de isopropanol, se centrífugo 15 minutos a 11,000 rpm y se lavó con etano al 70% dos veces, se dejó secar a temperatura ambiente y se disolvió en 100µl de agua estéril. Se cuantificó por espectrofotometría a 260nm y se corrió en geles de agarosa al 2% para determinar su calidad.
*Reacción en Cadena de la Polimerasa (PCR) .
La amplificación por PCR fue realizada con una mezcla de 0.5 mM MgCI, 200µM dNTP's, 0.2µM primer, 1 unidad taq polimerasa y 0.6µg de DNA, fue cubierta con 50µl de aceite vegetal. Los primeros para myco–plasma y el control positivo se obtuvieron del kit comercial mycopllasma Plus PCR primer Set N° de catálogo 302008 de Stratagene . Se utilizó DNA de mycoplasma purificado como control positivo de amplificación. Las muestras tanto de pacientes como de controles fueron procesadas de manera ciega.
Para corroborar la integridad del DNA se utilizó el gen β–globina cuya secuencia es ACACAACTGTGTTCACTAGC (nucleótidos 180–199) y GGAAAATAGACCAATAGGCTG (nucleótidos 430–410). Cuarenta ciclos de amplificación fueron realizados en un termociclador (Eppendorf master cycler 5330) en las siguientes temperaturas: 94° C (desnaturalización),50° C (alineación) y 72° C extensión por 1,1 y 2 minutos respectivamente. Previamente se realizó un ciclo a las mismas temperaturas pero diferentes tiempos (dos minutos para cada uno). Para el gen β–globina fueron 23 ciclos a las condiciones arriba mencionadas excepto la temperatura de alineación que fue de 58° C. Para controlar la contaminación se incluyó agua como control negativo.
Los productos de la PCR fueron visualizados en un gel de agarosa al 2% corrido por 1 hr a 100 V en TBE IX y teñido con bromuro de ethidium.
ANÁLISIS DE DATOS
Para el análisis de datos, se utilizó el programa informático SPSS 10.0, realizando estadística descriptiva y se usaron las siguientes pruebas estadísticas:
1. Kolmogorov–Smirnov: Para analizar la distribución de variables.
2. Chi cuadrada de Pearson: para verificar si existe diferencia significativa en sexo entre casos y controles.
3. Prueba exacta de Fisher: para medir significancia estadística en positividad a la prueba de PCR para mycoplasma sp entre casos y controles, así como para verificar si existe significancia estadística entre tipo de presentación de la enfermedad (espinal o bulbar) y positividad a la prueba de PCR para mycoplasma sp en pacientes con ELA.
4. t de student: para conocer si hay diferencia signíficativa en edad entre casos y controles y para conocer si existe diferencia significativa entre la puntuación de la escala ALSFRS y positividad a la prueba de PCR para mycoplasma sp en pacientes con ELA.
5. Prueba de Mann– Whitney: para saber si existe diferencia significativa entre el tiempo de evolución de la enfermedad y positividad a la prueba de PCR para mycoplasma sp.
6. Análisis Estratificado de Mantel–Haenszel: Para controlar el efecto de la variable confusora edad.
CONSIDERACIONES ÉTICAS
Tanto en los pacientes con ELA y en los controles sanos, se llevó a cabo la extracción de sangre venosa (5 a l0cc) por medio de técnica estéril, previa firma de carta de consentimiento informado. Se explicó claramente a los pacientes que es un procedimiento de bajo riesgo que sólo tendría como complicación dolor en el sitio de punción; que se trata de un proyecto de investigación sin costo para él y que los resultados que se obtengan podrían no ser útiles para el tratamiento de su enfermedad y que puede negarse a participar sin consecuencias en su atención en este Instituto.
RESULTADOS
1. Asociación entre esclerosis lateral amiotrofica y mycoplasma.
A) Características epidemiológicas: se incluyeron 20 pacientes con ELA con un rango de edad entre 35 y 82 años y una media de 52.5 años; 55 sujetos control con un rango de edad entre 35 y 60 años y una media de 44.1 años. Se realizaron pruebas de normalidad para conocer la distribución de variables. La curva de distribución de las edades de casos y controles es normal.
Se realizó la prueba t de student para comparar las edades entre ambos grupos, encontrando una desviación estándar de 11.08 para los casos y 6.28 para los controles, lo cual resulta en una diferencia significativa (p=.004).
En cuanto al sexo de los participante, se incluyeron en los casos 12 hombres y 8 mujeres (60 y 40% respectivamente), mientras que en los controles tenemos 29 hombres y 26 mujeres (52.7 y 47.3% respectivamente). Con la prueba de Chi cuadrada de Pearson, se obtiene que no hay diferencia estadística significativa en sexo entre casos y controles (p=. 576).
B) Resultado de PCR para mycoplasma sp en pacientes con ELA y controles sanos.
Después de realizar dicha prueba, se obtuvieron los siguientes resultados:
En los pacientes con ELA, 10 pacientes resultaron positivos (50%) y 10 negativos (50%), mientras que en los controles, tenemos seis pacientes positivos (10.91 %) y 49 negativos (89.09%), y al aplicar la prueba exacta de fisher, se obtiene significancia estadística (p= .001).
Al calcular el riesgo estimado, se obtiene una OR de 8.167 (95%IC 2.4 – 27.6), lo cual indica que el riesgo de padecer ELA siendo positivo a la prueba de PCR para mycoplasma sp. es 8:1 (ver tabla 1).
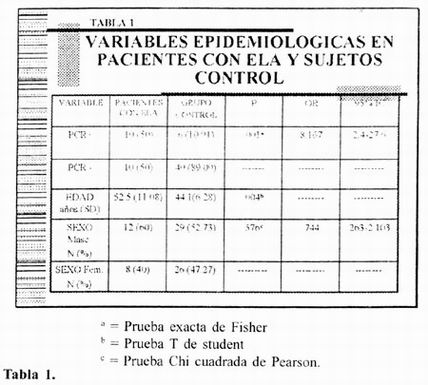
En un momento dado, se puede aseverar, que la diferencia significativa en el resultado de PCR para mycoplasma sp, pudiese estar influenciada por las diferencias de edad entre casos y controles. Para controlar la influencia de la variable edad, se realizó un análisis, estratificado. Calculamos la mediana de edad para los sujetos del estudio, y se obtuvo 45, por lo cual formamos 2 estratos, 1 conformado por sujetos de 45 años o mayores (n=40) y otro con sujetos de 44 años ó menores (n=35).
En el grupo 1 se encontró una p significativa de .029 (prueba exacta de fisher) y un OR de 5.5 (IC 95% 1.2 – 24.5). En el grupo 2, se encontró una p significativa de .026 y un OR de 13.5 (IC 95% 1.5 – 115.9). Finalmente, calculamos el OR ponderado mediante el método de Mantel–Haenszel y lo encontramos en 7.08, por lo cual esta es nuestra medida final de asociación entre ELA y PCR+.
Con esto se demuestra que en ambos grupos de edad, se conserva la significancia estadística y por lo tanto que la diferencia de edades entre casos y controles no anula la asociación encontrada entre ELA y PCR+.
2. Relación entre mycoplasma y severidad de la enfermedad
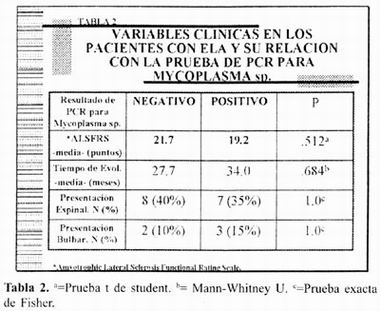
A todos los pacientes con ELA, se les aplicó la escala funcional ALSFRS, que mide el grado de afectación, tomando en cuenta actividades de la vida cotidiana, 10 items, graduados del 0 al 4, siendo 0 la mayor afectación y 4 normal. Dividimos a los pacientes en 2 grupos, los positivos y los negativos a la prueba de PCR para mycoplasma sp, con el fin de encontrar una relación entre severidad de la enfermedad y la presencia de mycoplasma sp. En el grupo negativo a la prueba (10 pacientes –50%–), se obtuvo una media de puntuación de la ALSFRS de 21.7, mientras que en el grupo positivo, la media es de 19.2. Al aplicar la prueba de Kolmogorov–Smirnov, hallamos que la distribución de ambas poblaciones es normal.
Al aplicar la prueba t de student, encontramos que no hay diferencia significativa entre ambos grupos (p=.512). Lo anterior, nos muestra que la severidad de la enfermedad no influye en el resultado de positividad a la prueba de PCR para mycoplasma sp (ver tabla 2).
3.Relación entre mycoplasma y tiempo de evolución de la enfermedad
También se tomaron en consideración los dos grupos anteriores, positivos y negativos a la prueba de PCR para mycoplasma sp, analizando el tiempo de evolución de la enfermedad. Los negativos a la prueba, tuvieron una media de 27.7 meses, mientras que los positivos observaron una media de 34.0 meses. El test de normalidad de Kolmogorov–Smirnov, mostró una distribución anormal (p=.032 para los negativos y p=<.001 para los positivos). Por lo anterior, se realizó la prueba de Mann–Whitney, obteniendo una p=.684, lo que indica que no hay significancia estadística y que el tiempo de evolución de la enfermedad no determina la positividad a PCR para mycoplasma sp. (ver tabla 2).
4. Relación entre mycoplasma y tipo de presentación de la enfermedad
Al considerar también los dos grupos, positivos y negativos, se trató de relacionar este resultado a la prueba con el tipo de presentación o inicio de la enfermedad, en dos categorías, inicio espinal e inicio bulbar. De los 20 pacientes, 15 tuvieron inicio espinal (75%), 8 negativos y 7 positivos a PCR; y 5 inicio bulbar (25%),2 negativos y 3 positivos a PCR. Con la prueba exacta de Fisher, no se obtuvo significancia estadística (p=1.0), lo cual muestra que no existe relación entre el tipo de presentación de la enfermedad y positividad a la prueba de PCR para mycoplasma sp (ver tabla 2).
PRODUCTOS DE LA REACCIÓN EN CADENA DE LA POLIMERASA



DISCUSIÓN
Los resultados obtenidos con este estudio de casos y controles son ampliamente demostrativos de que existe una asociación entre la infección crónica por mycoplasma sp y la esclerosis lateral amiotrófica. Al igual que en otras enfermedades crónicas y degenerativas como la artritis reumatoide, el síndrome de fatiga crónica, fibromialgia, etc. 9, en la ELA parece J haber una relación estrecha con la coexistencia de patógenos tales como mycoplasma sp.
En un estudio piloto realizado con anterioridad en Huntington Beach, California por Nicolson, et al 1 se mostró dicha asociación, sin embargo existen varias diferencias con nuestro estudio. En primer lugar, en el estudio de Nicolson se tomaron dos poblaciones diferentes de pacientes con ELA, civiles y veteranos de guerra (guerra del Golfo Pérsico), siendo la exposición a otras regiones del mundo y en condiciones adversas de supervivencia como lo es un conflicto bélico, un antecedente epidemiológico de consideración y posible factor de sesgo. En segundo lugar, aunque los resultados de ambos estudios son muy similares, difieren en porcentajes, ya que en el estudio mencionado 83% de los pacientes con ELA y <9% de los controles fueron positivos a la PCR para mycoplasma, mientras que nosotros obtuvimos un 50% en los pacientes y 10.9% en los controles. En ambos estudios se obtuvo la misma significancia estadística (p= .001).
Una limitante de nuestro estudio, fue la falta de diferenciación entre especies de mycoplasma. Sabemos que las principales especies de mycoplasma patógenas para el hombre son: M pneumoniae, fermentans, hominis y genitalium 10 . El factor que limitó nuestro estudio fue el no contar con la enzima de restricción Sau3A1, una enzima capaz de diferenciar entre el DNA de las distintas especies de mycoplasma. Hubiera sido interesante conocer la predominancia entre especies de mycoplasma en nuestra población de sujetos positivos y hacer una comparación entre los casos de ELA y los controles.
Son importantes los siguientes fenómenos analizados en este estudio. La relación entre positividad a la prueba de PCR para mycoplasma sp y el estado funcional de los pacientes, que se cuantificó por medio de la escala ALSFRS; el tiempo de evolución de la enfermedad cuantificado en meses y el tipo de presentación de la enfermedad (espinal o bulbar).
En cuanto al primer punto, no hallamos relación estadísticamente significativa entre la puntuación obtenida en la escala y la positividad a la PCR, lo cual indica que el grado de afectación del paciente no determina el presentar o no el fenómeno mycoplasma y por lo tanto no afecta la asociación hallada.
De forma análoga, no se encontró diferencia significativa entre tiempo de evolución de la enfermedad y positividad a la PCR para mycoplasma sp, por lo que concluimos que tanto los pacientes con corta y larga evolución están expuestos por igual a presentar la asociación con la infección crónica de mycoplasma.
Por último, tampoco influye el tipo de presentación de la enfermedad, el 75% de nuestros pacientes con ELA tuvieron presentación espinal y el 25% restante, presentación bulbar, tal y como se describe en la literatura mundial 6–8. No se halló diferencia significativa entre positividad a la PCR y tipo de presentación.
Todo lo anterior, sugiere que la asociación hallada entre mycoplasma sp y la esclerosis lateral amiotrófica, no distingue al variable comportamiento que pudiera tener la enfermedad, es decir, no discrimina la heterogeneidad clínica bien conocida en la ELA. Por ello, debemos de catalogar el fenómeno mycoplasma ELA como una asociación homogénea digna de investigarse más a fondo. Por otro lado, cabe mencionar que no se puede atribuir la presencia de mycoplasma en mayor proporción en los enfermos de ELA que en los controles por cuestiones estacionales o de tiempo, ya que la toma de muestras se realizó en las mismas épocas del año en ambos grupos. El factor lugar también debe tomarse en cuenta, pero prácticamente todos los participantes del estudio pertenecen a comunidades urbanas, por lo tanto dichos factores no influencian los resultados del estudio.
Los mycoplasmas pueden causar daño al sistema nervioso central por varios posibles mecanismos, como producción de superantígenos, estimulación anormal de citocinas como la interleucinados, generación de radicales tóxicos de oxígeno, lesión de diversos órganos e inducción de apoptosis muerte celular programada 1 . Todos los mecanismos anteriores, serían favorecidos por la muy efectiva evasión de la respuesta inmune del hospedero y el sinergismo con otros agentes infecciosos. Por tal motivo, es menester realizar más investigación básica para conocer en sus aspectos más íntimos tales mecanismos y fenómenos.
No se puede determinar con este tipo de diseño si existe una relación causa efecto, sólo podemos probar, como ya se mencionó, una asociación. Hacen falta más estudios, de seguimiento y de investigación básica para conocer el papel exacto de los patógenos intracelulares y las respuestas inmunitarias que despiertan en el hospedero para la producción de enfermedades degenerativas.
REFERENCIAS
1. Lee RJJ, Annegers JF, Appel SH. Prognosis of amyotrophic lateral sclerosis and the effect ofreferral selection. J Neurol Sci 1995;132:207–15. [ Links ]
2. Mitsumoto H. Classification and clinical features of amyotrophic lateral sclerosis. In. Mitsumoto H, Norris FH, eds. Amyotrophic lateral sclerosis: a comprehensive guide to management. New York: Demos Publications 1994;1–19. [ Links ]
3. Rosen AD. Amyotrophic lateral sclerosis. Clinical features and prognosis. Arch Neurol 1978;35:638–42. [ Links ]
4. Mitsumoto H. Diagnosis and progression of ALS. Neurology 1997;48(Suppl 4):S2–S8. [ Links ]
5. Charcot JM. De la sclérose latérale amyotrophique. Prog Med 1874;2:325–327, 3412, 453–5. [ Links ]
6. Mulder DW, Kurland L T, Offord KP, Beard CM. Familial adult motor neuron disease: amyotrophic lateral sclerosis. Neurology 1986;36:511–7. [ Links ]
7. World Federation of Neurology Research Group on Neuromuscular Diseases. El Escorial World Federation of Neurology Criteria for the Diagnosis of Amyotrophic Lateral Sclerosis. J Neurol Sci 1994;124(suppl):96–107. [ Links ]
8. Siddique T, Nijhawan D, Hentati A. Molecular genetic basis of familial ALS. Neurology 1996;47(suppI2):S27–S35. [ Links ]
9. Vojdani A, Franco AR. Multiplex PCR for the detection of Mycoplasma fermentans, M. hominis and M. penetrans in patients with Chronic Fatigue Syndrome, Fibromyalgia, Rheumatoid Arthritis and Gulf War IIIness. J Chronic Fatigue Syndr 1999;5:187–97. [ Links ]
10. Dybvig K, Voelker L. Molecular Biology of Mycoplasmas. Annu. Rev. Microbiol1996;50: 25–57. [ Links ]














