Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de neurociencias (México, D.F.)
versión On-line ISSN 1028-5938versión impresa ISSN 0187-4705
Arch. Neurocien. (Mex., D.F.) vol.9 no.3 Ciudad de México sep. 2004
Reporte de caso
Vertebroplastía percutánea
Percutaneous vertebroplasty
Francisco Gerardo López Espinoza, Andrés Antonio González Garrido
Servicio de Neurología y Neurocirugía del Hospital Civil de Guadalajara. Instituto de Neurociencias. Universidad de Guadalajara.
Correspondencia:
Francisco Gerardo López Espinoza.
Hospital Civil de Guadalajara "Fray Antonio Alcalde" Servicio de Neurología y Neurocirugía. Torre de Especialidades 8° Piso.
Coronel Calderón 777 Sector Hidalgo.
44280. Guadalajara, Jalisco. México.
E–mail: fglopeze@infosel.com
Recibido: 9 junio 2004.
Aceptado: 23 junio 2004
RESUMEN
La vertebroplastía percutánea es un procedimiento de mínima invasión que utiliza una aguja ósea para acceder a un cuerpo vertebral parcialmente colapsado e inyectar cemento óseo, con el objeto de aliviar el dolor, así como estabilizar y reforzar la estructura ósea remanente. Este procedimiento, cuyo uso inicial fue la intervención de hemangiomas agresivos, se emplea en la actualidad para el tratamiento de fracturas vertebrales compresivas secundarias a osteoporosis, linfomas, mieloma y metástasis osteolíticas refractarias a otros procedimientos terapéuticos. Se ha reportado que el procedimiento descrito resulta útil para mejorar la movilización y disminuir e incluso descontinuar el uso de analgésicos, mejorando en consecuencia la calidad de vida de las personas que padecen cualesquiera de estas entidades. Aún cuando no es un procedimiento exento de complicaciones, la adecuada selección de los candidatos y una depurada técnica quirúrgica podrían optimizar los beneficios, respecto a los posibles riesgos de su aplicación.
Palabras clave: vertebroplastía percutánea, fracturas vertebrales compresivas, osteoporosis, enfermedad espinal metastásica.
ABSTRACT
Percutaneous vertebroplasty is a minimally invasive procedure that uses a bonecutting needle to percutaneously approach a partially collapsed vertebral body, to inject bone cement with the aim to relief pain, as well as stabilize and reinforce the remaining bone structure. The procedure was initially used to treat aggressive hemangiomas, myeloma and osteolytic metastases, but it is currently employed either in osteoporotic compression fractures refractory to medical therapy or traumatic fractures. It has been reported that percutaneous vertebroplasty is useful to relieve pain, improving mobilization, and to reduce or even eliminate analgesic drugs requirements, improving so the quality of life. Although this is a nonfree complications procedure, the appropriate patient selection and a thorough technique could make that the benefits surpass the potential risks.
Key words: percutaneous vertebroplasty, spinal compression fractures, osteoporosis, metastasic spinal disease.
La vertebroplastía percutánea (VP) es un procedimiento de mínima invasión consistente en la inyección de un cemento acrílico (polimetilmetacrilato [PMMA]) dentro de la porción esponjosa de un cuerpo vertebral parcialmente colapsado que se realiza con el objeto de proporcionar alivio del dolor y prevenir el colapso vertebral y la seudoartrosis en pacientes con fracturas vertebrales osteoporóticas al incrementar la estabilidad mecánica. Se ha reportado que la VP produce efectos analgésicos y asiste en el fortalecimiento de los segmentos espinales debilitados cuando se utiliza en el manejo de fracturas vertebrales por compresión secundarias a osteoporosis, hemangiomas agresivos, mieloma múltiple focal espinal, quistes óseos aneurismáticos, linfomas, granulomas eosinofílicos, plasmocitomas y metástasis osteolíticas, así como en fracturas traumáticas 1–12.
Cada año, en los E.U.A. se diagnostican más de 700,000 fracturas secundarias a osteoporosis que resultan en 115,000 hospitalizaciones 13 . Las fracturas vertebrales por compresión son las fracturas por fragilidad más comunes, por encima incluso de las fracturas de cadera y muñeca 3,14 . El riesgo de padecer una fractura por compresión de cuerpo vertebral (FVC) es de alrededor de un 16% para mujeres y 5% para los hombres, y se espera un aumento en la osteoporosis de cuatro veces el nivel actual durante los próximos 50 años a nivel mundial 2,11,13 . De estas fracturas, hasta una tercera parte serán sintomáticas y requerirán de algún tipo de manejo médico. Entre las causas de osteoporosis distintas a la de origen posmenopáusica se distinguen: osteoporosis inducidas por corticosteroides, osteoporosis secundaria (enfermedad de Cushing, hipertiroidismo, hipogonadismo) o de causas idiopáticas 12 . Otras causas de fracturas por compresión dolorosas incluyen la invasión maligna de la columna espinal (metástasis, mieloma y linfoma), hemangiomas y la osteonecrosis vertebral. Las fracturas vertebrales postraumáticas constituyen una proporción considerable del total de las FVC's. El tratamiento para las fracturas por compresión ha sido, por mucho, e independientemente de la etiología, conservador y dirigido al control del dolor, consistente por lo general en analgésicos narcóticos (opioides), fisioterapia o reposo en cama y corsés 2,3,13 . Agregado al dolor, puede estar asociada inestabilidad en la columna vertebral 9.
Los regímenes farmacológicos actuales preventivos para la osteoporosis (terapia de reemplazo hormonal, vitamina D, bifosfonatos y calcitonina) con frecuencia se prescriben hasta que la enfermedad ha sido diagnosticada por la presencia de una fractura 3,15 . Las fracturas vertebrales por compresión por lo general permanecen en el espectro subclínico y progresan gradualmente; sin embargo, algunos pacientes desarrollan un síndrome doloroso agudo severo con movilidad limitada y deterioro funcional 12,13.
Las complicaciones de las FVC's son frecuentes e incluyen: íleo transitorio, retención urinaria, trombosis venosa profunda, cifosis, pérdida de peso, trastornos respiratorios o gastrointestinales, problemas emocionales o sociales secundarios al dolor incoercible y pérdida de la independencia 9,16 . Además, la inmovilización acelera la pérdida ósea, que pudiera contribuir a fracturas posteriores. Se ha reportado que el 84% de las FVC's son dolorosas, con duración del dolor en promedio de 4–6 semanas. Un subgrupo de estas FVC's experimentan dolor subagudo o crónico que es refractario al tratamiento conservador 2,3,14.
Los pacientes con FVC osteoporóticas tienen una mortalidad mayor al resto de pacientes de su edad y el doble de posibilidad de fallecer de trastornos respiratorios 3,15 . Se espera que los procedimientos intervencionistas que acortan el tiempo de recuperación y eliminan la necesidad de cuidados largos de rehabilitación deban reducir de manera significativa los altos costos de tratar las fracturas vertebrales osteoporóticas.
La primer vertebroplastía percutánea fue realizada por Deramond, et al en 1984, en Francia, para el tratamiento de un hemangioma doloroso en la columna cervical de una paciente joven 12,17. La vertebroplastía era utilizada anteriormente como adyuvante durante una cirugía abierta para reforzar los cuerpos vertebrales patológicos2.
El dolor debido a una FVC tiene que ver con diversos factores: involucración de terminales nerviosas en el segmento fracturado, los movimientos del mismo y la repetición de microfracturas y la redistribución de fuerzas mecánicas en el segmento afectado. Se ha postulado un mecanismo similar, además de la compresión tumoral de las estructuras nerviosas, como causa del dolor en las fracturas con metástasis vertebrales 17.
DEFINICIÓN
El procedimiento mediante el cual se realiza la vertebroplastía percutánea se define como la inyección de cemento óseo radiopaco (polimetil metacrilato [PMMA]) dentro de una fractura por compresión osteoporótica o traumática dolorosa o de un cuerpo vertebral patológico doloroso (con enfermedad tumoral primaria o metastásica), con guía radiológica 2,13.
La guía radiológica ha sido una parte crítica de la vertebroplastía percutánea desde sus inicios. La mayoría de los procedimientos son realizados con el uso del fluoroscopio para la colocación de la aguja y monitorear la inyección del cemento óseo, aunque también se ha descrito el uso con tomografía computada y opciones distintas al PMMA, como el cemento de fosfato de calcio, sustancia biodegradable desarrollada más recientemente, que combina el uso de fosfato di–,tri– y tetracálcico y sulfato de condroitinsulfato2,18.
INDICACIONES
Debido a que algunos pacientes tienen múltiples fracturas crónicas, debe existir una fuerte correlación entre los signos del examen físico, los síntomas y los hallazgos de imagen3,19,20.
Se ha reportado que la vertebroplastía puede tratar de forma efectiva ciertos tipos de FVC dolorosas y algunas lesiones vertebrales benignas y malignas inestables o dolorosas que fallan en la respuesta a los tratamientos no quirúrgicos tradicionales2,6,21.
La principal indicación para la VP ha sido el tratamiento del dolor de las fracturas por compresión de un cuerpo vertebral osteoporótico o neoplásico, refractarias al tratamiento médico. El candidato ideal para VP se presenta con una fractura de al menos 2 semanas de evolución, con dolor axial en línea media, no irradiado, que se incrementa con la carga de peso y con la palpación manual de las apófisis espinosas en el nivel afectado. El fracaso del tratamiento médico se define por el alivio mínimo o nulo del dolor con la administración de analgésicos, o el alivio adecuado del dolor pero con dosis de narcóticos que producen efectos colaterales indeseables (sedación excesiva e intolerable, confusión o constipación)1,2,13,22.
Se postula que la vertebroplastía resulta útil en pacientes en quienes se anticipa una sobrevida limitada (en el caso de enfermedad espinal metastásica), en candidatos pobres para cirugía, en quienes han recibido dosis de radiación máximas y en aquellos con un colapso vertebral sintomático significativo secundario a una lesión lítica17.
Aún cuando se ha considerado que la edad de la fractura es un factor de pronóstico importante para el alivio del dolor pos–VP y que su máximo beneficio se logra en FVC´s no mayores de 4 meses, se ha demostrado que la VP es una terapia eficaz para el alivio del dolor y la mejoría de la movilidad, independientemente de la edad de la fractura o la duración de los síntomas 23 . Otras indicaciones incluyen a la enfermedad de Krümmell, enfermedad de Paget espinal focal y como adyuvante en las FVC's traumáticas que se someterán a instrumentación de segmento corto con tornillos transpediculares 4,8,13,24 (tabla 1).
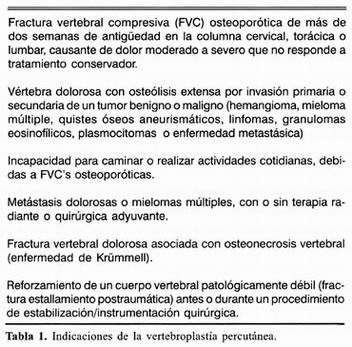
Las contraindicaciones absolutas son las FVC´s asintomáticas, pacientes con mejoría durante el tratamiento médico, como medida profiláctica, infección local o sistémica, fragmentos óseos que invaden el canal espinal y causan mielopatía, invasión al canal espinal por fractura tumoral que causa mielopatía, coagulopatía incorregible y alergia al cemento óseo. Algunas de las contraindicaciones relativas reportadas son: radiculopatía o dolor secundario a compresión no relacionado al cuerpo colapsado, la retropulsión asintomática de un fragmento vertebral, la extensión tumoral asintomática al canal espinal, vértebra plana, fractura que se extiende a la pared vertebral posterior o al pedículo, dolor de más de un año de duración 2,12,25 (tabla 2). También se ha observado una respuesta satisfactoria al utilizar la VP repetida en cuerpos vertebrales previamente tratados cuando ha habido una respuesta parcial o recaída 26 . Las indicaciones y contraindicaciones para la VP podrán cambiar en el futuro conforme se disponga de mayores investigaciones y resultados3.

Se requiere mínimo de 2 semanas (promedio de 3–4 semanas) de manejo oportuno y adecuado del dolor para considerar como fracaso al tratamiento médico 12.
Vertebroplastía en enfermedad espinal tumoral
Aproximadamente 30% de los pacientes con distintas condiciones neoplásicas desarrollan metástasis espinales sintomáticas durante el curso de su enfermedad y en la mayoría de los casos es el dolor el síntoma de presentación 25 . Las metástasis espinales constituyen casi el 70% de todos los tumores espinales y la columna lumbar es la más frecuentemente involucrada. Las metástasis pueden ser resultado de casi cualquier tumor maligno, pero los tumores sólidos mas frecuentes que se diseminan a la columna son los carcinomas de mama, pulmón o próstata. Los tumores linforeticulares, mieloma múltiple y linfoma, también son causas frecuentes de lesiones espinales metastásicas17.
Las lesiones metastásicas que causan dolor severo de espalda tienen numerosos efectos adversos en el paciente y llevan a la discapacidad funcional y deterioro de la calidad de vida, además de las consecuencias psicosociales mencionadas. Además, los tratamientos paliativos tienen complicaciones conocidas. La radioterapia proporciona alivio significativo del dolor pero con limitada o nula estabilización espinal. Ninguna de estas modalidades de tratamiento es efectiva de forma constante para el alivio del dolor o para mejorar el status ambulatorio. Por otra parte, el manejo quirúrgico generalmente involucra la vertebrectomía, con reconstrucción con un "cage" o cemento óseo y la estabilización con tornillos pediculares; este procedimiento requiere un período de recuperación significativo, además de la morbimortalidad agregada en pacientes que de sí tienen una expectativa de vida limitada. La vertebroplastía podría realizarse como complemento de la radioterapia para proporcionar alivio del dolor de forma inmediata y estabilización. Se ha planteado que la VP puede realizarse en pacientes en quienes la cirugía está contraindicada a fin de prevenir un mayor colapso del cuerpo vertebral y mejorar el alivio del dolor. Los mejores resultados de la VP en enfermedad metastásica se han obtenido en la columna dorsolumbar, aunque se realiza en la región cervical cuando la cirugía está contraindicada 17
Se han sugerido varias teorías respecto al alivio del dolor proporcionado por la vertebroplastía. En el caso de las metástasis vertebrales, se cree que el dolor local es secundario a las fracturas óseas y la reacción de las estructuras nerviosas remanentes al efecto de masa tumoral. Es probable que el componente de la analgesia relacionada a la vertebroplastía sea secundario a la inmovilización de microfracturas y la reducción de las fuerzas mecánicas 17 . También se han identificado como responsables del efecto analgésico a la destrucción de las terminaciones nerviosas causada por los efectos citotóxicos, mecánicos y vasculares del PMMA, así como los efectos térmicos de su polimerización. Estudios histológicos pos mortem de pacientes sometidos a VPcon lesiones vertebrales malignas, han mostrado un efecto local tumoricida alrededor de la masa de cemento, con osteonecrosis térmica focal, con reacción inflamatoria al medio opacificador del cemento (sulfato de bario) y quizá también al cemento2,17,27.
La evaluación de los pacientes en quienes se desconoce el origen de las metástasis incluye, además de niveles de calcio y fosfato séricos, pruebas de función hepática, radiografía de tórax, tomografía computada de cráneo, tórax, abdomen y pelvis y la mamografía en mujeres. Es deseable la participación del oncólogo y el radiólogo oncólogo17.
Cuando la vertebroplastía se realiza en conjunto con radioterapia, se recomienda que la primera se realice previa a la radioterapia. El rango de complicaciones relacionadas a la vertebroplastía en casos de enfermedad metastásica es aproximadamente al 10%, mayor al observado al tratar FVC's osteoporóticas 3,17,28.
Protocolo prevertebroplastía
El abordaje de todo paciente con dolor de espalda y en quienes se sospecha de la presencia de fracturas vertebrales de origen osteoporótico o tumoral, inicia con las radiografías simples y sus hallazgos deben correlacionarse con una historia clínica y examen físico meticulosos, para correlacionar la localización del dolor con el nivel de la fractura y excluir la presencia de déficit neurológico focal o mielopatía. Al definir el segmento espinal afectado, referirlo como: columna cervical, columna torácica (T1–T10), unión tóraco–lumbar (T11–L2) y lumbar baja (L3–L5 ) 22,29 . Se requiere de estudios con cortes transversales (imagen por resonancia magnética [IRM] y tomografía computada [TC]) para determinar si hay compromiso significativo del canal espinal y evaluar la integridad de la pared posterior del cuerpo vertebral, así como para excluir otras causas de dolor de espalda 12 . La IRM ayuda a determinar la evolución de la fractura: el edema del cuerpo vertebral (hipointensidad de la médula ósea en T1 e hiperintensidad en T2) es diagnóstico de fracturas agudas 30 (figura 1). La densitometría ósea y la gamagrafía ósea (figura 2) son otras herramientas diagnósticas; el encontrar actividad aumentada, parece tener valor predictivo de respuesta clínica favorable a la VP 2,19.


Para la evaluación del dolor causado por la fractura o por la involucración tumoral del cuerpo vertebral se utilizan diversas escalas, la más común es la escala visual análoga (EVA) y se consideran otros parámetros como la limitación en la movilización que condiciona el dolor, el uso de analgésicos y el grado de mejoría obtenido con el procedimiento 2,29,31 (tabla 3).

PROCEDIMIENTO
La vertebroplastía puede realizarse en la sala de radiología intervencionista o en quirófano. Es requisito contar con un fluoroscopio de alta resolución. Aunque es un procedimiento que puede realizarse bajo sedación con midazolam y fentanil, en pacientes con dolor severo hay que considerar el uso de anestesia general para que toleren adecuadamente la posición prona2,12.
Utilizando técnica estéril, se infiltra piel y periostio con anestésico local; con guía fluoroscópica en posición anteroposterior (AP) y lateral, se marca sobre la piel el punto de entrada y se introduce una aguja de 11G ó 13G dentro del cuerpo vertebral, ya sea vía transpedicular o parapedicular, hasta alcanzar la unión del segundo con el tercer tercio del cuerpo (figura 3). Si se eligió el abordaje transpedicular, se puede colocar una segunda aguja en el pedículo contralateral para a través de ésta aspirar de forma continua el tejido desplazado por la inyección del cemento, evitando así su posible desplazamiento hacia el canal o foramina que pudiera comprimir la médula o una raíz, en especial en casos de patología tumoral. Bajo cuidadosa visualización fluoroscópica y alternando la proyección AP y lateral, se inicia la inyección del cemento óseo opacificado, observando que este se difunda a través del espacio intertrabecular de la médula ósea. Se puede repetir la inyección del cemento a través del pedículo contralateral, a menos que se demuestre suficiente llenado del cuerpo vertebral a partir de la inyección inicial 12 . No es necesario rellenar por completo el cuerpo vertebral ya que no hay relación entre la cantidad de llenado y el alivio del dolor subsecuente 17 . Debe tenerse cuidado en evitar la extrusión del cemento más allá de los confines del cuerpo vertebral, así como el llenado inadvertido del canal espinal, la foramina, el espacio del disco intervertebral o los plexos venosos vertebrales. Para permitir manejar por más tiempo el cemento y lograr la infusión de múltiples niveles, se utiliza un baño de hielo para prolongar el tiempo del polimerizado del PMMA 32 , el momento adecuado para iniciar la infusión del cemento es cuando su consistencia es similar a la de la pasta dental 25 . El volumen total de cemento inyectado varía desde 3 hasta 15 cm3 con un promedio de 7 ml3 . El cemento consolida en menos de una hora y debe estabilizar la vértebra formando un soporte interno duro.

Posterior al procedimiento, se instruye al paciente para que permanezca recostado completamente en posición supina por un mínimo de una hora para permitir al cemento que se consolide completamente. Debe mantenerse en vigilancia hospitalaria al menos por un lapso de 3 a 6 horas, transcurrido el cual el paciente podrá ponerse de pie y caminar con mínimo o ningún dolor. Durante este lapso, se puede realizar una TC de columna como control posprocedimiento 12,29 . Antes de ser dados de alta, los pacientes deben ser evaluados para cuantificar el alivio del dolor, determinar si existe o no déficit neurológico focal agregado o dolor de pecho de nueva aparición. En algunos pacientes se prescribirán AINE's para aliviar el dolor asociado al procedimiento. Aunque por lo general es inmediato, el alivio del dolor puede tomar hasta 72 horas 2,12 . Puede mantenerse al paciente con una ortesis por lapso de 4 semanas como medida de precaución a fin de evitar lesión alas vértebras adyacentes12
RANGOS DE ÉXITO
Se considera que la VP en FVC's es eficaz para aliviar el dolor y mejorar la movilización del paciente, no importa la edad de la fractura 23 . También es efectiva para reducir los requerimientos de analgésicos, aunque este efecto puede ser ligeramente menor en pacientes que requieren de narcóticos antes del procedimiento y en aquellos que tienen fracturas antiguas 1 . Algunos pacientes pueden estar habituados o ser dependientes de cierto nivel de analgesia y por lo tanto responder menos a la VP en relación al uso de analgésicos. La mejoría esperada en la movilización del paciente después de la VP puede verse ligeramente limitada en los pacientes que mantienen niveles de baja actividad física previa al procedimiento23.
Se ha reportado que el alivio del dolor se obtiene de forma inmediata en la mayoría de los casos 2 diversas series han descrito un nivel de alivio del dolor dramático o muy significativo que varía del 73% hasta el 90% en los casos de FVC osteoporóticas 23,33 . El principal factor predictivo de evolución clínica satisfactoria a mediano plazo (promedio de 24 meses) es el alivio del dolor inmediato al procedimiento 34 . El mecanismo del alivio del dolor debido a la VP permanece incierto, aunque se han propuesto mecanismos como la estabilización de microfracturas, así como factores químicos, térmicos y vasculares 2 . Además del alivio del dolor, se ha demostrado que la vertebroplastía restaura la flexión, extensión y "compliance" lateral de cuerpos acuñados a valores similares a los de la biomecánica espinal normal 17 . También se ha sugerido que la mejoría en la movilización de los pacientes, así como la disminución de los requerimientos de analgésicos, son un efecto directo de la VP.
Se ha definido como éxito, en los casos de fracturas osteoporóticas, cuando se logra el alivio del dolor y/o mejoría de la movilidad en al menos un 80%. Cuando la VP se realiza por involucración neoplásica, el éxito se define como alivio del dolor y/o mejoría de la movilidad en un 50–60% 13.
En algunos pacientes con FVC's por osteoporosis en quienes se resuelve favorablemente el dolor, se ha reportado recurrencia del mismo y éste se ha atribuido al cuerpo vertebral tratado; en estas circunstancias se debe descartar primero que dicha recurrencia se deba a la presencia de nuevas fracturas compresivas 2,26,35.
COMPLICACIONES
Las complicaciones significativas ocurren en menos del 3% de los pacientes tratados por fracturas por compresión secundarias a osteoporosis y en menos de 10% de los pacientes tratados por involucración neoplásica 13 . La mayoría de las complicaciones reportadas son menores y transitorias 33 (tabla 4).

Las complicaciones intraoperatorias incluyen la hipotensión como efecto de la absorción del monómero del PMMA. Estudios experimentales en ovejas demostraron una mayor frecuencia de alteraciones cardiovasculares (deterioro de la presión arterial media y gases sanguíneos arteriales) ante el incremento en el número de niveles vertebrales tratados (>4), atribuidas al embolismo graso inducido por el aumento de la presión intraósea durante la inyección PMMA. Estos efectos negativos se atenuaron cuando se utilizaba un orificio de ventilación en el infusor durante la inyección del PMMA 36 . La extrusión del PMMA más allá de los límites del cuerpo vertebral es otra complicación común, en especial cuando el plano de fractura se extiende a las plataformas o la superficie cortical 12,37 . La fuga de cemento se reporta hasta en el 88% de las series (la mayoría de ellas asintomáticas) y pueden ocurrir en el espacio epidural del canal espinal, hacia la foramina neural y al espacio intervertebral, que potencialmente requerirán manejo quirúrgico 38 , o a través de las venas paraespinales hacia los pulmones 17,39–41 . Cada patrón de extrusión conlleva distintos riesgos. El llenado inadvertido del espacio intervertebral ocurre casi siempre asintomático; en contraste, la fuga hacia la foramina neural con frecuencia es sintomática. La fuga al canal espinal puede causar compresión medular, con grados variables de manifestaciones. La fuga del cemento es significativamente mayor hacia la periferia en vértebras afectadas por metástasis que en las osteoporóticas, mientras que en éstas se observa una mayor frecuencia de fugas hacia el espacio discal. 2,3,41,42 No se ha observado una correlación entre la cantidad total del cemento inyectado y la frecuencia de fugas del mismo; a su vez, la mejoría del dolor es constante, independiente de si existió o no fuga41.
Una de las complicaciones más serias es el embolismo pulmonar que ocurre por la migración del cemento a través de las venas paraespinales 28 . Muchas de estas complicaciones han ocurrido en diversas circunstancias: cuando no se realiza monitoreo fluoroscópico continuo durante la inyección del cemento; cuando la inyección se realiza en el centro geográfico del cuerpo vertebral; cuando no se hace una inyección de material de contraste preinfusión del cemento (venografía) 35 o cuando el cemento tiene una consistencia muy líquida durante su infusión 2 . Otra complicación, rara vez vista durante un procedimiento de vertebroplastía, es la toxicidad al PMMA 12,18 ; esta es una de las razones por las que se recomienda no tratar mas de tres niveles en una sola sesión14.
Según la severidad de las complicaciones estás podrían no requerir ningún manejo específico (como el caso de las fugas asintomáticas al espacio discal), o por el contrario, tener secuelas graves e incluso la muerte2.
Se ha reportado la presencia de nuevas FVC's sintomáticas pos–VP en niveles adicionales al tratado originalmente, que requieren a su vez tratamiento. Esto puede significar para el paciente la obtención de pobres resultados evolutivos, pero a la vez puede representar la historia natural de la osteoporosis, ya que el riesgo de una fractura subsecuente se encuentra aumentado hasta en 2.7 veces después de que se diagnostica de forma inicial una fractura vertebral 2,3,15,35 . También puede reflejar la biomecánica de la columna vertebral alterada después de la VP, donde la estabilización de un segmento impone mayor estrés en los niveles remanentes, mecanismo similar al que se ha postulado en la degeneración espondilótica de la columna cervical después de una discoidectomía cervical anterior y fusión2,30,43.
CASO CLÍNICO
Se presenta el caso de una mujer de 59 años, en quien se detecta un año previo un carcinoma broncogénico tratado con quimioterapia y control tumoral satisfactorio. Siete semanas previas a su valoración neurológica inicial la paciente inicia con dolor dorsal bajo, rápidamente progresivo, dolor evaluado con una puntuación de 9 de la escala visual análoga (EVA), incapacidad para realizar actividades de la vida diaria por el dolor, que la mantiene postrada en cama, con requerimiento de analgésicos opiáceos con horario (morfina) y sometida a bloqueo epidural dorsal alton 1 ocasión por médico algólogo que provocó remisión parcial del dolor por tiempo limitado. Además,la paciente presentó constipación considerable atribuida al uso de opiáceos y a su postración. A la exploración clínica la paciente experimentaba dolor local intenso a la palpación dorsal a nivel de T–12 y T–5 sin evidencia de radiculopatía o mielopatía. Las radiografías simples mostraron compresión parcial de los cuerpos vertebrales de T–5 (figura 4) y T–12, con captación aumentada del radiofármaco en el gamagrama esquelético en T–5 y T–12, correspondiente a actividad tumoral. La densitometría ósea no mostró datos de osteoporosis. En la tomografía computada se demostró integridad de la cortical posterior en los niveles afectados (figura 5).


Debido al fracaso en el tratamiento médico, la paciente fue sometida a vertebroplastía percutánea utilizando un abordaje posterior transpedicular de dos niveles. Se inyectaron 4 ml de PMMA a través de un solo pedículo en T–5 (figura 6) y 8 ml a través de ambos pedículos en T–12 (figura 7). Las imágenes transoperatorias mostraron un llenado adecuado de ambos cuerpos vertebrales. En el cuerpo de T–12 hubo fuga de PMMA hacia el espacio discal suprayacente (figura 8), que no tuvo significado clínico. Al concluir el procedimiento la paciente se mantiene en reposo absoluto por lapso de 2 horas e inicia bipedestación y deambulación 6 horas después. En el periodo posoperatorio inmediato la paciente mostró resolución total del dolor y es egresada del hospital al día siguiente sin déficit neurológico ni requerimientos de analgésicos. En el examen de seguimiento a dos y medio meses, la paciente se mantuvo libre de dolor dorsal. En esta fecha se presentó reactivación del proceso tumoral pulmonar, rápidamente progresivo y la paciente falleció 3 meses después de realizada la vertebroplastía percutánea.

CONSIDERACIONES TÉCNICAS
Durante los casi 20 años en que se ha realizado este procedimiento, ha habido modificaciones técnicas para evitar las complicaciones 44 . Un ejemplo, es el uso de una pequeña porción de material de hemostasia (v.g Gelfoam) inyectado a través de la aguja vertebral cuando se visualiza en la venografía un flujo rápido a través de las venas epidurales y perimedulares, con lo que se reducen las posibilidades de embolismo pulmonar 2.
Estudios de biomecánica no han demostrado diferencias en la rigidez y/o fortaleza del cuerpo vertebral pos–VP si ésta se realizó uni o bipedicularmente, por lo que algunos centros con mayor experiencia realizan el procedimiento a través de un solo pedículo 2,12. Esto se correlaciona con la observación de que se logra un llenado adecuado del cuerpo vertebral con el cemento utilizando una sola vía de acceso y con el hecho de que el alivio del dolor no está relacionado de forma directa con la cantidad de cemento inyectado 41 . Además, se ha demostrado en laboratorio que el reforzamiento del cuerpo vertebral en todas las regiones de la columna se logra con la inyección de apenas 2 ml de cemento, lo que en teoría no justificaría la inyección de grandes volúmenes 25,45.
Existen técnicas alternativas para el acceso percutáneo al cuerpo vertebral, como es la ruta paraespinal, procedimiento similar al utilizado para la discografía y la discoidectomía endoscópica. Los partidarios de esta técnica argumentan que, a diferencia de la vía transpedicular, no pone en mayor riesgo la raíz nerviosa y la médula espinal. Sin embargo, esta técnica posterolateral pone en riesgo estructuras como pulmones, riñón, grandes vasos, arterias espinales segmentarias y el colon. Incluso, el riesgo de fuga de cemento es mayor al momento de retirar la cánula.
Las descripciones iniciales del procedimiento utilizan la inyección del cemento a baja presión (usando jeringas de 1 ml) 12 pero con mayor grado de dificultad, haciendo necesario el uso de cemento de baja viscosidad, lo que conlleva a una mayor posibilidad de presentar fugas o de inyección inadvertida a los plexos venosos, exponiendo además al cirujano a una mayor radiación 46 . La introducción de sistemas de infusores tipo jeringa de rosca permite la inyección volumétrica controlada 47 de grandes bolos de cemento de alta viscosidad sin tener que rellenar el reservorio, lo que a su vez reduce la exposición a la radiación 12,46.
La exposición a la radiación a que se somete el cirujano que realiza la vertebroplastía se encuentra relacionada con la técnica e instrumentos con que se realiza el procedimiento. Al utilizar procedimientos de reducción de radiación, tales como la operación fluoroscópica pulsada (4 pulsos por segundo), el posicionar el tubo radiográfico bajo la mesa quirúrgica, el uso de sábanas de plomo en los pacientes, colocar mandiles de plomo entre el cirujano y el paciente y utilizar una extensión para conectar la aguja espinal al infusor, se multiplica hasta en 200 veces el número de procedimientos de VP que un solo cirujano puede realizar de forma segura al año48.
También se ha descrito la utilización del abordaje transpedicular transquirúrgico o abierto, sin que se haya demostrado un beneficio real con el procedimiento, agregando además la morbilidad de una cirugía abierta. Algunos grupos recomiendan la utilización de tomografía en lugar de fluoroscopio, argumentando mejor visualización del cemento y control de las fugas2.
CIFOPLASTÍA
Una variante importante de la VP es la cifoplastía con balón, un procedimiento que tiene las mismas utilidades que la VP pero además intenta restaurar la altura corporal vertebral perdida y reducir la cifosis asociada 2,9 . En este método se introduce a través de la cánula un balón inflable de alta presión y de gran resistencia que conforme se expande, hace que las plataformas se eleven, creando así una reducción en masa del cuerpo vertebral, intentando restaurar la altura original. Después de remover el balón, su hueco se rellena con cemento, a una presión menor que la necesaria en la VP convencional, reduciendo potencialmente el riesgo de fuga de cemento 3,9,12,14,16,49.
Respecto a la restauración de la altura vertebral, muchos autores han notado el restablecimiento espontáneo de la altura pos–VP convencional 50 y a la fecha no se sabe si los costos y complejidad adicional de la cifoplastía sobrepasan cualquier potencial beneficio, aun cuando ya existen reportes con seguimiento a varios meses con resultados favorables en las FVC's osteoporóticas2.
Por otra parte, por su perfil esta técnica requiere de estar reposicionando más frecuentemente el fluoroscopio para una adecuada visualización de la anatomía vertebral y del cemento inyectado, por lo que algunos autores han modificado la técnica, incorporando el uso de un tubo conector y un infusor de cemento tipo jeringa de rosca al equipo original de la cifoplastía, lo que permite a su vez inyectar cantidades adicionales de cemento a la cavidad creada por el balón 51.
En el momento actual, son escasos los reportes del uso de la cifoplastía con balón en el tratamiento de enfermedades neoplásicas como para determinar si los resultados son similares a los obtenidos al tratar fracturas osteoporóticas. De igual manera, la utilidad clínica de la restauración parcial de la altura y la reducción que se lograría de la cifosis con este procedimiento todavía necesita ser probada 49 , considerando además que su costo es varias veces mayor al de la técnica originalmente descrita.
CONSIDERACIONES FINALES
En el presente, la VP se utiliza para aliviar el dolor de vértebras osteopénicas que se encuentran ya colapsadas y para el manejo de lesiones neoplásicas primarias o metastásicas del cuerpo vertebral, que son dolorosas y requerirán o no de tratamiento posterior con quimio– y/o radioterapia. También se utiliza en el tratamiento de fracturas estallamiento (traumáticas) que serán sometidas a tratamiento quirúrgico de estabilización e instrumentación corta. Por sí solo, es un procedimiento que ofrece alivio del dolor, reforzamiento y estabilización vertebral, mejoría en la movilización y deambulación, mejor desempeño laboral, menores o nulos requerimientos de analgésicos y mejoría de la calidad de vida. Conforme se conozca más acerca de sus efectos preventivos, la VP podrá jugar un papel profiláctico al fortalecer cuerpos vertebrales osteoporóticos en riesgo de fracturarse, en especial si se demuestra que el tratamiento de un nivel incrementa el estrés impuesto a los niveles adyacentes35.
Además del PMMA, la VP permite la aplicación de diferentes materiales biocompatibles en el cuerpo vertebral. El tratamiento a futuro de las FVC's puede incluir la inyección de antibióticos o agentes quimioterapéuticos para tratar infecciones o enfermedad espinal tumoral, además de hidroxiapatita, cemento de fosfonato de calcio, hormonas, factores de crecimiento óseo u otros agentes biológicamente activos para inducir la regeneración ósea. Además, pueden desarrollarse nuevos cementos óseos que obvien las limitaciones del PMMA, como es la incapacidad de integrarse con el esqueleto. Se han investigado materiales osteoconductivos como el exoesqueleto de coral, y otros minerales sustitutos de hueso biodegradables que se reabsorben conforme el hueso se remodela2.
Entre las limitaciones del procedimiento en nuestro medio, está el hecho de que muchas de las fracturas por osteoporosis pasan inadvertidas en las personas mayores o no son referidas por los médicos de primer contacto (médicos generales, geriatras, endocrinólogos, reumatólogos) ante el desconocimiento de la técnica, que en México ha recibido poca difusión como opción de tratamiento, al ser un procedimiento relativamente nuevo. Algo similar ocurre con la enfermedad espinal tumoral, abordada inicialmente por médicos oncólogos e incluso cirujanos ortopedistas, que pueden no estar familiarizados aún con la vertebroplastía percutánea.
REFERENCIAS
1. Alvarez L, Perez–Higueras A, Quinones D, Calvo E, Rossi RE. Vertebroplasty in the treatment of vertebral tumors: postprocedural outcome and quality of life. Eur Spine J 2003; 2(4):356–60. [ Links ]
2. Amar AP, Larsen DW, Esnaashari N, Albuquerque FC, Lavine SD, Teitelbaum GP. Percutaneous transpedicular polyme–thylmethacrylate vertebroplasty for the treatment of spinal compression fractures. Neurosurgery 2001;49;1105–15. [ Links ]
3. Bono CM, Kauffman CP, Garfin SR. Kyphoplasty. Sem Spine Surg 2002;14(4):320–33. [ Links ]
4. Cho D, Lee W, Sheu P. Treatment of thoracolumbar burst fractures with polymethyl methacrylate vertebroplasty and short–segment pedicle screw fixation. Neurosurg 2003; 53:1354–61. [ Links ]
5. Diamond TH, Champion B, Clark WA. Management of acute osteoporotic vertebral fractures: a nonrandomized trial comparing percutaneous vertebroplasty with conservative therapy. Am J Med 2003 ;114(4):257–65. [ Links ]
6. Jang JS, Kim DY, Lee SH. Efficacy of percutaneous vertebroplasty in the treatment of intravertebral pseudarthrosis associated with noninfected avascular necrosis of the vertebral body. Spine 2003;15;28(14):1588–92. [ Links ]
7. Kallmes DF, Schweicker PA, Marx WF, Jensen ME. Vertebroplasty in the mid– and upper thoracic spine. AJNR Am J Neuroradiol 2002;23(7):1117–20. [ Links ]
8. Kremer MA, Fruin A, Larson TC 3rd, Roll J, Weil RJ. Vertebroplasty in focal Paget disease of the spine. Case report. J Neurosurg 2003;99(1 Suppl):110–3. [ Links ]
9. Ledlie JT, Renfo M. Balloon kiphoplasty: one–year outcomes in vertebral body height restoration, chronic pain and activity levels. J Neurosurg 2003;(spine 1)98:36–42. [ Links ]
10. McGraw JK, Lippert JA, Minkus KD, Rami PM, Davis TM, Budzik RF. Prospective evaluation of pain relief in 100 patients undergoing percutaneous vertebroplasty: results and follow–up. J Vasc Interv Radiol 2002;13(9 Pt 1):883–6. [ Links ]
11. Ng PP, Caragine LP Jr, Dowd CF. Percutaneous vertebroplasty: an emerging therapy for vertebral compression fractures. Semin Neurol 2002;22(2):149–56. [ Links ]
12. Peters KR, Guiot BH, Martin PA, Fessler RG. Vertebroplasty for osteoporotic compression fractures: current practice and evolving techniques. Neurosurgery 2002; 51 [suppl 2]:96–103. [ Links ]
13. McGraw JK, Cardella J, Dean–Barr J, Mathis JM, Sanchez O, Schwartzberg MS, et al. Society of interventional radiology quality improvement guidelines for percutaneous vertebroplasty. J Vasc Interv Radiol 2003; 14:827–31 [ Links ]
14. Coumans JV, Reinhardt MK, Lieberman IH. Kyphoplasty for vertebral compression fractures: 1–year clinical outcomes from a prospective study. J Neurosurg 2003;99(1 Suppl):44–50. [ Links ]
15. Papaioannou A, Watts NB, Kendler DL, Yuen CK, Adachi JD, Ferko N. Diagnosis and management of vertebral fractures in elderly adults. Am J Med 2002;15;113(3):220–8 [ Links ]
16. Phillips FM. Minimally invasive treatments of osteoporotic vertebral compression fractures. Spine 2003;1;28(15):S45–53. [ Links ]
17. Pilitsis JG, Rengachary SS, The role of vertebroplasty in metastatic spinal disease. Neurosurgery Focus 2001; 11(6). [ Links ]
18. Nakano M, Hirano N, Matsuura K, Watanabe H, Kitagawa H, Ishihara H, et al. Percutaneous transpedicular vertebroplasty with calcium phosphate cement in the treatment of osteoporotic vertebral compression and burst fractures. J Neurosurg 2002; (Spine 3) 97:287–93. [ Links ]
19. Predey TA, Sewall LE, Smith SJ. Percutaneous vertebroplasty: New treatment for vertebral compression fractures. Am Fam Physician 2002; 66:611–17. [ Links ]
20. Stallmeyer MJ, Zoarski GH, Obuchowski AM. Optimizing patient selection in percutaneous vertebroplasty. J Vasc Interv Radiol 2003;14(6):683–96. [ Links ]
21. Wetzel SG, Martin JB, Somon T, Wilhelm K, Rufenacht DA. Painful osteolytic metastasis of the atlas: treatment with percutaneous vertebroplasty. Spine 2002;15;27(22):E493–5. [ Links ]
22. Peh WC, Gilula LA, Peck DD. Percutaneous vertebroplasty for severe osteoporotic vertebral body compression fractures. Radiology 2002;223(1):121–6. [ Links ]
23. Kaufmann TJ, Jensen ME, Schweickert PA, Marx WF, Kallmes DF. Age of fracture and clinical outcomes of percutaneous vertebroplasty. AJNR Am J Neuroradiol 2001;22:1860–3. [ Links ]
24. Peh WC, Gelbart MS, Gilula LA, Peck DD. Percutaneous vertebroplasty: treatment of painful vertebral compression fractures with intraosseous vacuum phenomena. AJR Am J Roentgenol 2001;180(5):1411–7. [ Links ]
25. Fourney DR, Schomer DF, Nader R, Chlan–Fourney J, Suki D, Ahrar K, Rhines LD, Gokaslan ZL. Percutaneous vertebroplasty and kyphoplasty for painful vertebral body fractures in cancer patients. J Neurosurg 2003;98(1 Suppl):21–30. [ Links ]
26. Gaughen JR Jr, Jensen ME, Schweickert PA, Marx WF, Kallmes DF. The therapeutic benefit of repeat percutaneous vertebroplasty at previously treated vertebral levels. AJNR Am J Neuroradiol 4 2002;23(10):1657–61. [ Links ]
27. Togawa D, Bauer TW, Lieberman IH, Takikawa S. Histologic evaluation of human vertebral bodies after vertebral augmen–tation with polymethyl Methacrylate. Spine 2003; 28(14):1521–7. [ Links ]
28. Jang JS, Lee SH, Jung SK Pulmonary embolism of polymethyl–methacrylate after percutaneous vertebro–plasty: a report of three cases. Spine 2002;1;27(19):E416–8. [ Links ]
29. Evans AJ, Jensen ME, Kip KE, DeNardo AJ, Lawler GJ, Negin GA, et al. Vertebral compression fractures: pain reduction and improvement in functional mobility after percutaneous polymethylmethacrylate verte–broplasty retrospective report of 245 cases. Radiology 2003; 226(2):366–72. [ Links ]
30. Uppin AA, Hirsch JA, Centenera LV, Pfiefer BA, Pazianos AG, Choi IS. Occurrence of new vertebral body fracture after percutaneous vertebroplasty in patients with osteoporosis. Radiology 2003;226(1):119–24. [ Links ]
31. Perez–Higueras A, Alvarez L, Rossi RE, Quinones D, Al–Assir I. Percutaneous vertebroplasty: long–term clinical and radiological outcome. Neuroradiology 2002;44(11):950–4. [ Links ]
32. Chavali R, Resijek R, Knight SK, Choi IS. Extending polymerization time of polymethylmethacrylate cement in percutaneous vertebroplasty with ice bath cooling. AJNR Am J Neuroradiol 2003;24(3):545–6. [ Links ]
33. Deramond H, Mathis JM. Vertebroplasty in osteoporosis. Semin Muskuloskelet Radiol 2002;6(3):263–8 [ Links ]
34. Hodler J, Peck D, Gilula LA. Midterm outcome after vertebro–plasty: predictive value of technical and patient–related factors. Radiology 2003;227(3):662–8. [ Links ]
35. Kallmes DF, Jensen ME. Percutaneous vertebroplasty. Radiology 2003; 229(1):27–36. [ Links ]
36. Aebli N, Krebs J, Schwenke D, Davis G, Theis JC. Cardio–vascular changes during multiple vertebroplasty with and without vent–hole. An experimental study in sheep . Spine 2003;28(14):1504–12. [ Links ]
37. Sarzier JS, Evans AJ. Intrathecal injection of contrast medium to prevent polymethylmethacrylate leakage during percuta– neous vertebroplasty. AJNR Am J Neuroradiol 2003;24(5):1001–2. [ Links ]
38. Shapiro S, Abel T, Purvines S. Surgical removal of epidural and intradural polymethyl–methacrylate extravasation complicating percutaneous vertebroplasty for an osteoporotic lumbar compression fracture. Case report. J Neurosurg 2003; (Spine 1) 98:90–2. [ Links ]
39. Kelekis AD, Martin JB, Somon T, Wetzel SG, Dietrich PY, Ruefenacht DA. Radicular pain after vertebroplasty: compression or irritation of the nerve root? Initial experience with the "Cooling System". Spine 2003;15;28(14):E265–9. [ Links ]
40. Lee BJ, Lee SR, Yoo TY. Paraplegia as a complication of percutaneous vertebroplasty with polymethylmethacrylate: a case report . Spine 2002;1;27(19):E419–22. [ Links ]
41. Mousavi P, Roth S, Finkelstein J, Cheung G, Whyne C. Volumetric quantification of cement leakage following percutaneous vertebroplasty in metastatic and osteoporotic vertebrae. J Neurosurg 2003;(Spine 1) 99:56–9. [ Links ]
42. Yeom JS, Kim WJ, Choy WS, Lee CK, Chang BS, Kang JW. Leakage of cement in percutaneous transpedicular verte–broplasty for painful osteoporotic compression fractures. J Bone Joint Surg Br 2003;85(1):83–9. [ Links ]
43. Baroud G, Nemes J, Heini P, Steffen T. Load shift of the interver–tebral disc after a vertebroplasty: a finite–element study. Eur Spine J 2003;12(4):421–6. [ Links ]
44. Mathis JM, Wong W. Percutaneous vertebroplasty: technical considerations. J Vasc Interv Radiol 2003;14(8):953–60. [ Links ]
45. Molloy S, Mathis JM, Belkoff SM. The effect of vertebral body percentage fill on mechanical behavior during percutaneous vertebroplasty. Spine 2003; 28(14):1549–54. [ Links ]
46. Kallmes DF, O E, Roy SS, Piccolo RG, Marx WF, Lee JK, Jensen ME. Radiation dose to the operator during vertebroplasty: prospective comparison of the use of 1–cc syringes versus an injection device. AJNR Am J Neuroradiol 2003;24(6):1257–60. [ Links ]
47. Gangi A, Guth S, Imbert JP, Marin H, Dietemann JL. Percutaneous vertebroplasty: indications, technique, and results. Radiographics 2003;23(2):e10. [ Links ]
48. Kruger R, Faciszewski T. Radiation dose reduction to medical staff during vertebroplasty: a review of techniques and methods to mitigate occupational dose. Spine 2003;28(14):1608–13. [ Links ]
49. Phillips FM, Wetzel FT, Lieberman I, Campbell–Hupp M. An in vivo comparison of the potential for extravertebral cement leak after vertebroplasty and kiphoplasty. Spine 2002;27(19):2173–9. [ Links ]
50. Hiwatashi A, Moritani T, Numaguchi Y, Westesson PL. Increase in vertebral body height after vertebroplasty. AJNR Am J Neuroradiol 2003;24(2):185–9. [ Links ]
51. Amar AP, Larsen DW, Teitelbaum GP. Use of a screw–syringe injector for cement delivery during kyphoplasty: technical report. Neurosurgery 2003;53(2):380–2 [ Links ]














