Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de neurociencias (México, D.F.)
versión On-line ISSN 1028-5938versión impresa ISSN 0187-4705
Arch. Neurocien. (Mex., D.F.) vol.9 no.3 Ciudad de México sep. 2004
Reporte de caso
Vasculitis cerebral cisticercosa y neuropatía
óptica isquémica en una paciente con amaurosis
unilateral y recuperación ad integrum
Cerebral cycticercosis vasculytis and optic neuropaty
Guillermo Enríquez Coronel*, Edgar Santos Marcial**,
Eibar Ernesto Cabrera Aldana**
* Hospital de Especialidades IMSS Puebla.
** Facultad de Medicina BUAP.
Correspondencia:
Eibar E. Cabrera Aldana.
Instituto Nacional de Neurología y Neurocirugía.
Insurgentes Sur 3877. Col. la Fama.
14269 México D.F.
Recibido: 14 mayo 2004.
Aprobado: 2 junio 2004
RESUMEN
La cisticercosis es una parasitósis bien conocida que puede causar una gran cantidad de síndromes. La neuropatía isquémica–óptica es una enfermedad de adultos cuyas causas principales son hipertensión arterial y la diabetes y la arteritis de células gigantes. Presentamos el caso de una estudiante de medicina de 22 años que presentó súbitamente pérdida de la visión en el ojo derecho y después completa ceguera. Los estudios demostraron múltiples cisticercos en el hemisferio derecho. Fue tratada con corticoides, ciclosfosfamida y albendazol con buenos resultados. Otros casos similares se presentan.
Palabras clave: cisticercosis, vasculitis, cambios visuales, tratamiento.
ABSTRACT
Cisticercosis is a well know parasitosis that migt produce different syndroms that are well described. Optic isquemic neuropaty is a desease present in adults and the main causes are arterial hipertension, diabetes and giant cell arteritis. We present a clinical case of a 22 years old medical student that had a sudden decrease of visual activity in the sight eye and then complete blindness. The studies of TAC and RM demostrated several cisticercus in the sight hemisphere. She was treated with corticoids, ciclofosfamide and albendazol with recovery of vision. Is well know that the cysticercosis produce angiopaty and we present faces cases of visual lost due to the inflamatory reaction.
Key words : cysticercosis, vasculitis, optical changes, treatment.
La cisticercosis, la enfermedad parasitaria más frecuente del sistema nervioso central, es endémica en América Latina, sureste de Asia, África y las Filipinas, afectando en estas regiones del 2 al 4 % de su población. En algunas otras regiones la incidencia ha aumentado debido a la alta inmigración de personas provenientes de zonas endémicas, como es el caso del sur de los Estados Unidos de Norteamérica, y en Portugal, España y en general en el este de Europa, esto está llegando a ser relativamente frecuente 1–2.
La cisticercosis es una infección tisular con las larvas del céstodo taenia solium en la cual la persona es el hospedero intermediario para el parásito. La infestación se adquiere por ingesta de los huevos de este céstodo o bien por auto infestación. El individuo infectado, normalmente posee los cisticercos en muchas partes del cuerpo, en cuyo caso los signos y síntomas son desarrollados por el involucramiento del sitio inflamado, pero el daño a órganos como el corazón o al SNC produce manifestaciones más severas 3–5.
La neurocisticercosis puede involucrar cualquier sitio del SNC, pero la manifestación clínica está con frecuencia relacionada con las lesiones intracerebrales, intraventriculares, subaracnoideas y medulares, de ahí que la presentación clínica sea tan pleomorfa. La encefalitis cisticercosa es más frecuente en niños y mujeres jóvenes y se caracteriza por deterioro de conciencia, crisis convulsivas, disminución de agudeza visual, cefalea, vómitos y papiledema 6.
Entre los mecanismos que le permiten sobrevivir al cisticerco destacan el mimetismo molecular y la depresión de la inmunidad celular, la cual puede condicionar una serie de complicaciones en enfermos con cisticercosis 7.
El síndrome neurológico más frecuente es el epiléptico que ocurre más en los casos que se ve afectado el parénquima cerebral 8–9–10 . Le sigue en frecuencia la cefalea. Se han descrito una gran variedad de signos neurológicos focales en enfermos con neurocisticercosis, en particular en aquellos con quistes localizados en áreas cerebrales concordante. En algunos casos los signos focales aparecen en forma súbita, especialmente cuando se relacionan con infartos cerebrales secundarios a vasculitis cisticercosa 16–18 . Es muy poco frecuente la presentación clínica por vasculitis en la encefalitis cisticercosa o incluso la neuropatía óptica isquímica 19–24.
Los tres principales factores que participan para el desarrollo de la vasculitis cisticercosa son: la localización, la viabilidad de los cisticercos y el grado de reacción inmunológica del huésped hacia el parásito. Los cambios inflamatorios en la vasculitis pueden llevar a la necrosis, oclusión y formación de aneurismas que resultan en infartos y hemorragia. La vasculitis puede ser generalizada o localizada. El proceso puede encontrarse en arterias o venas. Diversos agentes, entre ellos los infecciosos, pueden estar implicados en la patogénesis de la vasculitis secundaria, y por tanto, al encontrada se debe tener un alto índice de sospecha de un proceso infeccioso sobre todo si se encuentra fiebre, anormalidades en la cuenta de leucocitos y el antecedente o un cuadro infeccioso presente en otras localizaciones. Dentro de los agentes infecciosos que pueden producir vasculitis están bacterias típicas de meningitis aguda, microbacterias, espiroquetas, entre otras; los virus como varicela zoster, citomegalovirus, hepatitis, retrovirus y otros; hongos como aspergillus, coccidioides, cándida y mucormycetos; rickettsiae; micoplasma y la larva del parásito taenia soilum 25–32.
La neuropatía óptica isquémica anterior habitualmente se ve en personas mayores de 40 años, siendo las causas habituales hipertensión arterial sistémica, diabetes mellitus y arteritis de células gigantes. También se ha visto que pacientes más jóvenes pueden presentada en asociación con diabetes, migraña, hipertensión en preclamsia, uso de anticonceptivos orales, asociada a lupus eritematoso generalizado, trastornos hematológicos, infección por aspergillus, enfermedad de Lyme, trombosis del seno cavernoso por estafilococo, sífilis o herpes zoster, complicación quirúrgica y radioterapia. Otras causas menos comunes son enfermedad de Fabry, arteritis de Takayasu, disección de carótida, tromboangeítis obliterante, enfermedad de Raynaud, hipotensión nocturna, además de hipotensión por pérdida sanguínea aguda 33–36.
PRESENTACIÓN DE CASO CLÍNICO
Mujer de 22 años de edad. Estudiante de medicina. Se presenta en junio de 2003 a la consulta con médico neurólogo por presentar disminución de agudeza visual en el ojo derecho, de manera intermitente, acompañada con dolor en el mismo. Presentó cefalea leve, proponiendo el diagnóstico de migraña oftalmopléjica.
Su agudeza visual disminuyó progresivamente en el ojo derecho, reportando ver solo sombras hasta o llegar a la amaurosis.
Después, otro médico neurólogo la hospitalizó y le administró esteroides y albendazol, sugiriendo abordaje quirúrgico urgente; en ese momento acude a nosotros por primera vez.
Exploración física:
A la exploración física la encontramos consciente, amaurótica de ojo derecho, con edema de papila, congestión venosa, hemorragias peripapilares, pupila fija de aproximadamente 6 mm sin reflejo fotomotor. Su ojo izquierdo tenía visión normal presentando solo congestión venosa. Su función motora (fuerza, tono y trofismo) era normal, ROT de ++, y respuesta plantar flexora. La sensibilidad y la coordinación eran normales. No presentaba signos meníngeos. El resto de la exploración física general era normal, sin datos de compromiso cardiopulmonar ni abdominal. Sus signos vitales fueron: tensión arterial de 120–80 mm de Hg, temperatura de 36.5° C y frecuencia cardiaca de 80 latidos por minuto.
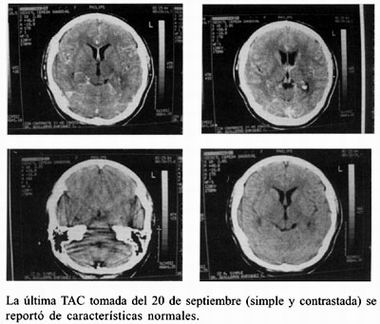
Nos muestra tomografía computada de cráneo tomada el 14 de agosto del 2003 la cual presenta imágenes hipodensas en lóbulo temporal derecho y lóbulo frontal compatibles con cisticercos vivos y evidencia de cisticerco intraventricular más datos de hidrocefalia mínima. Se solicita resonancia magnética el 25 de agosto del 2003 mostrando imágenes compatibles con cisticercos vivos de predominio en hemisferio derecho, aunque el reporte oficial de radiología fue de meningitis. Se procede a realizar punción lumbar con la finalidad de medir la presión del LCR y enviar muestra para la realización de la prueba de ELISA para cisticercosis. No se tomó citoquímico por que le presión inicial fue de 300 mm de agua.







El reporte del LCR fue positivo a cisticercosis.
Se solicitó citometría hemática, y química sanguínea, además de anticuerpos antinucleares, siendo de características normales.
Con base a lo anterior se decide la aplicación de bolos de metilprednisolona 19 al día por 3 días y dosis decreciente de manera paulatina hasta llegar a ingerir prednisona oral con dosis de 50 mg al día y disminuyéndola poco a poco hasta su suspensión. Simultáneamente se procedió a la administración de pulsos de ciclofosfamida 1 g al día durante 3 días y posteriormente oral 2 pastillas de 50 mg al día por 10 días.
Se prescribió dos ciclos de albendazol a razón de 15 mg por kg de peso por 7 días cada uno.
En la actualidad, se ha suspendido la ciclofosfamida y esta con prednisona 20 mg cada 24 horas, para retiro posterior, y omeprazol 20 mg al día. La evaluación neurológica actual muestra que la agudeza visual de ojo derecho se ha recuperado al 100 por ciento y a la evaluación del fondo de ojo se observa completamente normal, es decir ha desaparecido el edema de papila, han remitido las hemorragias y se ha recuperado el reflejo fotomotor. El ojo contralateral presenta características normales.
En la exploración general muestra rasgos de síndrome de Cushing, y lesiones dérmicas propias del uso de esteroide.
DISCUSIÓN
Se presenta el caso clínico de una mujer joven, la cual acudió al médico inicialmente por referir disminución de agudeza visual del ojo derecho, en un principio de manera intermitente, para posteriormente llegar a la amaurosis. La cefalea era mínima y ocasional. Fue vista inicialmente por neurólogo quien sugiere un diagnóstico de migraña oftalmoplégica, después con base a la tomografía, se observan imágenes compatibles con cisticercos, uno de ellos en lóbulo temporal derecho de características racemosa y otro intraventricular. Fue valorada por otro neurólogo quien proporciona albendazol y esteroides, proponiendo abordaje quirúrgico urgente. A partir de ese momento entramos en contacto con la paciente amaurótica del ojo derecho con edema de papila ipsilateral, hemorragias peripapilares sin reflejo fotomotor y ojo contralateral con agudeza visual normal pero con congestión venosa. Se decide hospitalizarla corroborando el diagnóstico de cisticercosis a través del LCR 37–40 , por lo que se dan pulsos de metilprednisolona y ciclofosfamida obteniendo como resultado la recuperación de la agudeza visual del ojo derecho y desaparición de cisticercos en la última tomografia. Nunca presentó crisis convulsivas. Presenta estigmas de Síndrome de Cushing, el cual quizá será transitorio.
Este caso ilustra una de las complicaciones más temibles de la cisticercosis activa, que es la angeítis cisticercosa cerebral, produciendo además del típico cuadro de neurocisticercosis, cambios muy localizados en el nervio óptico derecho. Este punto es el más complejo de abordar, ya que en la experiencia propia del autor, se ha tenido el antecedente de un paciente pediátrico de 11 años de edad con encefalitis cisticercosa. Esta persistió por aproximadamente un año, existiendo cefalea y edema de papila. Todas las tomografías simples y contrastadas sólo mostraron edema cerebral pero no a los cisticercos. Fue hasta la última realizada, que se evidenció a los cisticercos en su forma activa. Cabe mencionar que por cuestiones administrativas, a este paciente no se le realizó el estudio de resonancia magnética a pesar de habersele solicitado. Incluso se llegó a pensar en pseudo tumor cerebral. El citoquímico de LCR fue de características normales. No se solicitó reacción a cisticerco ya que todas las tomografías sólo mostraban datos indirectos de edema cerebral. Este caso mostró que la administración única de esteroides por aproximadamente un año no fue capaz de controlar el proceso vasculítico, y fue sólo hasta que se hospitalizó y aplicaron pulsos de ciclofosfamida de manera parenteral, y posteriormente de manera oral, que se resolvió dicho proceso.
Otro caso correspondió a una joven de 14 años de edad, la cual refería cefalea moderada y persistente. En su evolución clínica manifestó disminución de agudeza visual hasta llegar a la amaurosis. Este caso se abordó con esteroides y con ciclofosfamida, obteniendo por igual la remisión de la vasculitis, pero con la persistencia de la amaurosis de manera definitiva.
El último caso correspondió a un joven de 32 años de edad, el cual presentaba básicamente disminución de agudeza visual y edema de papila. Llegó a la amaurosis bilateral. El médico que lo estaba tratando proporcionó dexametasona sin obtener mejoría. Cuando vimos por primera vez al paciente estaba amaurótico, con edema de papila bilateral y la punción lumbar reveló una presión inicial de límites normales. La TAC de cráneo mostró imagen compatible con cisticerco vivo en cisterna quiasmática. Recibió metilprednisolona intravenosa mejorando su visión parcialmente en un ojo, aunque el contralateral permaneció amaurótico. Hubo respuesta favorable a la aplicación sólo de metilprednisolona parenteral a dosis convencionales.
Esta breve descripción de cuatro casos, en particular del primero, nos ejemplifica el hecho de tratar de manera rápida y eficaz a todo paciente que muestre clínicamente datos de vasculitis y en especial cuando exista neuropatía óptica.
La razón por la cual las manifestaciones clínicas de una isquemia con o sin infarto, debidas a la vasculitis cerebral neurocisticercosa, no se presentan es debido a que el grupo de edad de mayor incidencia no tiene factores de riesgo vascular agregados 41–46.
Las complicaciones cerebrovasculares están predóminantemente asociadas a la prevalencia de los cisticercos en el espacio subaracnoideo, especialmente en las cisternas basales y cercanas a un área isquémica progresiva asociada a una aracnoiditis de grado variable, como lo refiere Cantú, et al.
Se sabe que cuando los cisticercos están confinados a un área focal y se asocian a una aracnoiditis leve con pocos cambios en el LCR, generalmente se involucran a los vasos pequeños resultando un infarto reducido, manifestado como un síndrome lacunar indistinguible de los causados por arteriopatías o microateromas.
Cuando la neurocisticercosis se correlaciona con más anormalidades en el LCR, la arteriopatía inflamatoria involucra a los principales vasos del círculo de Willis, lo que origina grandes infartos.
El tipo más severo de angeítis, ocurre cuando el cisticerco tiene una amplia distribución en el espacio subaracnoideo, lo cual sea acompaña de intensos cambios en el LCR y se aprecia en los cursos prolongados de la enfermedad. Esta forma es la más común de la angeítis cerebral por cisticercos.
El síndrome neurovascular es generalmente la primera manifestación de la neurocisticercosis focal que produce infartos únicos (90%) con frecuencia, se relaciona a un buen pronóstico.
En contraste, los pacientes generalemente tienen ciertas complicaciones no vasculares (incluyendo hipertensión intracraneal y un deterioro neurológico progresivo) con la enfermedad difusa cisticercosa, mientras qne su sindrome neurovascular ocurre tardíamente durante el curso de la enfermedad. Este grupo tiene el mayor porcentaje de mal pronóstico 888.
En lo que respecta a las complicaciones oftalmológicas por neurocisticercosis, generalmente comprenden papiledema o efectos pretectales por la dilatación del tercer ventrículo. El deterioro severo de la visión no es común y puede estar asociado con daño en cualquier nivel de la vía visual (prequiasmática, quiasmática y retroquiasmática).
El compromiso intraocular, que se presenta en cerca del 3% de los casos, es un sitio relativamente infrecuente para la pérdida visual por neurocisticercosis 47–49.
La neurocisticercosis está bien descrita en la literatura, pero las discusiones referentes a la pérdida visual son sumamente raras:
Tres casos de atrofia óptica postpapiledema fueron reportados en 1905 y nueve años más tarde Uhthoff anunció que 1.1 % de casos de papiledema fueron debidos a neurocisticercosis a través de su estudio.
Wilbrand y Saenger en lista un caso de cisticercosis con hemianopsia temporal monocular y dos con hemianopsia homónima.
Más recientemente Sotelo, et al reportaron que 28% de sus 763 pacientes con neurocisticercosis tuvieron papiledema y el 10% presentaron una aguda pérdida visual.
En más de la mitad de los pacientes reportados por G. Youngnam Chang y R. Keane, la pérdida visual resultó del daño al nervio óptico producido, muy probablemente tanto por el papiledema como por la inflamación del nervio óptico El edema del disco óptico y la atrofia óptica secundaria, pueden producir restricción del campo visual. Menos frecuente lo son los escotomas centrales, presentes probablemente, como resultado de una isquemia secundaria.
El retraso en el tratamiento del papiledema es la principal causa de amaurosis o deterioro visual en la neurocisticercosis.
Por su parte, la afección quiasmática ocurre predominantemente tras la inflamación directa del quiasma o posiblemente, secundaria a vasculitis.
En la serie del doctor Youngnam Chang fueron más comunes los casos retroquiasmáticos, de los cuales dos terceras partes resultaron por efecto de masa de la zona inflamada periférica al cisticerco y el resto fue debido a un infarto secundario a vasculitis.
La exploración minuciosa de la visión es vital, pues muchos pacientes ignoran incluso severos deterioros visuales. Por tanto aunque el manejo debe ser individualizado, el manejo de la hipertensión intracraneana deberá ser lo antes posible.
Cuando el papiledema prueba ser refractario a otras medidas, la fenestración del nervio óptico deberá ser considerada.
La explicación más factible en este caso para la disminución de la agudeza visual, ya que ocurrió de manera unilateral, es la presencia de la vasculitis al nervio óptico, sitio proximal del quiste. En este caso, la presencia de mínima hidrocefalia se descarta como la causante de la hipertensión intracraneana, la cual se produjo por dicho proceso vasculítico.
Existen muy pocos casos reportados en la literatura con las características descritas de nuestra paciente, aún en Latinoamérica, quizá por la forma muy rara de presentación. Los criterios médicos son el punto más importante para seleccionar cuales casos no requieren tratamiento quirúrgico a pesar de tener forma racemosa y forma intraventricular.
En los casos reportados de vasculitis por neurocisticercosis por David Younger, cuando habla al respecto de su tratamiento, recomienda el uso de antihelmínticos, esteroides y válvula de derivación, sin mencionar a la ciclofosfamida. Sin embargo, ese mismo autor propone de manera general a los esteroides y válvula de derivación, sin mencionar a la ciclofosfamida. No obstante, ese mismo autor propone de manera general a los esteroides y a la ciclofosfamida como tratamiento para as vasculitis en general 50–75.
La paciente recibió en total tres cursos de albendazol a 15 mg por kg de peso por 7 días cada uno. Pulsos de ciclofosfamida y metilprednisolona, ambos medicamentos por vía oral.
Existe muy poca literatura en relación al tratamiento de la vasculitis cisticercosa y neuropatía óptica y sobre todo al uso de esteroides y ciclofosfamida.
Lamentablemente en México seguiremos enfrentando muchos pacientes con neurocisticercosis hasta que no existan medidas higiénico dietéticas adecuadas y mientras los alimentos no bien cocidos lleguen contaminados con cisticercos.
REFERENCIAS
1. Centers for Disease Control and Prevention. Neurocysticercosis: update: Intemational Task Force for Disease Eradication. MMWR Morb Mortal Wkly Rep . 1992;41 :697–8. [ Links ]
2. Roman G, Sotelo J, Del Brutto O, et al. A proposal to declare neurocysticercosis an international reportable disease. Bull World Health Organ 2000; 78:399–406 [ Links ]
3. Chang, Kee Hyun, MD, et al.Parasitic Disease ofthe Central Nervous System. In: HESSELINK, John R, editor. Neurolimaging Clinic of North America. Filadelfia: W. B. Saunders Company 1991;160–9. [ Links ]
4. Escobar A, Nieto D. Parasitic diseases. In: Minckler J, ed. Pathology ofthe Nervous System. New York, NY: McGraw–Hill International Book Co 1972;3:2503–21. [ Links ]
5. Garcia HH, Del Brutto OH. Taenia Solium cysticercosis. Infect Dis Clin North Am 2000; 14:97–119. [ Links ]
6. Madrazo I, Olhagaray B, Becerra M, Sandoval MA, Soto R. Acute cysticercotic encephalitis: description ofa histologically confirmed case. Neurosurgery 1983;13:593–95. [ Links ]
7. Del Brutto OH. Single parenchymal brain cysticercus in the acute encephalitic phase: definition of a distinct form of . 1995;58(2):247–9. [ Links ]
8. Del Brutto OH, Santibañez R, Noboa CA, Aguirre R, Díaz E, Alarcón TA. Epilepsy due to neurocysticercosis: analysis of203 patients. Neurology 1992;42:389–92. [ Links ]
9. Bhigjee Al, Kemp T, Cosnett JE. Cysticercosis presenting with hemichorea. J Neurol Neurosurg Psychiat 1987;50:1561–62 [ Links ]
10. Del Brutto OH. Cysticercosis and cerebrovascular disease: a review. J Neurol Neurosurg Psychiat 1992;55:252–4. [ Links ]
11. Alarcon F, Hidalgo F, Moncayo J, Vinan 1, Duenas G. Cerebral cysticercosis and stroke. Stroke 1992;23:224–8. [ Links ]
12. Alarcon F, Vanormelingen K, Moncayo J, Vinan I. Cerebral cysticercosis as a risk factor for stroke in young and middleage people. Stroke 1992;23:1563–5. [ Links ]
13. Barinagarrementeria F, Cantu C. Neurocysticercosis as a cause of stroke. Stroke 1992;23: 1180–1. [ Links ]
14. Chodosh EH, Foulkes MA, Kase CS, et al. Silent stroke in NINCDS stroke data bank. Neurology 1988;38:1674–9. [ Links ]
15. Del Brutto OH. Cysticercosis and cerebrovascular disease: a review. J Neurol Neurosurg Psychiatry 1992;55:252–4.
16. Garcia HH, Pretell EJ, Gilman RH. A trial of antiparasitic treatment to reduce the rate of seizures due to cerebral cysticercosis . N Engl J Med 2004;350:249–58. [ Links ]
17. Hatano S. Experience from a multicentre stroke registry: a preliminary report Bull World Health Organ , 1976;54:541–53. [ Links ]
18. Portenog RK, Abissi CJ, Lipton RE, et al. Headache in acute cerebrovascular disease. Stroke 1985;15:1009–12. [ Links ]
19. Del Brutto OH. Prognostic factors for seizure recurrence after withdrawal of antiepileptic drugs in patients with neurocysticercosis. Neurology 1994; 44:1706–9. [ Links ]
20. Del Brutto OH, Rajshekhar V, White AC Jr. Proposed diagnostic criteria for neurocysticercosis. Neurology 2001, 57: 177–83. [ Links ]
21. Del Brutto OH, Santibañez R, Noboa CA. Epilepsy due to neurocysticercosis: analysis of203 patients. Neurology 1992; 42:389–92. [ Links ]
22. García HH, Gilman R, Martinez M. Cysticercosis as a major cause of epilepsy in Peru. The Cysticercosis W orking Group in Peru (CWG). Lancet 1993; 341:197–200. [ Links ]
23. Medina MT, Rosas E, Rubio–Donnadieu F. Neuro–cysticercosis as the main cause oflate–onset epilepsy in Mexico. Arch Intem Med 1990; 150:325–7. [ Links ]
24. Vázquez V, Sotelo J. The course of seizures after treatment for cerebral cysticercosis. N Engl Med 1992;327:696–701. [ Links ]
25. Barinagarrementeria F. Non–vascular etiology of lacunar syndromes. J Neurol Neurosurg Psychiatry 1990;53:1111. [ Links ]
26. Barinagarrementeria F, Del Brutto OH. Lacunar syndrome due to neurocysticercosis. Arch Neurol 1989;46:415–7. [ Links ]
27. Barinagarrementeria F, Del Brutto OH. Neurocysticercosis and pure motor hemiparesis. Stroke 1988; 19:1156–8. [ Links ]
28. Del Brutto OH, Sotelo J. Neurocysticercosis: an update. Rev Infec Dis 1988;10: 1075–87. [ Links ]
29. Levy AS, Lilleher KO, Rubenstein D, Stears JC. Subarachnoid neurocysticercosis with occlusion ofthe major intracranial arteries: case report Neurosurgery 1995;36:183–8. [ Links ]
30. Mc Cormick GF, Giannota S, Zee CS, Fisher M. Carotid occluson in cysticercosis. Neurology 1983;33: 1078–80. [ Links ]
31. Rodríguez–Carbajal J, Del Brutto OH, Penagos P, Huebe J, Escobar A. Occlusion ofthe middle cerebral artery due to cysticercotic angiitis. Stroke 1989;20:1095–8. [ Links ]
32. Cardenas F, Quiroz H, Plancarte A. Taenia solium ocular cysticercosis: findings in 30 cases. Ann OphthalmoI1992 ; 24:25–8. [ Links ]
33. Chang GY, Keane JR. Visualloss in cysticercosis: analysis of 23 patients. Neurology 2001; 57:545–8. [ Links ]
34. Lee A, Brazis P. Clinical Pathways in neuro–ophthalmology An evidence–based approach. Estados Unidos . Thieme 1998. [ Links ]
35. Millar N, Newman N. Clinical neuroophthalmology the essentials. Baltimore : L. W. and W 1999. [ Links ]
36. Coker–Vann MR, Subianto DB, Brown P. ELISA anti–bodies to cysticerci ofTaenia solium in human populations in New Guinea, Oceania, and Southeast Asia. Southeast Asian J Trop Med Public Health 1981; 12:499–505. [ Links ]
37. Ramos–Kuri M, Montoya RM, Padilla A. Irnmunodiagnosis of neurocysticercosis: disappointing performance of serology (enzyme–linked irnmunosorbent assay) in an unbiased sample ofneurological patients. Arch NeuroI 1992;49:633–6. [ Links ]
38. Rosas N, Sotelo J, Nieto D. ELISA in the diagnosis of neuro–cysticercosis. Arch Neurol 1986; 43:353–6. [ Links ]
39. Tsang VCW, Brand JA, Boyer AE. An enzyme–linked irnmuno–electrotransfer blot assay and glycoprotein antigens for diagnosing human cysticercosis (taenia solium ). J Infect Dis 1989; 159:50–9. [ Links ]
40. White AC Jr. Neurocysticercosis. updates on epidemiology, pathogenesis, diagnosis, and management. Annu Rev Med 2000; 51:187–206. [ Links ]
41. Alarcon F, Vanormelingen K, Moncayo J, Vinan I. Cerebral cysticercosis as a risk factor for stroke in young and middle–age people. Stroke 1992;23:1563–5. [ Links ]
42. Chodosh EH, Foulkes MA, Kase CS. Silent stroke in NINCDS stroke data bank. Neurology 1988;38: 1674–9. [ Links ]
43. Garcia HH, Pretell EJ, Gilman RH. A trial ofantiparasitic treatment to reduce the rate ofseizures due to cerebral cysticercosis. N Engl J Med 2004;350:249–58. [ Links ]
44. Hatano S. Experience from a multicentre stroke registry: a preliminary reporto Bull World Health Organ. 1976;54:541–53. [ Links ]
45. Portenog RK, Abissi CJ, Lipton RB. Headache in acute cerebrovascular disease. Stroke 1985;15:1009–12. [ Links ]
46. Cardenas F, Quiroz H, Plancarte A. Taenia solium ocular cysticercosis: findings in 30 cases. Ann OphthalmoI 1992; 24:25–8. [ Links ]
47. Lee A, Brazis P. Clinical Pathways in Neuro–Ophthalmology An Evidence–Based Approach. Estados Unidos: Thieme 1998; 398. [ Links ]
48. Millar N, Newman N. Clinical Neuroophthalmology The Essentials. Baltimore: L W and W 1999; 820. [ Links ]
49. Apuzzo MLJ, Dobkin WR, Zee CS. Surgical considerations in treatment ofintraventricular cysticercosis. An analysis of 45 cases. J Neurosurg 1984;60:400–7. [ Links ]
50. Bittencourt PRM, Gracia CM, Gorz AM. High–dose praziquantel for neurocysticercosis: efficacy and tolerability . Eur Neurol 1990;30:229–34. [ Links ]
51. Carpio A, Santillan F, Leon P, Flores C, Hauser W A. Is the course ofthe neurocysticercosis modified by treatment with antihelminthic agent. Arch Intem Med 1995; 155: 1982–8. [ Links ]
52. Corona T, Lugo R, Medina R. Single–day praziquantel therapy for neurocysticercosis. N Engl J Med 1996; 334: 125. [ Links ]
53. Cruz M, Cruz I, Horton J. Albendazole vs praziquantel in the treatment of cerebral cysticercosis: clinical evaluation. Trans R Soc Trop Med Hyg 1991; 85:244–7. [ Links ]
54. Del Brutto OH. Albendazole therapy for subarachnoid cysticerci: clinical and neuroimaging analysis of 17 patients. J Neurol Neurosurg Psychiatry 1997;62:659–61. [ Links ]
55. Del Brutto OH, Campos X, Sánchez J. Single–day prazi–quantel versus I–week albendazole for c. Neurology 1999; 52:1079–81. [ Links ]
56. Del Brutto OH: Medical treatment ofcysticercosis effective. Arch Neurol 1995; 52:102–4. [ Links ]
57. Del Brutto OH, Sotelo J, Roman GC. Therapy for neurocys–ticercosis: a reappraisal. Clin Infec Dis 1993; 17:730–5. [ Links ]
58. Escobedo F, Penagos P, Rodriguez J. Albendazole therapy for neurocysticercosis. Arch Intem Med 1987; 147:738–41. [ Links ]
59. Garcia HH, Evans CA, Nash TE. Current consensus guidelines for treatment ofneurocysticercosis. Clin Microbiol Rev 2002; 15:747–56. [ Links ]
60. García HH, Gilman RH, Horton J, et al. Albendazole therapy for neurocysticercosis: a prospective double–blind trial comparing 7 versus 14 days oftreatment. Cysticercosis Working Group in Peru. Neurology 1997; 48:1421–7. [ Links ]
61. Garcia HH, Pretell EJ, Gilman RH. A trial of antiparasitic treatment to reduce the rate of seizures due to cerebral cysticercosis . N Engl J Med 2004;350:249–58. [ Links ]
62. López–Gómez M, Castro N, Jung H. Optimization of the single–day praziquantel therapy for neurocysticercosis. Neurology 2001; 1929–930. [ Links ]
63. Medina MT, Genton P, Montoya MC. Effect of anticysticercal treatment on the prognosis of epilepsy in neurocysticercosis: a pilot trial. Epilepsy 1993; 34:1024–7. [ Links ]
64. Pérez López C, Isla Guerrero A, Álvarez F. Actualizacióp en el tratamientode la neurocisticercosis . Rev neurol 2003; 36:805–11 [ Links ]
65. Pretell EJ, Garcia HH, Custodio N, et al: Short regimen ofpraziquantel in the treatment ofsingle brain enhancing lesions. Clin Neurol Neurosurg 2000;102:215–8. [ Links ]
66. Proaño JV, Madrazo l, A velar F. Medical treatment for neurocysticercosis characterized by giant subarachnoid cysts. N Engl J Med 2001; 345:879–85. [ Links ]
67. Riley T, White AC Jr. Management ofneurocysticercosis. CNS Drugs 2003; 17: 577–91. [ Links ]
68. Sotelo J, del Brutto OH, Penagos P. Comparison of therapeutic regimen of anticysticercal drugs for parenchymal brain cysticercosis. J Neurol 1990; 237:69–72. [ Links ]
69. Sotelo J, Escobedo F, Penagos P. Albendazole vs praziquantel therapy for neurocysticercosis. A controlled trial. Arch Neurol 1988; 45:532–4. [ Links ]
70. Sotelo J, Escobedo F, Rodriguez–Carbajal J. Therapy of parenchymal brain cysticercosis with praziquantel. N Engl J Med 1984;310:1001–7. [ Links ]
71. Sotelo J, Torres B, Rubio–Donnadieu F. Praziquantel in the treatment ofneurocysticercosis: a long–term follow–up. Neuro–logy 1985; 35:752–5. [ Links ]
72. Takayanagui OM, Jardim E. Therapy for neurocysticercosis. Comparison between albendazole and praziquantel. Arch Neurol 1992; 49:290–4. [ Links ]
73. Torrealba G, del Villar S, Tagle P, Arriagada P, Kase CS. Cysticercosis of the central nervous system: clinical and therapeutic considerations. J Neurol Neurosurg Psychiatry 1984;47:784–90. [ Links ]
74. White AC Jr. Neurocysticercosis: updates on epidemiology, pathogenesis, diagnosis, and management. Annu Rev Med 2000; 51:187–206. [ Links ]














