Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de neurociencias (México, D.F.)
versión On-line ISSN 1028-5938versión impresa ISSN 0187-4705
Arch. Neurocien. (Mex., D.F.) vol.9 no.3 Ciudad de México sep. 2004
Artículo de revisión
Nutrición en la enfermedad de Alzheimer
Alzheimer disease and nutrition
Aracelí Trejo Contreras
Laboratorio de Nutrición. Instituto Nacional de Neurología y Neurocirugía Manuel Velasco Suárez
Correespondencia:
Aracelí Trejo Contreras.
Instituto Nacional de Neurología y Neurocirugía Manuel Velasco Suárez. Laboratorio de Nutrición.
Insurgentes Sur 3877. Col. la Fama.
14269 México D.F.
E–mail: aratrejoc@hotmail.com
Recibido: 30 octubre 2003.
Aceptado: 9 enero 2004
RESUMEN
La enfermedad de Alzheimer (EA) es un padecimiento degenerativo del sistema nervioso central caracterizado por pérdida de memoria y deterioro de las funciones cognoscitivas. Los pacientes con EA tienen un alto riesgo de desarrollar desnutrición energético–proteínica, la cual se ha asociado con aumento en la morbilidad y mortalidad. Algunos problemas que influyen sobre el estado nutricio de pacientes con EA son la pérdida de la independencia, dificultad para orientarse, desórdenes en el comportamiento para comery deambulación frecuente; en ellos se observa pérdida de peso que tiende a incrementar con la severidad y progresión de la enfermedad, a pesar de que su ingesta de energía es mayor que en sujetos no demenciados. Respecto a la composición corporal se ha reportado que el peso, el índice de masa corporal y el porcentaje de grasa son menores en pacientes con EA comparados con sujetos no demenciados y algunos estudios han reportado que los niveles de vitamina B 12 , tiamina, folato y albúmina son menores en estos pacientes.
Es fundamental evaluar periódicamente el estado de nutrición de estos pacientes, para proporcionar un adecuado aporte de energía y nutrimentos, con la finalidad de mantener un estado nutricio aceptable.
Palabras clave: enfermedad de Alzheimer, nutrición, pérdida de peso.
ABSTRACT
Alzheimer disease (AD) is a degenerative illness of the central nervous system, characterized by memory loss and cognitive dysfunction. A high risk for developing energetic protein malnutrition has been identified in AD patients, which is associated with morbidity and mortality increments. The nutritional status of AD patients is affected by their lack of independency, orientation difficulties, eating behavior disturbance and frequent ambulatory activity, among other problems related with this disease. As a consequence, these patients experience weight loss, which increases according to the severity and progression of the disease, even though energy intake is higher in AD patients as compared with non–demented subjects. In addition, body mass index and body fat percent have been found lower in AD patients than in control healthy subjects, and some studies have also reported decreased levels of B 12 vitamin, thiamine, folate and albumin. Is extremely important to asses periodically the nutritional status of AD patients, in order to maintain adequate energy and nutriments supply, which will be reflected in an acceptable nutritional status.
Key words: Alzheimer disease, nutrition, weight loss.
La enfermedad de Alzheimer (EA) es un padecimiento degenerativo del sistema nervioso central caracterizado por pérdida de memoria y deterioro de las funciones cognoscitivas. Es la forma más común de demencia, por lo general afecta a personas mayores de 60 años de edad, progresando gradualmente en un promedio de 8–10 años 1. Fue descrita por primera vez en 1911 por Alois Alzheimer como un desorden neuropsiquiátrico que afectaba a adultos mayores, estudios tempranos de pacientes afectados con esta enfermedad demostraron la presencia de lesiones en la corteza cerebral, que corresponden a marañas neurofibrilares localizadas en las células neuronales 2y placas neuríticas que están formadas por neuritas, células gliales y una sustancia amiloide 3,4.
Hay dos tipos de enfermedad de Alzheimer: La forma familiar y la esporádica. El 10% de los casos de EA son de tipo familiar y se heredan siguiendo un patrón de herencia autosómico dominante 5.
Los pacientes con EA tienen un alto riesgo de desarrollar desnutrición energético–proteínica 6,7, en pacientes hospitalizados con esta enfermedad la desnutrición está presente hasta en el 50% y se ha asociado con aumento de infecciones, úlceras por presión, fracturas de cadera, disfunción cognitiva, anemia 8, y por lo tanto con incremento en la morbilidad y mortalidad 9. Algunos problemas que se presentan en la demencia y que influyen sobre el estado nutricio son: la pérdida de la independencia, dificultad para orientarse y desórdenes en el comportamiento para comer 10; por lo general éstos van aunados a los cambios propios de la sexta década de la vida, como la disminución de estatura, redistribución del tejido adiposo, disminución de masa muscular, pérdida de agua corporal y de densidad ósea; asimismo la anodoncia, gastritis, deterioro de los sentidos del gusto y olfato, son aspectos que ocasionan deficiencias nutricias 11.
Los pacientes con enfermedad de Alzheimer pueden presentar alteraciones en su estado de nutrición respecto a la pérdida de peso, composición corporal e indicadores bioquímicos.
PÉRDIDA DE PESO CORPORAL
En los individuos con EA con frecuencia se observa pérdida de peso, que incrementa el riesgo de infecciones, úlceras en piel y caídas; lo que consecutivamente disminuye su calidad de vida 10,12.
La pérdida de peso en pacientes con EA fue observada por primera vez por Alois Alzheimer en 1901, después a partir de 1980 varios estudios han observado pérdida de peso en estos pacientes.
Chouinard, et al 13, reportaron que los pacientes con demencia avanzada tienen una pérdida promedio anual del 4%.
Riviére, et al 10, mostraron que a mayor estrés, depresión y cansancio del cuidador, los pacientes con EA tienden a perder más peso. Contrario a esto, Barret–Connor, et al 14, reportaron que la pérdida de peso podría ocurrir antes de que se diagnosticara la demencia; durante 20 años estudiaron sujetos, encontrando que en 60 participantes se diagnosticó EA al final del estudio y habían tenido una disminución significativa del peso corporal.
En estudios avanzados de la EA es común el bajo peso 14, White, et al 15, mostraron que los cambios en el estado de la EA fueron correlacionados significativamente con la pérdida de peso.
Wang, et al 16, reportaron que el peso de los pacientes hospitalizados con demencia fue significativamente menor desde su ingreso y durante su estancia hospitalaria en comparación con los no demenciados, teniendo una pérdida de peso de 4 o más kg durante 4 años de estudio.
Los cambios en cada estudio de la EA se han asociado significativamente con la pérdida de peso, lo cual indica que dicha pérdida tiende a incrementar con la severidad y progresión de la enfermedad; por lo tanto la pérdida, de peso es un predictor de mortalidad entre sujetos con Alzheimer 17.
Se ha reportado que los pacientes con EA pierden peso corporal, a pesar de que su consumo de energía es mayor o igual que sujetos controles, 18que por lo general ocurre en etapas avanzadas y que en muchos casos es inevitable 19,20. Sin embargo, existe una controversia puesto que aunque la pérdida de peso es común en estos pacientes, algunos comen más y ganan peso 21.
MECANISMOS RESPONSABLES DE LA PÉRDIDA DE PESO
Los mecanismos que pueden ser responsables de la pérdida de peso en diferentes etapas son:
1. Etapas tempranas de la enfermedad: hay deterioro del olfato y del gusto, disminución en la ingesta de alimentos debido al deterioro funcional por ejemplo para ir de compras y preparar alimentos; aumento de los requerimientos de energía por deambulación o agitación, aislamiento social, depresión y presencia de otras enfermedades 10,12,21,22. Un estudio comprobó que los pacientes con EA presentan menor peso corporal y mayor consumo de energía que los controles o los pacientes con demencia vascular 18
2. Etapas avanzadas de la enfermedad: los pacientes no reconocen los alimentos, olvidan comer, tienen incapacidad para comer por sí mismos y dependen de alguien para ser alimentados, además presentan anorexia y disfagia 10,23,24.
La anorexia puede ocurrir en estadios avanzados de la enfermedad y asociarse con la pérdida de peso, esto puede ser debido al deterioro en los sentidos del gusto y del olfato o a una disminución del apetito por efecto de medicamentos como los opioides, asimismo a desórdenes neuropsiquiátricos asociados con la enfermedad como la pérdida de memoria, desorientación y deterioro del juicio 25
La disfagia está relacionada con el riesgo aspiración, neumonía, deshidratación crónica y desnutrición; se ha reportado como una causa de muerte inmediata en el 33% de los pacientes con EA 13,26,27.
HIPÓTESIS PARA EXPLICAR LA PÉRDIDA DE PESO
Pocos estudios se han realizado con el objetivo de entender los determinismos del bajo peso en los pacientes con EA. Dos estudios apuntaron sobre la posible importancia de zonas pertenecientes al sistema límbico en la regulación del estado nutricional en los pacientes con EA sin que una clara relación de causalidad pueda todavía ser demostrada. Grundman, et al21 estudiaron pacientes con EA y encontraron una asociación significativa entre la atrofia de diferentes estructuras de la región temporal mesial (uncus, amígdala, hipocampo y giro hipocampal) y un bajo índice de masa corporal (IMC). La atrofía de esta región podría relacionarse con la pérdida de peso en la EA por medio de la alteración cognitiva pero igualmente podrían ser involucrados otros mecanismos. Influyendo la conducta del apetito y la alimentación. Por ejemplo, participan en la pérdida de peso la incapacidad para comprar y preparar alimentos, depender de otros para alimentarse, incapacidad para comunicar que se desea comer, olvidar comer u omitir comidas, descuido dental, depresión secundaria a la pérdida cognitiva, disminución del apetito, pérdida de motivación para preparar alimentos, alteración del olfato y gusto, cambios en la personalidad (combativos), aumento de actividad física y del requerimiento de energía, reducción del estado socioeconómico, reducción de la socialización, aumento de estrés emocional. Además factores asociados con el bajo peso corporal tales como la falta de nutrimentos esenciales, el aumento del cortisol, el aumento del factor de necrosis tumoral y el bajo nivel de estrógenos pueden favorecer la atrofía de la región temporo mesial y el deterioro cognoscitivo o demencia (figura 1). Asimismo, XiaSheng Hu, et al 28utilizando la tomografía por emisión de positrón (PET scan) demostraron que existía una asociación entre una disminución del metabolismo de la glucosa en el giro cingulado anterior y un bajo IMC en los pacientes con EA. Este resultado puede sugerir que el giro cingulado anterior esta involucrado en la regulación del estado de nutrición de estos pacientes.

En sujetos normales la pérdida de peso debida a la restricción de alimentos y a la desnutrición se ha asociado con niveles elevados de cortisol sérico 29. En pacientes con EA los niveles de cortisol están elevados 30, en respuesta a la carga de glucosa, los niveles elevados de cortisol se correlacionan con volúmenes hipocampales pequeños 30. El hipocampo es un sitio que en la EA podría causar pérdida de peso por influir en la conducta del apetito y la alimentación y los niveles de cortisol han sido asociados con deterioro cognoscitivo acelerado. El bajo peso corporal puede contribuir a la presencia de niveles elevados de cortisol en algunos pacientes con EA, la exposición prolongada a cortisol elevado puede inducir a incremento en el daño hipocampal, atrofía de las estructuras de la región temporal mesial y deterioro de la demencia. El IMC bajo en la EA puede ser resultado de una combinación de influencias genéticas, biológicas,de comportamiento y ambientales; la atrofía de la región temporal mesial podría estar correlacionada con el bajo peso corporal en la EA pero no causalmente vinculado a éste.
Respecto a los estrógenos se ha reportado que un nivel bajo es un factor de riesgo potencial para EA en mujeres posmenopáusicas, por lo que el reemplazo de estrógenos en estas mujeres puede mejorar la cognición 31,32
CAMBIOS EN LA COMPOSICIÓN CORPORAL
Los pacientes con EA perecen ser más delgados que la población general, el peso bajo en estos individuos puede incrementar el riesgo de úlceras por decúbito, infecciones y mortalidad 34; sin embargo, algún grado de pérdida de peso y redistribución de la grasa corporal entre la sexta y octava década de la vida es considerada como parte normal del envejecimiento 35. Se ha reportado que cuando aumenta el deterioro cognoscitivo de pacientes con EA, presentan una disminución en sus indicadores antropométricos como el peso corporal, circunferencias y pliegues cutáneos 25. Al respecto se mencionan los siguientes estudios realizados en los que se han comparado compartimientos de la composición corporal de pacientes con EA y sujetos no demenciados:
Berlinger y Potter 12concluyeron que el IMC es 11–13% menor en los pacientes con demencia, en comparación con sujetos controles.
Renvall, et al 36reportaron que el peso, el índice de masa corporal y el porcentaje de grasa tuvieron valores menores en pacientes con EA comparados con un grupo control; sin embargo, los valores del porcentaje de masa magra y agua corporal fueron mayores en los casos que en los controles.
Cronnin–Stubbs, et al 19examinaron que la EA era un factor de riesgo para la pérdida de peso y encontraron que el IMC disminuía significativamente más que en los sujetos sin EA.
ALTERACIONES EN LOS INDICADORES BIOQUÍMICOS
Algunos estudios han reportado que los niveles de vitamina B 12 y tiamina son 25% menores en pacientes con EA al compararse con un grupo control 37.
Clarke, et al 38 reportaron que los niveles de folato y vitamina B12 fueron significativamente menores en pacientes con EA comparados con sujetos no demenciados.
Levitt y Karlinsky 39sugieren una relación entre niveles bajos de vitamina B12 y la severidad del deterioro cognoscitivo en pacientes con EA.
Spindler, et al 23reportaron niveles bajos de albúmina en mujeres con EA, además se ha encontrado que la pérdida de peso corporal se acompaña de una disminución de albúmina; sin embargo, Berlinger y Potter 12reportaron niveles normales de albúmina en pacientes demenciados y no demenciados.
TRATAMIENTO NUTRICIO
Identificar riesgo de desnutrición: es fundamental identificar el riesgo de presentar desnutrición en los pacientes con enfermedad de Alzheimer, lo cual puede llevarse a cabo a través de la evaluación mínima del estado de nutrición (The Mini Nutritional Assessment–MNA) 8,10, que es un instrumento estandarizado y validado en dos estudios realizados en Toulose (Francia) y en Nuevo México (Estados Unidos de Norteamérica) 40. La MNA permite obtener una evaluación rápida del estado de nutrición en individuos de la tercera edad, está compuesto por los siguientes apartados: evaluación antropométrica, evaluación general, evaluación dietética y percepción de sí mismo en relación con la salud y nutrición. La puntuación obtenida permite clasificar en tres categorías el estado de nutrición: normal (24 puntos), riesgo de desnutrición (17–23.5 puntos) y desnutrición (< 17 puntos) 41. cuadro 1.
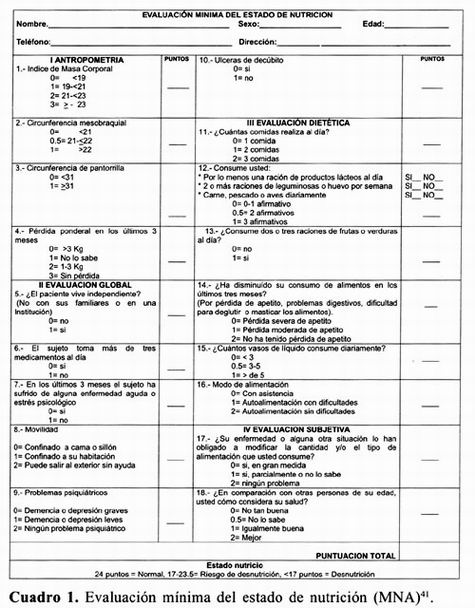
Además del MNA puede utilizarse un cuestionario para detectar desnutrición en adultos mayores, que permite conocer el riesgo de presentar desnutrición a través de una puntuación que incluye aspectos sobre la salud y la alimentación, y se clasifica de la siguiente manera 0–2 puntos: Sin riesgo, 3–5 puntos: riesgo moderado y > 6 puntos: riesgo alto. cuadro 2.

Evaluación del estado de nutrición: Es importante evaluar periódicamente el estado de nutrición a través de antropometría, indicadores bioquímicos, inmunológicos y clínicos.
a . Antropometría: los indicadores antropométricos que pueden medirse son los siguientes:
– Peso corporal: representa la suma de todos los componentes corporales que son la grasa, agua, proteínas, minerales y glucógeno; es de utilidad evaluar sus cambios como el porcentaje de peso ideal, porcentaje de pérdida de peso y el porcentaje de peso habitual 43,44.
– Estatura: representa la suma de la altura de las extremidades inferiores, pelvis, columna vertebral y cráneo. Debido a que en los adultos mayores es común la cifosis, la escoliosis o la dificultad para deambular; la talla puede estimarse a partir de la medida de la altura de rodilla o de la envergadura 45,46.
– Pliegues cutáneos: se emplean para medir el grado de adiposidad e indican las reservas energéticas corporales. Los que se miden con mayor frecuencia son el tricipital, bicipital,subescapular y suprailiaco 47–49.
A pesar de que las mediciones antropométricas son de utilidad en la evaluación del estado de nutrición, pueden ser difíciles de obtener en población geriátrica y sobre todo con enfermedad de Alzheimer, por lo que pueden resultar mediciones inseguras 50
b . Indicadores bioquímicos: la albúmina sérica es la más utilizada en la práctica clínica, el nivel menor a 3.5 g/dL puede ser un indicador de desnutrición 51. También es de utilidad el nivel de proteínas séricas; sin embargo, al igual que la albúmina, su depleción no es necesariamente un indicador de desnutrición, puesto que sus niveles también pueden disminuir por enfermedades hepáticas, enfermedades renales, falla cardiaca congestiva, diarrea y síndrome de mala absorción 50.
c . Indicadores inmunológicos: en la desnutrición la cuenta total de linfocitos se observa disminuida; sin embargo, sus niveles aumentan con la presencia de infecciones o pueden elevarse en estrés metabólico, cáncer, terapia con esteroides y en el posoperatorio 52,53.
d . Indicadores clínicos: es importante observar signos clínicos que indican deficiencias nutricionales. El edema en extremidades inferiores o región sacra puede indicar hipoproteínemia o retención de sodio, las lesiones en la piel como petequías o hemorragias subcutáneas pueden deberse a una deficiencia de vitaminas C y K. Las conjuntivas pálidas pueden indicar presencia de anemia ferropénica. La queilosis angular de los labios puede deberse a una deficiencia de riboflavina y el desprendimiento fácil del cabello a una deficiencia de zinc 54.
Requerimiento energético: al estudiar el gasto energético en reposo a través de calorimetría indirecta en pacientes con enfermedad de Alzheimer, se ha encontrado que sus requerimientos de energía están incrementados significativamente al compararlos con un grupo control 55, y su ingesta de calorías es mayor que sujetos no demenciados 56.
El cálculo individual de los requerimientos de energía ha sido un problema debido a los siguientes factores 57.
1 . El cálculo de la ingesta de energía a través de encuestas dietarias de recordatorio es inseguro, debido al deterioro cognoscitivo.
2 . El uso de diferentes mediciones de la tasa metabólica basal o gasto energético en reposo para predecir las necesidades de energía.
3 . La falta de exactitud sobre recomendaciones diarias de energía para los diversos estados de la enfermedad, composición corporal y actividad física del adulto mayor.
Para predecir las necesidades diarias de energía Poehlman y Dvorak 57midieron el gasto energético total con el método de agua doblemente marcada y la composición corporal con DEXA (Dual–Energy X–ray Absortiometry) y examinaron el gasto energético en reposo, masa libre de grasa y peso corporal; después obtuvieron la siguiente ecuación para predecir el gasto energético total (GET):
GET (MJ/d)=[0.141 x peso corporal (kg)] – 0.720.
Sin embargo, estos autores sugieren que la seguridad de la ecuación necesita evaluarse en poblaciones independientes de pacientes con enfermedad de Alzheimer.
Spindler, et al 23sugieren proporcionar un aporte energético de 35 kcal/kg/día y Finley 6menciona que las necesidades de energía pueden cubrirse con dietas hipercalóricas de 3000–4000 kcal/día.
Recomendaciones de nutrimentos: para los pacientes con enfermedad de Alzheimer se sugieren las mismas recomendaciones de nutrimentos que para los adultos mayores. Es fundamental cubrir las recomendaciones de vitaminas y minerales, cuya deficiencia es frecuente en esta etapa de la vida. (piridoxina, cobalamina, folatos, tiamina, vitamina D, zinc, hierro y calcio) cuadro 3.

Se ha propuesto incluir en el tratamiento de la EA, el uso de antioxidantes tales como las vitaminas C y E 59 . En un estudio publicado por Sano, et al 60, reportaron que el tratamiento con vitamina E a dosis de 2000 UI/día durante un período de 7.4 meses, evita la oxidación de las membranas y retarda el avance de la enfermedad.
Sugerencias para mejorar la alimentación : Debido al elevado requerimiento energético y a las implicaciones nutricionales en la enfermedad de Alzheimer, es importante llevar a cabo las siguientes estrategias para prevenir la pérdida de peso y mejorar su estado de nutrición. 10,22–24,57
•Incluir en cada comida alimentos que proporcionen energía, proteínas, vitaminas y minerales.
• Proporcionar alimentos con alta densidad energética.
• Tener una frecuencia en los tiempos de comida, para lo cual se pueden proporcionar de 5–6 comidas durante el día o colaciones entre las comidas principales.
• Servir un alimento a la vez.
• Proporcionar como sea posible, alimentos que puedan tomarse con los dedos, ya que no requieren de utensilios para comerse e incrementan la ingesta de energía.
• Tomar suficientes líquidos.
• En los casos que se presente disfagia se debe modificar la textura y consistencia de los alimentos que pueden ser suaves, purés, picados finos, o líquidos espesos. Se recomienda utilizar vajillas y cubiertos irrompibles, sentar al paciente correctamente con la espalda recta, colocar poca comida en la boca y no hablar mientras se come.
Apoyo nutricio : para incrementar el aporte energético pueden emplearse complementos nutricionales por vía oral 10, en casos severos en los que el paciente no pueda consumir alimentos por esta vía se sugiere el apoyo nutricio enteral, que puede ser a través de una sonda de gastrostomía endoscópica percutánea 61,62.
Franzoni, et al 9, concluyeron que cuando la asistencia nutricional es apropiada en los pacientes con demencia no puede desarrollarse desnutrición.
CONCLUSIÓN
En la práctica clínica se requiere asegurar la ingesta adecuada de energía y nutrimentos en los pacientes con enfermedad de Alzheimer, para mantener un estado nutricio adecuado y contribuir a mejorar su calidad de vida
AGRADECIMIENTOS
Se agradece a la doctora Agnes Fleury por sus valiosas observaciones.
REFERENCIAS
1. Samll GW, Rabins PY, Barry PP. Diagnosis and treatment of Alzheimer's disease and related disorders. JAMA 1997;278;1363–7. [ Links ]
2. Graever MB, Kosel S, Egensperger R. Rediscovery of the case described by Alois Alzheimer in 1911: historical, histological and molecular genetic analysis. Neurogenetics 1997;1:73. [ Links ]
3. Kamboh MI. Apolipoprotein E polymorphism and susceptibility to Alzheimer's disease. Human Biology 1995;67:195–215. [ Links ]
4. Dewji MS, Tangalos EG, Petersen RC. Apolipoprotein E. Risk Factor for Alzheimer Disease. Am J Hum Genet 1994;54:643–9. [ Links ]
5. Marx J. Alzheimer's research moves to mice, the first mouse models for studying amyloid's role in Alzheimer's may help solve one of the most vexing issues in research on the neurode–generative disease. Science 1991;253;266–7. [ Links ]
6. Finley B. Nutritional needs of the person with Alzheimer's disease: practical approaches to quality care. J Am Diet Assoc 1997;97:S177–80. [ Links ]
7. Young KW, Greenwood CE. Shift in diurnal feeding patterns in nursing home residents with Alzheimer's disease. J Gerontol A Biol Sci Med Sci 2001;56:700–6. [ Links ]
8. Morley JE. Dementia is not necessarily a cause of under–nutrition. JAGS 1996;44:1403–4. [ Links ]
9. Franzoni S, Frisoni GB, Boffelli S, Rozzini R, Trabucchi M. Good nutritional oral Intake Is associated with equal survival in demented and nondemented very old patients. JAGS 1996;44:1366–70. [ Links ]
10. Riviére S, Gillette–Guyonnet, Nourhashemi F, Vellas B. Nutrition and Alzheimer's disease. Nutr Rev 1999;57:363–7. [ Links ]
11. Gutiérrez LM, Llaca MC. Nutrición del Anciano. En: Nutriología Médica. Casanueva E, Kaufer–Horwitz M, Pérez–Lizaur A, Arroyo P. (Eds.) Médica Panamericana. México, 2000:152–74. [ Links ]
12. Berlinger WG, Potter JF. Low body index in demented out patients. JAGS 1991;39:973–8. [ Links ]
13. Chouinard J, Lavigne E, Villenueve C. Weight Loss, Dysphagia, and Outcome in Advanced Dementia. Dysphagia 1998;13:151–5. [ Links ]
14. Barret–Connor E, Edelstein SL, Corey–Bloom J, Wiederholt WC. weight loss precedes dementia in community–dwelling older adults. JAGS 1996;44:1147–52. [ Links ]
15. White H, Pieper C, Schmader K. A longitudinal analysis of weight change in Alzheimer's disease. JAGS 1997;45:531–3. [ Links ]
16. Wang S, Fukagawa N, Hossain M, Ooi W. Longitudinal weight changes, length of survival, and energy requirements of long term care residents with dementia. JAGS 1997;45:1189–95. [ Links ]
17. White H, Pieper C, Schmader K. The association of weight change in Alzheimer's disease with severity of disease and mortality: a longitudinal analysis. JAGS 1998;46:1223–7. [ Links ]
18. Niskanen L, Piirainen M, Koljonen M, Uusitupa M. Resting energy expenditure in relation to energy intake in Patients with Alzheimer's Disease, multi–infarct dementia and control women. age ageing 1993;22:132–7. [ Links ]
19. Cronin–Stubbs D, Beckett LA, Scherr PA. Weigth loss in people with Alzheimer's disease: a prospective population based analisys. BMJ 1997;314:178–9. [ Links ]
20. Clagget MS. Nutritional factors relevant to Alzheimer's disease. J Am Diet Assoc 1989;89:392–6. [ Links ]
21. Grundman M, Corey–Bloom J, Jernigan T, Archibald S. Low body weight in Alzheimer's disease is associated with mesial temporal cortex atrophy. Neurol 1996;46:1585–91. [ Links ]
22. Soltesz KS, Dayton JH. Finger foods help those with Alzheimer's maintain weight. J Am Diet Assoc 1993;93:1106–8. [ Links ]
23. Spindler A, Renvall MJ, Nichols JF, et al. Nutritional status of patients with Alzheimer's disease: a 1–year study. J Am Diet Ass 1996;96:1013–9. [ Links ]
24. Davis J, Kim S. Applied Nutrition and Diet Therapy for Nurses. 2nd. Edition. W. B. Saunders Company. USA, 1994. [ Links ]
25. Gillette–Guyonnet S, Nourhashémi F, Andrieu S, et al. Weight loss in Alzheimer disease. Am J Clin Nutr 2000;71:637S–42S. [ Links ]
26. Chouinard J. Dysphagia in Alzheimer disease: a review. J Nutr Health Aging 2000;4:214–217. [ Links ]
27. Kirshner HS. Causes of neurogenic dysphagia. Dysphagia 1989;3:184–8. [ Links ]
28. XiaSheng Hu, Lobuyuki Okamura, Hiroyuki Arai, et al. Neuroanatomical correlates of low body weight in Alzheimer's disease: a PET study. Progress in Neuro–Psychopharmacology and Biological Psychiatry 2002;26:1285–9. [ Links ]
29. Weiner MF, Davis BM, Mohs RC, Davis KL. Influence of age and relative weight on cortisol suppression in normal subjects. Am J Psychiatry 1987;144:646–9. [ Links ]
30. Davis KL, Davis BM, Greenwald BS, et al. Cortisol and Alzheimer's disease. I. Basal studies. Am J Psychiatry 1986;143:300–5. [ Links ]
31. De Leon MJ, McRae T, Tsai JR, et al. Abnormal cortisol response in Alzheimer's disease linked to hippocampal atrophy. Lancet 1988;2:391–2. [ Links ]
32. Fillit H, Weinreb H, Cholst I. et al. Observations in a preliminary open trial of stradiol therapy for senile dementia– Alzheimer's type. Psychoneuroendocrinology 1986;11:337–45. [ Links ]
33. Honjo H, Ogino Y, Naitoh K, et al. In vivo effects by strone sulfate on central nervous system–senile dementia (Alzheimer's type). J Steroid Biochem 1989;34:521–5. [ Links ]
34. Pinchcofsy–Devin GD, Kaminsky JR. MV: Correlation of pressure sores and nutritional status. J Am Geriatric Soc 1986;34:435. [ Links ]
35. Shimokata H, Tobin JD, Muller DC, Elahi D, Coon PJ, Andres R. Studies in the distribution of body fat, I: Effects of age, sex, and obesity. J Gerontol 1989;44:M66–M72. [ Links ]
36. Renvall MJ, Spindler AA, Nichols JF, et al. Body composition of patients with Alzheimer's disease. J Am Diet Ass 1993;93:47–52. [ Links ]
37. Folstein M. Nutrition and Alzheimer's disease. Nutr Rev 1997;55:23–5. [ Links ]
38. Clarke R, Smith D, Jobst KA,. Folate, vitamin B12, and serum total homocysteine levels in confirmed Alzheimer disease. Arch Neurol 1998;55:1449–55. [ Links ]
39. Levitt AJ, Karlinsky H. Folate, vitamin B12 and cognitive impairment in patients with Alzheimer's disease. Acta Psychiatr Scand 1992;86:301–5. [ Links ]
40. Velázquez AMC, Irigoyen CME, Llaca MC. La evaluación mínima del estado de nutrición en ancianos (The mini nutritional assessment, MNA). Nutrición Clínica 2000;3:107–11. [ Links ]
41. Nourhashemi F, Guyonnet S, Ousset PJ, et al. Mini Nutritional Assessment and Alzheimer patients. Nestle nutr workshop ser Clin Perform Programme 1999;1:87–91. [ Links ]
42. Hensrud D. Nutrition screening and assessment. Medical Clinics of North America 1999;83:1525–46. [ Links ]
43. Heymsfield SB, Matthews D. Body Composition: Research and Clinical Advances–1993 ASPEN Research Workshop. JPEN 1994;18:91–102. [ Links ]
44. Grant JP. Nutritional Assessment in Clinical Practice. In: In: Bell SJ, Matarese LE, Heymsfield SB, eds. Nutrition assessment anthology. Aspen Publications, Silver Spring, 1991:24. [ Links ]
45. Chumlea WC, Roche AF, Steimbough ML. Estimation stature from knee height for persons 60 to 90 years of age. JAGS 1985;33:116–20. [ Links ]
46. Mitchel C, Lipschitz D. Arm length, measurements as an alternative to height in nutritional assessment of the elderly. JPEN 1982;33:226–9. [ Links ]
47. Fajardo A, Eichner B, Muñiz I. Diccionario de Términos de Nutrición. Auroch. México, 1996. [ Links ]
48. Morrow FD, Sahyoun N, Jacob RA. Clinical Assessment of the Nutritional Status of Adults. In: Nutritional Biochemistry and Metabolism with Applications. Linder CM (Eds) Appleton and Lange USA, 1991:393–5. [ Links ]
49. Gray G. Anthropometric measurements and their interpretation: Principles, practices and problems. J Am Diet Ass 1980;77:534–8. [ Links ]
50. Grixty R. Assessing nutrition in older patients. Elderly Care 1999;11:12–5. [ Links ]
51. Ize LL. Evaluación nutricional. En: Nutrición enteral y parenteral. Villazón S, Arenas MH (Eds.) Interamericana. 1ª Edición México, 1993:53. [ Links ]
52. Hopkins B. Assessment of Nutritional Status. In: Nutrition support dietetics core curriculum. Gottschlich MM, Matarese LE, Shronts EP (Eds.) ASPEN Publication 1993:30–43. [ Links ]
53. Gibson RS. Principles of Nutritional Assessment. Oxford University Press, New York, 1990. [ Links ]
54. Khursheed N. Jeejeebhoy. Clinical and Functional Assessments. In: Modern nutrition in health and disease. Shills ME, Goodhart RS (Eds.) Lea Febiger 1994:805–11. [ Links ]
55. Wolf–Klein GP, Silverstone FA, Lansey SC, et al. Energy requirements in Alzheimer's disease patients. Nutrition 1995;11:264–68. [ Links ]
56. Otsuka M, Yamaguchi K, Ueki A. Similarities and differences between Alzheimer's disease and vascular dementia from the viewpoint of nutrition. Ann N Y Acad Sci 2002;977:155–61. [ Links ]
57. Poehlman ET, Dvorak RV. Energy expenditure, energy intake, and weight loss in Alzheimer disease. Am J Clin Nutr 2000; 2:650S–5S. [ Links ]
58. Clarke R. Prevention of vitamin B12 deficiency in old age. Am J Clin Nutr 2001;73:151–2. [ Links ]
59. Tabet N, Mantle D, Walker Z, et al. Vitamins, trace elements, and antioxidant status in dementia disorders. Int Psychogeriatr 2001;13:265–75. [ Links ]
60. Sano M, Tomas RG, et. al. A controlled trial of selegiline, alpha–tocopherol, or both as treatment for Alzheimer's disease. N Eng J Med 1997;36:1216–22. [ Links ]
61. Finucane TE, Christmas C, Travis K. Tube feeding in patients with advanced dementia: A review of the evidence. JAMA 1999;282:1365–70. [ Links ]
62. Park RH, Allison MC, Lang J, et al. Randomised comparison of percutaneous endoscopic gastrostomy and nasogastric tube feeding in patients with persisting neurological dysphagia. BMJ 1992;304:1406–9. [ Links ]














