Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de neurociencias (México, D.F.)
versión On-line ISSN 1028-5938versión impresa ISSN 0187-4705
Arch. Neurocien. (Mex., D.F.) vol.9 no.3 Ciudad de México sep. 2004
Artículo de revisión
Daño neurológico secundario a hipoxia isquemia
perinatal
Neurological damage due to perinatal isquemia
Gabriela Romero Esquiliano, Ignacio Méndez Ramírez, Armando Tello Valdés,
Carlos A. Torner Aguilar
Departamento de atención a la Salud. Universidad Autónoma Metropolitana Xochimilco
Correspondencia:
Gabriela Romero Esquiliano.
Calz. del Hueso 1100. Col. Villa Quietud.
14960 México D.F.
E–mail: gromero@cueyatl.uam.mx
Recibido: 31 mayo 2004.
Aceptado: 7 junio 2004.
RESUMEN
En este trabajo se revisan los eventos relacionados a la presencia de alteración hipóxicoisquémica en el periodo perinatal, tales como, la condición al nacimiento, el bajo peso al nacimiento, la etapa de maduración del sistema nervioso central (SNC), la extensión y/o duración del evento, además de la presencia de enfermedades concomitantes: neuroinfecciones, desnutrición, pobre estimulación ambiental, alteraciones metabólicas, tóxicos, entre otros, son factores que confluyen y condicionan el daño neurológico subsiguiente constituyendo combinaciones de riesgos que determinan la presencia y severidad de las alteraciones. Con esto, se esclarece la perspectiva de que el daño neurológico secundario a la hipoxia–isquemia es un proceso que puede derivar en la manifestación de secuelas neurológicas, tales como: parálisis cerebral, deficiencia mental, alteraciones sensoriales auditivas o visuales, crisis convulsivas, entre otras.
Palabras clave: asfixia perinatal, encefalopatía, hipoxia–isquemia, daño neurológico.
ABSTRACT
This work review the events related to the presence of hypoxic and ischemic disorders in the perinatal period, such as: the condition at birth, the birth weight, the maturational stage of the central nervous system (SNC), the extension and duration of the injury, the presence of accompany iIInesses, neuroinfection, malnutrition, poor environmental stimulation, metabolic derangements, toxic alterations, among other. These are factors that may converge constituting combinations of risks that may induces the presence and severity of the subsequent neurological damage. With this perspective, the secondary neurological damage to the hypoxicischemic is clarified as a process that can derive in the manifestation of neurological sequels, such as, cerebral paralysis, mental deficiency, auditory or visual sensorial alterations, and seizures, among other.
Key words: neurological damage, neurological outcome, perinatal hypoxic–ischemic, neurological sequels.
El daño neurológico perinatal es considerado como la lesión del cerebro que altera la integridad estructural y funcional del sistema nervioso en desarrollo secundario a un evento perinatal. En él se incluye la encefalopatía perinatal, que es un proceso con perfiles neuropatológicos y clínicos que condicionan deficiencias neurológicas severas no progresivas 1 . Representa causa frecuente de secuelas neurológicas tales como: parálisis cerebral, retardo mental, epilepsia, alteraciones sensoriales y trastornos del aprendizaje en preescolares, entre otras 2.
La existencia de diversos eventos que contribuyen a la presencia de alteraciones del desarrollo es bien conocido y establecido en la literatura, entre ellos la condición en la que nace el neonato de término (entre 37 y 42 semanas de gestación) o pretérmino (menor a 37 semanas de gestación), además de la presencia de diversas enfermedades en las etapas pre, trans o posnatal inmediata. Son algunos de los factores considerados como de riesgo para diferentes enfermedades, entre ellas la encefalopatía y su consecuencia el daño neurológico 1–7.
Dentro de las causas conocidas que pueden determinar el daño neurológico se encuentran la hemorragia peri e intraventricular, las encefalopatías hipóxico–isquémicas y metabólicas, la hiperbilirrubinemia, las neuroinfecciones, las anormalidades cerebrales y las crisis convulsivas neonatales 2,5.
La encefalopatía hipóxico–isquémica (EHI) se considera la causa más frecuente de daño neurológico 1.2.4 , ha sido definida como el síndrome que presenta el recién nacido secundario a la hipoxia o isquemia, debido a la disminución del oxígeno y el flujo sanguíneo en el sistema nervioso central. Este síndrome cursa con alteración de las funciones neurológicas en los primeros días de vida, con dificultad para iniciar y mantener la respiración, con depresión del tono muscular y de los reflejos, con estados anormales de la conciencia, y en algunos casos, la presencia de convulsiones. Esta definición se sustenta en los signos que manifiesta el recién nacido, que son usualmente registrados y comparados en los diferentes grupos de riesgo, sin deducir los mecanismos etiológicos a través de los cuales se presenta 8.
EPIDEMIOLOGÍA
La EHI representa la causa más frecuente de padecimientos neurológicos en el período posnatal temprano, es origen de secuelas neurológicas a corto, mediano y largo plazo, tales como: retraso psicomotor, sordera, ceguera, parálisis cerebral, crisis convulsivas, trastornos de conducta y aprendizaje, entre otras 8,9.
Se estima en diversos países que entre el 2 y 4 de cada 1,000 recién nacidos de término sufren asfixia antes o durante el parto. Aproximadamente entre el 15 y el 20% de ellos fallecen en el periodo neonatal (cifra que alcanza el 60% en prematuros). De los que sobreviven, el 25% presenta déficit neurológico. La incidencia de encefalopatías del recién nacido en diversos estudios epidemiológicos de la neurología neonatal reportan entre 1.9 y 3.8 en 1,000 nacidos vivos 5,10.
Estos estudios evalúan la presencia de encefalopatía del recién nacido, no solo por interés intrínseco, sino como indicador cualitativo de la evolución del embarazo y del parto, que con frecuencia es referenciado como un índice pronostico a largo plazo de la presencia de secuelas 10,11.
En México la existencia de datos epidemiológicos que permitan conocer la dimensión del problema son escasos. En el Instituto Mexicano del Seguro Social, González, et al (1985) 4 reportaron la incidencia de EHI de 14.6 por cada 1,000 recién nacidos vivos, con una letalidad del 8.5% y un índice de secuelas de 3.6%.
El XII censo de población del año 2000 en México, reporta datos generales que permiten inferir la magnitud de la EHI, se reportaron 2,098,212 recién nacidos vivos; ciertas afecciones originadas en el período perinatal fueron referidas como la 6ª causa de egreso hospitalario en el rubro morbilidad hospitalaria, representando el 4.4 % por entidad federativa, las relacionadas con el embarazo, parto y puerperio representaron el 33.9% de la morbilidad hospitalaria total. El porcentaje de defunciones en menores de un año relacionadas con ciertas afecciones originadas en el período perinatal para este mismo año fue de 50.2% y las infecciones respiratorias agudas del 2.4% 12.
Las estadísticas de egresos hospitalarios del sector publico del 2002, hacen referencia a datos de morbilidad y mortalidad de los principales representantes del sector salud (Secretaria de Salud, Instituto Mexicano del Seguro Social, Instituto de Seguridad y Servicios para los trabajadores del Estado, Petróleos Mexicanos, SEDENA, Secretaria de Marina) 13 . En el rubro clasificado como afección principal (morbilidad), las referidas a ciertas afecciones relacionadas con el periodo perinatal, presentaron en promedio una tasa de 207.8/100,000 habitantes en hombres y de 159/100,000 habitantes en mujeres, representando el 7.9 % y 2.9% respectivamente del total de la morbilidad hospitalaria en México. La dificultad respiratoria del recién nacido y otros trastornos respiratorios originados en el periodo perinatal representaron el porcentaje más alto de la morbilidad, todos ellos cursaron quizá con algún grado de encefalopatía principalmente hipóxico–isquémica. Con relación a la causa básica de mortalidad según causa de defunción por grupos de edad en el sector publico, ciertas afecciones relacionadas con el período perinatal representaron el 33 % (12,743 casos de ambos sexos), el 100% de ellas ocurridas en menores de un año. Del total de 99,489 niños que presentaron la morbilidad, murieron el 12.8%, mientras que el resto (89,746 niños) sobrevivió y constituye el grupo de riesgo de presentar daño neurológico, y durante su desarrollo diversos tipos y severidades de secuelas neurológicas. El porcentaje de discapacidad general nacional en el 2002 fue de 1,84 %, de un poco más de cien millones de habitantes 13.
La Organización Mundial de la Salud (OMS) estima que cada año hay cuatro millones de niños recién nacidos que presentan asfixia de los cuales 800,000 desarrollarán secuelas neurológicas y un número similar fallecerán como consecuencia de estos eventos 14.
Estudios como el de Iriondo M. 15 , señalan que alrededor del 40% de los neonatos con asfixia presentan diversos grados de EHI originándose el 90 % de las lesiones cerebrales antes o durante el parto, la incidencia es de 6/1000 recién nacidos a término, presentando a la asfixia como la 5ª causa de muerte neonatal. Se ha descrito que entre el 3 y 13 % de todos los niños con secuela estructurada tuvieron signos de sufrimiento fetal durante el parto, situación que podría ser prevenible en diferentes formas. Ruíz–Extremera, et al 6 , reportan que en la última década la prematurez es una de las causas de patología neurosensorial severa, afectando entre el 10 y 15 % de los neonatos de bajo peso, 13% de neonatos prematuros de bajo peso tendrán parálisis cerebral. Mientras que en el grupo de término nacidos con asfixia y presentan datos de encefalopatía moderada 5% morirá y 20 % presentará secuelas severas; cuando la encefalopatía es severa, el riesgo de morir es de 27–60% y el de desarrollo de secuelas es entre el 50 y 100%. Reportando que en España la incidencia de secuela neurológica atribuida a la hipoxia isquemia es de 16.5% y de parálisis cerebral es de 2.6% 6.
En Estados Unidos de Norteamérica aproximadamente 50,000 niños nacen al año con un peso menor a los 1,500 g, debido a los avances tecnológicos de las unidades de cuidados intensivos, el 85% de ellos sobreviven, pero entre el 5 y el 15% presentan déficit motores mayores de tipo espástico agrupados bajo el rubro de parálisis cerebral y entre un 25 y 50% presentan alteraciones del desarrollo menos evidentes que involucran no sólo el movimiento sino la cognición y la conducta1. Otras autores reportan entre 5 y 15% la presencia de alteraciones del desarrollo en niños secundarias a daño perinatal 9,10.
EL RIESGO DE PRESENTAR DAÑO NEUROLÓGICO
Entre los factores biológicos conocidos que contribuyen a la presencia de daño se encuentran enfermedades de la madre como toxemía, diabetes, infecciones durante el embarazo, enfermedades isquémicas, drogadicción, entre otras; en el feto: placenta previa, colapso del cordón, polihidramnios, fetos múltiples; en el recién nacido: la insuficiencia respiratoria por apneas prolongadas y repetidas, enfermedad por membrana hialina, cardiopatías congénitas cianosantes o persistencia de circulación fetal, sepsis con colapso cardiovascular secundario y asfixia al nacimiento. En el RN a término, la asfixia intrauterina e intraparto es la responsable del 80 al 90% del síndrome hipóxicoisquémico 3,11,16,17 . En la tabla 1, se listan algunos de los factores asociados con la presencia del daño neurológico en diversos estudios.

Los factores de riesgo social también contribuyen en forma importante para la presencia de alteraciones o secuelas del desarrollo y al aparecer en forma conjunta con los factores de riesgos biológicos aumentan la probabilidad de presentar daño, secuela o invalidez. Se han utilizado diversos indicadores del llamado riesgo social o desventaja social como la condición ocupacional de la familia, el nivel escolar de la madre, la economía familiar, el contexto étnico y la estimulación en el hogar. Desconociéndose en forma clara el peso que tienen estos factores tanto para la presencia y severidad del daño como para la secuela neurológica 18,19.
Diversos autores 3.8.10,20,21 , han señalado la asociación entre la presencia de factores de riesgo y la presencia de secuelas (parálisis cerebral y retraso mental) a largo plazo, determinando los diferentes estadios que van del daño a la secuela como parte de un mismo proceso, el riesgo de presentación del daño o la secuela aumenta si los factores que se presentan son múltiples en un momento dado. Existen diversos indicadores para reconocer tanto los factores de riesgo, como la presencia del daño, su severidad y/o el diagnóstico de las secuelas, estos indicadores han sido determinados y utilizados en la practica clínica, como ejemplo, para el caso de la encefalopatía hipóxico–isquémica: la presencia de acidemia mixta o metabólica, Apgar de 0 a 3 en los primeros cinco minutos, presencia de convulsiones, coma o hipotonía y alteraciones en diversos sistemas (gástrico, pulmonar, renal, hemático, etc.); sin embargo, al no considerarse como un proceso secuencial, se obtienen datos aislados que no siempre reflejan la complejidad del proceso, limitando la identificación de los factores causales y/o el diagnóstico oportuno.
DAÑO NEUROLÓGICO
En la etapa perinatal, existe vulnerabilidad del cerebro a los diferentes factores tanto biológicos como ambientales que interfieren con el desarrollo normal de las estructuras y la organización de sus funciones, que pueden interrumpir la secuencia de eventos propios del desarrollo y determinar la presencia de una alteración neurológica de diversas severidades y diferentes expresiones 7,22.
La vulnerabilidad intrínseca de sistemas y tipos de células específicas en el cerebro en desarrollo, determinan el patrón final de daño y alteración funcional. Los procesos de desarrollo susceptibles son: la organización cerebral que se inicia a partir del 5° mes de gestación hasta años después del nacimiento, y la mielinización caracterizada por la adquisición de mielina altamente especializada alrededor de los axones, proceso acelerado después del nacimiento que progresa de lo posterior a lo anterior en el sistema sensorial y en el sistema motor de lo proximal a lo distal. Los eventos principales, periodos críticos y alteraciones subsecuentes se encuentran sintetizados en la tabla 2 23 . La encefalopatía hipóxico–isquémica perinatal (EHI), presenta un conjunto de manifestaciones clínicas y neuropatológicas que ocurren en el RN tras un episodio de asfixia, siendo necesario diferenciar con claridad la asfixia de la encefalopatía, dado que fisiopatológicamente son diferentes, aunque sean eventos secuenciales: la asfixia es causa, mientras que la encefalopatía es efecto; sin embargo, no siempre la asfixia produce EHI, ni en todas las lesiones se encuentra el factor asfixia 10 . El entendimiento de los mecanismos subyacentes al daño cerebral por hipoxia isquemia han avanzado con rapidez en los últimos años 7 . Entre los mecanismos para la producción de la alteración neurológica, la deficiencia en la oxigenación del tejido es el factor más importante, el déficit de oxigenación puede ocurrir por hipoxemia (disminución del oxígeno a nivel sanguíneo), o por isquemía (disminución de la perfusión sanguínea en el tejido), quizá, ambas ocurren simultáneamente o en secuencia. La asfixia es referida a la dificultad en el intercambio de gases, la cual puede ocurrir no sólo por la deficiencia de oxígeno en la sangre, sino también por un exceso de bióxido de carbono 24,25

La asfixia provoca cambios fisiológicos y bioquímicos que contribuyen al efecto alterado sobre el SNC del recién nacido, siendo los principales: la alteración del flujo sanguíneo y la liberación de aminoácidos que tienen funciones de neurotransmisores excitatorios, tales como los ácidos glutámico y aspártico. La excitotoxicidad (muerte neuronal y de otras células), es causada por la sobre–estimulación excitatoria, principalmente por el glutamato, quien juega un papel crítico en el proceso de daño. Células de diversos circuitos neuronales así como ciertas poblaciones de células gliales, y la oligodendroglía periventricular inmadura, pueden morir por la activación de la excitoxicidad en la EHI, este proceso se ha asociado a la presencia de algunos tipos de síndromes clínicos neurológicos o secuelas neurológicas, así como a algunas formas de parálisis cerebral 26.
Otro de los efectos adversos en estas condiciones es la aceleración del metabolismo cerebral, los niveles de glucosa cerebral disminuyen rápidamente, en casos severos se produce daño irreversible al tejido y se acelera el consumo de glucosa, derivado del aumento de la glicólisis y en la producción de lactato, disminución en la concentración de intermediarios del ciclo del ácido tricarboxílico y disminución en la producción de ATP y fosfocreatina 1,29.
La hipocapnia (exceso de bióxido de carbono), es otro de los mecanismos de daño, resultado de problemas respiratorios severos, hipertensión pulmonar e hipoxemia severa; tiene efectos neurológicos importantes que condicionan daño cerebral principalmente en neonatos. El proceso inicia con la presencia de alcalosis del líquido cefalorraquídeo, disminución del flujo sanguíneo cerebral, y menor perfusión de oxígeno en el tejido, produciendo un aumento en la excitabilidad cortical con liberación de excitoxinas como glutamato y la presencia de hiperemia.
Los daños relacionados con este proceso son encefalopatía multiquística, necrosis pontosubicular e infarto cerebral 27.
Un acompañante del daño cerebral resultante de la EHI es el edema cerebral. Las hipodensidades vistas en los estudios de neuroimagen como la tomografía axial computarizada (TAC), reflejan áreas de edema cerebral las cuales son presumiblemente áreas de infarto isquémico. La asociación entre necrosis neuronal selectiva, infarto y reblandecimiento cerebral, no esta totalmente clara, ni si la presencia de edema es producto del daño por EHI severa o es sólo una fase del daño tisular1,22.
Los patrones de daño en el SNC son la necrosis neuronal selectiva, el status marmoratus, las alteraciones parasagitales, el daño focal y multifocal, y la leucomalacia paraventricular. Estos patrones son influenciados principalmente por la naturaleza misma de la alteración y por la edad gestacional en el momento del daño 17,28.
Se han identificado diversos patrones neuropatológicos de daño por hipoxia–isquemia y sus consecuencias clínicas de acuerdo a la condición al nacimiento:
EN NIÑOS DE TÉRMINO
La necrosis neuronal selectiva. Se caracteriza por daño neuronal en diversas partes del SNC, siendo de todos los componentes celulares del cerebro, las neuronas las que muestran una gran sensibilidad a la deprivación de oxígeno. La región CA 1 del hipocampo, las capas más profundas de la corteza cerebral y las células cerebelosas de Purkinge son las que con más frecuencia se lesionan. La región bulbar afectada incluye el colículo inferior, los núcleos oculomotor y tróclear, núcleos del nervio facial y trigémino y núcleo motor dorsal del vago 29.
Este daño también puede ser observado en el prematuro, en el cual, involucra neuronas del hipocampo, la base del puente y la oliva inferior, a menudo la necrosis es más pronunciada en las regiones divisorias de la corteza cerebral y en la profundidad de los surcos corticales, reflejando el gran efecto que la isquemia tiene en estas regiones. Clínicamente durante el periodo neonatal, la necrosis neuronal selectiva que involucra los hemisferios cerebrales puede manifestarse por convulsiones y patrones electroencefalográficos de descarga típicos de daño. La alteración de los centros primarios de organización respiratoria en el tallo cerebral, serían presumiblemente los responsables de la apnea y otras alteraciones respiratorias. La hipotonía, el déficit oculomotor, la parálisis facial y la falta de movilidad orofaríngea, son alteraciones que indican daño hemisférico o bulbar, los rasgos crónicos de este daño constituyen el déficit motor estático comúnmente descrito como parálisis cerebral, además del déficit cognitivo y convulsiones 1,30.
Status marmoratus. Se presenta en los ganglios básales (caudado, putamen, pálido) y el tálamo. Denota la respuesta celular de necrosis neuronal, gliosis e hipermielinización después de la hipoxiaisquemia. La lesión es mucho más frecuente en niños de término que en prematuros 28.
La hipermielinización que afecta las estructuras crea una apariencia jaspeada y sugiere el nombre de la lesión. Existe controversia con respecto a qué es exactamente la hipermielinización dentro de la lesión, las evidencias sugieren que la plétora de astrocitos fibrosos es anormalmente mielinizada y los axones lejanos también pueden ser mielinizados.
Además, los cambios en los ganglios básales son similares pero menos evidentes, a menudo se acompañan de uligiria de la corteza cerebral. Las manifestaciones clínicas del daño incluyen corea, atetosis y distonía 1.
Daño cerebral parasagital. Representa la lesión isquémica primaria, este daño incluye la necrosis cortical que involucra áreas de materia blanca en una distribución característica, abarcando las áreas parasagitales, las áreas superior y medial de las convexidades, con mayor involucramiento de las regiones parieto–occipitales, más que las regiones anteriores. Esta distribución del daño señala los bordes de las zonas entre las arterias anterior, media y posterior, los campos dístales de perfusión son más vulnerables a la disminución de flujo sanguíneo cerebral durante la hipoperfusión, en la asfixia perinatal severa. En estos casos, se observa durante el periodo neonatal una disminución de los movimientos vigorosos en las extremidades, desembocando a largo plazo en cuadriparesia con mayor afección de miembros inferiores 1,29,30.
Daño cerebral isquémico focal y multifocal. Este daño ocurre en la distribución vascular, se han identificado infartos cerebrales que ocurren antes del parto. En este caso, las convulsiones sirven con frecuencia como un signo de daño en la etapa neonatal. No obstante, los signos clínicos correspondientes al área de infarto pueden estar ausentes. Existe una predilección de estas lesiones en el territorio de la arteria cerebral media izquierda cosa aún no explicada.
Enfermedades venosas cerebrales también han sido identificadas recientemente en neonatos, asociadas con coagulopatías, asfixia, sepsis, deshidratación y policitemia. Los signos clínicos únicos de alteraciones neonatales son: letargo, convulsiones, o ambas. El resultado a largo plazo del infarto focal arterial es variable, las secuelas más comunes son los déficit motores focales, por lo general la hemiparesia espástica o los déficit cognitivos 30.
DAÑO CEREBRAL EN PREMATUROS
La patogénesis de las dos principales lesiones cerebrales que fundamentan las manifestaciones neurológicas subsecuentemente observadas en el niño prematuro, son los infartos hemorrágicos periventriculares, y la leucomalacia paraventricular. Se reporta el aumento en la incidencia de problemas del neurodesarrollo entre niños con dilatación ventricular poshemorrágica, por encefalia y leucomalacia periventricular 31.
Una de las manifestaciones neurológicas mayores del daño cerebral en el niño prematuro, es el déficit motor de tipo espástico. Consiste primero en cuadriparesia espástica con alteración tanto de extremidades inferiores y superiores, y hemiparesia espástica acompañada comúnmente de déficit intelectual. Otras alteraciones menos severas en la movilidad y cognición se presentan alrededor del 25 al 50% de los sobrevivientes 21.
Infarto hemorrágico periventricular (infarto venoso). Hace referencia a la necrosis hemorrágica periventricular de la materia blanca, siempre asimétrica, justo en el ángulo dorsal y lateral externo del ventrículo lateral. Aproximadamente en la mitad de los casos, las lesiones son extensas e incluyen la materia blanca periventricular de las regiones fronto–parieto–occipitales, en la otra mitad, las lesiones son más localizadas 27 . El 80% de los casos se relaciona con una gran hemorragia intraventricular, por lo regular, las lesiones hemorragicas del parénquima se describen como una extensión de la hemorragia.
Estas lesiones son distinguibles neuropatológicamente de las secundarias a hemorragia en la leucomalacia periventricular, la isquemia por lo regular no hemorrágica, y las lesiones simétricas de la materia blanca periventricular del niño prematuro 21 (tabla 3). A largo plazo, se asocian principalmente con la hemiparesia espástica o la cuadriparesia asimétrica que afecta las extremidades inferiores tanto como superiores, presumiblemente porque el sitio de la lesión afecta fibras descendentes de la corteza motora relacionadas con las extremidades inferiores.

Leucomalacia periventricular. Representa la lesión isquémica primaria del prematuro, existiendo una necrosis de la sustancia blanca con distribución característica, materia blanca dorsal y lateral del ángulo externo del ventrículo lateral Iniciando en las radiaciones occipitales adyacentes al trígono y los ventrículos laterales y secundariamente a nivel de foramen de Monro 32.
Los rasgos patológicos del daño focal y difuso de la LP son distintivos y consisten en necrosis focal periventricular y daño en la materia blanca difusa. La necrosis focal ocurre primariamente y se distribuyen en las zonas finales de larga penetración de las arterias; su principal característica es la perdida de oligdendrocitos e incremento en la hipertrofia de los astrositos. 33.
La evolución de los cambios celulares inicia entre 6 y 12 horas, con coagulación necrótica de los sitios de la lesión periventricular focal, y lesiones con pérdida de la arquitectura normal y áreas de necrsis. 25,28 Durante el periodo posnatal inmediato se observa hipotonía, debilidad e las extremidades inferires, esto sugiere que se involucran las fibras las cuales corren adyacentes a los ventrículos laterales a largo plazo aparece una diplejía espástica en casos severos puede existir una cuadriparesia espástica y daño visual. 29
Los hallazgos patológicos más importantes descritos en la literatura son: lesiones macroscópicas en la sustancia gris poco aparentes, edema, reblandecimiento, palidez o congestión. Histológicamente, se encuentra daño neuronal hipóxico con retracción angular y acidofilia. Lo más evidente es la fragmentación nuclear (cariorrexis). A veces las neuronas aparecen necróticas, y sobre todo en el tálamo, muestran cuerpos básofilos. Existen cuatro patrones anatómicos: 1. Necrosis cortical que abarca la corteza parasagital. 2. Necrosis de los núcleos básales del tálamo, los cuerpos geniculados laterales, núcleos de los pares craneales III, IV, V, VII Y VIII así como en los núcleos del cutaneus. 3. Necrosis diencefálica y romboencefálica. 4. Necrosis pontosubicular; sin embargo, muchas de estas alteraciones se presentan combinadas 1.
CONSECUENCIAS DEL DAÑO NEUROLÓGICO
La causalidad múltiple en los mecanismos de producción del daño neurológico es innegable. Un evento anormal en la etapa perinatal con frecuencia se asocia a otros factores como trauma obstétrico, insuficiencia respiratoria, inmadurez, desnutrición, sepsis o alteraciones metabólicas, se encuentran conjuntamente con la ocurrencia de lesiones transitorias de la sustancia gris y blanca, o lesiones más severas en el SNC 19 . La expresión funcional del SNC que se no se encuentra totalmente organizado y mielinizado, hace que los signos clínicos del daño sean inespecíficos o incluso inexistentes en un momento dado del proceso, y los hace evidentes en otro momento.
Sumado al peso que tienen los factores ambientales en interacción con los biológicos, hacen que las expresiones de daño sean variadas y difíciles de seguir en su secuencia hasta la presencia de alteraciones y/o complicaciones. Es indudable que en muchas ocasiones la evolución del daño corresponde a la presencia de secuelas neurológicas de diferentes severidades, pero en otras ocasiones, el SNC a partir de la reorganización nerviosa limita al máximo su manifestación. El conocimiento de los mecanismo fisiopatológicos de este proceso desde los factores de riesgo, morbilidad, daño neurológico y secuela, aun están en plena investigación, y en la practica resultan de extrema complejidad.
González de Dios, et al 4 , sugieren que para una adecuada interpretación de la relación entre el riesgo y la presencia de secuelas es necesario tener en cuenta 1. la vulnerabilidad individual a la lesión hipóxico–isquémica, 2. la presencia del lesiones cerebrales antes del nacimiento y el tiempo de duración de la asfixia, y 3. los factores ambientales o genéticos que puedan determinar un sistema nervioso o cardiovascular menos tolerante al estrés del parto, entre otros.
El conocimiento del proceso entre los factores de riesgo y la presencia de secuelas, buscando predecir el daño neurológico a partir de la morbilidad, y predecir la secuela a partir del daño, hagenerado la necesidad de buscar indicadores específicos que permitan inferir cual va a ser la evolución a largo plazo. Diversos indicadores bioquímicos, neuroimágenes, neurofisiológicos, indicadores de desarrollo y clínico neurológicos, han sido utilizados en diversas investigaciones en la búsqueda de alta sensibilidad y especificidad para el diagnóstico y pronóstico del proceso riesgo–secuela 3,19,33–37.
La secuencia de eventos que ocurren en el proceso que va de la presencia de riesgo al desarrollo de secuelas, se resume en la figura 1.
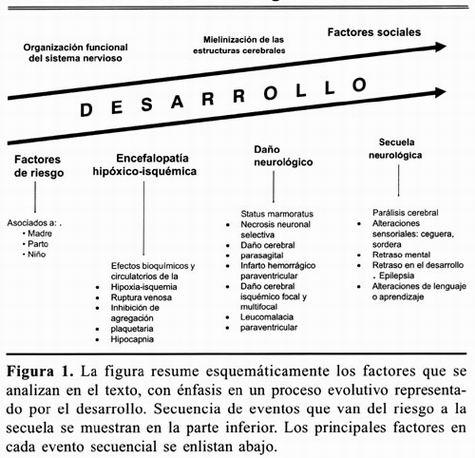
CONCLUSIONES
La información en la literatura especializada en relación a la presencia de la hipoxia–isquemia durante la etapa perinatal, ha permitido ir identificando la cascada de eventos del proceso que inicia desde el riesgo del evento hipóxico–isquémico, la presencia, duración, severidad e implicaciones del evento, así como sus consecuencias a mediano y largo plazo. Desde luego, la mayor complicación es la muerte del niño en las primeras horas posteriores a la hipoxiaisquemia; no obstante, cuando el organismo logra la homeostasis necesaria para sobrevivir a esta etapa, se encuentra una diversidad de posibilidades para que el sistema se reorganice y logre un equilibrio, aunque muchas veces deficiente e inestable, pero que mantiene a los sistemas del organismo, es ahí cuando se expresan las diferentes lesiones con diversas severidades, y la presencia de secuelas mediatas e inmediatas.
RECONOCIMIENTOS
Este trabajo forma parte del trabajo de doctorado de Gabriela Romero Esquiliano. Doctorado en Ciencias Biológicas, Universidad Autónoma Metropolitana–Xochimilco.
REFERENCIAS
1. Volpe J. Perinatal Hypoxic–Ischemic. In Neurology of the Newbom. Saunders 40 Ed. 2000;265–318. [ Links ]
2. Freeman lM. President of Committee of Nationallnstitute of Health. Report on causes of mental retardation and cerebral palsy. Special Article. Pediatrics 1985;76:457–8. [ Links ]
3. Stanley F, Alberman E. Birthweigh Gestational age and cerebral Palsies. No. 87. 0xford Blackwell Scientific Pub. Ltd 1984. [ Links ]
4. González de Dios J, Moya M. Asfixia perinatal, encefalopatía hipóxico–isquémica y secuelas neurológicas en recién nacidos a término: estudio epidemiológíco (1). Rev Neurol (Barc ) 1996; 24(131):812–9. [ Links ]
5. Johnston M. Hypoxic and ischemic disorders of infants and children. Lecture for 38th meeting of Japanese's society of children neurology, Tokyo, Japan, 1996. Brain Develop–ment . 1997;19:235–9. [ Links ]
6. Ruiz–Extrema A, Robles–Vizcaino C, Benitez MT, Ocete E, Lainez C, Benitez A, et al. Neurodevelopment of neonates in neonatal intensive care unít and grown of surviving infants at age 2 years. Early human development 2001;65:11932. [ Links ]
7. Plessis A, Volpe J. Perinatal brain injury in the preterm and term newbom. Current opinion in Neurology 2002;15:151–7. [ Links ]
8. Badawi N, Kurinczuk J, Hall O, Field O, Pemberton P, Stanley F. Newbom encephalopathy in term infants: three approaches to population–based investigation . Semin NeonatoI 1997;2:181–8. [ Links ]
9. Aso K, Scher MS, Barmada MA. Neonatal encephalography and neurophatology. J Clin Neurophysiol 1989;6:103–23. [ Links ]
10. Levy S, Hyman S. Valoración pediátrica del niño con retraso del desarrollo. En minusvalidez del desarrollo. Clínicas Pediá–tricas de Norteamérica 1993;31:489–504. [ Links ]
11. González Ch. Lima O, Posada, Huesca J, González S, Sobrino M. Aspectos epidemiológicos de la encefalopatía hipóxico–isquémica. Bol Med Hosp Infant Mex 1985; 42(9): 541–550. [ Links ]
12. INEGI 2000. SSA Dirección general de información y evaluación de desempeño, estimadores a partir de los totales de la población. Proyecto de población Mexicana 1996–2050, CONAPO 96 y XII Censo de población y vivienda INEGI 2000. [ Links ]
13. Salud Pública México. Indicadores. Egresos hospitalarios del sector publico del sistema nacional de salud, 2000. Rev Sal Púb México 2002;44(2):310–25. [ Links ]
14. Banm JD. Birth risks. Nestlé Nutrition Workshop Series . 1993;31:1–24. [ Links ]
15. Iriondo M. Encefalopatía hipóxico–isquémica. Revista Latinoamericana de Neonatología 2001. [ Links ]
16. Hagberg G, Hagber B, Olow I. The Changing Panorama of Cerebral Palsy in Sweden 1954–1970. 111. The importance of fetal deprivation of supply . Acta Pediat Scand 976;65:403–8. [ Links ]
17. Sarnat HB, Sarnat MS. Neonatal encephalopathy following fetal distress. Archi Neurology 1976;33:696–705. [ Links ]
18. Lindahl E, Michelson K, Helenius M, Parre. Neonatal risk factors and later neurodevelpmental disturbances . Devel Med Chil Neurology 1988;30:571–89. [ Links ]
19. Weisglas–Kruperus N, Uleman–Vleeschdrager M, Baerts W. Ventricular hemorrhages and hipox–ischaemic lesions in preterm infant: neurodevelopmental outcome at 31/2 years. Devel Med Child Neurology 1987;29:623–9. [ Links ]
20. Scher MS. Neonatal Encefalopathies as classified by EEG Sleep Criteria: Severityand timing based on Clinical/Pathologic Correlations. Pediatric Neurology 1994;11(3): 2147. [ Links ]
21. Volpe J. Neurologic outcome of prematurity. Arch NeuroI 1998;55(3):297–300. [ Links ]
22. Inder T, Volpe JJ. Mechanisms of perinatal brain injury. Semin Neonatol 2000;5(1):3–16. [ Links ]
23. Volpe J. Brain development Normal and abnormal. J Perinat Med 1991;19:29–34. [ Links ]
24. Volpe J. Brain injury in the premature infant. Current concepts of pathogenesis and prevention. Biol Neonate 1992; 62:231–42. [ Links ]
25. Volpe J. Brain injury in the premature infant from pathogenesis to prevention. Brain and development 1997;19 (8):519–34. [ Links ]
26. Johnston M, Trescher W, Ishida A, Nakajima W. Neurobiology of hypoxic–ischemic injury in the developing brain. Pediatric Research 2001;49:735–41. [ Links ]
27. Laffey J, Kavanagh B. Hypocapnia. N Engl J Med 2002; 347(1):43–53. [ Links ]
28. Volpe J. Brain injury in the premature infant. Neuropathology, clinical aspects, pathogenesis, and prevention. Clin Perinatol 1997;24(3):567–87. [ Links ]
29. HiII A. Volpe J. Perinatal asphyxia. clinical aspect. neonatal neurology. Clinics in Perinatology 1989;16(2):435–57. [ Links ]
30. Rivkin M, Volpe J. Hipoxic–Ischemic Brain Injury in the Newbom. Seminars in Newbom 1993 ;113 (1) :30–9. [ Links ]
31. Weisglas–Kruperus N, Baerts W, Smrkovsky M, Sauer P. Effects of biological an social factors on the cognitive development of very low birth weight children. Pediatrics 1993;92(5):658–665. [ Links ]
32. Volpe J. Neurobiology of periventricular leukomalacia in the premature infant. Pediatr Res 2001 ;50(5):553–62. [ Links ]
33. Back S, Luo N, Borenstein N, Levine J, Volpe J, Kinney H. Late oligodendrocyte progenitors coincide with the developmental window of vulnerability for human perinatal white matter injury. J Neurosci 2001;21(4):1302–12. [ Links ]
34. Evrard P, Gressens P, Volpe J. New concepts to understand the neurological consequences of subcorticallesions in the premature brain. Biol Neonate 1992;61(1):1–3. [ Links ]
35. Póo–Arguelles P, Campistol–Plana J, Iriondo–Sanz M. Recién nacido de riesgo neurológico en el año 2000. Recomendaciones para el seguimiento, incorporación de nuevos instrumentos. Rev Neurol 2001 (7):645–52. [ Links ]
36. Harkleroad A, Schirf D, Volpe J, Holm M. Critical pathway development: an integrative literature review. Am J Occup Ther 2000;54(2):148–54. [ Links ]
37. Gaffney G, Sellers S, Flavell V, Squier M, Johnson M. Case–control study of intrapartum care, cerebral palsy, and perinatal death. 1994;308:743–50. [ Links ]














