Introducción
El género Pleurotus (Fr.) P. Kumm es cosmopolita, con especies que pueden crecer en altitudes tan variables como son, desde el nivel del mar hasta más de 3000 metros (Guzmán, 2000). Las especies del género se caracterizan por poseer un alto valor nutrimental, potencial nutraceútico y variadas aplicaciones biotecnológicas y ambientales (Cohen et al., 2002; Bordallo et al. 2002; Asaduzzaman Khan y Mousumi, 2012).
Guzmán (2000) consideró 50 especies válidas del género, aunque taxonómicamente es un grupo muy complejo ya que presenta especies con gran similitud morfológica. Genéticamente se han encontrado relaciones de intercompatibilidad y grupos de interesterilidad entre organismos pertenecientes o no a la misma especie, lo que ha complicado la sistemática del género (Salmones y Mata, 2017).
Pleurotus spp. es uno de los grupos más importantes de hongos comestibles cultivados comercialmente, con una producción estimada de 6.46 X 109 Kg que los posiciona en el segundo lugar a nivel mundial (Royse et al., 2017). El 99% de la producción de Pleurotus se concentra en el continente asiático, especialmente en China. En Latinoamérica, la producción comercial se genera mayoritariamente en Brasil, México, Colombia, Argentina y Guatemala (Royse y Sánchez, 2017). En México, el cultivo de hongos comestibles y funcionales es considerada una agroindustria promisoria y en expansión, que actualmente presenta varios retos para su consolidación, entre ellos, la adaptación de cepas a las condiciones ambientales, especialmente para las regiones tropicales y subtropicales (Martínez-Carrera et al., 2016). Las especies principalmente cultivadas en el país son P. pulmonarius y P. ostreatus, ambas preferentemente desarrolladas bajo condiciones templadas (Gaitán-Hernández y Salmones, 2008; Royse y Sánchez, 2017). Sin embargo, considerando el incremento de temperatura ambiental que gradualmente se está presentado debido a los efectos del cambio climático y, por otra parte, el que gran parte del territorio nacional presente condiciones ambientales cálidas (Villers-Ruiz y Trejo-Vázquez, 1998), es apremiante considerar la propagación comercial de otras especies adscritas al género que pudieran ser viables de producirse y comercializarse a corto plazo. Entre ellas, destaca la especie P. djamor, un hongo nativo capaz de desarrollarse a temperaturas cálidas, que se cultiva comercialmente en diversas regiones del mundo (Quimio, 1978; Rajarathnam et al., 1986; Miles y Chang, 2004) y que en Latinoamérica se ha cultivado principalmente con fines experimentales (Bononi et al., 1991; Rosado et al., 2002b; Valencia del Toro et al. 2003; Salmones et al., 1997, 2004, 2005; Vega et al., 2006; Ancona et al. 2007) presentando características de cultivo y propiedades nutraceúticas y biodegradativas de interés para los productores regionales (Figura 1). En esta revisión, se presentan las habilidades biosintéticas y biodegradativas de esta especie tropical, destacando su potencial aprovechamiento biotecnológico para el neotrópico.
Sistemática y características morfológicas
Pleurotus djamor (Rumph.: Fr.) Boedijn fue originalmente descrito por Fries en 1821, como Agaricus djamor. Posteriormente Boedijn, en 1959, lo transfirió al género Pleurotus de la familia Pleurotaceae (Nicholl y Petersen, 2000).
De acuerdo con Pegler (1977, 1983, 1986), Guzmán (2000) y Nicholl y Petersen (2000), P. djamor es la especie pantropical más importante y abundante del género Pleurotus. Guzmán (2000), consideró que P. djamor es sinónimo de P. flabellatus, P. eous y P. salmoneostramineus. En el continente americano se le ha encontrado creciendo silvestre en Argentina, Bolivia, Brasil, Colombia, Costa Rica, Cuba, Guadalupe, Guatemala, Martinica, México, Panamá, Puerto Rico y Venezuela (Guzmán et al., 1993; Legon 1999; Putzke, 2002; Morales et al., 2003; Lechner y Wrigth, 2004; Guzmán y Piepenbring, 2011; Menolli et al., 2014; Melgarejo, 2015), aunque probablemente tiene una distribución más amplia.
Pegler (1986) describió a la especie con basidiomas de color blanco a blanquecino, aunque previamente Corner (1981) había observado una amplia variabilidad micromorfológica entre los especímenes estudiados provenientes de Malasia, determinando que esta especie podría clasificarse en seis variedades de acuerdo con su variabilidad en color, micromorfología y hábitat, además de presentar especímenes de clasificación intermedia entre las variedades establecidas. Guzmán et al., (1993) también notaron diferencias de coloración en los píleos de la especie estudiados, desde blanquecino a grisáceo o rosáceo, proponiendo una posible sinonimia con otras especies de Pleurotus, como P. salmoneostramineus y P. ostreatoroseus. Esta última especie fue estudiada por Murakami y Takemaru (1990), quienes observaron la formación de basidiocarpos blancos en la progenie de cepas de P. ostreatoroseus cultivadas en el laboratorio, por lo que consideraron que la variabilidad de color entre los especímenes silvestres y cultivados se debía a mutaciones controladas por genes recesivos. Paralelamente, Neda et al. (1988) descubrieron que los especímenes identificados como P. salmoneostramineus eran compatibles con aquellos registrados como P. djamor, concluyendo que las diferencias de color entre los basidiomas y basidiosporas no eran un factor determinante para separar a los especímenes en dos especies; coincidiendo con Petersen y Hughes (1993) quienes encontraron que P. ostreatoroseus y P. salmoneostramineus eran genéticamente compatibles. Estudios posteriores mostraron compatibilidad entre las formas rosas y blancas (Petersen y Ridley, 1996, Nicholl y Petersen, 2000, Gaitán-Hernández y Salmones, 1999; Salmones et al., 2004), por lo que Guzmán et al. (1995) describieron tres variedades ecológicas en la especie: P. djamor (Fr.) Boedijn var. djamor, caracterizada por desarrollar primordios y basidiomas blanquecinos; P. djamor var. roseus Corner, conformada por individuos que presentan primordios de color rosa y/o naranja que disminuyen notoriamente su coloración en estado adulto y P. djamor var. salmoneostramineus (L. Vass) Guzmán, que se distingue por presentar primordios y basidiomas adultos de color rosa y/o naranja (Figura 2). Posteriormente, Lechner et al. (2004) incorporaron la variedad cyathiformis Corner, caracterizada por representar basidiomas blanquecinos con manchas oscuras sobre el píleo.
Con la incorporación de técnicas moleculares y bioquímicas en los estudios sistemáticos del género Pleurotus, la ubicación taxonómica de esta especie fue mejor definida. Zervakis y Labarere (1992) y Zervakis et al. (1994) después de analizar zimogramas de progenies homocarióticos y realizar pruebas enzimáticas con 11 especies de Pleurotus determinaron que P. djamor (citada como P. flabellatus) es una especie bien definida y separada de P. cornucopiae, P. cystidiosus, P. eryngii, P. ostreatus y P. pulmonarius. Por otra parte, Iracabal et. al. (1995) obtuvieron unidades de ADN ribosomal de P. cornucopiae con la finalidad de hibridizarlas con 11 taxa de Pleurotus, observando alta heterogeneidad entre los taxa y definiendo claramente tres especies: P. dryinus, P. eryngii y P. flabellatus (P. djamor), las cuales presentaron grandes distancias fenéticas con el resto de los taxones estudiados.
Es interesante destacar que la permanencia del color rosa en los basidiomas es una parte de la biología del hongo aún no concluyente, que ha generado conclusiones opuestas en los trabajos publicados, ya que mientras Cedano et al. (1993) citaron que la pérdida del color rosa en las fructificaciones cultivadas de una cepa mexicana de P. ostreatorroseus se debía a una alta intensidad lumínica en las áreas de cultivo, otros autores no encontraron correlación entre las variaciones de color rosa de los basidiomas y la intensidad de luz empleada durante el desarrollo de los mismos (Nicholl y Petersen, 2000). Probablemente esto se debe a que la permanencia del color depende, tanto de las características genéticas de los parentales como de las condiciones de cultivo y ambientales en que se desarrollan los esporomas, de igual manera a lo reportado para otras especies del género (Valencia del Toro y Leal-Lara, 1999; Guzmán, 2000).
Con referencia a su genética, presenta un patrón de sexualidad heterotálico tetrapolar (Chandrashekar et al., 1981), es decir sus talos o estructuras miceliales son autoestériles, por lo que para obtener descendencia se necesitan entrecruzar talos compatibles en dos pares de factores (A y B), localizados en dos cromosomas diferentes. James et al. (2004) reportó que la segregación de las secuencias de ADN en las regiones genómicas de la especie revelaba un par de genes homodominantes en el factor A y tres pares de receptores feromonales en el factor B, sugiriendo que las bases genéticas de P. djamor son similares a las de otras especies de hongos.
Valor nutrimental
Los esporomas de P. djamor presentan un aceptable contenido nutrimental. Estos hongos son especialmente ricos en carbohidratos, con 32.7 a 48.3 g por cada 100 g de hongo (base seca) y proteína cruda de 20.7 a 28 g, con valores recomendables de fibra cruda (9.1 a 22.4 g) y cenizas (4.1 a 7.4 g), baja cantidad de grasas (0.11 a 2.09 g) y alta humedad (79.5 a 90%) (Ancona et al., 2005; Mshandete y Cuff, 2007; Khan et al., 2013; Dharmarai et al., 2014; Selvakumar et al., 2015). La calidad nutrimental de la proteína de los hongos ha sido ampliamente estudiada, ya que una de las más importantes características biológicas de estos organismos son su capacidad de obtener el nitrógeno del sustrato de crecimiento y posteriormente sintetizarlo y transformarlo en aminoácidos. En este punto, los hongos del género Pleurotus son especialmente interesantes porque ellos pueden crecer en residuos lignocelulósicos con muy bajo contenido de nitrógeno, teniendo la capacidad de producir biomasa con mayor contenido de nitrógeno que el sustrato en el que están creciendo (Rajarathnam et al., 1998). Su calidad de proteína es alta, ya que está constituida principalmente por aminoácidos esenciales entre los que destacan la valina, isoleucina y fenilalanina, aunque también presentan valores aceptables de aminoácidos no esenciales como son, prolina, glutamato y aspartato (Ranzani y Sturion, 1998; Capetillo Leal et al., 2010). También contienen vitaminas, especialmente del complejo B (B1, B2) y D, además de los minerales K, P, Mg, Ca, Na, Zn, Fe, entre los más frecuentes, por lo que los hongos se consideran una buena fuente de K y P (Guo et al., 2007; Rampinelli et al., 2010). Con base en su contenido nutrimental, Pleurotus djamor, y en general los hongos comestibles, son un alimento altamente recomendado para diversos tipos de dietas (Martínez-Carrera et al., 2016).
En cuanto a su palatabilidad, la especie se caracteriza por presentar un olor farináceo (harina húmeda) y cierta dureza y picor en sus fructificaciones frescas, aunque esta última característica es muy variable entre las cepas cultivadas (Ancona et al., 2005). Con referencia a su sabor, en el caso de los hongos éste proviene de compuestos volátiles derivados del metabolismo de sus ácidos grasos, predominantemente ácidos linoleicos y linolénicos, siendo el más importante el alcohol 1-octen-3-ol (Rajarathnam et al., 1998; Zawirska-Wojtasiak et al. 2009). Para la especie P. djamor (citada como P. flabellatus), se reportaron 16 compuestos que influyen en el sabor, siendo el 2-pentanona, 3-pentanona, butirato de metilo y 2-metil-3-pentanona, los mayormente encontrados por Rajarathnam et al. (1998); además del 3-octanol, 3-octanona y 1-octen-3-ol, reportados por Zawirska-Wojtasiak et al. (2009).
Propiedades medicinales
Las propiedades medicinales de los hongos comestibles cultivados no sólo se han detectado en los esporomas, sino también, en el micelio e incluso en el medio de cultivo derivado del crecimiento micelial (Rosado et al., 2002a; Martínez-Carrera et al., 2016). Estas propiedades han sido ampliamente documentadas en las principales especies cultivadas y en el caso de P. djamor se han reportado compuestos bioactivos con propiedades anticancerígena, inmunomuladora, antibiótica (antimicrobianas, antiviral, antifúngica), antiparasitaria, antioxidante, antiinflamatoria, antidiabética, antilipidémica y hepaprotectora (Tabla 1).
Condiciones de cultivo
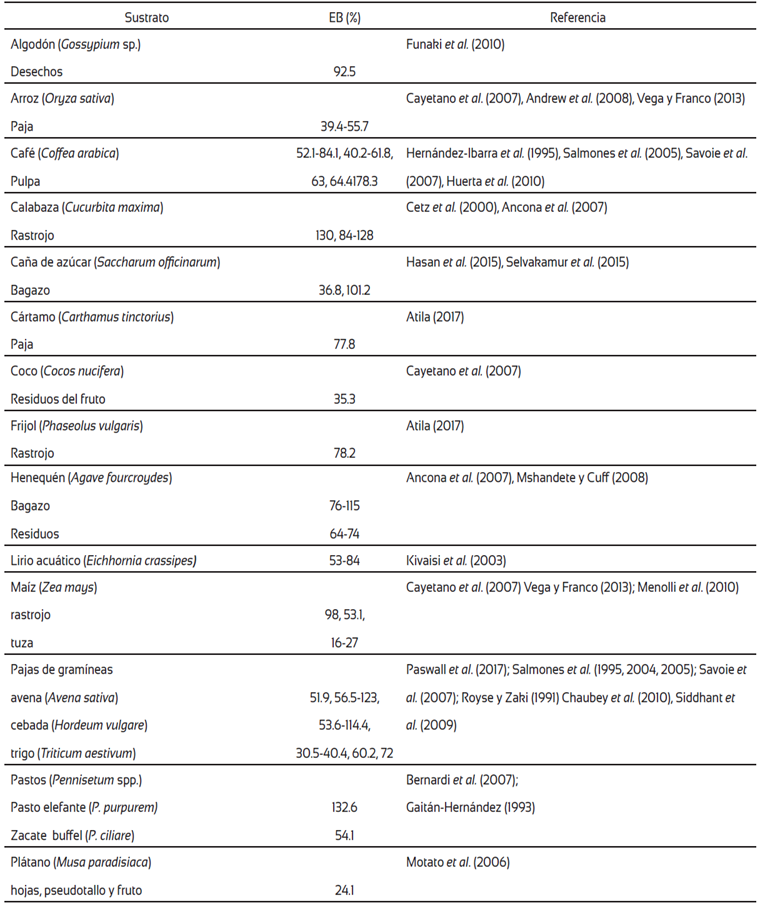
Al igual que otras especies del género, P. djamor presenta enzimas ligninocelulíticas que le permiten crecer en gran variedad de materiales agrícolas y forestales, especialmente bajo condiciones ambientales cálidas. Bano et al. (1979) y Geetha y Sivaprakasam (1993) encontraron que la especie (citada como P. flabellatus) es un hongo saprobio que crece en clima tropical a temperaturas óptimas entre 22 a 30 °C. Las metodologías para la producción del hongo son similares a las empleadas para otras especies comerciales del género, como P. ostreatus y P. pulmonarius, con la diferencia de que su periodo de incubación es muy corto, incluso existen datos de obtención de la primera cosecha a partir de la segunda semana de incubación (Rajarathnam et al., 1986; Cetz et al., 2000), por lo que sus ciclos de cultivo son más cortos en comparación con las otras especies comerciales del género. A la fecha, una gran variedad de materiales lignocelulósicos ha sido utilizados para evaluar la productividad de la especie (Tabla 2).
A pesar de los avances significativos en la evaluación de sustratos para el cultivo de P. djamor, la disponibilidad de residuos agroindustriales en los trópicos es muy alta y se requiere intensificar la prospección de otros materiales orgánicos que permitan incrementar las eficiencias biológicas hasta ahora alcanzadas, con la finalidad de hacerlas competitivas con los rendimientos de las especies de Pleurotus cultivadas comercialmente. Generalmente, las fructificaciones de P. djamor se caracterizan por presentar cierta dureza en su estípite, lo que representa una desventaja de comercialización (Zawirska-Wojtasiak et al. 2009); pero esto se compensa con la precocidad en la formación y madurez de sus esporomas. Además, esta capacidad del hongo para colonizar el sustrato en tiempos cortos de incubación, le da ventaja competitiva ante la presencia de mohos antagonistas, frecuentemente presentes en las diferentes etapas del proceso de cultivo (Salmones y Mata, 2015).
Capacidad biodegradativa
Los hongos del género Pleurotus están adaptados a crecer sobre una gran variedad de materiales lignocelulósicos, como las pajas de gramíneas, bagazos, residuos de la madera y de cultivos agrícolas (Tabla 2). Estos organismos están considerados como eficientes descomponedores de la lignocelulosa, principal polímero constituyente de los materiales lignocelulósicos, debido a que tienen la capacidad de sintetizar un amplio espectro de enzimas involucradas en los procesos de biodegradación y síntesis de compuestos participantes en las diferentes procesos vitales del organismo, como son: el metabolismo respiratorio, la construcción de biomasa fúngica y cuerpos fructíferos, la producción y descarga de las esporas y los mecanismos competitivos y defensivos, entre otros (Rajarathnam et al., 1998). Además, la degradación biológica de la lignocelulosa en compuestos de menor peso molecular y mayor digestibilidad, incluso para su aprovechamiento como alimento para consumo humano (las fructificaciones) y como forraje de animales (residuos sólidos con una digestibilidad mejorada), ha convertido el proceso del cultivo de especies comestibles de hongos en una atractiva alternativa del concepto de delignificación.
De acuerdo con los resultados publicados, las especies de Pleurotus presentan el tipo de la pudrición blanca selectiva, caracterizada por una degradación más rápida de la fracción lignina y una posterior despolimerización de la celulosa y hemicelulosa presentes (Leonowics et al., 2001; Mata et al., 2017). En lo general, las enzimas que degradan la celulosa y la hemicelulosa se encuentran asociadas a las etapas de producción de los basidiomas, mientras que las oxidasas aparecen durante las primeras etapas del desarrollo micelial (Salmones y Mata, 2002; Mata et al., 2007). Sin embargo, este patrón de producción enzimática puede verse afectado por la composición química del sustrato de cultivo o por la presencia de microorganismos contaminantes (Mata et al., 2005; Salmones y Mata, 2015). Durante los últimos años, diversas investigaciones se han realizado para determinar el potencial de biodegradación de la lignocelulosa por especies comerciales de Pleurotus. Las enzimas ligninocelulolíticas producidas por Pleurotus spp. tienen un alto potencial de aplicación en las industrias papelera, química, textil y alimentaria, principalmente, aunque también tienen aplicación en procesos agrícolas y producción de forrajes para alimento animal (Rajarathnam et al., 1987, 1989; Cohen et al., 2002); y recientemente para la producción de bioenergéticos a partir de desechos agroindustriales (Sánchez-Cantú et al., 2017).
En cuanto a la especie P. djamor, los primeros estudios fueron realizados en la India por Rajarathnam et al. (1979), dichos autores observaron que al cultivar el hongo (citado como P. flabellatus) en paja de arroz, se presentaban pérdidas continuas en el contenido de celulosa, hemicelulosa, lignina, carbono y nitrógeno totales, desde el día de inoculación hasta la cosecha de los basidiomas, mientras que el contenido de azúcares libres, cenizas y relación C/N se incrementaba. Los porcentajes de decremento cuantificados para la celulosa contenida variaron de 13.9 a 14%, para las hemicelulosas de 6.6 a 7% y para la lignina de 1.5 a 4%. El contenido de nitrógeno disminuyó entre 0.16 a 0.23%. Estos autores concluyen que la progresiva degradación de la celulosa y hemicelulosa estaba relacionada con las actividades enzimáticas de las celulasas y hemicelulasas detectadas durante diferentes etapas del crecimiento del hongo. Kivaisi et al. (2003) citan una pérdida de fibra entre 31 al 40% al final del ciclo de cultivo, decreciendo la fracción de celulosa entre 35 a 48%.
Rolz et al. (1986) cultivaron P. djamor en pasto de limón, determinando pérdidas en el sustrato residual de 42.6% de lignina, 32.35% de hemicelulosa y 22.58% de celulosa. En el mismo estudio, el hongo también fue cultivado en bagazo de citronela (Cymbopogon spp.) y para este sustrato los porcentajes de lignina, hemicelulosa y celulosa cuantificados fueron de 30, 44.96 y 36.57%, respectivamente. Por otro lado, Capelari y Zadrazil (1997) cultivaron una cepa de P. ostratorosesus en paja, determinando pérdidas mayores al 50% del contenido de liginina, después de 60 días de cultivo, especialmente cuando las temperaturas de incubación se mantuvieron entre 25 °C a 30 °C.
En contraste, Okano et al. (2006) encontraron poca capacidad de digestibilidad de P. salmonostramineus en bagazo de caña, después de 12 semanas de incubación, por lo que concluyen que la especie presenta baja digestibilidad en cultivos in vitro, en comparación con otras especies cultivadas comercialmente como Lentinula edodes.
Biorremediación
En la naturaleza los principales compuestos xenobióticos contaminantes del ambiente y susceptibles de eliminarse con hongos macroscópicos son: colorantes, aromáticos, hidrocarburos aromáticos, pesticidas y clorofenoles, por lo que los hongos lignocelulósicos han sido frecuentemente estudiados para determinar su capacidad de biorremediación (Cohen et al., 2002). Diversas cepas de Pleurotus comerciales han sido probadas con resultados prometedores para la producción de enzimas y la degradación de compuestos recalcitrantes (Mata et al., 2017).
Upadhyay y Hofrichter (1993) observaron que una cepa de P. djamor (citada como P. flabellatus) logró metabolizar 67 mgL-1 de fenol en 10 días, produciendo una pigmentación café sobre el medio de cultivo. Estudios preliminares habían indicado que la incorporación de fenol (hasta 1600 mgL-1) durante la hidratación de las pajas, favoreció el crecimiento micelial de otras especies de Pleurotus e inhibió el crecimiento de organismos antagonistas, como Stachybotrys sp. y Coprinus sp.
Sánchez et al. (2007) lograron cultivar P. djamor en medio de cultivo sólido conteniendo endosulfán, un insecticida organoclorado utilizado en México para control de plagas de diversos cultivos de importancia económico; mientras que Ferrera Cerrato et al. (2007) cultivaron cepas de la especie in vitro utilizando petróleo crudo como fuente de carbono. Por otra parte, Selvakumar et al. (2007), mostraron que esta especie puede crecer en extractos de pino conteniendo una concentración de taninos crudos de hasta 10000 ppm, sin observar inhibición alguna en el desarrollo de los micelios.
Chan-Cupul et al. (2014) evaluaron el efecto de diferentes concentraciones de atrazina sobre el crecimiento micelial y la actividad enzimática de ocho macrohongos ligninolíticos, siendo la especie P. djamor más tolerante a la atrazina (CE50= 2281 mg/l), aunque sus actividades enzimáticas no fueron altas, con respecto a las otras especies estudiadas.
Por otra parte, la industria textil es uno de los sectores más contaminantes ya que se estima que del 10 al 25% de los colorantes aplicados para el teñido de telas, se vierten en efluentes de agua dulce, estando principalmente constituidos por compuestos aromáticos (antraquinonas y trifenilmetano) o del grupo azo (azobencenos), además de numerosos compuestos orgánicos tóxicos y recalcitrantes que afectan el ecosistema acuático; por lo que es necesario la remoción de los colorantes antes de su descarga en los cuerpos de agua, ya que actualmente es considerado uno de los principales problemas de contaminación ambiental (Thakur y Chauhan, 2018).
Estos compuestos son estables a la acción degradadora por la microbiota natural, porque presentan gran similitud química con algunos otros compuestos utilizados en los procesos vitales celulares. Para disminuir ese impacto negativo, existe la alternativa de usar las enzimas extracelulares ligninolíticas producidas por los hongos. Kalmis et al. (2007) realizaron un ensayo para determinar la capacidad de decoloración de diversas especies de Pleurotus, entre ellas P. djamor cultivadas in vitro. Los resultados del estudio muestran que la especies de Pleurotus tuvieron la capacidad de decolorar totalmente el azul brillante de Remazol R (antraquinona) y el azul brillante de Levafix, en concentraciones mayores a 20 mgL-1, mientras que otros colorantes, como el negro de Indanthren RB fueron parcialmente decolorizados. De acuerdo con dichos autores, las especies de Pleurotus cultivadas pudieron crecer adecuadamente en concentraciones de colorantes superiores a 200 mgL-1. En un estudio posterior realizado por los mismos autores, se determinó que P. djamor también puede decolorizar el negro benazol ZN, a partir de cultivos iniciales conteniendo de 500 a 1000 mgL-1 del colorante (Kalmis et al., 2008). Mientras que Nilsson et al. (2006) cultivaron la especie con la finalidad de determinar su capacidad de decoloración en desechos de colorantes textiles, mostrando que P. djamor puede degradar hasta el 67% de los compuestos en cultivos realizados en reactores continuos tipo Batch.
Arboleda et al. (2008) experimentaron con 19 cepas de diferentes especies de hongos de pudrición blanca provenientes de un bosque tropical de Colombia, evaluando su capacidad para decolorar los compuestos Azure B y azul de Coomassie en medio sólido. P. djamor logró disminuir la decoloración de los compuestos en medio líquido, aunque su capacidad de producción de enzimas ligninolíticas, específicamente lacasa, ligninasa y peroxidasa dependiente de Mn, fue menor con respecto a las otras especies estudiadas. Tanto las cepas rosadas (consideradas como P. ostreatoroseus) como las blancas (citadas P. flabelllatus) mostraron capacidad de crecimiento micelial y actividad de decoloración más fuerte que P. chrsosporium, especialmente cuando fueron cultivadas en medio sólido y suelo contaminado como organoclorinados, incluso logrando decolorar el azul brillante de Remazol.
Machado et al. (2005), realizaron un estudio para evaluar la actividad ligninolítica de 125 basidiomicetos aislados de ecosistemas tropicales. Entre las especies evaluadas en agar con extracto de malta y diversos colorantes, P. djamor presentó alta capacidad de decolorar el azul brillante Remazol R en cultivos de agar con extracto de malta.
Santos et al. (2002) utilizaron una cepa rosada (citada como P. ostreatoroseus) para tratar efluentes de una planta de papel kraft blanco, logrando inicialmente una remoción de 18.6% de color y un 11.6% de fenoles totales. En un segundo experimento y después de añadir una fuente extra de carbono (glucosa), la máxima remoción de color, fenoles totales y lignina/clorolignina fueron de 19.4, 9.4 y 44.5%. Los mejores resultados del estudio se alcanzaron utilizando una suspensión de 20% de masa micelial con el efluente, en agitación, ya que al tercer día los porcentajes de remoción de color, fenoles totales y lignina/clorolignina fueron de 84.4, 82.1 y 72.4 %, respectivamente.
Por otra parte, es importante considerar que, debido a la capacidad degradativa que caracteriza a los hongos, parte de elementos y/o compuestos químicos pueden concentrarse en el micelio y las fructificaciones del hongo. Brunnert y Zadrazil (1983) reportaron que una cepa de P. djamor, citada como P. flabellatus, logró incorporar a sus cuerpos fructíferos el 75% de cadmio y el 38.5% de mercurio depositado en los cultivos, destacando que, a diferencia de otras especies de hongos, P. flabellatus almacenó más cadmio que mercurio en sus fructificaciones (relación Cd/Hg 0.65). Mientras que Maihara et al. (2008), reportaron que una cepa cultivada de la especie, citada como P. salmoneostramineus, presentó 0.229 m/kg de arsénico en los esporomas cultivados, aunque este valor es más bajo que los niveles máximos recomendados para el consumo de alimentos.
De los resultados obtenidos hasta ahora con P. djamor, se puede concluir que la especie presenta un gran potencial como degradadora de compuestos recalcitrantes, debido a su capacidad de secretar diversas enzimas ligninocelulolíticas durante su ciclo de vida, tanto en la etapa de colonización del sustrato, como durante la formación y desarrollo de las fructificaciones (Salmones et al., 2005). Sin embargo, la mayoría de los estudios realizados han sido a nivel de laboratorio, por lo que será necesario verificar si la capacidad biodegradativa del hongo se mantiene a nivel planta piloto, y preferentemente, bajo las condiciones ambientales propias del trópico. Escalar el proceso enfrenta otros retos metodológicos, tanto en el manejo del sustrato como en la producción de biomasa fúngica, pero finalmente esto podría favorecer los costos del proceso, lo que repercutiría en el interés de utilizar esta especie hongo en diversos procesos de biorremediación.
Conclusiones
Pleurotus djamor es un hongo comestible cultivado exitosamente en algunos países asiáticos. El conocimiento actual que se tiene de su biología, fisiología, enzimología y biología molecular es considerable y ha permitido desarrollar su cultivo con la finalidad de obtener alimento para consumo humano con aceptable valor nutrimental, además de explorar las posibilidades de aprovechar sus propiedades biosintéticas y degradativas en otros procesos biotecnológicos. Debido a las condiciones climáticas y a la disponibilidad de materiales lignocelulósicos disponibles en el neotrópico, el cultivo de esta especie comestible resulta viable económica y ambientalmente. La duración del proceso puede ser menor a los ciclos de cultivo de otras especies comerciales de Pleurotus y las similitudes morfológicas con éstas, favorecería una rápida aceptación en el mercado regional. Cosechar todo el año resulta altamente ventajoso para los productores, por lo que la propuesta de contar con cepas para los meses calurosos deberá ser bien recibida por el sector productivo. Además, hay un interés creciente entre la población de consumir alimentos que contengan compuestos bioactivos y los hongos son los organismos más prometedores para descubrir nuevos fármacos a partir de sus metabolitos primarios y secundarios. Existen aún interrogantes sobre la acción del sistema enzimático de la especie y su potencial aprovechamiento en procesos de remediación de suelos y agua, así como en la biodegradación de plásticos y sus derivados, pero con las nuevas herramientas moleculares es muy probable que el avance en la interpretación del metabolismo del hongo y sus procesos biológicos se acelere. En conclusión, la producción y consumo de esta especie, representa un beneficio para la población.











 nueva página del texto (beta)
nueva página del texto (beta)