Introducción
Los hongos micorrizógenos arbusculares (HMA) pertenecen al phylum Glomeromycota (Schüβler et al., 2001), que incluye una clase (Glomeromycetes), cuatro órdenes (Glomerales, Diversisporales, Paraglomerales y Archaeosporales), once familias, 22 géneros y aproximadamente 260 especies descritas (Schüβler y Walker, 2010; Redecker et al., 2013), de ese total, en México, se ha reportado casi el 50% (Montaño-Arias et al., 2012).
Estos organismos son simbiontes obligados que establecen una relación mutualista con las plantas a través de sus raíces, se han observado en briofitas, pteridofitas y angiospermas, y pueden llegar a determinar la distribución de éstas (van der Heijden y Sanders, 2002; Sanders, 2003).
En esta relación, el hongo obtiene carbono y a cambio facilita a la planta la absorción de nutrientes, principalmente fósforo y nitrógeno (Smith y Read, 2008). Además, las plantas que se asocian con los HMA tienen una mayor tolerancia a patógenos (Borowics, 2001), al estrés hídrico (Augé, 2001), a la salinidad (Tian et al. 2004) y a la toxicidad hacia ciertos metales (Hildebrandt et al., 2007). Los HMA juegan también un papel clave en la estructura de las comunidades vegetales, en la diversidad y productividad de los ecosistemas (Klironomos et al., 2000), así como en la regeneración y sucesión vegetal (Kardol et al., 2006), teniendo un papel muy importante en la determinación de los mecanismos de coexistencia de las comunidades vegetales (Montesinos-Navarro et al., 2012; Veresoglou et al., 2017).
Los Glomeromycota forman esporas asexuales, individualizadas o agrupadas que funcionan como estructuras de almacenaje de fosfolípidos, resistencia y propagación (Bonfante et al., 1994), que se forman a través de un engrosamiento de una o más hifas que están en el suelo y/o en las raíces de las plantas (Hernández-Cuevas et al., 2003). En general, la identificación taxonómica de los HMA a través de la morfología de las esporas aún es un excelente método para estudiarlos a nivel comunidad (Landis et al., 2004, Stürmer y Siqueira, 2010), por lo que ha sido muy utilizado para evaluar la diversidad de la comunidad de HMA; sin embargo, tiene sus desventajas ya que es posible que algunas especies de HMA no hayan producido esporas en el momento del muestreo o que la calidad de las esporas en el suelo colectado no permita una correcta observación de sus paredes y capas respectivas (Clapp et al., 1995).
Los HMA son cosmopolitas y se encuentran ampliamente distribuidos en los trópicos (Smith y Read, 2008). Se ha observado que el 80% de las plantas estudiadas pertenecen a familias que forman micorrizas (Smith y Read, 2008; Brundrett, 2009), y dada las características biológicas de la diversidad de ambientes en México se esperaría que la diversidad de HMA siguiese el mismo patrón que otros grupos, es decir, que aumentase hacia el trópico. De acuerdo a la CONABIO (2009), hay un mayor número de especies en general por unidad de área hacia el sur de nuestro país, en el trópico húmedo; sin embargo, aún hay muchos ambientes y sitios que explorar. Además, para ecosistemas tropicales, prácticamente no existe información en el sentido de que como señaló Janos (1980), la diversidad de HMA podría aumentar en el curso de la sucesión vegetal. El objetivo de este trabajo fue caracterizar a las comunidades de HMA a través de la estimación de la riqueza de especies y la abundancia de esporas de HMA en sitios que presentan distintas etapas de regeneración derivados de una selva húmeda en un municipio de la selva Lacandona (Chiapas) en dos temporadas.
Se espera que la mayor producción de esporas ocurra durante la temporada de secas ya que se ha demostrado que la baja disponibilidad de agua genera estrés hídrico a las plantas y ello, a su vez, en los hongos, que responden incrementando su producción de esporas (Ramírez et al., 1997; Guadarrama y Álvarez-Sánchez, 1999; Violi et al., 2008). Por otro lado, dado que se ha señalado que la diversidad de plantas determina la de HMA (van der Heijden et al., 1998), se espera que la riqueza, diversidad y abundancia de esporas aumenten en los sitios con mayor diversidad, es decir, los sitios tardíos sucesionales (Fitzsimons et al., 2008).
Materiales y Métodos
Sitio de Estudio
El municipio de Marqués de Comillas se ubica en la zona fronteriza entre México y Guatemala, al este del estado de Chiapas. Tiene una superficie territorial de 94 266 ha, lo que equivale a aproximadamente una décima parte de la Selva Lacandona (Figura 1). El clima es cálido con dos subcategorías de acuerdo con la clasificación de Köppen, húmedo y subhúmedo. La precipitación va de 2000 a 3 000 mm anuales (García, 2004); las lluvias se concentran entre junio y septiembre, con mínimos entre marzo y abril donde no rebasan los 40 mm mensuales. La temperatura media anual varía entre 22 y 26 ºC (García, 2004).
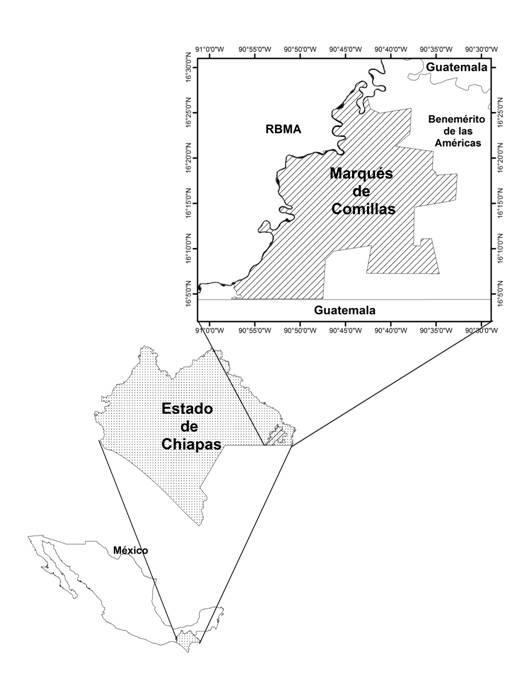
Figura 1 Localización de Marqués de Comillas, en el Estado de Chiapas, México. RBMA: Reserva de la Biosfera de Montes Azules.
Los suelos son fundamentalmente luvisoles stágnicos y háplicos, acrisoles húmicos y férricos, cambisoles stágnicos y vérticos (Siebe et al., 1995). Las principales diferencias de los suelos están dadas por su grado de acidez, con valores de 3.9 en acrisoles a 7.9 en algunos sitios con leptosoles réndzicos.
El tipo de vegetación es selva alta perennifolia, que presenta tres estratos arbóreos y uno más bajo (<10 m), y se reporta como inundable. Algunas de las especies con valores de importancia más altos en el estrato superior son Brosimun alicastrum Sw., Spondias mombin L., Ficus tecolutencis (Liebm.) Miq. y Ampelocera hottlei (Standl.) Standl. El estrato medio se caracteriza por la presencia de Castilla elastica Cerv., Zantoxylum caribaeum Lam. y Cordia bicolor A. DC.; en el estrato inferior destacan Clarisa biflora Ruiz & Pav., Quararibea yunckeri Standl. y Orthion subssesile (Standl.) Steyerm. & Standl., entre otras (Carabias et al., 2015).
Muestreo
Se seleccionaron doce sitios en el municipio Marqués de Comillas, Chiapas, dentro de los ejidos Boca de Chajul y Playón de la Gloria; diez de ellos corresponden a zonas modificadas (potreros) y dos son áreas conservadas (selva). Se realizaron dos muestreos, el primero durante la temporada de secas, del 16 al 18 de abril de 2010, y el otro en la temporada de lluvias, del 2 al 4 de diciembre de 2010.
Para representar un gradiente de regeneración se escogieron sitios con diferentes características de acuerdo a la magnitud de biomasa vegetal, las formas de crecimiento dominantes y composición de especies (Álvarez-Sánchez et al., en prensa; Meli et al., 2015); etapa 1a: dos sitios de herbáceas, etapa 1b: un sitio de herbáceas, etapa 2: tres sitios de herbáceas y arbustos, etapa 3a: un sitio de herbáceas y leguminosas (principalmente arbustos de Acacia sp.), etapa 3b: un sitio de herbáceas y árboles, etapa 4a: dos sitios de arbóreas (vegetación ribereña) y etapa 4b: dos sitios de arbóreas (selva) (Tabla 1).
Tabla 1 Características de los sitios de estudio de acuerdo con sus formas de crecimiento, etapas de regeneración, biomasa vegetal y propiedades del suelo (modificado de Álvarez-Sánchez et al., en prensa).
| Biomasa vegetal | Suelo | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dueño | Formas de crecimiento | Etapa de regeneración | Pastos (g) | Latifoliadas (g) | Arbustos (g) | Mantillo (g) | Árboles (AB) | MO (%) | Densidad aparente (g cm -3 ) | pH | P (mg kg -1 ) | N (mg kg -1 ) |
| Gabino | Herbáceas | 1a | 894.8 | 43.1 | 0 | 61.6 | 92.4 | 5.8 | 0.7 | 6 | 2662.3 | 0.1 |
| Heriberto | Herbáceas | 1a | 171.4 | 26.9 | 0 | 68.1 | 251.8 | 4.3 | 0.8 | 6.5 | 1007.2 | 0.1 |
| Francisco | Herbáceas | 1b | 1201.3 | 171.0 | 0 | 545.9 | 0 | 7.2 | 0.6 | 6.6 | 872.6 | 0.2 |
| Olivar | Herbáceas y arbustos | 2 | 431 | 51.3 | 164.0 | 110.2 | 80.2 | 4.7 | 0.6 | 6 | 862.2 | 0.2 |
| Ricardo | Herbáceas y arbustos | 2 | 916.8 | 137.0 | 934.3 | 359.4 | 236.9 | 7.4 | 0.6 | 5.9 | 1075.8 | 0.1 |
| Abel | Herbáceas y arbustos | 2 | 219.4 | 234.1 | 33.6 | 56.1 | 0 | 4.8 | 0.6 | 5.9 | 437.4 | 0.2 |
| Teódulo | Herbáceas y árboles | 3a | 348.5 | 50.7 | 0 | 277.2 | 333.5 | 2.3 | 0.9 | 7 | 1324.3 | 0.8 |
| Laureano | Herbáceas y Leguminosas | 3b | 2005.4 | 27.7 | 214.9 | 94.9 | 728.1 | 3.8 | 0.9 | 6.4 | 986.1 | 0.2 |
| Ramiro | Vegetación Ribereña | 4a | 236.4 | 166.2 | 0 | 654.8 | 360.7 | 4.1 | 0.7 | 7 | 767.3 | 0.2 |
| Rubén | Vegetación Ribereña | 4a | 124.1 | 94.6 | 0 | 99.4 | 558.3 | 5.6 | 0.8 | 7.8 | 1023.4 | 0.1 |
| Miranda | Árboles | 4b | - | ND | ND | ND | ND | 5.8 | ND | 7 | ND | ND |
| José | Árboles | 4b | - | ND | ND | ND | ND | 5.9 | ND | 7.2 | ND | ND |
Los datos de P y N son promedio de las temporadas de secas y lluvias (Adriano et al., datos no publicados). ND: No determinado
Si bien las condiciones edáficas son relativamente similares (Tabla 1), los diez sitios en regeneración muestran características contrastantes en cuanto a la dominancia de los distintos grupos funcionales (Figura 2; estas características no fueron evaluadas en los dos sitios de selva). Los sitios de estadios más temprano presentan una importante presencia de gramíneas y ausencia de árboles, y viceversa para sitios más avanzados en la regeneración. En estos sitios se establecieron parcelas de restauración de riberas de 8 × 60 m de acuerdo a la disposición del dueño de la parcela (Meli et al., 2015).
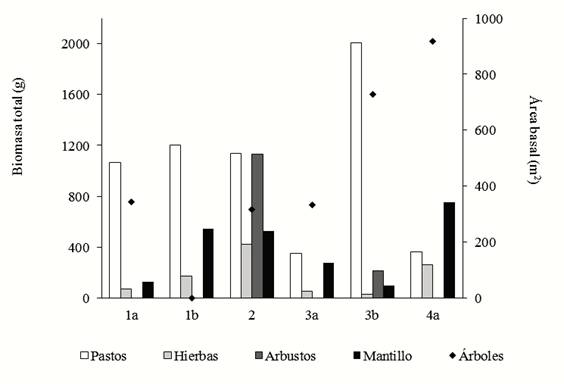
Figura 2 Abundancia total de esporas por género en cada uno de los sitios en todas las etapas de regeneración durante ambas temporadas, secas y lluvias, en Marqués de Comillas, Chiapas, México.
Dado este tamaño de parcela y para representar la potencial variación de la comunidad de HMA dentro de cada sitio se establecieron dos líneas de 50 m de largo, paralelas al cauce del río y distantes a 1 y 20 metros del borde de ribera . De esta manera las líneas representan la zona riparia y la zona de tierra firme de cada sitio (Meli et al., 2015).
Sobre cada línea se establecieron tres y dos puntos de muestreo, respectivamente, a una distancia de quince metros entre sí. En cada punto de muestreo se trazó un cuadro de 1×1 m y de su centro y sus esquinas se tomó suelo para una muestra compuesta de 1.5 kg aproximadamente. Las muestras fueron tomadas de los primeros 15 cm de profundidad, dando como resultado cinco muestras por parcela. Posteriormente, se secaron a temperatura ambiente, se eliminaron raíces y rocas y se pesaron 100 g de suelo de cada una para efectuar la extracción de esporas.
Extracción e identificación de esporas
La extracción de esporas se llevó a cabo por el método modificado de tamizado húmedo, decantación y centrifugación en agua y sacarosa de Brundrett et al. (1996). Las esporas extraídas fueron montadas en portaobjetos con alcohol polivinílico (PVLG) como medio fijador y Reactivo de Melzer. Las preparaciones se observaron a detalle con la ayuda de un microscopio Zeiss® modelo Axioscop II Plus, equipado con contraste de interferencia de Nomarski. Con una cámara digital Toupcam UCMOS02000KPB y el software de digitalización de imágenes ToupTek ToupView versión x64.3.7.1460 (2003-2013) se capturaron imágenes de las esporas. Para la determinación a especie, se consideraron las características morfológicas de las esporas, color, tamaño, tipo de hifa, escudos de germinación y la consistencia, arreglo, ornamentación y reacción al Melzer de las capas que componen la pared de las esporas. El tamaño de las esporas y el grosor de los estratos de pared se obtuvieron con una reglilla micrométrica acoplada a uno de los oculares. Para la determinación de las especies se consultó la información del Internacional Culture Collection of Vesicular Arbuscular Mycorrhizal Fungi (INVAM), a través de la página web http://invam.caf.wvu.edu/myc_info/taxonomy, así como las descripciones de diferentes especies que pueden obtenerse en la página web http://www.agro.ar.szczecin.pljblaszkowski/index.html y a través de las ligas en la página web http://schuessler.userweb.mwn.de/amphylo/. Las especies citadas por primera vez para México se describen en extenso; los colores se indican con base en las tablas de colores Munsell para suelos (U.S. Department of Agriculture, 1975). La clasificación de los HMA se enuncia de acuerdo con la propuesta de Redecker et al. (2013), Schüßler et al. (2001) y dicha última página web.
Para complementar el registro de especies y cotejar las esporas obtenidas en las muestras, se elaboraron macetas de propagación con el suelo recolectado de cada uno de los doce sitios con el fin de obtener una mayor abundancia de esporas y de mejor calidad (Brundrett et al., 1996). Preparaciones permanentes con esporas de algunas de las especies se encuentran depositadas en el Herbario TLXM de la Universidad Autónoma de Tlaxcala.
Análisis de datos
Para estimar la diversidad de especies de HMA en cada uno de los sitios se utilizó el índice de Shannon-Wiener (H´) y, a partir de éste se estimó la equitabilidad (Magurran, 2004). Se comparó la riqueza de especies entre temporadas (secas y lluvias) y entre sitios (de 1 hasta 12) con un análisis de varianza (ANOVA); en el caso de la abundancia de esporas se consideraron los datos de ambas estaciones conjuntamente y solo se comparó entre sitios. Los datos cumplieron con los supuestos para aplicar la prueba de ANOVA. Cuando se detectaron diferencias significativas con la prueba de ANOVA, se aplicó la prueba de Tukey de comparación múltiple de medias (α = 0.05), utilizando el programa Statistica versión 8.0 (StatSoft, 2007).
Resultados
Diversidad de especies y nuevos registros para México
Se identificaron 49 especies de hongos micorrizógenos arbusculares pertenecientes a 15 géneros (HMA) (Tabla 2, Figura 3). Las especies corresponden a los géneros: Acaulospora, Ambispora, Archaeospora, Claroideoglomus, Diversispora, Dominikia, Entrophospora, Funneliformis, Gigaspora, Glomus, Racocetra, Rhizophagus, Sclerocystis, Scutellospora y Septoglomus. El género Acaulospora tuvo la mayor riqueza de especies (15) que corresponden al 31% del total, seguido del género Glomus (10) con el 24%, de Ambispora fueron cuatro (9%), Claroideoglomus, Funneliformis, Diversispora, Scutellospora, Rhizophagus y Sclerocystis tuvieron dos (4%), mientras que los géneros Septoglomus, Dominikia, Gigaspora, Entrophospora, Archaeospora y Racocetra presentaron los valores más bajos con sólo una especie, contribuyendo cada uno con el 2%.
Tabla 2 Familias y especies de hongos micorrizógenos arbusculares (HMA) encontradas en doce sitios pertenecientes a cuatro etapas de regeneración
| Especies | Frecuencia relativa | |
|---|---|---|
| Diversisporales | ||
| Acaulosporaceae | ||
| Acaulospora bireticulata F.M. Rothwell & Trappe+ | 8.33 | |
| Acaulospora delicata C. Walker, C.M. Pfeiff. & Bloss | 33.33 | |
| Acaulospora foveata Trappe & Janos | 75 | |
| Acaulospora kentinensis (C.G. Wu & Y.S. Liu) Kaonongbua, J.B. Morton & Bever | 58.33 | |
| Acaulospora laevis Gerd. & Trappe+ | 58.33 | |
| Acaulospora mellea Spain & N.C . Schenck+ | 91.66 | |
| Acaulospora morrowiae Spain & N.C. Schenck | 91.66 | |
| Acaulospora rehmii Sieverd. & S. Toro | 25 | |
| Acaulospora scrobiculata Trappe | 100 | |
| Acaulospora spinosa C. Walker & Trappe | 75 | |
| Acaulospora aff. undulata Sieverd. | 41.66 | |
| Acaulospora sp. 1 | 33.33 | |
| Acaulospora sp. 2 | 8.33 | |
| Acaulospora sp. 3 | 50 | |
| Entrophospora infrequens (I.R. Hall)R.N. Ames & R.W. Schneid | 16.66 | |
| Diversiporaceae | ||
| Diversispora eburnea (L.J. Kenn., J.C. Stutz & J.B. Morton) C. Walker & Schuessler | 16.66 | |
| Diversispora spurca Pfeiffer, Walker & Bloss+ | 8.33 | |
| Diversispora aurantia (Blaszk., Blanke, Renker & Buscot) C. Walker & A. Schuessler | 58.33 | |
| Gigasporaceae | ||
| Gigaspora gigantea (T.H. Nicolson & Gerd.) Gerd & Trappe | 33.33 | |
| Scutellospora dipurpurescens J.B. Morton & Koske | 8.33 | |
| Scutellospora gilmoreii (Trappe & Gerd.) C. Walker & F. E. Sanders | 33.33 | |
| Racocetra gregaria (N.C.Schenck ?αμπ; T.H.Nicolson) Oehl, F.A.Souza ?αμπ; Sieverd | 8.33 | |
| Glomerales | ||
| Claroideoglomeraceae | ||
| Claroideoglomus claroideum (N.C. Schenck & G. S. Sm.) C. Walker & A. Schuessler+ | 16.66 | |
| Claroideoglomus etunicatum (W.N. Becker & Gerd.) C. Walker & A. Schuessler | 83.33 | |
| Glomeraceae | ||
| Dominikia minuta (Błaszk., Tadych & Madej) Błaszk., Chwat & Kovács | 33.33 | |
| Funneliformis geosporus (T.H. Nicolson & Gerd.) C. Walker & A. Schuessler | 91.66 | |
| Funneliformis mosseae (T.H. Nicolson & Gerd.) C. Walker & A. Schuessler | 58.33 | |
| Glomus albidum C. Walker & L.H. Rhodes | 75 | |
| Glomus ambisporum G.S. Sm. & N. C. Schenk | 91.66 | |
| Glomus multiforum Blaszk. | 8.33 | |
| Glomus spinuliferum Sieverd. & Oehl, in Oehl, Wiemken & Sieverding+ | 66.66 | |
| Glomus sp. 1+ | 100 | |
| Glomus sp. 2 | 16.66 | |
| Glomus sp. 3 | 8.33 | |
| Glomus sp. 4 | 75 | |
| Glomus sp. 5 | 25 | |
| Rhizophagus clarus (T.H. Nicolson & N.C. Schenck). C. Walker & A. Schuessler+ | 16.66 | |
| Rhizophagus diaphanus (C. Cano & Y. Dalpé) C. Walker & A. Schuessler | 33.33 | |
| Rhizophagus fasciculatus (Thaxt.) C. Walker & A. Schuessler | 16.66 | |
| Sclerocystis clavispora Trappe | 16.66 | |
| Sclerocystis sinuosa Gerd. & B. K. Bakshi | 25 | |
| Septoglomus constrictum (Trappe) C.Walker & A. Schübler | 50 | |
| Archaeosporales | ||
| Ambisporaceae | ||
| Ambispora appendicula (Spain, Sieverd. & N.C. Schenck) C. Walker | 50 | |
| Ambispora gerdemannii (S.L. Rose, B.A. Daniels & Trappe) C. Walker, Vestberg & A. Schuessler | 100 | |
| Ambispora sp. 1+ | 41.66 | |
| Ambispora sp. 2 | 16.66 | |
| Archaeosporaceae | ||
| Archaeospora sp. 1 | 8.33 | |

Figura 3 Algunas especies de hongos micorrizógenos arbusculares de la Selva Lacandona. a. Acaulospora colombiana. b. Ambispora appendicula. c. A. gerdemannii. d. Acaulospora aff. undulata. e. Claroideoglomus claroideum. f. Esporas de Dominikia minuta dentro de una espora vacía de A. scrobiculata. g. Entrophospora infrequens. h. Glomus insculptum. i. G. pustulatum. j. G. spinuliferum. k. Rhizophagus clarus. l. Septoglomus constrictum. Las barras de escala equivalen a 25 μm.
El género Acaulospora presentó 908 esporas, lo que corresponde al valor más alto, seguido de Glomus con 762 esporas, mientras que Archaeospora sp. y Racocetra gregaria sólo presentaron una espora (Figura 4).
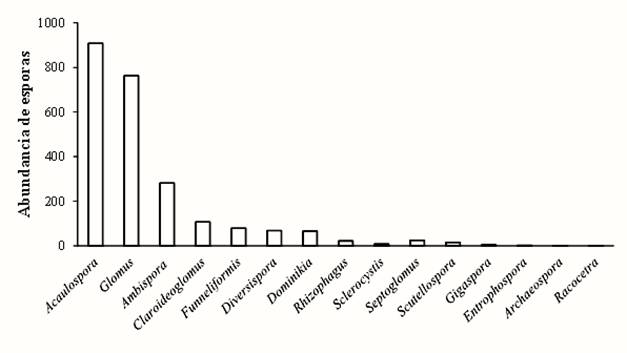
Figura 4 Abundancia total de esporas por género en cada uno de los sitios en todas las etapas de regeneración durante ambas temporadas, secas y lluvias, en Marqués de Comillas, Chiapas, México.
Los valores de frecuencia relativa entre 75 y 100% se resaltan con negritas. El símbolo + indica que la especie se propagó en maceta. Acaulospora colombiana y Glomus pustulatum (que se mencionan en el texto) se obtuvieron solamente de macetas de propagación.
Acaulospora colombiana y Glomus pustulatum se obtuvieron sólo de macetas de propagación. Diez especies (tres de Acaulospora, cinco de Glomus y dos de Ambispora) fueron asignadas como sp. debido a que no corresponden con las especies de HMA descritas hasta la fecha y podrían corresponder a especies nuevas. Acaulospora aff. undulata se designó como afín debido a que los caracteres morfológicos de sus esporas no coincidieron completamente con los descritos para la especie.
Acaulospora scrobiculata, Ambispora gerdemannii y Glomus sp. 1 se presentaron en todos los sitios. Acaulospora foveata, A. spinosa, Glomus albidum y Glomus sp. 4 se presentaron en nueve sitios. Acaulospora bireticulata, Glomus sp. 3, Racocetra gregaria y Diversispora spurca fueron encontradas en los sitios de la etapa 4a y Archaeospora sp. 1 sólo se encontró en un sitio de la etapa 4b, por lo que son consideradas especies exclusivas de estos sitios.
A continuación se describen los nuevos registros para México
Dominikia minuta (Blaszk., Tadych & Madej) Blaszk., Chwat. & Kovács
Glomerosporas glomoides, ectocárpicas, de color hialinas a blancas por la luz reflejada, globosas, de 23.4-35.1 μm de diámetro. Pared de la espora (SW) integrada por dos estratos hialinos (SW1, SW2). Estrato SW1 semi-rígido, de menos de 1 μm de grosor; estrato SW2 laminado, de menos de 1 μm a 1.9 de grosor, las láminas muy delgadas y poco perceptibles. Hifa de origen hialina, cilíndrica, recta, de 3.9-4.8 μm de diámetro, con dos estratos, continuos con los estratos de la pared de la espora. Oclusión en la base de la espora, formada por un septo originado en el estrato laminado de la pared. Ninguno de los estratos de la pared de la espora o de la hifa reacciona con Melzer.
Dominikia minuta se distingue de otras especies de HMA de esporas hialinas o blancas por la composición de sus estratos y la ausencia de reacción con Melzer. Es común observar varias esporas de esta especie aglomeradas en esporocarpos laxos dentro de los restos de esporas muertas de otros HMA.
Glomus insculptum Blaszk.
Glomerosporas glomoides, ectocárpicas, de color amarillo (Munsell: 2.5Y8/8), globosas, de 46.8-68.4 (-82) μm de diámetro. Pared de la espora integrada por dos estratos (SW1, SW2). Estrato SW1 hialino a blanquecino, semi-rígido, de menos de 0.9-1.9 μm de grosor; estrato SW2 amarillo dorado (5Y8/6) laminado, de 3.9-7.8 μm de grosor, liso en su superficie externa y ornamentado en la interna; ornamentación formada por areolas circulares a ligeramente poligonales, distribuidas uniformemente, de 1.9-2.9 μm de diámetro por 0.9-1.9 μm de profundidad, con el fondo redondeado. Hifa de origen de color amarillo pálido (2.5Y8/4), cilíndrica a ligeramente ensanchada, de 3.9-7.8 μm de diámetro, con dos estratos continuos con los estratos de la pared de la espora. Oclusión ligeramente por debajo de la base de la espora, en forma de septo formado por el segundo estrato de la pared. Ninguno de los estratos reacciona con Melzer.
Las características distintivas de esta especie son la ausencia de reacción al Melzer en los estratos y la ornamentación en forma de areolas en la superficie interna del estrato laminado.
Riqueza de especies
En cuanto a la riqueza de especies entre temporadas (secas y lluvias) se observaron diferencias marginalmente significativas (F1,96 = 30.96, p<0.06). Los valores más altos se presentaron durante la temporada de secas con un total de 45 especies, mientras que durante la temporada de lluvias se detectaron 32. Ambas temporadas compartieron 31 especies. Acaulospora bireticulata, Ambispora sp. 1, Archaespora sp., Diversispora eburnea, Dominikia minuta, Glomus albidum, G. diaphanum, G. insculptum, Glomus sp. 2, Glomus sp. 3, Racocetra gregaria, Rhizophagus fasciculatus, Sclerocystis clavispora y S. sinuosa fueron especies que sólo se presentaron durante la temporada de secas. Acaulospora sp. 2 es una especie exclusiva de un sitio de la etapa 2, mientras que Diversispora spurca sólo presentó tres esporas en un sitio de la etapa 4a, ambas en la temporada de lluvias.
Tanto en la temporada de secas como de lluvias se presentaron Acaulospora delicata, A. foveata, A. kentinensis, A. laevis, A. mellea, A. morrowiae, A. rehmii, A. scrobiculata, A. spinosa, A. aff. undulata, Acaulospora sp. 2, Acaulospora sp. 3, Ambispora appendicula, A. gerdemannii, Ambispora sp. 2, Claroideoglomus claroideum, C. etunicatum, D. aurantia, Entrophospora infrequens, F. geosporus, F. mosseae, Gigaspora gigantea, Glomus ambisporum, G. spinuliferum, Glomus sp. 1, Glomus sp. 4, Glomus sp. 5, Rhizophagus clarus, Scutellospora gilmoreii y Septoglomus constrictum.
Durante la temporada de lluvias y secas los valores más altos de riqueza de especies se presentan en uno de los sitios de la etapa 4a con 15 especies y 22 especies, respectivamente; mientras que los valores más bajos se presentaron en los sitios de la etapa 2 y 3b con cinco especies cada uno (Figura 5) en la temporada de lluvias y durante la temporada de secas los valores más bajos los tuvo otro de los sitios de la etapa 4a con diez especies (Figura 5).
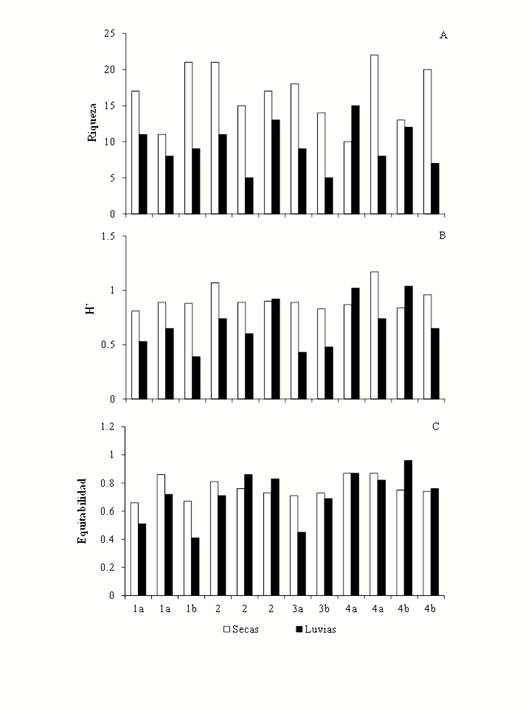
Figura 5 Riqueza de especies (arriba), índice de diversidad de Shannon-Wiever (en medio) y Equitabilidad (abajo) de hongos micorrizógenos arbusculares en Marqués de Comillas, Chiapas, México en los sitios en las etapas de regeneración durante la temporada seca (negro) y de lluvias. Etapa 1a y 1b: Herbáceas, 2: Herbáceas y arbustos, 3a: Herbáceas y leguminosas, 3b: Herbáceas y árboles, 4a: Arbóreas (Vegetación ribereña) y 4b: Arbóreas (Selva).
El índice de diversidad más alto correspondió a la temporada de secas en uno de los sitios de la etapa 4a (1.17) y el valor más bajo (0.39) se dio en la temporada de lluvias en un sitio de la etapa 2 (Figura 5). La equitabilidad (0.96) fue mayor en temporada de lluvias en un sitio de la etapa 4b y el valor más bajo (0.41) también fue en lluvias pero en un sitio de la etapa 2 (Figura 5).
Con respecto a la abundancia de esporas, el ANOVA mostró diferencias significativas entre sitios (F11,96=4.56, p<0.001), siendo uno de los sitios de la etapa 2 el que tuvo el mayor número de esporas(413) y el menor (61) ocurrió en el sitio de la etapa 3b (Figura 6).
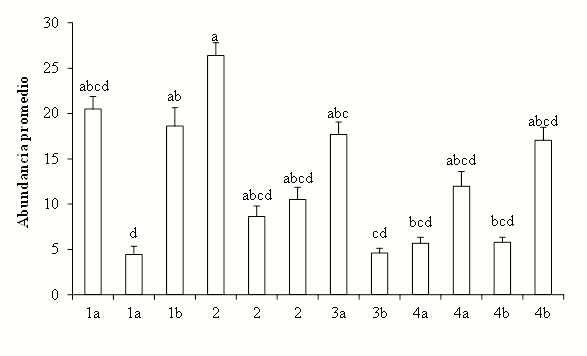
Figura 6 Abundancia promedio (+EE) de esporas de hongos micorrizógenos arbusculares en Marqués de Comillas, Chiapas, México en los sitios con distintas etapas de regeneración. Etapa 1a y 1b: Herbáceas, 2: Herbáceas y arbustos, 3a: Herbáceas y leguminosas, 3b: Herbáceas y árboles, 4a: Arbóreas (Vegetación ribereña) y 4b: Arbóreas (Selva). Letras iguales indican que no hay diferencias significativas de acuerdo a la Prueba de Tukey (p<0.001).
Discusión
En este estudio encontramos una riqueza de HMA de 49 especies, lo que representa el 18.8% de las 260 especies descritas a nivel mundial (Schüβler y Walker, 2010), este valor está por arriba de lo reportado para otros estudios en selvas húmedas de otras regiones del mundo; 27 especies en China (Zhao et al., 2003), 16 en Costa Rica (Lovelock et al., 2003) y 27 en Panamá (Mangan et al., 2004), pero también es menor a las 61 especies reportadas para la región occidental de la Amazonía por Stürmer y Siqueira (2010), aunque ellos abarcan diferentes usos de suelo. En particular, en México, la riqueza que contabilizamos es un valor alto, representando el 47.1% del total de especies reportadas para México (Montaño-Arias et al., 2012; Chimal-Sánchez et al., 2016), siendo la segunda riqueza más alta reportada para México, está por arriba de las 16 especies en sitios de selva conservada en Los Tuxtlas, Veracruz (Guadarrama y Álvarez-Sánchez, 1999), aquella encontrada en fragmentos de diferente tamaño de vegetación original remanente (43) (Sánchez-Gallen et al., datos no publicados) o en distintos usos de suelo (44) (Varela et al., 2009) y se ubica después de la registrada por Violi et al. (2008) quienes reportaron un total de 60 especies dentro de una zona de selva y áreas con cierto grado de disturbio dentro de los estados de Chiapas y Veracruz (para Chiapas sólo reportaron 35 especies).
Esta alta riqueza puede estar relacionada con diversos factores, por un lado, al patrón global de distribución de la riqueza biológica donde el mayor número de especies de muchos grupos biológicos se concentra en los trópicos dadas sus condiciones constantes de radiación solar y disponibilidad de agua (Read, 1994), y, por otro lado, puede estar relacionada con las respuestas más puntuales de los HMA a las condiciones ambientales locales y de alto recambio espacial (Davidson et al., 2015), dado que factores tales como la humedad y el tipo de comunidad vegetal explican solo una pequeña parte de la variación de las comunidades de HMA (Kivlin et al., 2012).
Las diferencias entre sitios pueden estar relacionadas con el efecto que tienen las prácticas de manejo del suelo ya que si son muy intensas pueden reducir la abundancia de propágulos así como la riqueza de especies de HMA (Owen et al., 2009), esto ocurre porque algunas especies de los HMA son sensibles a los disturbios naturales o antropogénicos que alteran las características del suelo, como son las prácticas de labranza aplicadas a la agricultura (Alguacil et al., 2008). También la adición de fertilizantes puede reducir el número de especies de HMA, ya que a bajas concentraciones de fósforo se favorece la relación HMA-plantas, mientras que a concentraciones altas, como se observa en algunos de los sitios 2, 3a y 4a, puede inhibirse la relación (Johnson et al., 1991).
Con una diferencia marginal, la mayor riqueza de especies (44) se presentó durante la temporada de secas, lo que concuerda con nuestra hipótesis. Es importante tomar en cuenta que ante una baja disponibilidad de agua, el desarrollo fúngico y la germinación de las esporas se ven afectados, así como el desarrollo vegetal, lo que promueve la producción de las esporas que son estructuras de resistencia (Augé, 2001). Al contrario, durante la temporada de lluvias, la disponibilidad de agua favorece la germinación de las esporas, una elevada actividad microbiana nociva y la depredación de micelio y esporas de HMA por la microfauna edáfica (Ragupathy y Mahadevan, 1993; Ramírez et al., 1997) por lo que la caracterización de las especies a través de las esporas producidas se dificulta, ya que no abundan en el suelo.
Chaudhary et al. (2008) propusieron que los factores que afectan más consistentemente la distribución de las especies de HMA son el clima y las propiedades del suelo (la textura del suelo, el contenido de materia orgánica, el pH y la disponibilidad de N y P), combinadas con las propiedades bióticas como la composición de las comunidades vegetales y las interacciones intra- e interespecíficas. Sin embargo, actualmente gran cantidad de evidencia apunta a las propiedades físico-químicas del suelo como los factores determinantes de la composición de la comunidad de HMA (de Souza y Freitas, 2017).
La mayor abundancia de esporas se presentó en los sitios con menor desarrollo sucesional como es el caso de los sitios con herbáceas (etapa 2). Probablemente ello pueda explicarse por la menor densidad aparente del suelo y el mayor porcentaje de materia orgánica que tienen estos sitios, ya que estas condiciones permiten y promueven un mayor crecimiento de las raíces de las plantas y, por lo tanto, los HMA cuentan con una mayor disponibilidad de raíces para desarrollarse y obtener recursos que promuevan una mayor esporulación (Lovelock et al., 2003; Stürmer y Siqueira, 2010). El pH, que en estos sitios se encuentra entre 6.2 y 6.7, también pudo haber influido en la abundancia de esporas; se ha reportado que el pH ideal para el desarrollo de los HMA está entre 6 y 7 sin importar el género (Bagyaraj, 1991), aunque especies del género Acaulospora pueden desarrollarse más en suelos con pH de 4.9 hasta 6.4 (Silva et al., 2007) o más bien ácido (Souza et al., 2003).
Contrario a lo anterior, en la etapa con herbáceas y árboles (3b), la densidad aparente del suelo muestra un valor alto, lo que indica que son suelos más compactos que no permiten un buen crecimiento de las raíces ni desarrollo del micelio y, por lo tanto, el desarrollo de los HMA no es favorecido, lo cual se puede reflejar en una menor abundancia de esporas.
En cuanto a la composición, la mayor proporción de especies pertenecen a los géneros Acaulospora y Glomus, con un total de esporas de 908 y 762, respectivamente, esto coincide con otros estudios en sistemas tropicales que reportan el mismo comportamiento como Nicaragua, Costa Rica y Brasil (Picone, 2000; Lovelock et al., 2003). Hart y Reader (2004) señalaron que las esporas glomoides (especies del género Glomus sensu lato) suelen predominar en diversas condiciones de suelo debido a que resisten más los disturbios que las especies gigasporoides (géneros Gigaspora, Dentiscutata, Racocetra y Scutellospora). Se ha señalado que los géneros Acaulospora y Glomus comprenden un mayor número de especies que presentan adaptaciones a suelos degradados, poco fértiles y con valores bajos de pH, pero con una alta disponibilidad de agua durante gran parte del año (Boddington y Dood, 2000; Lovelock et al., 2003).
No obstante, también para sistemas tropicales se ha encontrado lo contrario, es decir, que Glomus domina sobre Acaulospora, como en los estudios de Zhao et al. (2003) en China, Mangan et al. (2004) en Panamá, Zangaro et al. (2007), Stürmer y Siqueira (2010) en Brasil, y en México, Guadarrama y Álvarez-Sánchez (1999) y Varela et al. (2009). Todas las especies de ambos géneros fueron encontradas en todas las etapas sucesionales, lo que indica que, al menos algunas de las especies, son capaces de resistir cambios en las condiciones edáficas.
Las diferencias en la composición de especies de acuerdo a la temporada están relacionadas con el hecho de que, ante la escasez de agua, es común que las esporas de géneros como Acaulospora (Gazey et al., 1993), Gigaspora (Maia y Yano-Melo, 2001) y Glomus (Juge et al., 2001) entren en latencia para permanecer por más tiempo en el suelo, produciendo más esporas.
En este estudio sólo se encontró una especie de Gigaspora, dos de Scutellospora y una de Racocetra; G. gigantea y S. gilmoreii procedentes de un sitio con herbáceas y otro con vegetación ribereña, y R. gregaria sólo de un sitio de esta última etapa; estos géneros, debido al tamaño de sus esporas y su gran desarrollo micelial, están más asociados a sitios conservados y a las últimas etapas sucesionales (Allen et al., 2003), por lo que se puede afirmar que los sitios donde se encontraron están poco perturbados a pesar de haber ocurrido un cambio de uso de suelo. Algo importante que hay que señalar al respecto de estas tres especies es que además de solo encontrarse en pocos sitios, lo hicieron con muy pocas esporas concentradas en la temporada de secas, todo ello puede apuntar a que son especies raras, aunque también puede ser que se encuentren en las raíces y sea difícil que produzcan esporas (Clapp et al., 1995) por el costo energético que ello implica.
Dominikia minuta y Glomus insculptum constituyen nuevos registros para México, estas especies se reportaron por primera vez en dunas de arena (Blaszkowski et al., 2000; Blaszkowski et al., 2004). Ambispora gerdemannii, sólo conocida de matorral xerófilo en México (Montaño-Arias et al., 2012), se encontró en todos los sitios de estudio en ambas temporadas, lo que indica que puede comportarse como generalista dentro de un intervalo de condiciones de alta humedad. No obstante, su carácter dimórfico dificulta su registro a través de sus características morfológicas, ya que sus esporas de tipo glomoide pueden confundirse con las de otras especies (Spain et al., 2006) y, por lo tanto, encubrir su distribución en otros ambientes.
Glomus sp. 1 fue la morfoespecie más abundante tanto en secas como en lluvias y en todas las etapas de regeneración, lo que puede indicar que es una especie generalista y que la estacionalidad no es un factor que influya sus patrones de esporulación.
En conclusión, la selva Lacandona es el segundo sitio más rico en especies de HMA en México reportado hasta la fecha; alberga especies poco conocidas a nivel mundial y especies posiblemente nuevas para la ciencia. En la selva Lacandona, confirmando nuestra primera hipótesis, la estacionalidad afecta la riqueza de especies, la abundancia de esporas y la composición de especies; por otro lado, debido al cambio de uso del suelo y en estadios sucesionales tempranos, se observó menor abundancia de esporas, riqueza y diversidad de especies de HMA, confirmando sólo parcialmente nuestra segunda hipótesis.











 nueva página del texto (beta)
nueva página del texto (beta)


