El pulgón amarillo del sorgo Melanaphis sacchari (Zehntner, 1897), es una plaga de importancia económica que afecta principalmente los cultivos de sorgo, avena, caña de azúcar, trigo, cebada, y como hospedantes secundarios arroz y maíz (Singh et al., 2004). Esta plaga se detectó por primera vez en México en noviembre de 2013 al norte del estado de Tamaulipas, ocasionando daños severos en cultivos de sorgo (Rodríguez-del-Bosque y Terán, 2015). Para junio de 2015, su distribución incluía 13 estados de la República Mexicana (SENASICA, 2015). La ausencia de enemigos naturales de M. sacchari incrementa sus poblaciones en sorgo, por lo que su conservación juega un papel importante para mantener este cultivo por debajo del umbral de daño económico (van Rensburg y van Hamburg, 1975; Hall, 1987). Los hongos entomopatógenos se encuentran dentro de los enemigos naturales de M. sacchari, una de las especies reportadas es Lecanicillium lecanii (Zimm.) Zare & W. Gams (Singh et al., 2004), sin embargo, existen otras especies de Lecanicillium asociadas a áfidos, por lo que su estudio es fundamental en la búsqueda de aislados prometedores para el desarrollo de insecticidas microbianos (Gallou et al., 2016).
En la comunidad de Tecuanillo, Tecomán, Colima (18.85775° N y 103.88159° W, 85 msnm) se observaron altas infestaciones del pulgón amarillo en un cultivo de sorgo en enero de 2016 (0.3 ha). Durante el hallazgo se observó una gran cantidad de afídos micosados sobre el follaje con aspecto algodonoso y de apariencia amarillenta, se procedió a la colecta de dicho material para su aislamiento y caracterización morfológica. Además se colectaron áfidos sanos, los cuales fueron utilizados para realizar la identificación molecular mediante secuenciación del gen mitocondrial de la Citocromo c Oxidasa I (COI) (Herbert et al., 2003). Se realizó un segundo muestreo (una semana posterior) para recolectar aleatoriamente secciones de hojas de aproximadamente 8 x 2.5 cm con la finalidad de contabilizarlos y determinar el porcentaje de infección en áfidos ocasionado por el hongo (un total de 26 cortes). Para esta determinación se consideró como infectados a aquellos insectos con signos visibles, incluyendo cambios de coloración y presencia de hifas en diversas partes del cuerpo, en individuos vivos y muertos. Para que un hongo entomopatógeno infecte a un número inusual de huéspedes al mismo tiempo, debe haber condiciones abióticas favorables (Liu, 2012). Se consultó la temperatura y humedad relativa (HR) promedio mensual que fue de 24.5°C y 78.5% para enero de 2016 (Red de estaciones del INIFAP, 2016).
La identificación morfológica del hongo en principio se realizó sobre insectos micosados y una vez purificados del proceso de aislamiento, se realizaron micro-cultivos de Riddel siguiendo la metodología descrita por Mier et al. (2002), el medio base consistió de agar de dextrosa Sabouraud suplementado con extracto de levadura al 1% (ADSY), se incubaron a 27°C por 7 días, midiendo el largo y ancho de los conidios y conidióforos de acuerdo al estudio de Zare y Gams (2001). El material se examinó con un microscopio óptico AXIO Scope A1 (Carl Zeiss, Microscopy GmbH, Gottingen, Germany) utilizando el objetivo 100x. El crecimiento radial de los micelios fue ensayado por triplicado en ADSY, durante 17 días a 25 ± 2°C, y se registraron las características de los mismos. La caracterización molecular se realizó con un análisis multigénico de la región de los espaciadores transcritos internos (ITS), el exón del factor de elongación 1-α (TEF) y las subunidades 1 y 2 de la ribopolimerasa II (RPB1 y RPB2). Los procesos de extracción de ADN, amplificación por PCR y secuenciación se desarrollaron conforme a Gallou et al. (2016) exceptuando la amplificación de las regiones TEF, RPB1 y 2 (Johnson et al., 2009). La inferencia filogenética bayesiana se obtuvo con el software MrBayes 3.2.5 (Ronquist y Huelsenbeck, 2003).
La mayoría de áfidos vivos colectados en campo, estadios ninfales y adultos desarrollaron infección por el hongo en el laboratorio, los signos iniciales fueron cambios de coloración y crecimiento de micelio blanco en antenas y patas, y una vez muertos, abundante esporulación de tonalidad amarilla claro a crema en la parte central de los cadáveres. Las características morfológicas del hongo fueron fiálides verticiladas con cabezas globosas en las que se aglutinaban los conidios de forma de elipsoidal a oval-oblonga (Figura 1). La morfometría de los conidios del hongo a partir de insectos recolectados en campo fue 7.05 ± 1.22 (5.62 - 12.18) x 2.45 ± 0.51 (1.63 - 3.56) µm (n = 30), las fiálides midieron 32.46 ± 6.21 (21.6 - 47.19) x 1.90 ± 0.33 (1.32 - 2.72) µm (n = 30). Por su parte los micro-cultivos de siete días, mostraron las siguientes dimensiones conidiales 7.54 ± 1.27 (5.61- 9.85) x 2.69 ± 0.47 (1.94 - 3.44) (n = 30) y de fiálides 25.87 ± 6.04 (13.88 - 39.64) x 1.98 ± 0.33 (1.37 - 2.68) µm n = 30); el tamaño de las estructuras conidiales sobre el insecto y medio de cultivo son similares, las dimensiones de las fiálides en los áfidos fueron ligeramente mayores a las observadas en medio de cultivo, no obstante ambos caracteres se ubicaron en los rangos descritos por Zare y Gams (2001) y corresponden a Lecanicillium longisporum (Petch.) Zare y W. Gams. El crecimiento radial de los micelios en medio de cultivo después de 17 días fue de 3.6 cm, el anverso de los mismos mostró forma irregular, elevación umbonada, margen ondulado, consistencia dura y coloración blanca que se tornó amarilla azufre conforme a la maduración del cultivo; el reverso del micelio fue de amarillo a crema. Además la identidad del hongo fue confirmada con la inferencia filogenética procedente del análisis multigénico agrupándola en el clado de la cepa tipo CBS126.27 con un valor del 100% de Bootstrap y también corresponde a L. longisporum (Figura 2) (Número de accesión GenBank; ITS: KX426564; TEF: KX426565; RPB1: KX426566; RPB2: KX426567). El aislado de L. longisporum obtenido fue depositado en la Colección de Hongos Entomopatógenos (CHE) del Centro Nacional de Referencia de Control Biológico (CNRCB) en Tecomán, Colima, con el acrónimo CHE-CNRCB 620.
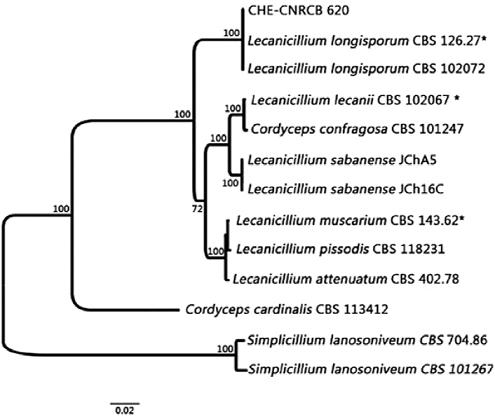
Figura 2: Filograma derivado del análisis Bayesiano acorde a la concatenación de ITS (región de espaciadores transcritos internos), TEF (exón del factor de elongación 1-α), RPB1 y RPB2 (sub unidad 1 y 2 de la ribopolimerasa II) (± 3100 pb). Se utilizó el modelo de evolución GTR (General Time-Reversible) con una distribución gamma y 1 000 000 de generaciones con un muestreo cada 200 árboles. El soporte de las ramas del árbol se representa como valor numérico en cada nodo. Las cepas ex-tipo (Zare y Gams, 2001) se señalan con un *.
Lecanicillium longisporum es referido como patógeno de los áfidos Myzus persicae (Sulzer) y Macrosiphoniella sanborni (Gillette) y se le ubica en el clado del género Lecanicillium que incluye a los patógenos de insectos L. attenuatum Zare & W. Gams, L. lecanii (Zimerm.) Zare & W. Gams, L. longisporum, L. muscarium (Petch) Zare & W. Gams y L. nodulosum (Petch) Zare & W. Gams, los cuales fueron clasificados anteriormente como Verticillium lecanii (Zimm.) Viégas (Zare y Gams, 2001).
La identidad del áfido M. sacchari fue confirmada al nivel molecular (Número de acceso Genbank: KY033389), el material fue depositado en alcohol al 100%, en la Colección de Insectos Entomófagos del Centro Nacional de Referencia en Tecomán, Colima.
Del material colectado en el segundo muestreo se contaron 5434 áfidos, el 90% presentaron infección por L. longisporum, incluyendo pulgones vivos y muertos. En estudios previos de laboratorio para L. lecanii, Ayala-Zermeño et al. (2002) determinaron que la temperatura óptima para su crecimiento es 25°C. La temperatura y humedad registrados en Tecuanillo, Colima, para el mes de enero de 2016, favorecieron el desarrollo de L. longisporum originando un alto porcentaje de infección sobre M. sacchari.
Al respecto, Steinkraus (2006) indica que los hongos entomopatógenos desempeñan un papel importante en el control biológico de áfidos puesto que tienen características morfológicas, biológicas y ecológicas que los hacen susceptibles a ser atacados por hongos patógenos, y son capaces de producir epizootias que reducen drásticamente sus poblaciones. Por otra lado, Shah y Pell (2003), mencionan que hongos como L. lecanii han sido reportados causando epizootias naturales en pulgones y escamas, en regiones tropicales y subtropicales.
Se reporta por primera vez el hallazgo de L. longisporum asociado a M. sacchari, el conocimiento preciso de hongos controlando a plagas de importancia fitosanitaria es primordial en la búsqueda de aislados prometedores para el desarrollo de insecticidas microbianos.
En ensayos posteriores, se evaluarán variables de virulencia de la cepa CHE-CNRCB 620, para determinar su potencial como agente de control biológico de M. sacchari.











 nova página do texto(beta)
nova página do texto(beta)



