Introducción
El ácido jasmónico (AJ), moléculas relacionadas y sus derivados, todos llamados jasmonatos, son fitohormonas de origen lipídico. Actúan como moléculas señal de las respuestas de las plantas a diversas situaciones de estrés como: heridas, ataque por patógenos y plagas (Ueda y Nishi, 2006; Howe y Browse, 2009), así como exposición a sequía y ozono, de igual forma participan en diversos procesos del crecimiento, desarrollo y defensa (Avanci et al., 2010; Wasternack, 2014). Este ácido es generado por la planta después del daño producido por un patógeno, el cual puede ser ocasionado por un microorganismo o insecto y da como resultado un incremento de la producción de compuestos de resistencia, como el ácido salicílico y etileno, entre otros (Pauwels y Goossens, 2011; Chávez et al., 2012; Xiaoyi et al., 2014). Se ha demostrado que la aplicación exógena de los jasmonatos a las plantas, inhibe o promueve cambios morfológicos y fisiológicos como la inducción de la síntesis de proteínas, sustancias de defensa y la estimulación de la formación de tubérculos, entre otras actividades (Pieterse et al., 2009; Rohwer y Erwin, 2010).
Las vías de obtención comercial del AJ son a partir de la extracción de plantas y síntesis química. Sin embargo, el desarrollo de ácido jasmónico por síntesis química es de alto costo. De igual forma en el caso de la extracción a partir de plantas donde el AJ se encuentra en concentraciones traza y donde se requiere de eficientes métodos de extracción y purificación, elevando el precio del producto (Pinakin et al., 2007). Una de las alternativas para su producción es el uso de microorganismos por medios de sistemas de fermentación, entre los cuales destacan los hongos, tal es el caso del hongo fitopatógeno de zonas tropicales Botryodiplodia theobromae (Aldridge et al., 1971). Los estudios realizados en cultivo líquido revelaron que es capaz de producir este tipo de producto como resultado de su metabolismo secundario con rendimientos satisfactorios (Miersch et al., 1987; Michelena et al., 2001; Wasternack et al., 2007; Pinakin et al., 2007; Andolfi et al., 2014; Castillo et al., 2014). La producción de metabolitos por vía microbiana, es una de las alternativas compatible con los principios de la agricultura sostenible, debido a su menor impacto en el medio ambiente, ya que son menos agresivos en comparación con los plaguicidas y fertilizantes minerales convencionales, ampliamente aplicados, de igual forma este tipo de productos han presentado una gran versatilidad en la agricultura, obteniendo resultados similares a los productos químicos, un ejemplo de esto sería la activación de los mecanismos de resistencia contra patógenos como bacterias y hongos (Yuan et al., 2007; Jaiti et al., 2009). Este trabajo tiene la finalidad de presentar una evaluación comparativa en relación a la productividad entre los sistemas de fermentación en cultivo líquido y sólido, utilizando el hongo fitopatógeno Botryodiplodia theobromae.
Materiales y métodos
Microorganismo
El hongo Botryodiplodia theobromae fue obtenido de una colección de cultivos micológicos del Laboratorio de Nanobiociencia de la Facultad de Ciencias Químicas de la Universidad Autónoma de Coahuila. Este hongo fue aislado a partir de tejido vegetal de cacao procedente de la zona sureste de México. Se utilizó el medio agar papa dextrosa (PDA) para su aislamiento, desarrollo y conservación (Torres et al., 2008). El hongo fue conservado en tubos con medio inclinado a 4°C.
Procesos de fermentación
a) Fermentación en cultivo líquido
Para la evaluación de producción por fermentación en cultivo líquido (FCL) se siguió la metodología propuesta por Michelena (2001), la cual se describe a continuación. Se usaron matraces Erlenmeyer de 250 mL con 50 mL del medio Miersh modificado, se esterilizaron en autoclave a 15 lb de presión durante 15 minutos. Para la inoculación del medio se usaron tres fragmentos de 5 mm de diámetro del micelio pre cultivado (obtenidos a partir de siembras realizadas en placas Petri) sobre PDA a 28oC durante tres días. Posterior a la inoculación los matraces se incubaron en oscuridad por 15 días a una temperatura constante de 28oC, sin agitación y sin aireación (Eng et al., 1998). Para evaluar este proceso se siguió un estudio cinético respecto al tiempo, analizando un matraz cada 48 horas.
Medio de cultivo. La composición del medio Miersh modificado fue la siguiente: sacarosa 50 g/L, KNO3 3 g/L; MgSO4. 7H20 0.2 g/L; KCl 0.1 g/L; FeSO4. 7H2O 0.01 g/L; ZnSO4. 7H2O 0.01 g/L; MnSO4 0.001 g/L; Na2MoO4. 2H2O 0.001 g/L; CuSO4. 5H2O 0.001 g/L y extracto de levadura 0.1 g/L (Eng et al, 2008).
Procedimientos analíticos. Al término de la fermentación se procedió a realizar una filtración rápida, el sobrenadante se recuperó para análisis posteriores como: consumo de sustrato, pH y la cuantificación de AJ.
Biomasa. La biomasa se determinó por diferencia de peso seco. Se colocó en un embudo de filtración rápida, un papel filtro Whatman No. 4 previamente pesado, se filtró la muestra y se colocó en una estufa de desecación a 60°C durante 24 horas (Arnáiz et al., 2000).
Determinación de pH. La evaluación se realizó mediante el uso de un potenciómetro digital Hanna instruments HI10, analizando el sobrenadante procedente del caldo microbiano cada 48 horas (Willard et al., 1974).
Consumo de sustrato. Para la evaluación de este parámetro, se determinaron azúcares totales, para ello se empleó el método de fenol - sulfúrico descrito por Dubois et al. (1956).
Cuantificación de ácido jasmónico por cromatografía de gases. Recuperación del ácido jasmónico: Las muestras analizadas procedentes de biopreparados libres de células fueron obtenidas por fermentación en cultivo líquido. Después de los 15 días de fermentación, la fase líquida de la fermentación se separó del micelio por filtración al vacío, utilizando papel de filtro Whatman N° 4. Posteriormente, alícuotas de 5 mL del cultivo filtrado se ajustaron a pH 3.0 con HCl (4M) y se sometieron a tres extracciones con acetato de etilo (1:1) en un embudo de separación. Las fracciones conteniendo el AJ se deshidrataron con sulfato de sodio anhidro y se llevaron a sequedad por rotoevaporación a 50°C (Dathe et al., 1981). Las fracciones obtenidas se resuspendieron en 1 mL de acetato de etilo en un recipiente ámbar, y se mantuvo en refrigeración a 4°C hasta su detección o cuantificación. En base a la respuesta del detector se realizó la dilución de la muestra, como patrón fue empleado ácido jasmónico (Sigma, J2500).
Cuantificación de AJ. Para determinar la cuantificación se empleó la técnica de CG descrita por Lorenzo (2007). En este caso se utilizó un cromatógrafo de gases Agilent Technologies 7820A con un detector FID (detector de ionización de flama). Como gas portador se empleó Helio con una velocidad de flujo de 1 mL/min. Las temperaturas de inyector y detector fueron de 280°C, todo con un tiempo total de corrida de 20 min.
b) Fermentación en cultivo sólido
La metodología utilizada en el proceso de fermentación en cultivo sólido (FCS) se realizó según lo citado por Raimbault (1988), la cual se describe a continuación. Se utilizó como soporte inerte bagazo de caña. La metodología que se siguió para el tamizado y lavado del bagazo fue la siguiente: 2 kg del material húmedo se secó a temperatura ambiente y se tamizó con malla #4 (tamaño de partícula de 4.75 mm), posteriormente se realizó otro tamizado con mallas de 30 a 20 (tamaño de partícula 0.850 mm a 0.600 mm) con el objetivo de eliminar las partículas menores de 0.84mm y mayores 0.59 mm. Una vez tamizado el bagazo, se le adicionaron 40 L de agua a 45oC y se dejó en reposo por dos horas, agitando periódicamente. Posteriormente, se decantó y se añadió nuevamente 20 L de agua a 75°C, dejando en reposo por 30 min con agitación periódica, repitiendo esta operación cuatro veces. Finalmente, el material se lavó con 20 L de agua destilada a temperatura ambiente procediendo de forma similar a los anteriores lavados. El bagazo resultante se prensó y secó en estufa a 55°C por tres días. Finalmente al material se le determinó la humedad final y se almacenó en bolsas de polipapel a temperatura ambiente; la humedad final fue de 4.89%.
El medio de cultivo utilizado fue el medio Mierch modificado (Eng et al., 2008). El medio y el bagazo fueron esterilizados por separados, al término de la esterilización se mezclaron uniformemente con los fragmentos del inóculo. El inóculo de B. theobromae se obtuvo a partir de cultivos en placa con agar papa dextrosa, se tomaron fragmentos miceliales de 1 cm3. Finalmente se vaciaron en matraces Erlenmeyer de 125 mL estériles los cuales se dejaron incubar por un periodo de 15 días a 28°C (Raimbault,1988).
Recuperación de las muestras. El medio fermentado contenido en los matraces se mezcló de forma homogénea en un recipiente adecuado y se dividió en 3 porciones. La primera de un 1 g de muestra aproximadamente, se destinó para realizar la determinación de humedad por peso seco, a la segunda de 1 g también se le adicionó 10 ml agua destilada para las determinaciones del pH, glucosa, y la última de ellas de 10 gramos se destinó para realizar la extracción del AJ, la cual se realizó empleando una solución de etanol al 85 % , se ajustó el pH a 2.0 con HCl (1 N) y posteriormente se prensó a 2000 PSI; el material sólido se desechó y el sobrenadante se centrifugó a 4000 rpm durante 40 minutos (Eng, 1996).
Procedimientos analíticos. Pérdida de humedad: La diferencia entre el peso inicial y final, dividido entre el peso inicial representa el YO (cantidad de biomasa) de materia seca, y la diferencia entre el 100% y el porcentaje de materia seca se reportó como 1% de humedad de la muestra (Fernández et al., 2006).
Determinación de pH. se midió el pH en un potenciómetro eléctrico (Bates, 1983).
El consumo de sustrato, detección y cuantificación de ácido jasmónico se realizó de la forma en que se describió previamente.
Resultados
Fermentación en cultivo líquido
Un perfil típico de desarrollo microbiano puede observarse en la producción de AJ usando Botryodiplodia theobromae en condiciones estáticas (Figura 1).
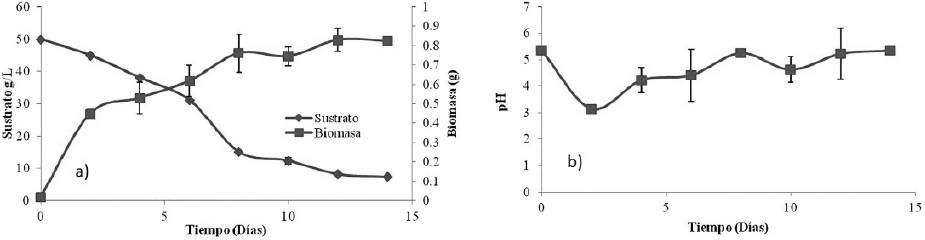
Figura 1: a. Curvas cinéticas de la formación de biomasa y del consumo de sustrato durante el proceso de fermentación en cultivo líquido empleando Botryodiplodia theobromae. b. Cambio del pH por B. theobromae en medio líquido.
Para el caso de la fermentación en cultivo líquido el consumo de sustrato se ve mayormente marcado durante los primeros cinco días, observándose un consumo del 60% de los carbohidratos iniciales. Un consumo similar en los carbohidratos se presentó en el trabajo desarrollado por Pinakin (2007), en el que se realizó una fermentación líquida en fase estacionaria, obteniendo como resultado que el mayor consumo de azucares se presentó entre el segundo y tercer día del bioproceso.
Respecto a la formación de biomasa se presentó un aumento celular a partir del segundo día y continuó así hasta el sexto día, posteriormente los niveles de producción celular se estabilizaron en un valor constante hasta el final de la fermentación. Este tipo de proceso con una descripción similar del comportamiento observado en el presente estudio ha sido descrito por otros autores (Madigan et al., 2004). En los cambios de pH durante la fermentación se pudo observar que a partir del segundo día se presentó una disminución marcada, que posteriormente fue en aumento hasta mantenerse en un valor de 5.3. Se sabe que el pH representa un parámetro que está relacionado con los procesos metabólicos de los microorganismos (Michelena et al., 2001). El cambio en el pH fue probablemente la consecuencia de la acumulación de los metabolitos resultantes del proceso de fermentación como el AJ y algunas otras moléculas bioactivas no identificadas, o simplemente fue una consecuencia de la degradación de la fuente de carbono que deriva en otros ácidos orgánicos como ácido láctico, pirúvico o acético (Marero et al., 1997), ya que se ha demostrado que la glucosa y otros metabolitos derivados de las fuentes de azúcar interfieren en la síntesis de muchos metabolitos secundarios (Espeso et al., 1993). El pH del medio de cultivo es uno de los factores determinantes para el metabolismo y por lo tanto, para la biosíntesis de metabolitos secundarios (Chang et al., 1991).
En los resultados obtenidos de la fermentación en cultivo sólido, se logra apreciar que durante los primeros seis días se marca una tendencia negativa en la concentración de azúcares en el medio, sin embargo, a partir del octavo día se muestra un aumento en la concentración de estos mismos, este incremento se puede atribuir a que debido al uso de un soporte como es el bagazo de caña los mecanismos enzimáticos del microorganismo se activen y realicen una hidrólisis de los carbohidratos pertenecientes al soporte, como la celulosa como fuente importante de azucares (Figura 2). Eng (1996), menciona que en la FCS la concentración de nutrientes en el medio se puede incrementar respecto a los utilizados en la fermentación líquida, sin que se produzca una inhibición por acumulación de metabolitos o la interacción entre diversos complejos enzimáticos, esto es debido a los nutrientes propios del soporte así como a la adición de algunos otros compuestos como minerales específicos (Almeida et al., 1999) derivados del medio empleado (Eng et al., 2008) esenciales para la actividad metabólica del microorganismo. Se ha demostrado que tanto el Fe, Mg y Mn influyen en la biosíntesis de ácido jasmónico (Dhandhukia y Thakkar, 2007).

Figura 2: a. Curvas cinéticas de los cambios de humedad y del consumo de sustrato durante el proceso de fermentación en cultivo sólido empleando Botryodiplodia theobromae. b. Cinética del comportamiento del pH por B. theobromae en cultivo sólido.
En el caso de la humedad, el cual no es un proceso estático durante el proceso de la fermentación, los resultados demostraron que en los primeros dos días se observó un alto porcentaje de pérdida alrededor del 30%, a diferencia del cuarto y sexto día que se presentó una estabilidad, sin embargo posteriormente al día seis hay una marcada disminución que continua hasta un valor final del 20%. Estos resultados se atribuyen a cambios en la actividad metabólica constante del microorganismo sobre todo relacionados con el calor metabólico generado durante el crecimiento del microorganismo, que es uno de los parámetros importantes a controlar en la FCS. Oriol et al., (1988), describen que en las fermentaciones en estado sólido la humedad del medio puede variar entre 30 y 80% en dependencia del sólido utilizado, del microorganismo y el objetivo del proceso. Un factor importante es que la actividad del agua no sólo afecta el crecimiento del microorganismo en el sistema que se desarrolle, sino también afecta a los productos de interés obtenidos a partir del metabolismo de dicho microorganismo. Se puede apreciar que en tiempos posteriores a los 12 días de fermentación el porcentaje de humedad disminuye notablemente pudiendo introducir en una etapa de estrés metabólico al microorganismo. Las condiciones medioambientales como la temperatura, humedad, pH, radiaciones ultra violeta (UV), nutrientes y salinidad, establecen efectos críticos sobre la composición celular fúngica y metabolismo bioquímico, algunos relacionados con cambios en el proceso metabólico de carbohidratos y lípidos que han sido bien identificados (Buensanteail et al., 2012).
En la cinética del pH obtenida durante los 15 días del bioproceso se destaca el marcado aumento de pH en los primeros días de fermentación el cual llega hasta obtener un valor de 9 para posteriormente disminuir hasta 7.8. Estos cambios se atribuyen a la acumulación de algunos metabolitos y de AJ en el medio. Eng (1996), menciona que el pH es una de las principales variables que afectan el desarrollo de los procesos de fermentación en estado sólido, así como afecta a otro tipo de procesos biotecnológicos. En la fermentación en estado sólido, el control de esta variable es algo complicado; la complejidad es debida a la ausencia de instrumentos capaces de medir el pH en la capa de líquido que rodea el sólido y por la necesidad de instrumentos de respuesta rápida, sin embargo es un parámetro de control importante del proceso el cual se controla con la medición multipuntual de parámetro de interés como es el caso del pH y la temperatura.
Producción de ácido jasmónico por FCL y FCS
Respecto a la producción de ácido jasmónico durante la fermentación en cultivo liquído, se apreció que este metabolito comenzó a producirse a partir del séptimo día, durante el inicio de la fase estacionaria respecto al crecimiento microbiano, corroborando de esta forma que es un metabolito secundario (Aldridge et al., 1971). La producción de AJ continúa en aumento hasta obtener un valor de 701 mg/L en el día 14, siendo este mismo su nivel máximo de producción obtenido en esta cinética (Figura 3). Los resultados obtenidos concuerdan con lo citado por Eng (1996), quien evaluó la producción de AJ de diversas cepas, mismas que generaron un incremento de producción a partir del décimo día, estas reportaron valores que oscilan desde los 80mg/L hasta los 915 mg/L. Pinakin (2007) reportó que la producción de AJ se ve incrementada en un proceso fermentativo en estado líquido ausente de agitación, esto debido a la formación de partículas aglomeradas, a diferencia del proceso en estado estático el cual forma crecimiento micelial sobre la superficie del medio de cultivo, lo que indica que es un hongo aerobio, característica morfológica que se ha establecido como uno de los parámetros clave de bioprocesos (Znidarsic y Pavko, 2001).

Figura 3: Cinética de producción de ácido jasmónico durante el proceso de fermentación en medio líquido empleando Botryodiplodia theobromae en el medio Miersh modificado.
La cinética de producción de ácido jasmónico durante la fermentación en cultivo sólido demostró que la producción de este metabolito comenzó a partir del sexto día, toda la producción se desarrolló durante la fase estacionaria respecto al crecimiento microbiano (Figura 4). A diferencia de la fermentación en cultivo líquido la producción máxima de AJ se presenta al décimo día y no al catorceavo, el resultado de concentración máxima en este caso fue de 23 mg/g de materia seca, para posteriormente caer a un valor de 10 mg/g. Debido a que el metabolito pudo ser degradado por las condiciones ambientales en las que se encuentra como los cambios de pH del medio. Eng (1996) evaluó la producción de AJ en condiciones similares, con la diferencia de que, en su trabajo la etapa de producción se desarrolló en columnas de fermentación. En dicho trabajo se obtuvo niveles máximos de concentración del orden de los 24 mg/g de materia seca, similares a los resultantes en este trabajo.
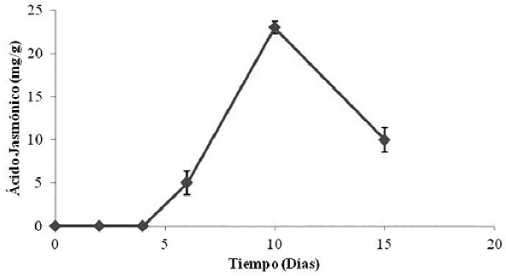
Figura 4: Cinética de producción de ácido jasmónico durante el proceso de fermentación en medio sólido.
Se puede apreciar que la producción de AJ en este proceso fermentativo se desarrolló con mayor velocidad que en la fermentación en cultivo líquido. Robinson et al., (2002), mencionan que la morfología del micelio asociada con los microorganismos predominantemente usados para la producción de metabolitos secundarios, es muy adecuada para el crecimiento sobre soporte sólido, ya que puede haber también un efecto dañino sobre la formación de productos en medios líquidos, ya que existen medios líquidos altamente viscosos que son requeridos para la producción exitosa de metabolitos y esto puede interferir la transferencia de oxígeno. La morfología de esos microorganismos y además la secreción de esos metabolitos sobre el medio de crecimiento pueden incrementar la viscosidad. Por lo tanto la tecnología de FCS puede ser explotada como una alternativa de producción, sin embargo se requiere una mejora al sistema que permita una mejor circulación de oxígeno (Elboil y Mavituna, 1997).
Comparación entre los procesos de fermentación en cultivo líquido y en sólido
Los resultados obtenidos en la evaluación de ambos sistemas de fermentación fueron comparados y evaluados, únicamente se tomaron los puntos de concentración máxima en ambos casos. Se pudo apreciar que en relación de tiempo, la FCS presentó cierta ventaja respecto a FCL ya que se redujo el tiempo de producción máximos casi en un 30%. La FCS alcanzó el nivel máximo de producción a las 240 horas mientras que la FCL requirió por lo menos de 312 horas.
La producción máxima de AJ en la FCL presentó un valor de 701 mg/L mientras que para la FCS se obtuvo un valor de 23 mg/g de materia seca. Estos valores son difíciles de comparar debido a que ambos procesos cuentan con características específicas muy diferentes, sin embargo, se podría realizar una comparación volumétrica para demostrar que la FCS presenta una ventaja debido a que obtiene valores de hasta 2705.88 mg/L de producción (Tabla 1).
Tabla 1: Capacidad de producción de AJ obtenidos a partir de la FCL y FCS, en relación con el tiempo de evaluación
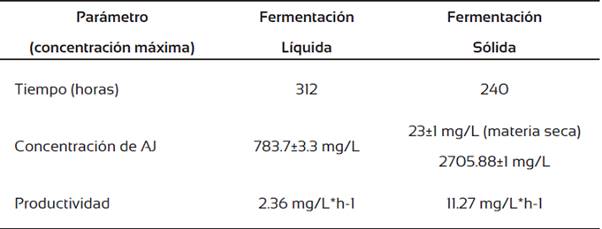
En comparación con la FCL esta productividad es superior casi en tres veces. Si se realiza un escalamiento en cada uno de ellos se podría decir que la FCS presentaría una producción mucho mayor respecto a la resultante de la FCL, sin embargo son muchos factores los que alteran el metabolismo microbiano, aunado a las dificultades de manipulación y evaluación en la FCS, por tales motivos se dificulta determinar cuál de estos sería el sistema primordial de producción.
Industrialmente, los metabolitos secundarios son principalmente producidos bajo condiciones sumergidas porque los procesos asociados con el escalamiento son más simplificados, comparados con aquellos requeridos para el escalamiento en FCS (Robinson et al., 2002). Una de las ventajas de la FCL sobre la FCS es la necesidad de menos mano de obra para operar el fermentador y manejo del producto (Plascencia, 2009), además la fermentación en estado líquido permite un mejor control de los parámetros tales como pH, calentamiento, condiciones nutricionales, etc. Sin embargo, la producción de metabolitos secundarios con el uso de FCS no debe ser menospreciada ya que también presenta ventajas sobre la FCL una de ellas es que debido a la ausencia de agua libre, se emplean fermentadores pequeños y por lo tanto se requiere menos esfuerzo para los procesos de separación (Barrios et al., 1995).
Conclusiones
Mediante este análisis se corroboró que con el uso del hongo fitopatógeno Botrydiplodia theobromae, como inóculo para un bioproceso de fermentación en cultivo líquido y sólido, se logró obtener una producción de ácido jasmónico con niveles satisfactorios en comparación con los presentados en la literatura. La comparación volumétrica entre los sistemas de fermentación en cultivo líquido y en sólido demostró que el nivel de producción y productividad de FCS, fue tres veces superior a los presentados por la fermentación en cultivo líquido, de igual forma la FCS logró alcanzar los niveles superiores de producción en menor tiempo que el obtenido por la fermentación en cultivo líquido. De esta forma se demostró que en temas de producción a escala laboratorio el sistema de fermentación en cultivo sólido utilizando el hongo fitopatógeno Botrydiplodia theobromae se presenta como la mejor opción.











 nova página do texto(beta)
nova página do texto(beta)


