Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de micología
versão impressa ISSN 0187-3180
Rev. Mex. Mic vol.35 Xalapa Jun. 2012
Contribuciones
Identificación del agente causal de la pudrición basal del tallo de vainilla en cultivos bajo cobertizos en Colombia
Identification of the causal agent of vanilla basal stem rot in crops under greenhouse shed conditions from Colombia
Carolina Santa Cardona1 Mauricio Marín Montoya1 María Claudia Díez2
1 Laboratorio de Biología Celular y Molecular, Facultad de Ciencias, Universidad Nacional de Colombia Sede Medellín, Calle 59A No 63 -20, Medellín, Colombia.
2 Departamento de Ciencias Forestales, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia Sede Medellín, Calle 59A No 63 - 20, Medellín Colombia
*Autor para correspondencia:
Mauricio Marín Montoya mamarinm@unal.edu.co
Recibido 24 de febrero 2012;
Aceptado 2 de mayo 2012.
Abstract
Due to its high added value, vanilla (Vanilla planifolia) is a promising crop for the colombian agroindustry. Unfortunately, there is very little knowledge on the agronomical and phytosanitary management of this plant. One of the main issues concerning this crop is the basal stem rot. The objective of this work was to determine the causal agent of this disease in vanilla plantations under greenhouse shed conditions in western Antioquia. A total of 20 fungal isolates were obtained from infected stems and five of them were used in pathogenicity tests. Our results suggest that Fusarium oxysporum f. sp. vanillae is the causal agent of basal stem rot in Colombia. Phoma sp., Lasiodiplodia sp. and Bionectria sp. were also identified as associated to vanilla crops; future work should address their involvement in disease. This work will serve as the basis of plant disease management programs aimed at increasing the cultivated area of this orchid in Colombia.
Key words: Vanilla planifolia, Fusarium oxysporum, molecular identification, morphological identification, sequencing.
Resumen
El cultivo de vainilla (Vanilla planifolia) es una actividad agroindustrial promisoria, de alto valor agregado para el sector rural colombiano. Sin embargo, el nivel de conocimiento que se tiene sobre su manejo agronómico y en especial fitosanitario es muy incipiente. Uno de los problemas que afecta los planes de expansión de este cultivo, es la pudrición basal del tallo. Por tal razón se planteó la presente investigación con el objetivo de determinar el agente causal de esta enfermedad en plantaciones de vainilla bajo cobertizos de techo sombra en el occidente de Antioquia. A partir de tejido de tallo infectado se obtuvieron 20 aislamientos, cinco de los cuales fueron seleccionados para realizar pruebas de patogenicidad. Los resultados indicaron que el agente causal de la pudrición basal de las plantas de vainilla en Colombia corresponde al hongo Fusarium oxysporum f. sp. vanillae. Adicionalmente, se identificaron los hongos Phoma sp., Lasiodiplodia sp. y Bionectria sp., siendo necesario en el futuro determinar si están asociados a alguna patología de este cultivo. Se espera que los resultados de este estudio sirvan de base para el establecimiento de un programa de manejo integrado de enfermedades que conduzca al aumento del área de siembra de esta orquídea en Colombia.
Palabras clave: Vanilla planifolia, Fusarium oxysporum, identificación molecular, identificación morfológica, secuenciación.
Introducción
El género Vanilla pertenece a la familia Orchidaceae, la cual consta de más de 110 especies (Bory et al., 2008), destacándose por su importancia económica Vanilla planifolia Andrews, V. tahitensis J.W. Moore y V. pompona Schiede, las cuales se cultivan comercialmente para la producción de extractos de vainilla natural, el saborizante más utilizado en la industria alimenticia y la segunda especia de mayor costo en el mercado mundial después del azafrán (Havkin-Frenkel y Dorn, 1997). Este cultivo es afectado por diferentes enfermedades, incluyendo pudriciones basales, marchitamientos vasculares, necrosis y tizones foliares, antracnosis, manchas de frutos y diversas virosis. Estudios realizados en varios países asiáticos y africanos, han determinado la presencia de una gran variedad de hongos y oomycetes asociados a dichas sintomatologías, entre los que se destacan: Phytophthora meadii, Fusarium oxysporum, Calospora vanillae, Sclerotium sp., Colletotrichum gloeosporioides, Colletotrichum vanilla y Cylindrocladium quinquiseptatum, entre otros (Thomas y Sussela, 2001; Bhai y Dhanesh, 2008; Pinaria et al., 2010). Adicionalmente, se han reportado diferentes enfermedades virales causadas por Cucumovirus y Potyvirus, que causan afecciones severas en el tejido foliar y en las vainas, causando una reducción significativa en el rendimiento de los cultivos de vainilla (Richard et al., 2009).
En Colombia, se tienen registros de la presencia de poblaciones nativas de V. planifolia en los bosques de la región del Pacífico, Urabá, la costa Atlántica, los valles interandinos y la cuenca Amazónica (Ordoñez et al., 2011), así como de cultivos comerciales en algunos municipios de la región de Urabá y el occidente antioqueño, en sistemas agroforestales y cobertizos de techo-sombra. Sin embargo, el nivel de conocimiento que se tiene en el país sobre las diferentes variables agronómicas de este cultivo, es muy incipiente. Uno de los aspectos menos estudiados son los fitosanitarios, desconociéndose los agentes causales responsables de las diferentes enfermedades que afectan este cultivo. Ya que uno de los problemas más limitantes de la producción comercial de vainilla bajo condiciones de cobertizos de techo-sombra en Colombia es la pudrición basal del tallo, en esta investigación se determinó el agente causal de esta enfermedad en plantaciones del occidente del departamento de Antioquia, a partir de la identificación molecular de aislamientos de hongos asociados a los síntomas de la enfermedad y del seguimiento de los postulados de Koch.
Materiales y métodos
Obtención de muestras
Se seleccionaron porciones de tallo de 25 plantas con síntomas de pudrición basal en plántulas de seis meses y plantas en plena producción, establecidas en cultivos de vainilla bajo cobertizos de techo-sombra en el municipio de Sopetrán (Antioquia) (coordenadas 6°29'52.94" N y 75°43'42.71" O, altitud 1052 msnm, temperatura promedio 26.8°C y precipitación promedio 1243 mm/año). Las muestras se desinfestaron con una solución de hipoclorito de sodio al 1% durante 1 min, posteriormente se enjuagaron con agua destilada estéril y con un bisturí se extrajeron fragmentos de aproximadamente 0.5 cm2 de la zona de avance de la enfermedad. Cuatro de estos fragmentos se colocaron en cajas de Petri con medio de cultivo papa dextrosa agar (PDA). Las cajas se incubaron a temperatura ambiente y en condiciones de oscuridad durante 8-15 días.
Extracción de DNA
Cada aislamiento purificado se colocó en matraces conteniendo 20 mL de medio líquido extracto de malta al 2% (ME), y se mantuvieron bajo las condiciones descritas previamente durante 16-20 días. El micelio obtenido después de este tiempo se utilizó para realizar las extracciones de DNA por los métodos: CTAB 3X y kit DNeasy Plant mini (Qiagen, EUA). En el primer caso se utilizaron 200 mg de micelio macerado con nitrógeno líquido, colocados en tubos eppendorf de 1,5 mL y se le adicionaron 400 μL de buffer CTAB 3X de acuerdo al protocolo descrito por Doyle y Doyle (1990). Para el caso de la extracción de DNA con kit DNeasy Plant mini, se utilizaron 100 mg de micelio macerado, y se prosiguió con las instrucciones del fabricante. La integridad del DNA se determinó por electroforesis en gel de agarosa al 1% suplementado con bromuro de etidio (10 mg/mL). Los geles se fotodocumentaron con el sistema digital Bio Doc Analyze (Biometra, Alemania). La concentración y pureza del DNA se determinó por lecturas a 260 nm y 280 nm en un Nanodrop 2000C (Thermo, EUA).
Identificación molecular de hongos
Para la identificación filogenética de los hongos a nivel de especie se realizó la amplificación y secuenciación de las regiones del Espaciador Transcrito Interno (ITS) del rDNA con los iniciadores universales ITS1 (5' TCC GTA GGT GAA CCT GCG G 3') e ITS4 (5' TCC TCC GCT TAT TGA TAT GC 3') (White et al., 1990). Adicionalmente, en ocho de los aislamientos se secuenció un segmento del extremo 5' de la subunidad grande (28S) del rDNA, que contiene los dominios D1 y D2, utilizados en estudios filogenéticos de hongos (Zuluaga et al., 2011). Para la amplificación de esta región se utilizaron los iniciadores LROR (5' ACC CGC TGA ACT TAA GC 3') y LR6 (5' CGC CAG TTC TGC TTA CC 3') (Hopple y Vilgalys 1999). Las reacciones de PCR se prepararon en un volumen final de 25 μL, agregándole 14.6 μL H2Odd, 1X Buffer PCR, 0.2 mM dNTPs, 2 mM MgCl2 , 0.4 2 2 μM de cada iniciador, 2 U de Taq polimerasa (Fermentas, Lituania), 0.2 μL de BSA (10mg/μL) y 25 ng/μL de DNA. El progr ama de ampl i f i c a c ión cons i s t ió de una desnaturalización inicial a 95°C durante 3 min, seguida de 40 ciclos a 94°C por 30 s, 58°C por 50 s, 72°C por 1 min, y una extensión final a 72°C por 5 min. Los amplicones obtenidos fueron visualizados en electroforesis de agarosa al 1.5%, tal como se describió anteriormente y el tamaño de los fragmentos (500 a 600 pb para ITS y 1100 pb para 28S), fue verificado por comparación con el marcador de peso molecular Generuler 100 pares de bases (bp) Plus (Fermentas, Lituania). Las bandas del tamaño esperado se purificaron directamente del gel mediante los kits QIAquick PCR Purification y QIAquick Gel Extraction (Qiagen, USA). Se realizó una secuenciación directa de los productos de PCR en ambas direcciones mediante la metodología de Big Dye Terminator Cycle (Applied Biosystems, EUA), en un secuenciador ABI Prism 3730XL (PE Applied Biosystems).
Las secuencias obtenidas con cada iniciador, se editaron y ensamblaron con el software Chromas Lite. Las secuencias consenso se compararon con la base de datos de GenBank, mediante el programa BLAS TN (http://www.ncbi.nlm.nih.gov/BLAST).
Posteriormente, con secuencias representativas de los géneros y especies pre-identificadas en el análisis BLAST, se procedió a realizar un alineamiento con el algoritmo Clustal W incluido en el software Bioedit 6.0.6. (Hall, 1999). La matriz obtenida fue utilizada para realizar un análisis filogenético basado en el método de máxima parsimonia (MP) con búsqueda heurística y TBR (tree-bisectionreconnection), mediante el software PAUP 4.0b10 (Swofford, 1998). El soporte de la topología interna del árbol filogenético se realizó mediante análisis de bootstrap con 1000 iteraciones (Felsenstein, 1985). Los números de accesión de las secuencias de este trabajo corresponden al rango JQ975396 a JQ975407.
Identificación morfológica
De cada uno de los subclados obtenidos en el árbol filogenético, se seleccionó un aislamiento para la observación y descripción de sus estructuras en un microscopio óptico Zeiss modelo Axioplan (Göttingen, Alemania) acoplado a un sistema fotográfico digital. Para la caracterización de las colonias, se colocó un disco de 4 mm de diámetro con micelio del hongo en el centro de las cajas de Petri con los medios PDA, ME y Agar-V8. Para inducir esporulación, cada repetición se mantuvo bajo diferentes condiciones de fotoperíodo: luz constante, oscuridad constante y 12 h luz / 12 h oscuridad. Transcurridos 15 y 30 días de incubación, se evaluó la coloración, diámetro y presencia de estructuras reproductivas de los hongos en cada uno de los medios. Como base de comparación para el análisis microscópico de los hongos, se usaron las herramientas de búsqueda del Mycobank (http://www.mycobank.org/).
Pruebas de patogenicidad
Las evaluaciones microscópicas, coloniales y los resultados de los análisis filogenéticos, permitieron seleccionar cinco aislamientos (MA124_1, MA127_5, MA128_10, MA13618, MA140 22) como asociados a la pudrición basal de plantas de vainilla, dada su identificación como posibles microrganismos fitopatógenos. Los hongos seleccionados para esta prueba se transfirieron a medio ME y se mantuvieron a temperatura ambiente, bajo condiciones de oscuridad durante 15 días. Para realizar las pruebas de patogenicidad bajo condiciones de cobertizos de techo-sombra, se utilizaron plantas de vainilla de seis meses de edad.
Cada uno de los aislamientos seleccionados se inoculó sobre 10 plantas, utilizando el sistema de herida en el cambium vascular de la parte basal del tallo. Se realizaron cortes tipo bolsillo, ubicándose en su interior un disco de 4 mm de ME con micelio del hongo. Posteriormente, se colocó un algodón humedecido con agua destilada estéril rodeando la herida y se cubrió con cintas plásticas (papel vinipel). La evaluación de los síntomas causados por los hongos se realizó a los 15 y 30 días después de la inoculación.
Adicionalmente, los dos aislamientos identificados como pertenecientes al género Fusarium (MA136_18, MA140_22), fueron inoculados con 1 mL de una solución de 1x106 c/mL inyectada en la base del tallo y también se adicionó sobre el suelo 5 mL de la misma suspensión de conidias, con el fin de alcanzar las raíces subterráneas de la planta. En este caso se evaluó el número de plantas con síntomas de pudrición basal. Como grupo control del experimento, se utilizaron 10 plantas a las cuales se les realizó el corte tipo bolsillo y la cobertura con algodón y vinilpel, pero no se colocó discos de agar con el inóculo fungico. Así mismo, cinco plantas fueron inoculadas por inyección y riego con 5 mL de agua destilada estéril, como controles para dicho sistema de evaluación. Transcurrido el período de 30 días, se procedió al re-aislamiento en los medios ME y PDA de los hongos presentes en los tejidos sintomáticos, realizándose nuevas observaciones microscópicas para completar los postulados de Koch.
Resultados
Sintomatología en plantas
En los cultivos de vainilla bajo cobertizos de techo-sombra del occidente de Antioquia, se evidenciaron dos tipos principales de síntomas en tallos asociados a enfermedades presumiblemente de orígen micótico. El primero de ellos correspondió a una pudrición inicialmente húmeda rodeada de un halo clorótico y descendente, que terminó con una necrosis seca y con el estrangulamiento de la base del tallo; mientras que el otro síntoma se caracterizó por la presencia de pequeños puntos necróticos que coalescieron constituyéndose en tizones de tallo con desarrollo longitudinal bidireccional y perimetral (Figura 1).
Identificación molecular de hongos Análisis filogenético de regiones ITS de rDNA. A partir de las 25 muestras de tejidos de tallo sintomáticas, se obtuvieron 20 aislamientos de hongos que representaban nueve morfotipos. La amplificación del DNA extraído en los 20 aislamientos, permitió la obtención de amplicones de 500 a 600 bp para las regiones ITS del DNAr (Figura 2). El análisis BLAST de las secuencias de los 20 aislamientos, permitió la identificación de hongos de los géneros: Lasiodiplodia (4 aislamientos), Fusarium (4 aislamientos), Phoma (3 aislamientos), Bionectria (2 aislamientos), Arthrinium (3 aislamientos) y Nigrospora (1 aislamiento), además de tres ascomycetes no determinados a nivel de género, uno de ellos posiblemente asociado a la familia Xylariaceae (Tabla 1).
El árbol filogenético se construyó con 15 secuencias obtenidas en el presente trabajo; 22 secuencias de hongos depositadas en el GenBank y seleccionadas por presentar altos niveles de identidad con los aquí obtenidos y el hongo roya Puccinia acroptili, utilizado como grupo externo de análisis (outgroups) y seleccionado por no estar filogenéticamente relacionados con ninguno de los hongos bajo estudio.
El alineamiento final de las secuencias fue de 532 sitios, de los cuales 141 caracteres eran constantes, 63 variables pero no informativos y 328 informativos. La longitud del árbol filogenético con máxima parsimonia fue de 1198 pasos, con índices de consistencia (IC) y retención (IR) de 0.66 y 0.88, respectivamente. En el árbol filogenético se presentaron ocho clados bien definidos, todos ellos con soportes de bootstrap de 100% (Figura 3). Estos clados permitieron identificar a nivel de especie a los hongos Lasiodiplodia gonubiensis (1 aislamiento), L. theobromae (2 aislamientos) y Fusarium oxysporum (2 aislamientos), mientras que el análisis filogenético con la región ITS, no ofreció una resolución suficiente para determinar las especies de los hongos identificados como miembros de los géneros Phoma (2 aislamientos), Arthrinium (3 aislamientos), Bionectria (2 aislamientos) y Nigrospora (1 aislamiento).

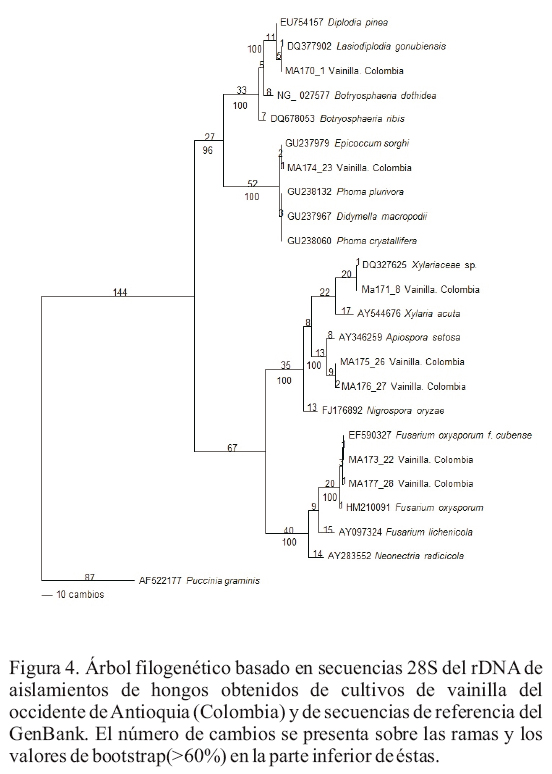
Análisis filogenético de 28S de rDNA. La amplificación de la región 5' del 28S del DNAr se realizó para ocho de los aislamientos previamente identificados mediante análisis de ITS, con el fin de reconfirmar la ubicación taxonómica, especialmente de los aislamientos identificados como F. oxysporum, dada la baja resolución que en algunos casos presenta la región ITS para los miembros de este género (Leslie y Summerell, 2006). Los amplicones obtenidos fueron de 1100 bp aproximadamente (Figura 4). El análisis filogenético permitió identificar a los hongos Lasidiplodia sp., F. oxysporum y Phoma sp., mientras que los dos aislamientos de Arthrinium se presentaron como un clado asociado con el Ascomycete sordarial Apiospora setosae. El alineamiento final para este análisis alcanzó 969 sitios, de los cuales 568 caracteres eran constantes, 150 variables pero no informativos y 251 informativos. La longitud del árbol filogenético con máxima parsimonia fue de 705 pasos, con índices de consistencia (IC) y retención (IR) de 0.78 y 0.90, respectivamente y su enraizamiento se efectúo con base en secuencias del hongo roya Puccinia graminis. Adicionalmente, el análisis de BLAST de las secuencias permitió confirmar la identidad de uno de los aislamientos como miembro del género Bionectria, aunque no fue incluido en el análisis filogenético debido a que la secuencia obtenida fue muy corta (522 bp).
Caracterización morfológica
Las observaciones microscópicas y coloniales permitieron confirmar las identificaciones moleculares realizadas para los hongos F. oxysporum, Arthrinium sp. y Bionectria sp. Sin embargo, los hongos identificados mediante secuenciación como miembros de Phoma, Lasiodiplodia y Nigrospora, además de los tres ascomycetes sin filiación genérica, solamente produjeron micelio en los medios de cultivo y condiciones de fotoperíodo evaluadas, no siendo posible su identificación morfológica. Para el caso de F. oxysporum, se presentaron colonias de rápido crecimiento, con micelio aéreo inicialmente blanco y con cambios en el tiempo a color púrpura. Microscópicamente, presentaban conidióforos cortos, simples, con monofiálides laterales y densamente ramificados. Macroconidias fusiformes del tipo alantoespora (23-54 x 3.0-4.5 μm), levemente curvadas, con tres a cinco septos y células basales pediceladas. Microconidias (5-12 x 2.3-3.5 μm) abundantes, no catenuladas y frecuentemente no septadas, elipsoidales a cilíndricas, rectas a curvadas. En cultivos de dos semanas, se observó la presencia de clamidosporas terminales o intercaladas (5-13 μm), con paredes lisas o débilmente rugosas (Figura 5).
Pruebas de patogenicidad
Transcurridos 30 días después de la inoculación con los cinco hongos seleccionados, se evidenció que solamente los hongos identificados como miembros de la especie F. oxysporum (MA13618 y MA140 22) indujeron desarrollo de lesiones necróticas en los tallos de las plantas evaluadas, mientras que aquellos identificados como Lasiodiplodia gonubiensis (MA124_1), Phoma sp. (MA127_5) y Bionectria sp. (MA128_10) no generaron ninguna lesión en los tallos. Estas lesiones necróticas inducidas por F. oxysporum variaron de 1.1 a 10 cm de longitud, presentaron un aspecto acuoso con halos cloróticos y desarrollo con tendencia descendente (Figura 5). El aislamiento MA136_18 causó la muerte de dos plantas, mientras que el MA140_22 provocó la muerte de 5 plantas por estrangulamiento de la base del tallo (Tabla 2). Adicionalmente, ambos aislamientos causaron síntomas de lesiones basales de plantas cuando se inocularon con la suspensión de conidias, siendo el aislamiento MA140_22 aparentemente el más agresivo, al inducir síntomas en 7 de las 10 plantas inoculadas, mientras que el MA136_18 afectó durante el mes de evaluación a 3 de las 10 plantas. Las plantas utilizadas como controles negativos, no presentaron ningún tipo de lesión y continuaron con su crecimiento normal después del mes de evaluación.
Con el fin de cumplir con los postulados de Koch, se procedió al re-aislamiento de los hongos a partir de las plantas que presentaron los tejidos sintomáticos inoculados con los dos aislamientos de F. oxysporum. En todos los casos se logró la obtención de colonias típicas de este hongo, con micelio aéreo de color púrpura después de 15 días de incubación y producción abundante de macroconidias, microconidias y clamidosporas con morfología y dimensiones similares a las inicialmente descritas para estos aislamientos (Figura 5).
Discusión
Vanilla planifolia es la única orquídea que produce una sustancia consumible, la especia vainilla y aunque esta planta es originaria de América Tropical su producción agroindustrial se ha concentrado en Madagascar y otras islas del océano Índico, y países del sudeste de Asia como Indonesia e India, entre otros (FAO, 2011). Las múltiples aplicaciones cosméticas, comestibles, industriales y terapéuticas de esta especia representan un mercado mundial de cerca de 500 millones de dólares al año y 6715 toneladas métricas/año de vainas de vainilla (Ploetz, 2006). En Colombia, como ya se mencionó se reportan poblaciones nativas de V. planifolia en varias regiones, así como otras trece especies del género Vanilla (Ordoñez et al., 2011). En los últimos años se han establecido algunos cultivos en varias zonas mediante programas gubernamentales como el desarrollado con campesinos de las zonas de Urabá y el Putumayo, así como cultivos establecidos por empresarios privados en varias regiones del departamento de Antioquia, con aproximadamente 100,000 plantas en producción, cifra que aunque resulta muy baja con respecto al mercado mundial, representa el inicio de una naciente agroindustria de saborantizantes naturales en Colombia (MADR, 2008). Entre los limitantes que afectan el desarrollo de esta agroindustria en el país, se encuentran los problemas relacionados con la nutrición, el beneficio de las vainas, los sistemas de polinización y la presencia de enfermedades como la mancha foliar y la pudrición basal de tallo y raíces. Esta última, es especialmente limitante, ya que causa la muerte prematura de las plantas, disminuyendo las densidades de siembra en las plantaciones y por ende la producción de vainilla por unidad de área. Dado que en Colombia no se conocía la naturaleza del agente causal de la pudrición basal de plantas de vainilla, en esta investigación se abordó dicha problemática a partir del aislamiento, la caracterización morfológica y molecular de hongos asociados a plantas con tejidos sintomáticos, y la conducción de pruebas de patogenicidad.
El desarrollo de este trabajo permitió la obtención de 20 aislamientos de hongos, y la identificación de F. oxysporum, especie ampliamente reportada en la literatura afectando el cultivo de vainilla (Bhai y Dhanesh, 2008; Suprapta y Khalimi, 2009; Pinaria et al., 2010), y de otros no registrados en dicha planta, pero sí ampliamente reconocidos como fitopatógenos, como Phoma sp., L. theobromae y L. gonubiensis. Adicionalmente, se detectaron hongos aparentemente saprofitos como Arthrinium sp., o cuyo nicho ecológico se desconoce en este cultivo como es el caso de Bionectria sp.
Tres de los hongos aislados, no pudieron ser identificados a nivel de género y especie, con las metodologías moleculares y morfológicas utilizadas, dada la ausencia de secuencias de referencia en el GenBank que compartieran altos niveles de identidad con éstos y a la carencia de estructuras reproductivas en las colonias. La identificación de dichos microorganismos merece ser retomada en un estudio que ofrezca continuidad al aquí presentado, ya que es posible que correspondan a fitopatógenos o incluso biocontroladores con potencial para su uso en este cultivo. Las pruebas de patogenicidad realizadas con cinco aislamientos, indicaron que dos de ellos inducían lesiones necróticas a nivel de la base de las plantas, luego de 30 días de inoculación. Estos hongos fueron identificados como pertenecientes a la especie F. oxysporum y por la agresividad de su ataque, se considera que hacen parte de la forma specialis vanillae (F. oxysporum f.sp. vanillae), previamente denominada en Puerto Rico como F. batatas var. vanillae (Ploetz, 2006). Los síntomas que se presentaron en las plantas inoculadas fueron semejantes a los inicialmente observados en el cultivo y que se constituyen en el principal problema fitosanitario de las plantaciones en estudio. Dichos
íntomas se caracterizan por la presencia de lesiones necróticas, acuosas y rodeadas de halos cloróticos en la parte basal de los tallos, que terminan con el estrangulamiento de la corona de las plantas, desprendiendo la parte aérea del suelo y por tanto causando marchitez y en muy poco tiempo la muerte de las plantas. Estos síntomas ya habían sido descritos como asociados a dicho patógeno en cultivos de vainilla de India (Ashoka, 2005; Bhai y Dhanesh, 2008), China (He, 2007), Puerto Rico (Ploetz, 2006) e Indonesia (Pinaria et al., 2010), entre otros. En este último país, se ha estimado que la enfermedad puede causar perdidas de hasta 80% en los cultivos (Pinaria et al., 2010).
Además de los síntomas descritos, se ha reportado que F. oxysporum f.sp. vanillae también puede causar muerte de brotes meristemáticos, pudrición de vainas y necrosis en hojas, lo que incrementa sus daños (Bhai y Dhanesh, 2008). Generalmente su ataque está relacionado con altos niveles de humedad en el suelo por exceso de lluvias, riego o deficiencias en el drenaje de los lotes, sombrío excesivo, altas densidades de cultivo y falta de prácticas sanitarias tanto a nivel de cultivos establecidos, como en los bancos de propagación (Bhai y Dhanesh, 2008). Algunas de dichas situaciones (ej. deficiencia en drenaje y manejo fitosanitario y presencia de altas densidades de siembra) son frecuentemente observadas en los cultivos bajo cobertizos de techo-sombra presentes en Colombia y merecen por tanto se reevaluadas para continuar con el plan de expansión del cultivo de vainilla en este país suramericano. Adicionalmente a la gravedad del problema, F. oxysporum produce gran cantidad de clamidosporas que le permiten sobrevivir en el suelo por largos períodos de tiempo, haciendo de la resiembra una medida impráctica y del control químico, una herramienta temporal a nivel de planta, pero no de suelo (Ploetz, 2006).
Por estas razones, el mejoramiento genético por resistencia a F. oxysporum f.sp. vanillae es imperativo para el manejo de la pudrición del tallo y raíces. Algunos ensayos exitosos se han realizado a partir de cruces entre V. planifolia y especies no comerciales como V. phaeantha. Sin embargo, la calidad de las vainas resultantes es deficiente, siendo necesario un esfuerzo multilateral de fitomejoramiento para lograr híbridos estables y altamente productivos, a partir de las poblaciones naturales de V. planifolia y de otras especies de Vanilla sp. como las presentes en Colombia y otros países tropicales.
La otra alternativa de manejo ha sido el control biológico, para lo cual se han utilizado cepas de Pseudomonas fluorescens como antagonistas (Tombe et al., 1997), formulaciones de extractos vegetales de Eugenia aromatica (Myrtaceae) y Piper betle (Piperaceae) (Suprapta y Khalimi, 2009) e incluso de plantas de clavos de olor (Syzygium aromaticum), que aparentemente inhiben el hongo a partir de compuestos como el eugenol (Tombe et al. 1997). El uso de especies de Fusarium no patogénicas ha sido reportado como una forma de atenuar los efectos de las especies y f.sp. más agresivas de estos hongos. Así por ejemplo, se ha reportado que la inoculación con cepas no patogénicas de F. oxysporum reduce el efecto de la marchitez por Fusarium en melón, tomate e incluso vainilla (Pinaria et al., 2010). Para nuestro caso en Colombia, la identificación de F. oxysporum f. sp. vanillae como agente causal de la pudrición basal de tallo y raíces en vainilla, es el punto de partida para realizar recomendaciones de manejo fitosanitario en este cultivo, que incluyan algunas de las antes descritas y otras ajustadas a las particularidades de nuestros sistemas productivos, como son la propagación vegetativa por esquejes, los arreglos agroforestales que se presentan en algunas plantaciones, la realización constante de podas de formación y la utilización de sustratos orgánicos que pudieran ser fuente de inóculo del patógeno, cuando no son sometidos a procesos adecuados de compostaje. En cualquier caso, el manejo de esta enfermedad debe estar fundamentado en evitar la llegada de propágulos del patógeno, especialmente de clamidosporas, a los sustratos de propagación y establecimiento de los cultivos, el tratamiento de herramientas tipo tijeras podadoras con desinfectantes genéricos, la detección temprana de focos de enfermedad, el tratamiento cuarentenario de sitios de siembra afectados por el patógeno y el establecimiento de bancos de plantas madre a partir de materiales provenientes de cultivo in vitro.
Agradecimientos
Este trabajo se realizó como parte de las actividades del proyecto "Manejo integrado de la nutrición del cultivo de vainilla" (contrato 082-2008V6151-3701), financiado por el Ministerio de Agricultura y Desarrollo Rural de Colombia, la Universidad Nacional de Colombia, Bioandes C. I. Ltda. y la Corporación Autónoma Regional del Centro de Antioquia.
Literatura citada
Ashoka, S., 2005. Studies on fungal pathogenies of vanilla with special references to Colletotrichum gloeosporioides. PhD. Tesis, Department of Plant Pathology, University of Agricultural Sciences, Dharwad. [ Links ]
Bhai, S., J. Dhanesh, 2008. Occurrence of fungal diseases in vanilla (Vanilla planifolia Andrews) in Kerala. Journal of Spices and Aromatic Crops 17:140-148. [ Links ]
Bory, S., P. Lubinsky, A.M. Risterucci, J.L. Noyer, M. Grisoni, M.F. Duval, P. Besse, 2008. Patterns of introduction and diversification of Vanilla planifolia (Orchidaceae) in Réunion Island (Indian Ocean). American Journal of Botany 95: 805-815. [ Links ]
Doyle, J.J., J.L. Doyle, 1990. Isolation of plant DNA from fresh tissue. Focus 12:13-15. [ Links ]
FAO (Food and Agriculture Organization), 2011. FAOSTAT website (http://faostat.fao-org/site/339/default.aspx). Consultado en Octubre de 2011. [ Links ]
Felsenstein, J., 1985. Confidence limits on phylogenies: an approach using the bootstrap. Evolution 39: 783-791. [ Links ]
Hall, T.A., 1999. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucleic Acids Symposium Series 41: 95-98. [ Links ]
Havkin-Frenkel, D., R. Dorn, 1997. Vanilla spices, flavor chemistry and antioxidant properties. ACS Symposium 660: 29-40. [ Links ]
He, X.H., 2007. Bio-control of root rot disease in vanilla. PhD. Tesis, Yunnan Agricultural University. [ Links ]
Hopple, J., R. Vilgalys, 1999. Phylogenetic relationships in the mushroom genus Coprinus and dark-spored allies based on sequence data from the nuclear gene coding for the large ribosomal subunit RNA: divergent domains, outgroups, and monophyly. Molecular Phylogenetics Evolution 13: 1-19. [ Links ]
Leslie J.F., B.A. Summerell, 2006. Fusarium laboratory manual. Blackwell Pub., Iowa. [ Links ]
MADR (Ministerio de Agricultura y Desarrollo Rural de Colombia), 2008. "PROYECTO: Manejo integrado de la nutrición del cultivo de vainilla 2008", Investigación, Desarrollo Tecnológico e Innovación. Disponible en: http://sigp.minagricultura.gov.co/portal/proyectosanteriores.jsp (Consultado en Noviembre de 2011). [ Links ]
Ordoñez, N.F., A.I. Osorio, J. E. Calle, M.C. Díez, F.H. Moreno, 2011. La vainilla en Colombia y en el mundo. In: Moreno, F., M. C. Díez (eds.), Cultivo de vainilla: contribuciones para el desarrollo de su cadena productiva en Colombia. Universidad Nacional de Colombia, Medellín. pp. 11-23. [ Links ]
Pinaria, A.G., E.C.Y. Liew, LW. Burguess, 2010. Fusarium species associated with vanilla stem rot in Indonesia. Australasian Plant Pathology 39:176-183. [ Links ]
Ploetz, R.C. 2006, Fusarium-induced diseases of tropical, perennial crops. Phytopathology 96:48-652. [ Links ]
Richard, A., K. Farreyrol, B. Rodier, K. Leoce-Mouk-San, M. Wong, M. Pearson, M. Grisoni, 2009. Control of virus diseases in intensively cultivated vanilla plots of French Polynesia. Crop Protection 28: 870-877. [ Links ]
Swofford, D.L., 1998. PAUP: Phylogenetic analysis using parsimony (* and other methods), Versión: 4. Sinauer Associates, Sunderland. [ Links ]
Suprapta D., K. Khalimi, 2009. Efficacy of plant extract formulations to suppress stem rot disease on vanilla seedlings. International Society for Southeast Asian Agricultural Sciences Journal 15: 3441. [ Links ]
Thomas, J., B. Suseela, 2001. Sclerotium rot - a new disease of vanilla (Vanilla planifolia Andrews) in India. Journal of Spices and Aromatic Crops 9: 175-176. [ Links ]
Tombe M., D. Sitepu, S. Mogi, 1997. Present status of biological control research of vanilla stem rot disease in Indonesia. In: Ogoshi, A., Kobayashi, K., Homma, Y., Kodama, F., Kondo N., Akino, S. (eds), Proceedings of the 4th international workshop on plant growth promoting rhizobacteria, Sapporo. pp. 13-21. [ Links ]
White, T.J., T. Bruns, S. Lee, J. Taylor, 1990. Amplification and direct sequencing of fungal rRNA genes for phylogenetics. In: Innis A.M., Gelfand, D. H., Sninsky J.J., White, T.J. (eds). PCR Protocols: A guide to methods and applications. Academic Press, San Diego. pp. 315-322. [ Links ]
Zuluaga, C., P. Buriticá, M. Marín, 2011. Filogenia de hongos roya (Uredinales) en la zona andina colombiana mediante el uso de secuencias del ADN ribosomal 28S. Revista Biología Tropical 59:517-540. [ Links ]














