Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de micología
Print version ISSN 0187-3180
Rev. Mex. Mic vol.34 Xalapa Dec. 2011
Contribuciones
Inóculo suplementado: evaluación de un método para optimizar la producción de inoculo para el cultivo de Pleurotus en pulpa de café
Supplemented spawn: evaluation of a method for optimizing spawn production for the cultivation of Pleurotus on coffee pulp
Gerardo Mata, Carlos Ortega Sánchez, Rosalía Pérez Merlo
Instituto de Ecología, A. C., Carretera antigua a Coatepec, No. 351, CP 91070, Xalapa, México.
Autor para correspondencia:
Gerardo Mata gerardo.mata@inecol.edu.mx.
Received 17 May 2011;
Accepted 3 December 2011.
Abstract
A suitable spawn must have the ability to grow rapidly and invade the substrate, overall on pasteurized substrates. The objective of the paper was to evaluate a method to determine the appropriate physiological state of inoculum for a quick and vigorous colonization of substrate. Mycelial growth of 11 strains of Pleurotus (P. ostreatus, P. pulmonarius and P. djamor) from 10 types of spawn prepared with seeds of sorghum, millet, powdered coffee pulp and peat was studied. Samples were taken every week for 3 weeks to determine the peak of metabolic activity in the mycelium, through the oxidation of fluorescein diacetate (FDA) and best results were obtained in week 2. The higher metabolic activity was obtained with two formulations of spawn and they were used to evaluate the productivity of the 6 selected strains. Results suggest that the use of supplemented spawn does not increase the biological efficiency. However, the method of assessing the oxidation of FDA, to determine the time the seed has a high metabolic activity and differentiate spawn formulations that ensure rapid and vigorous growth initiative.
Key words: metabolic activity, biomass, fluorescein diacetate, biological efficiency.
Resumen
Un inóculo adecuado debe tener la capacidad de crecer e invadir rápidamente el substrato, sobre todo en substratos pasteurizados. El objetivo del trabajo fue evaluar un método que permita determinar el estado fisiológico adecuado del inóculo para obtener una rápida y vigorosa colonización del sustrato. Se estudió el crecimiento micelial de 11 cepas de Pleurotus (P. ostreatus, P. pulmonarius y P. djamor) a partir de 10 tipos de inóculo preparado con semillas de sorgo, mijo, polvo de pulpa de café y turba. Se tomaron muestras cada semana durante 3 semanas para determinar el momento de mayor actividad metabólica en el micelio, a través de la oxidación del diacetato de fluoresceína (FDA), los mejores resultados se obtuvieron en la segunda semana. La mayor actividad metabólica se obtuvo con dos formulaciones de inóculo que se utilizaron para evaluar la productividad de las 6 cepas seleccionadas. Los resultados sugieren que el uso del inóculo suplementado no aumenta la eficiencia biológica, sin embargo, el método de evaluación de la oxidación del FDA, permite determinar el momento en que el inóculo tiene una actividad metabólica alta y diferenciar las formulaciones de inóculo que aseguran un rápido y vigoroso inicio de crecimiento.
Palabras clave: actividad metabólica, biomasa, diacetato de fluoresceína, eficiencia biológica.
Introducción
El inóculo comúnmente utilizado para el cultivo de hongos comestibles, conocido popularmente como "semilla", se obtiene con la reproducción masiva del micelio en granos de diferentes gramíneas que son utilizados como vectores para la dispersión del mismo en el sustrato final de cultivo. El inóculo de Pleurotus spp. se prepara comercialmente sobre granos de sorgo, mijo, trigo u otros materiales de fácil acceso (Chang y Miles, 1989).
La presencia de mohos antagonistas es frecuente en los cultivos de especies de Pleurotus en pulpa de café. Dichos mohos compiten por espacio y nutrientes lo que causa severos daños en la producción (Savoie y Mata, 1999). Los ataques de estos mohos, pueden inhibir el crecimiento del micelio de Pleurotus y reducir o anular la producción de las fructificaciones (Guzmán et al., 1993).
La adición de suplementos al inóculo mejora la resistencia del micelio de los hongos comestibles contra el ataque de mohos antagonistas, así también sirve para una pre–adaptación del micelio al sustrato en el cual será cultivado (Savoie et al., 2000). La elaboración de un inóculo vigoroso, capaz de colonizar el sustrato rápidamente y evitar así la posible aparición de antagonistas, es una de las necesidades fundamentales en la industria del cultivo de los hongos comestibles. La estimación de la hidrólisis del diacetato de fluoresceína (FDA) permite asociar la actividad metabólica del micelio a la biomasa del mismo en etapas iniciales del crecimiento micelial (Mata y Savoie, 1998). Este principio podría permitir una evaluación sencilla que ayude a determinar el estado fisiológico del micelio en el inóculo así como su capacidad para invadir las semillas y materiales utilizados para su preparación. El objetivo de este trabajo fue optimizar la calidad del inóculo para el cultivo de Pleurotus spp. en pulpa de café y evaluar un método que permita determinar el estado fisiológico de la biomasa micelial para obtener una rápida y vidorosa colonización del sustrato.
Materiales y métodos
Cepas estudiadas
Se estudiaron 11 cepas adscritas al género Pleurotus, de las cuales 6 pertenecen a P. ostreatus (IE–38, IE–49, IE–131, IE–137, IE–238, IE–240), 2 son P.pulmonarius (IE–140, IE–225) y 3 son P. djamor (IE–121, IE–197, IE–218). Todas las cepas se conservan en medio de cultivo papa dextrosa agar (PDA) y se encuentran depositadas en el cepario de hongos del Instituto de Ecología, A. C. en Xalapa, Veracruz, México.
Preparación de las formulaciones de inóculo
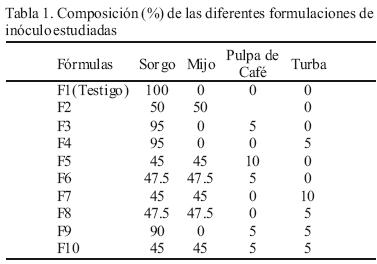
Se utilizaron semillas de sorgo (Sorghum vulgare Pers.) y mijo (Panicum miliaceum) así como los suplementos polvo de pulpa de café (Coffea arabica L.) y polvo de turba. Las semillas se tamizaron para eliminar todo tipo de residuo y se hidrataron en agua durante 24 h hasta obtener un porcentaje de humedad entre el 70 y 75 % (Guzmán et al., 1993). La turba y la pulpa de café se colocaron en un horno a 70° C durante 24 h, para su deshidratación. Posteriormente, se molieron y se depositaron en frascos herméticos para evitar su rehidratación. Se prepararon 10 diferentes formulaciones de inoculo (Tabla 1), de las cuales la formulación 1 (F1) fue considerada como testigo. Una vez preparadas las formulaciones con los suplementos, se esterilizaron a 121° C durante 1 h. Después de enfriarse, cada una se inoculó con un círculo de 0.7 cm de diámetro de medio de cultivo PDA con micelio de cada una de las cepas.
Sustrato utilizado
Se utilizó pulpa de café obtenida de un beneficio en la ciudad de Coatepec, Ver., la cual se deshidrató al sol. La rehidratación de la pulpa de café se realizó sumergiéndola en agua por un lapso de 24 h.
Estimación del área de crecimiento micelial
La prueba de crecimiento micelial se realizó en cajas de Petri estériles, con 20g de pulpa de café pasteurizada con vapor durante 1 ha 95° C. Las muestras se inocularon, en condiciones de esterilidad en una cámara de flujo laminar, con 1 g de inóculo de cada una de las formulaciones (F1 a F10). Se prepararon 10 réplicas por formulación. Las muestras se incubaron a 25° C en oscuridad durante 4 días al término de los cuáles se marcó en la tapa de la caja Petri la superficie que ocupaba el micelio. Se calculó el área micelial desarrollada, con un medidor de área foliar marca Licor modelo 3100. Las áreas miceliales fueron expresadas en cm2 (Mata et al., 2001).
Estimación de la biomasa micelial asociada a la actividad metabólica
Se estudiaron únicamente las cepas y las formulaciones en las que se obtuvo mayor crecimiento micelial. Se colocaron 50 g de las formulaciones seleccionadas en frascos de vidrio (15 réplicas por formulación) y se esterilizaron en autoclave durante 1 h a 121 °C. Ya fríos los frascos, se inocularon con 2 fragmentos circulares (0.7 cm de diámetro) de medio PDA con micelio de cada una de las cepas seleccionadas y se incubaron en oscuridad a 25° C. Se determinó la biomasa fúngica asociada a la actividad metabólica por peso del sustrato, de acuerdo a la hidrólisis del diacetato de fluoresceína (FDA) en muestras frescas de diferentes formulaciones de inóculo (Lestan et al., 1996; Mata y Savoie, 1998). Los resultados se expresaron como µg de FDA hidrolizados por g de sustrato seco colonizado por el micelio del hongo.
Preparación y siembra del sustrato
Se prepararon muestras de 1 Kg de pulpa de café hidratada y se colocaron en bolsas de polipapel para su esterilización en autoclave durante 1 h a 121° C. Una vez frío, el sustrato se inoculó, en una cámara de flujo laminar, con 50 g de inóculo incubado durante 15 días (Guzmán et al., 1993). Se sembraron 10 bolsas por cepa y formulación seleccionadas. La pulpa de café inoculada fue transferida al área de incubación a una temperatura de 25°C en oscuridad. Una vez que aparecieron los primordios de fructificación (aproximadamente a los 30 días), las muestras se trasladaron a la zona de producción con condiciones adecuadas de luz, aire, temperatura y humedad para el desarrollo de las fructificaciones (Sánchez y Royse, 2001).
Evaluación de la producción
Se evaluó el tiempo de aparición de los primordios y la producción total de hongos frescos en un lapso de 30 días después de la incubación. Se determinó la eficiencia biológica (EB): relación entre el peso fresco de los hongos y el peso seco del substrato expresado en porcentaje (Tchierpe y Hartman, 1977).
Análisis estadístico de los datos
Los datos obtenidos de las áreas de crecimiento micelial in vitro, los resultados de la estimación de la biomasa micelial y los resultados de la eficiencia biológica se sometieron a un análisis de varianza (p = 0.05). Para determinar las diferencias significativas en los valores promedio de cada uno de los experimentos anteriores, se realizó una prueba de rangos múltiples de Tukey con ayuda del programa de Computo Statistica (6.0). En todos los casos se siguió un diseño completamente al azar.
Resultados
Los resultados del área de crecimiento micelial en la pulpa de café a partir de diferentes formulaciones de inóculo, se muestran en la Tabla 2. Las cepas de P. ostreatus alcanzaron áreas miceliales entre los 20.3 cm2 y 37.4 cm2 correspondiendo a los valores máximos de las cepas IE–38 en la formulación 2 (F2) y la IE–49 en la formulación 4 (F4). De las 6 cepas de P. ostreatus, 5 de ellas (IE–49, IE–131, IE–238 e IE–240) presentaron los mayores valores de área en la F4. Las cepas de P. pulmonarius IE–140 e IE–225 alcanzaron su mayor crecimiento en la formulación 3 (F3) con áreas miceliales entre 29.0 y 30.7 cm2 respectivamente. En cuanto a P. djamor el mayor crecimiento se observó para la cepa IE–121 en la F4 con 14.7 cm2, mientras que para las cepas IE–197 e IE–218 el mayor crecimiento se obtuvo en la F3 con 23.2 y 35.3 cm2 respectivamente.
En la Tabla 3 se muestran los resultados del análisis de comparación de rangos múltiples de Tukey obtenidos de cada formulación. Los valores de crecimiento más altos se encontraron en F3 y F4 que mostraron diferencias significativas con todas las otras formulaciones. Sin embargo, en la selección de formulaciones se incluyeron también las tres siguientes formulaciones con valores de crecimiento altos: F9, F2 y F10 y la F1 como testigo.
Una vez seleccionadas las formulaciones (F3, F4, F9, F2, F10 y F1), se procedió a la selección de cepas. Para tal propósito, se realizó un análisis de comparación de rangos múltiples de Tukey, obtenido de las áreas de crecimiento en cada cepa, con únicamente los datos de cada cepa en las formulaciones seleccionadas (Tabla 3). El promedio de crecimiento más alto se obtuvo con la cepa IE–240 (25.5 cm 2) y el más bajo con la cepa IE–121 (11.4 cm 2). De acuerdo a los valores obtenidos, las cepas seleccionadas para la siguiente fase de este trabajo fueron: IE–240, IE–218, IE–49, IE–238, IE–225, e IE–38 las cuales son las que presentaron los valores más altos y con diferencia significativa.
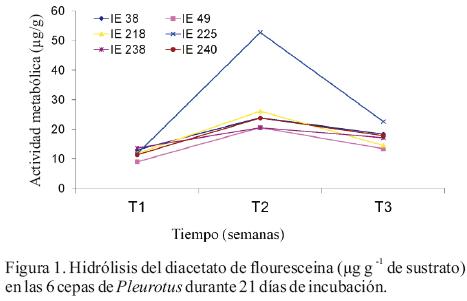
Los valores de actividad metabólica de todas las cepas se lograron estimar a partir de la primera semana de incubación (T1). En la Figura 1 se observa que todas las cepas mostraron su mayor actividad en la segunda semana de incubación del inóculo (T2). Los valores más altos de actividad se obtuvieron con la cepa IE–225 de Pleurotus pulmonarius (52.73 µg FDA). Con estos resultados el T2 fue seleccionado como el tiempo de incubación ideal del inóculo para su utilización en la evaluación de la productividad de las cepas.
Para seleccionar la formulación de inóculo que produce mayor actividad metabólica se consideraron todos los datos de todas las cepas y tiempos de incubación por cada formulación. La mayor actividad metabólica se obtuvo en F3 (25.8 µg FDA) y F4 (22.1 µg FDA), cuyos valores fueron significativamente diferentes de los obtenidos con las demás formulaciones (Tabla 4). Las formulaciones F3 y F4 fueron seleccionadas para preparar el inóculo que se utilizó en la siembra en pulpa de café para evaluar la producción de basidiomas. Por otra parte es importante mencionar que la formulación F1 fue la que presento la menor actividad (14.6 µg FDA).
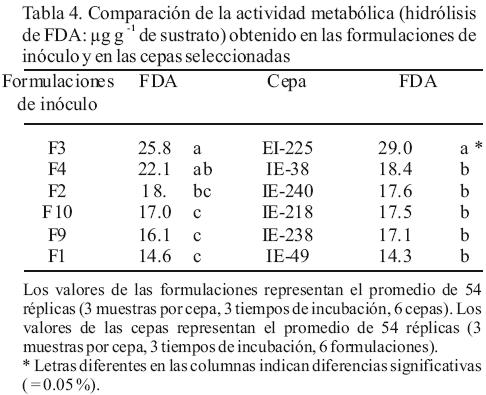
La actividad metabólica obtenida en las cepas varió dependiendo de la formulación utilizada. Se observó una mayor actividad en F3 y F4, pero con una mayor dispersión de los datos, es decir valores muy diferentes entre las cepas. Los valores más bajos de actividad se obtuvieron en F1 y F10 con datos poco dispersos. En F9, por el contrario, se obtuvieron también valores bajos pero con alta dispersión (Figura 2). Para seleccionar las cepas con mayor actividad metabólica se realizó un análisis de varianza con todos los datos de cada cepa (seis formulaciones y tres tiempos de incubación). La mayor actividad metabólica (29.0 µg FDA) se obtuvo con la cepa IE–225, que mostró diferencias significativas con todas las otras cepas seleccionadas (Tabla 4). En virtud que los resultados únicamente permitieron separar a las cepas en dos grupos (un grupo compuesto por la cepa IE–225 y otro grupo con las otras cinco cepas seleccionadas), se decidió utilizar las seis cepas con tres formulaciones de inóculo (F3, F4 y F1) para evaluar su productividad y poder compararlas entre sí.
Evaluación de la producción
En las seis cepas evaluadas se observó crecimiento micelial homogéneo, sin problemas de contaminación. En cuanto al tiempo de aparición de primordios, la cepa de mayor precocidad fue la IE–218 en la F4 con 12 días y la de menor precocidad la IE–38 en la F3, con más de 50 días (Tabla 5). Los resultados obtenidos no permiten establecer claramente un efecto en la disminución del tiempo de incubación debido al uso de una formulación de inóculo en particular. Únicamente las cepas IE–240 e IE–49 mostraron una disminución del tiempo de incubación relacionada al uso de las formulaciones F3 y F4 respecto de la formulación testigo F1. El tiempo de maduración de los primordios fue muy similar en todas las cepas y formulaciones estudiadas, entre 4 y 6 días.

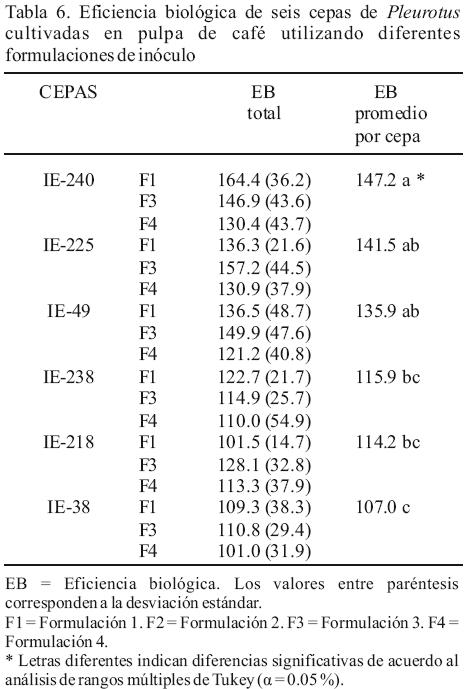
En todas las cepas y formulaciones estudiadas se obtuvieron 4 cosechas durante un período de 30 días. La mayor eficiencia biológica se obtuvo con la cepa IE–240 en la F1 con 164 % y la menor con las cepas IE–218 en la F1 e IE–38 en la F4 ambas con 101 %. La mayoría de las cepas mostró valores de desviación estándar elevados, lo que hace difícil separar tanto las cepas como las formulaciones más productivas (Tabla 6). El análisis de la EB por cepa mostró que la cepa IE–240 presentó la mayor EB promedio (147.2 %) y la cepa IE–38 la menor (117.0 %). Estos resultados ponen en evidencia las diferencias significativas que existen entre las cepas y sugieren que algunas cepas responden de mejor manera a la utilización de un inóculo suplementado. Por otra parte, los resultados obtenidos de la EB por formulación muestran que con la formulación F3 se obtuvo la mayor EB (134.6 %) la cual no fue significativamente diferente de la obtenida con la F1 (128.4 %) pero si de la F3 (117.8%).
Discusión
Los resultados obtenidos en este trabajo muestran que el inóculo suplementado invade más rápidamente el sustrato que el inóculo testigo. La capacidad de los hongos para crecer en un sustrato lignocelulósico está relacionada con el vigor de su micelio (Mata et al., 2001), así como la habilidad de las cepas para explotar adecuadamente los nutrientes del sustrato y tener mayor posibilidad de competir frente a los antagonistas. Esta característica, ligada a la producción de enzimas lignoceluloliticas, se debe considerar como un criterio para la selección de cepas de importancia comercial.
Los resultados del crecimiento de las cepas en las diferentes formulaciones de inóculo mostraron que el promedio más alto fue el de la cepa IE–240 con 25.5 cm2 y la mejor formulación para el crecimiento de los micelios fue la F3 con 27.0 cm3. La suplementación del inóculo con elementos ricos en compuestos fenólicos produce un aumento en el vigor del micelio (Mata et al., 1998; Savoie et al., 2000), además debido a que el tamaño de partícula de los suplementos es muy pequeño, el número de puntos de invasión desde donde reiniciará el crecimiento micelial es mayor, lo que favorece una rápida invasión del sustrato. En este trabajo el mayor crecimiento en pulpa de café se obtuvo con las cepas de Pleurotus ostreatus, seguido de P. djamor y por ultimo de P. pulmonarius. Las diferencias encontradas en la capacidad de adaptación a la pulpa de café podrían estar relacionadas con la producción de enzimas que permitan la degradación de fenoles y sustancias antifisiológicas presentes en el sustrato. La producción de lacasa y otras oxidasas al inicio del crecimiento micelial, está relacionada con la colonización del sustrato así como la degradación de los compuestos fenólicos del mismo (Salmones y Mata, 2002, 2005).
La mayor biomasa asociada a la actividad metabólica, en todas las cepas estudiadas, se encontró en el tiempo T2 (14 días), lo cual puede ser considerado el tiempo adecuado de incubación para el inóculo. Esto sugiere que, bajo las condiciones probadas, después de 14 días de incubación el micelio estaría iniciando un cambio metabólico que tendría por objetivo la acumulación de nutrientes que se utilizarían durante la fructificación, lo que produce en términos prácticos el envejecimiento del inóculo. Por otra parte la mayor actividad metabólica se encontró con la cepa IE–225 de P.pulmonarius con 52.73 µg FDA. En cuanto a las formulaciones, se observó que las fórmulas F3 y F4 presentaron mayor actividad metabólica respecto al testigo (F1), lo cual corrobora la posibilidad de mejorar el inóculo a través de la adición de suplementos y muestra que es factible utilizar el método de la hidrólisis del FDA.
Con el empleo de inóculo suplementado, el tiempo de incubación de las muestras, necesario para la formación de primordios, disminuyó en la mayoría de los casos. La mayor precocidad en la aparición de primordios se obtuvo a los 12 días con la F4 en la cepa IE–218. La reducción del tiempo de incubación es una estrategia muy importante para evitar la aparición de organismos antagonistas, sobre todo cuando el sustrato utilizado no ha sido esterilizado. En lo general los sustratos pasteurizados presentan problemas frecuentes de contaminación, por mohos del género Trichoderma, durante los primeros días de incubación. Las formulaciones seleccionadas en la fase final de este trabajo (F3 y F4) favorecieron el crecimiento micelial de las cepas estudiadas en un sustrato a base de pulpa de café pasteurizado por inmersión de agua y disminuyeron el tiempo de aparición de primordios.
Si bien la mayor eficiencia biológica, obtenida con las formulaciones probadas en este trabajo, se alcanzó con el inóculo suplementado de la F3 (134.6 %), ésta no fue significativamente diferente de la obtenida con la formulación testigo. Algunas de las cepas probadas mostraron un comportamiento similar a lo encontrado por otros autores al cultivarlas en pulpa de café (Alvarado Olivares, 2003; Velázquez–Cedeño et al., 2002). Los resultados obtenidos en este estudio sugieren que el uso del inóculo suplementado no aumenta la eficiencia biológica. Sin embargo, el método propuesto para la evaluación del inóculo, permite determinar el momento en que el inóculo tiene una actividad metabólica alta y diferenciar las formulaciones de inóculo que aseguran un rápido y vigoroso inicio de crecimiento, lo cual permite seleccionar un inóculo que favorezca la colonización del sustrato y ayude a prevenir la presencia de mohos antagonistas.
Literatura citada
Alvarado–Olivares, Z., 2003. Efecto de mohos antagonistas Trichoderma y Monilia en el género Pleurotus cultivados en pulpa de café y su producción de lacasa in vitro. Tesis de Licenciatura. Facultad de Biología. Universidad Veracruzana. Xalapa, Ver. [ Links ]
Chang, S.T., P.G. Miles, 1989. Edible mushrooms and their cultivation. Boca ratón, Florida. CRC Press. 345p. [ Links ]
Guzmán, G., G. Mata, D. Salmones, C. Soto–Velazco, L. Guzmán–Dávalos, 1993. El cultivo de los hongos comestibles, con especial atención a especies tropicales y subtropicales en esquilmos y residuos agroindustriales. Instituto Politécnico Nacional. México, D.F. 245 p. [ Links ]
Lestan, D., M. Lestan, J.A. Chapelle, R.T. Lamar, 1996. Biological potential of fungal inocula for bioaugmentation of contaminated soils. Journal of Industrial Microbiology 16: 286–294. [ Links ]
Mata, G., J.M. Savoie, 1998. Extracellular enzyme activities in six Lentinula edodes strains during cultivation in wheat straw. World Journal of Microbiology and Biotechnology 14: 1–7. [ Links ]
Mata, G., J.M. Savoie, P. Delpech, J.M. Olivier, 1998. Reductions of the incidence of Trichoderma spp. using substrate supplementation with peat and an alternative spawn during cultivation of Lentinula edodes on pasteurised wheat straw. Agronomie: Agriculture and Environment 18: 515–520. [ Links ]
Mata, G., R. Gaitán–Hernández, R. Pérez–Merlo, C. Ortega, 2001. Improvement of shiitake spawn for culturing on pasteurized wheat straw. In: Sánchez, J.E., G. Huerta, E. Montiel (eds.). Mushroom Biology and Mushroom Product, Proceeding of the 4th International Conference. UAEM, Cuernavaca. pp. 303–309. [ Links ]
Salmones, D., G. Mata, 2002. Detection of extracellular enzymes produced by Pleurotus spp. grown on coffee pulp. In: Sánchez, J.E., G. Huerta, E. Montiel (eds.), Mushroom Biology and Mushroom Products. UAEM, Cuernavaca. Pp. 213–219. [ Links ]
Salmones, D., G. Mata, 2005. Efecto de la presencia de compuestos solubles de lignina y fenoles sobre la producción de lacasa y biomasa en cultivos de Pleurotus spp. Revista Mexicana de Micología 21: 63–69. [ Links ]
Sánchez, J.E., D.J. Royse. 2001. La biología y el cultivo de Pleurotus spp. El Colegio de la Frontera Sur–Limusa. México, D.F. 290p. [ Links ]
Savoie, J.M., G. Mata, 1999. The antagonistic action of Trichoderma sp. hyphae to Lentinula edodes hyphae changes in lignocellulolytic activities during cultivation in wheat straw. World Journal of Microbiology and Biotechnology 15: 369–373. [ Links ]
Savoie, J.M., P. Delpech, C. Billette, G. Mata, 2000. Inoculum adaptation changes the outcome of the competition between Lentinula edodes and Trichoderma spp. during shiitake cultivation on pasteurized wheat straw. Mushroom Science 15: 667–674. [ Links ]
Tchierpe, M.J., K. Hartman, 1977. A comparison of different growing methods. Mushroom Journal 60: 404–416. [ Links ]
Velázquez–Cedeño, M.A., G. Mata, J.M. Savoie, 2002. Waste–reducing of Pleurotus ostreatus and Pleurotus pulmonarius on coffee pulp, changes in the production of some lignocellulolytic enzymes. World Journal of Microbiology and Biotechnology 18: 201–207. [ Links ]














