Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de micología
versión impresa ISSN 0187-3180
Rev. Mex. Mic vol.34 Xalapa dic. 2011
Contribuciones
Producción y caracterización de la fenol oxidasa de Scytalidium thermophilum
Production and characterization of phenol oxidase produced by Scytalidium thermophilum
Yasmin Sánchez–Rosario1, José E. Sánchez1, Rafael Vázquez–Duhalt2, René H. Andrade–Gallegos1
1 Hongos Tropicales, El Colegio de la Frontera Sur, Apartado postal 36, Tapachula, Chiapas, México. 30700.
2 Departamento de Ingeniería Celular y Biocatálisis, Instituto de Biotecnología (UNAM), Apdo. Postal 510–3, Cuernavaca, Morelos, México. CP. 62250.
Autor para correspondencia:
J. E. Sánchez esanchez@ecosur.mx.
Received 14 April 2011;
Accepted 8 November 2011
Abstract
In this work, the production of phenol oxidase from three strains of Scytalidium thermophilum was studied and the enzyme from the best producing strain was characterized. The enzyme production in three different culture media: Starch (SM), Potato Dextrose Yeast (PDY), and Grass Infusion (GI) at different temperatures (42, 45 and 48 °C) and different pH (6, 7 and 8) was evaluated. The highest enzymatic activity (0.115U/ml) was observed with the ECS–0602 strain in a Pangola grass infusion at pH 8 and 45 °C. Subsequently the purification of the enzyme by ionic exchange chromatography was carried out and the purified enzyme was characterized. The enzyme showed a molecular weight of 87 kDa in 10% SDS–PAGE gel and showed the highest activity at pH 7 and 55 °C. The –1 –1 maximal rate (Vmax) was 80.72 μmoles min–1mg of protein–1 and the catalytic affinity constant max (KM) was 302.79 mM, both determined with catechol as a substrate. The partially purified enzyme also showed catalase activity from pH 5.5 to 8 and at room temperature, with a maximal catalase activity of 10 640 Umg–1 of protein at pH 6. The enzyme is a glycosilated hemoprotein that contains 0.7 moles of Fe per mol of protein.
Keywords: thermophilic fungi, catalase, extracellular enzyme, phenolic compounds, oxidase.
Resumen
En este trabajo se estudió la producción de fenol oxidasa de tres cepas de Scytalidium thermophilum y se caracterizó la enzima de la cepa más productora. Se evaluó la producción de enzima en tres diferentes medios de cultivo: almidón (SM), papa dextrosa y levadura (PDY) e infusión de pasto (GI) a diferentes temperaturas (42, 45 y 48 °C) y diferentes valores de pH (6, 7 y 8). La actividad enzimática más alta (0.115 U/ml) fue observada con la cepa ECS–0602 en infusión de pasto Pangola a pH 8 y 45 °C. Subsecuentemente, se llevó a cabo la purificación de la enzima por cromatografía de intercambio iónico y la enzima parcialmente purificada fue caracterizada. La enzima mostró un peso molecular de 87 kDa en gel 10% SDS–PAGE y mostró la actividad más alta a pH 7 y 55 °C. La máxima velocidad (Vmax) fue de 80.72 μmoles min–1 mg de proteína–1 y la constante de afinidad catalítica (KM) fue de 302.79 mM, ambas determinadas sobre catecol como sustrato. La enzima purificada mostró también actividad catalasa de pH 5.5 a 8 y a temperatura ambiente, con una máxima actividad catalasa de 10 640 Umg–1 de proteína a pH 6. La enzima es una hemoproteína glicosilada que contiene 0.7 moles de Fe por mol de proteína.
Palabras clave: hongos termófilos, catalasa, enzimas extracelulares, compuestos fenólicos, oxidasa.
Introducción
La contaminación ambiental originada por la acumulación de compuestos fenólicos de actividades industriales representa un riesgo para la salud. Los compuestos fenólicos se encuentran comúnmente en muchos tipos de efluentes y residuos industriales, como los producidos por la industria destiladora, la de extracción de aceite de oliva, el del descortezado de madera, el despulpado del café, la industria textil, entre otras (Field y Lettinga, 1991; Borja et al., 1993; Brand et al., 2000; Lesage–Meessen et al., 2001; Minhalma y De Pinho, 2001; Aggelis et al., 2002). Estos compuestos fenólicos son considerados como contaminantes ambientales prioritarios por causa de su alta toxicidad. Son compuestos que frecuentemente determinan la vía de degradación de un material orgánico en particular (Kang et al., 2009).
El tratamiento biológico de efluentes industriales depende generalmente de la actividad oxidativa de los microorganismos (Mendonca et al., 2004). Es bien conocido que los compuestos fenólicos son naturalmente polimerizados durante la formación de humus y pueden formar otros productos biológicos por la actividad de las fenol oxidasas (Brown, 1967). Estas enzimas también juegan un papel importante en procesos de descomposición de carbono (Freeman et al., 2001). Además, constituyen un grupo biocatalizador capaz de catalizar la oxidación de compuestos aromáticos en quinonas. Las fenol oxidasas están clasificadas en dos grupos principales: el primer grupo incluye las polifenol oxidasas, las tirosinasas (monofenol monooxigenasas; EC 1.14.18.1) y las catecol oxidasas (o–difenol oxidasa; EC 1.10.3.1), y el segundo grupo incluye las multicobre oxidasas, también conocidas como lacasas (Ögel et al., 2006). Los compuestos fenólicos también son oxidados por las oxidasas que dependen de H2O2 (EC 1.11.1.7) (Griffith, 1994).
Los hongos filamentosos capaces de crecer en madera, material en el cual las estructuras fenólicas están presentes, podrían ser una fuente importante de fenol oxidasas (Mendonca et al., 2004). Entre estos hongos está Scytalidium thermophilum, un hongo inocuo que es importante en el cultivo del champiñón y que tiene una temperatura óptima de crecimiento a 45 °C (Straatsma et al., 1991; Wiegant, 1992). Recientemente ha sido reportado que S. thermophilum es un productor de fenol oxidasa (Ögel et al., 2006; Sutay et al., 2008), lo cual es de particular interés para la industria y el ambiente por las aplicaciones potenciales en la degradación de compuestos recalcitrantes. Se ha reportado la capacidad de la fenol oxidasa de Sporotrichum pulverulentum para degradar lignina y los principales componentes de la madera (Ander y Eriksson, 1976). La fenol oxidasa (tirosinasa) de Amylomices rouxii es una de las principales enzimas que participan en la degradación de PCF (penta–cloro–fenol) el cual es un componente tóxico producto de la industria papelera (Montiel et al., 2004). La fenol oxidasa de Phanerochaete chrysosporium puede ser aplicada en la degradación de compuestos clorados (Oses et al., 1999). Además, la fenol oxidasa participa en la descomposición de la lignina y la polimerización de sustancias fenólicas a sustancias húmicas en la composta del champiñón desarrollada por hongos termofílicos (van Griensven, 1988; Chefetz et al., 1998; Maheshwari et al., 2000; Tuomela et al., 2000; Mayer y Staples, 2002). A diferencia de los hongos mesófilos, estos hongos termófilos son capaces de producir enzimas funcionalmente estables a altas temperaturas (Machuca y Durán, 1993). Las enzimas de hongos termófilos están generalmente glicosiladas (Mason, 1957) y activas a pH alcalino y neutral (Ögel et al., 2006).
Con base en lo mencionado anteriormente, el objetivo de este estudio fue determinar la capacidad de producción de la fenol oxidasa de tres cepas de S. thermophilum y caracterizar la enzima de mayor producción.
Materiales y métodos
Cepas, mantenimiento y cultivo
Se utilizaron las cepas Scytalidium thermophilum ECS–0601, ECS–0602 y ECS–0603 de la colección micológica de El Colegio de la Frontera Sur. Las cepas fueron cultivadas en PDA (extracto de papa, 20%; dextrosa, 1% y agar, 2%) a 45 °C hasta que alcanzaron la fase de esporulación y fueron conservadas a temperatura ambiente. El medio de crecimiento fue: Medio de almidón (SM), compuesto de extracto de levadura (0.4%), fosfato dipotásico (0.1%), sulfato de magnesio (0.05%) y almidón soluble (1.5%); el medio papa–dextrosa–levadura (PDY) consistió de extracto de papa (20%), dextrosa (1%) y levadura Bioxon (0.3%), y el medio de infusión de pasto (GI), con 20g de pasto Pangola, Digitaria decumbens, preparado hirviendo 1 litro de agua por cinco minutos, y después agregando dextrosa (1%) y levadura (0.3%). Todos los medios fueron esterilizados a 121°C por 20 minutos.
Crecimiento micelial
Se preparó una suspensión de esporas de cada cepa (ECS–0601, ECS–0602 y ECS–0603) en agua destilada estéril a partir de cultivos en caja de Petri de 4 días a 45 °C. Se hizo una serie de diluciones hasta 10–3, las esporas fueron contadas al microscopio con una cámara de Neubauer para inocular 2500 esporas en matraces de 125 mL con 50mL de medio (PDY, SM o GI) (concentración final de 50 esporas mL–1). Los matraces inoculados fueron incubados por 5 días a 45 °C y 135 rpm en un agitador orbital Lab–line modelo Orbite 3526. Cada 24 horas, fueron retirados tres matraces para determinar biomasa, azúcares, pH y actividad enzimática. La biomasa fue determinada por gravimetría después de filtrar en papel Whatmann # 6 (Williams, 1984). Posteriormente, el filtrado fue centrifugado a 5000 rpm por 10 min y el supernadante fue usado para determinar pH, contenido de azúcar con DNS (Miller, 1959) y fenol oxidasa, como se describe abajo.
Actividad enzimática
La actividad fenol oxidasa fue medida por espectrofotometría usando catecol como sustrato (ε420 nm= 3,450 M–1cm–1). La mezcla de reacción consistió de 250 µL de solución de catecol (0.1 M en 0.1M amortiguador fosfato, pH 7) y 500 µL de amortiguador fosfato y la reacción fue iniciada al agregar 250 µL de extracto (Ögel et al., 2006). Una unidad enzimática fue definida como la cantidad de enzima requerida para la formación de 1|xmol de producto por minuto.
La actividad catalasa fue medida espectrofotométricamente a 25 °C por el decremento de absorbancia a 240 nm. La mezcla de reacción (1 mL) contenía 10.5 mM H2O2, 50 mM fosfato de potasio, amortiguador fosfato a diferentes valores de pH (rango de 5 a 8) y extracto enzimático. Se utilizó el coeficiente de extinción ε240 nm= 0.040 mmol–1 cm–1 (Beers y Sizer, 1952). Una unidad enzimática fue definida como la cantidad que cataliza la descomposición de 1 µmol de H2O2 por minuto.
Efecto del pH y la temperatura sobre la producción de fenol oxidasa
La combinación de cepa y medio que presentó la mayor actividad fenol oxidasa fue usada para determinar el efecto del pH del medio sobre la producción de enzima a 42 °C y 135 rpm. El pH inicial fue ajustado antes de la inoculación a 6, 7 u 8 (Sánchez et al., 2008). Posteriormente, fue evaluado el efecto de la temperatura de cultivo incubando el hongo a diferentes temperaturas (42, 45 ó 48 °C).
Purificación de la fenol oxidasa
S. thermophilum fue cultivado en un fermentador de 10 L (New Brunswick Scientific Co; Inc, Modelo MF–114) en medio GI a pH 8 (esterilizado previamente a 121 °C, 20 min.), durante dos días a 135 rpm y 45 °C. El medio fue filtrado y centrifugado a 21000 rpm a temperatura ambiente (centrífuga Sharples, modelo CL–T.1) y luego concentrado en un equipo de ultrafiltración de 20 L (Amicon, modelo DC) con cartucho de 50000 Da. El extracto enzimático crudo fue concentrado en un equipo de ultrafiltración de 350 ml con una membrana de 50000 Da. Después se centrifugó a 14000 rpm a 4 °C durante 12 min y posteriormente se fraccionó en una columna cromatográfica DEAE Sephadex de intercambio iónico (20 × 5 cm). Las proteínas fueron eluídas con un gradiente de NaCl de 100 a 500 mM en amortiguador 10 mM Tris–HCl a pH 8. Las fracciones que mostraron actividad fenol oxidasa fueron colectadas y concentradas nuevamente con una membrana de 30000 Da. Y lavadas tres veces con amortiguador fosfato 10 mM a pH 8. La pureza de la fenol oxidasa fue evaluada por electroforesis en 10% SDS–PAGE y el peso molecular fue calculado según su movilidad electroforética con un marcador conocido. La concentración de proteínas fue determinada por el método Bradford (1976).
Efecto del pH y la temperatura en la actividad fenol oxidasa
El efecto del pH y la temperatura en la actividad fenol oxidasa fue determinado por la oxidación de catecol usando el método de Ögel et al. (2006) a una concentración de 0.16 M de catecol en 1mL de ensayo, en un espectrofotómetro (Perkin Elmer Lambda 25 UV/VIS) a 420nm. Se usó un coeficiente de extinción de 3450 M–1cm–1. El efecto del pH sobre la actividad enzimática fue determinado en un rango de pH de 3 a 11, a 60 °C. Para el establecimiento de los diferentes valores de pH, se utilizaron diferentes sales a concentraciones de 0.1 M, de acuerdo con Guiraud y Galzy (1980). En cuanto al efecto de la temperatura, la actividad enzimática fue determinada a pH 7 entre 30 y 80 °C.
Determinación de los parámetros cinéticos (kcat y KM)
Con el fin de determinar la velocidad (Vmax ó kcat) y la constante de afinidad (KM) para catecol, se determinó la actividad inicial basándose en la oxidación del sustrato a diferentes concentraciones (70 mM a 450 mM) a 55 °C y pH 7. Las constantes catalíticas fueron calculadas a partir de los datos experimentales según el modelo de Michaelis–Menten usando el programa Biosoft EnzFitter (Cambridge, UK).
Glicosilación de la enzima
Para la tinción de glicoproteínas se utilizó gel de electroforesis y como referencia se usó gel teñido con azul de Coomassie (Gersten, 1996).
Detección del grupo prostético heme en la fenol oxidasa de S. thermophilum
Se realizó el espectro UV–Vis de la enzima purificada para observar la banda de absorción Soret. Además, se removió el grupo heme usando 500 µL de extracto con dos gotas de ácido clorhídrico y 800 µL de 2–butanona. La mezcla fue vigorosamente agitada y luego centrifugada a 14000 rpm por 5 min. El espectro de la fase orgánica fue observado en el rango de 340 a 800 nm usando como blanco 2–butanona.
Análisis de metales
Un mL de la enzima purificada fue digerido con 1 mL de ácido perclórico al 70% (J.T. Baker). El control consistió en 1 mL 10 mM de amortiguador fosfato. Todo el material de vidrio fue previamente lavado con 10% ácido nítrico y enjuagado con agua doble destilada y desmineralizada. Las muestras fueron analizadas por espectroscopía de absorción de masas en la Unidad de Análisis de la Facultad de Química de la UNAM, con un equipo Varian, SPECTRAA–220.
Análisis estadístico
En los ensayos de actividad enzimática se usó un diseño factorial de tres factores con tres repeticiones, así como para la cinética de crecimiento (medio de cultivo, cepa y tiempo) y de dos factores para el efecto de la temperatura (temperatura y tiempo) y efecto del pH (pH y tiempo) (Montgomery, 2006). Para la producción de biomasa y consumo de glucosa se realizó un análisis de covarianza (Montgomery, 2006) usando transformaciones de Boxcox (Kemp, 1996) y de rangos (Conover y Ronald, 1981). Para la separación de medias se usó la prueba de Tukey (P=0.05) excepto cuando se observó una interacción con el tiempo, en donde se aplicó la prueba de Bonferroni (P=0.016).
Resultados
Cinética de crecimiento
Las tres cepas de S. thermophilum, ECS–0601, ECS–0602 y ECS–0603, fueron cultivadas en tres medios líquidos que fueron almidón (SM), papa (PDY) y pasto (GI) (Figuras 1, 2, 3). El crecimiento de la cepa ECS–0601 en los tres medios mostró tasas de crecimiento promedio de 6.06 gL–1D–1,4.44 gL–1D–1 y 3.64 gL–1D–1 y el consumo de glucosa de 3.01 gL–1D–1, 4.48 gL–1D–1 y 3.71 gL–1D–1, respectivamente (Tabla 1). El análisis estadístico no mostró diferencias significativas al comparar el crecimiento micelial entre los medios de cultivo mencionados. Por el contrario, para el consumo de glucosa, el análisis estadístico demostró que únicamente se observaron diferencias significativas al comparar el medio SM con PDY (P= 0.008) y SM con GI (P= 0.000). En los tres medios estudiados, el pH tendió a incrementarse hasta alcanzar un valor cercano a nueve después de cinco días de crecimiento. Por otra parte, la actividad enzimática incrementó de aproximadamente 3 mU/mL en el primer día a una máxima producción de 20 mU/mL.
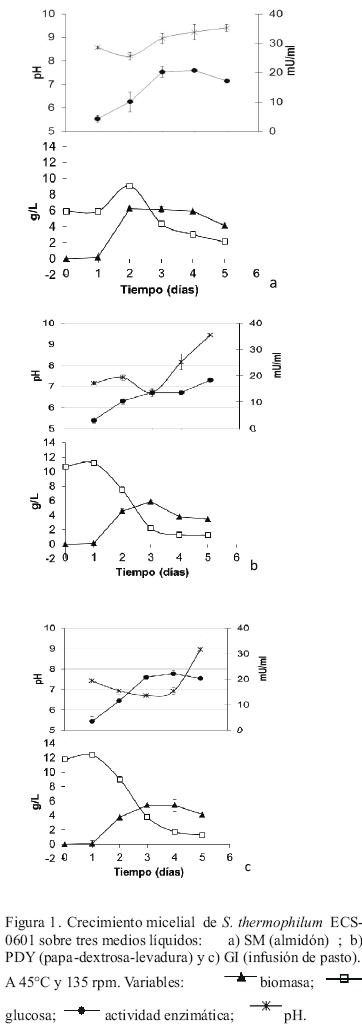



La cepa ECS–0602 (Figura 2) mostró tasas de crecimiento promedio de 4.73 gL–1D–1, 3.79 gL–1D–1 y 3.37 gL–1D–1 para los medios SM, PDY y GI, respectivamente. El consumo de glucosa mostró valores de 1.56 gL–1D–1, 5.68 gL–1D–1 y 5.32 gL–1D–1, en los medios SM, PDY y GI, respectivamente. El análisis estadístico mostró diferencias significativas, del medio GI con respecto de SM (P=0.000) y GI con PDY (P=0.000), en cuanto a tasa de crecimiento. Para el consumo de glucosa, el análisis estadístico reveló diferencias significativas entre los medios SM y PDY (P=0.001) y los medios SM y GI (P= 0.007). En los tres medios estudiados, el pH también tendió a incrementarse hasta alcanzar un valor cercano a nueve después de cinco días de crecimiento. La actividad enzimática se incrementó de aproximadamente 2 mU/mL, en los tres medios estudiados, hasta una máxima producción de más de 30 mU/mL en el medio GI y más 20 mU/mL en los otros medios.
Finalmente, las tasas de crecimiento promedio de la cepa ECS–0603 (Figura 3) fueron 2.6 gL–1D–1, 2.1 gL–1D–1 y 1.55 gL–1D–1 y el consumo de glucosa fue de 3.04 gL–1D–1, 3.23 gL–1D–1 y 2.91 gL–1D–1, en los medios SM, PDY y GI, respectivamente (Tabla 1). El análisis estadístico de estos datos mostró diferencia significativa únicamente entre los medios SM y GI (P= 0.000). En cuanto al consumo de glucosa, el análisis estadístico no demostró diferencia estadística entre los medios de cultivo antes mencionados. El pH se mantuvo estable de 8 a 8.6 en el medio SM, de 7.2 a 7.6 en PDY y con un ligero decremento 7.3 a 6.5 en el medio GI después de cinco días de crecimiento. La actividad enzimática pasó de aproximadamente 1 mU/mL a arriba de 12 mU/mL como su máxima producción.
La cepa ECS–0601 mostró una tasa de crecimiento promedio más alta que las otras cepas. Se observaron diferencias significativas entre las cepas ECS–0601 y ECS–0602 (P= 0.000) y entre las cepas ECS–0601 y ECS–0603 (P=0.000) en el medio SM. En el medio PDY se observaron diferencias significativas en cuanto a tasa de crecimiento entre las cepas ECS–0601 y ECS–0602 (P=0.005), ECS–0601 y ECS–0603 (P=0.000) y ECS–0602 y ECS–0603 (P=0.000). Finalmente, en la infusión de pasto (GI) se presentaron diferencias significativas en cuanto a tasa de crecimiento entre las cepas ECS–0601 y ECS–0602 (P=0.005), ECS–0601 y ECS–0603 (P=0.000) y ECS–0602 y ECS–0603 (P=0.003).
En cuanto al consumo de glucosa de las tres cepas estudiadas, en el medio SM, se observaron diferencias estadísticas de las cepas ECS–0602 y ECS–0601 (P= 0.004) y la cepa ECS–0602 y ECS–0603 (P=0.000) (Tabla 1). En el medio PDY el análisis estadístico mostró diferencias significativas entre las tres cepas; es decir, la cepa ECS–0603 con respecto a la ECS–0601 (P= 0.000) y ECS–0602 (P=0.000) y entre las cepas ECS–0601 y ECS–0602 (P=0.004). En infusión de pasto (GI) hubo diferencias significativas entre las tres cepas; es decir, la cepa ECS–0603 con las cepas ECS–0601 y ECS–0602 (P= 0.000 para ambas comparaciones) y la cepa ECS–0601 con la ECS–0602 (P= 0.0005).
El objetivo de estos experimentos fue seleccionar un medio de cultivo favorable para la producción de fenol oxidasa. La actividad más alta en los medios SM, PDY y GI fue producida por la cepa ECS–0602 (Fig. 4). Es importante mencionar que hubo diferencia significativa entre cepas y medios (P=0.000) con la excepción de los PDY y SM (P= 0.2880). La cepa ECS–0602 mostró la actividad enzimática más alta en el medio GI (33 mU/mL) en el 4° día, seguida por el medio SM (22 mU/mL) y el PDY (21 mU/mL).

Efecto del pH y la temperatura sobre la producción de fenol oxidasa
La cepa ECS–0602 y el medio GI fueron seleccionados porque su interacción presentó mayor actividad enzimática. Posteriormente se evaluó el efecto del pH inicial (6, 7 y 8) y la temperatura de cultivo (42, 45 y 48 °C) sobre el crecimiento y la actividad fenol oxidasa. A pH 6 no hubo crecimiento, mientras que a pH 7 y 8, las tasas de crecimiento promedio fueron 4.19 gL–1D–1 y 4.95 gL–1D–1 y consumo de glucosa de 3.64 gL–1D–1 y 4.32 gL–1D–1, respectivamente. El análisis estadístico no reveló ninguna diferencia significativa con respecto al crecimiento (P= 0.26) y el consumo de glucosa (P= 0.6862); pero sí con respecto a la actividad fenol oxidasa (P= 0.000), con una actividad más alta a pH 8 (55 mU/mL).
La tasa de crecimiento promedio de la cepa ECS–0602 a diferentes temperaturas fue de 5.42 gL–1D–1, 5.39 gL–1D–1 y 5.26 gL–1D–1 y el consumo de glucosa de 4.48 gL–1D–1, 5.48 gL–1D–1 y 5.17 gL–1D–1, a 42, 45 y 48 °C, respectivamente. La tasa de crecimiento de esta cepa a 48°C no mostró diferencia significativa cuando se le comparó con las obtenidas a 42°C y 45°C, sin embargo sí hubo diferencia estadística entre las tasas de crecimiento a 42°C y 45°C (P= 0.005). En cuanto a consumo de glucosa, las diferencias fueron las mismas que las encontradas para las tasas de crecimiento: sin diferencia en consumo de glucosa a la temperatura de 48°C con respecto de 42°C y 45°C, pero sí entre 42°C y 45°C (P= 0.001). La actividad enzimática mostró diferencias significativas al comparar los tratamientos de 48°C con los de 42°C y 45°C (P=0.0087 y P=0.000, respectivamente). El tratamiento a 42°C comparado con el de 45°C también mostró una diferencia significativa (P= 0.000). La actividad más alta fue encontrada a 45°C (115 mU/ml).
Purificación y caracterización de la fenol oxidasa
Se realizó un cultivo de 10 L de medio con el fin de obtener suficiente cantidad de enzima. La enzima fue purificada de acuerdo a como se describió en materiales y métodos y se obtuvo un rendimiento de 56.17% de las U totales iniciales (153.37 U de enzima pura). La pureza de la enzima fue determinada por electroforesis sobre gel de acrilamida (Fig. 5), y se obtuvo una proteína con alto grado de pureza. De acuerdo con la banda observada y el peso de los marcadores de peso molecular, el peso molecular de la proteína fue de 87 Kda.

La enzima purificada no mostró actividad a pH 4 y a pH 11 aún tenía una actividad de 10.6 U mg–1 de proteína (46.2% remanente) (Fig. 6). El pH óptimo fue 7, con una actividad específica de 22.9 U mg–1 proteína. La temperatura afectó de menor manera la actividad enzimática, ya que se observó actividad entre 30°C y 80°C, con una reacción catalítica óptima a 55°C con actividad específica de 22.89 U mg–1 de proteína (Fig. 6).

Se determinaron las constantes cinéticas de la fenol oxidasa. El valor de la constante catalítica o velocidad máxima (kcat) fue 80.72 µmolesmin–1mg proteína–1 y la constante de afinidad de Michaelis–Menten (KM) fue 302.8 mM. La enzima mostró también actividad catalasa. Esta actividad catalasa varió con el pH (Fig. 7). La máxima actividad catalasa fue obtenida a pH 6, con valor de 10 640 U mg–1 de proteína.

La fenol oxidasa producida por S. thermophilum es una glicoproteína. La glicosilación fue corroborada con un gel teñido para glicoproteínas. Finalmente, el espectro UV–VIS de la fenol oxidasa purificada mostró una banda de absorción Soret que indica la presencia de un grupo prostético heme. El grupo heme fue extraído con 2–butanona y mostró bandas de absorción máxima en el espectro a 380 nm, 490 nm y 600 nm. El contenido de fierro de la proteína, determinado por espectroscopia de adsorción atómica demostró que la enzima contiene 0.7 moles de Fe por mol de proteína.
Discusión
En este estudio se determinaron las condiciones de producción (medio de cultivo, temperatura y pH) de la enzima fenol oxidasa de tres cepas de S. thermophilum. Así mismo, se procedió a purificar y caracterizar la enzima de la cepa más prominente. La actividad fenol oxidasa fue detectada durante el crecimiento en los tres medios de cultivo a 45°C. La cepa ECS–0602 mostró la producción más alta en el medio infusión de pasto (GI). La máxima producción de fenol oxidasa fue de 115 mU/ml, en el segundo día de incubación. Esta actividad enzimática es mayor que la obtenida por Ögel et al. (2006) quienes reportaron 75 mU/ml, aunque se debe considerar que estos autores no optimizaron la producción de la fenol oxidasa estudiada. A pesar de las diferencias en producción de la fenol oxidasa, la producción de biomasa de S. thermophilum fue muy parecida en ambos estudios y se situó entre 5 y 6 g/L.
En el día de mayor producción enzimática, el pH del medio para las cepas ECS–0601 y ECS–0602 fue de alrededor de 8–9. Este valor de pH es similar a los observados para la fenol oxidasa de Thermoascus aurantiacus en medio líquido a base de aserrín de Eucalyptus grandis (Machuca y Duran, 1993). Sin embargo, este dato contrasta con los observados para la cepa ECS–0603 que presentó la máxima producción enzimática entre pH 6.5 y 7.5 con una actividad extracelular más baja.
La cepa ECS–0602 no presentó crecimiento a pH 6. Este resultado difiere parcialmente de los resultados reportados por Sánchez et al. (2008) en un medio de cultivo sólido en caja de Petri, ya que la cepa S. thermophilum ECS–0601 mostró el crecimiento más alto a valores de pH de 7–8 y una tasa de crecimiento de 0.3 mm/h a pH 6. Sin embargo, esta diferencia puede deberse a las características particulares del medio de cultivo y a la cepa.
La producción más alta de enzima fue observada en el medio GI, probablemente por la presencia de oligómeros de lignina en la infusión de pasto; aunque en este medio no se presentó ni el crecimiento ni el consumo de glucosa más altos. Esta observación concuerda con lo expresado por Ögel et al. (2006), quienes indicaron que la presencia de compuestos fenólicos induce la expresión enzimática. Por otra parte, es comprensible que los azúcares simples presentes hayan facilitado el crecimiento en detrimento de la producción de fenol oxidasa en los otros medios. Se observó que cada cepa presentó ciertas particularidades en cuanto a la cantidad y cinética de producción de la enzima. Esto concuerda con Lyons y Sharma (1998) quienes reportaron diferencias de comportamiento en función de la cepa de S. thermophilum estudiada. Efectivamente, mientras la cepa ECS–0603 no mostró variaciones en la producción de enzima en los tres medios utilizados, la cepa ECS–0602 fue significativamente influenciada por el medio de cultivo empleado. Así también, la cepa ECS–0603 mostró la menor tasa de crecimiento con su máxima producción de fenol oxidasa en el día cinco de cultivo, lo que difirió de las otras cepas que la presentaron en el día cuatro.
La fenol oxidasa purificada mostró un peso molecular 87 KDa, el cual es muy parecido al de la proteína estudiada por Ögel et al. (2006) y Sutay et al. (2008), con 83 y 80 KDa, respectivamente. Dicha enzima mostró estar glicosilada, lo cual es característico de la mayoría de las enzimas extracelulares provenientes de hongos, sin embargo deberán hacerse más estudios para determinar la concentración de azúcares. Entre las enzimas que contienen la más alta cantidad de carbohidratos se encuentran la fosfatasa alcalina extracelular e intracelular de S. thermophilum, que contienen alrededor de 54 y 63% de azúcares, respectivamente (Guimaraes et al., 2001). Un contenido alto de carbohidratos es también característico de las fosfatasas (Vasileva–Tonkova et al., 1993). La glucoamilasa de Aspergillus niveus contiene 11% de carbohidratos y la glucoamilasa de diversos hongos típicamente contiene entre 10 y 20% de carbohidratos (Da Silva et al., 2009).
Por otra parte, el espectro UV–Vis confirmó la presencia de un grupo heme como sitio activo, lo que categoriza esta enzima como una hemoproteína típica que 0.7 moles de Fe/mol de proteína. El espectro del grupo heme de esta enzima no reflejó similitud con respecto a la holoenzima catalasa–fenol oxidasa de S. thermophilum estudiada por Sutay et al. (2008).
La enzima purificada mostró un pH y una temperatura óptimos de 7 y 55 °C, respectivamente. Estos valores son ligeramente diferentes a los reportados por Ögel et al. (2006) para una fenol oxidasa de S. thermophilum con catecol como sustrato (óptimo pH 7.5 y 65 °C). Estos autores mencionaron que la actividad enzimática a altos valores de pH y temperatura son una excepción entre las fenol oxidasas provenientes de hongos termófilos. El pH óptimo para la fenol oxidasa de Chaetomium thermophile es 6.0 (Ishigami et al., 1988), y de Thermoascus aurantiacu, para la oxidación de o–dianisidine, es de 2.8 (Machuca et al., 1998). Bollag y Leonowicz (1984) encontraron que la fenol oxidasa de Rhizoctonia practicola tuvo un pH óptimo cercano a la neutralidad (7.2), mientras que otras fenol oxidasas extracelulares mostraron óptimos significativamente más bajos (3.0 – 5.7). Entre otras de las pocas excepciones se encuentra la lacasa de Acremonium murorum, la cual tiene un óptimo de actividad a pH 9 para la oxidación de syringaldazina (Gouka et al., 2001).
La fenol oxidasa purificada de la cepa S. thermophilum ECS–0602 mostró 82% de su máxima actividad a 70 °C y 39.6% a 80 °C. Como lo mencionaron Wasserman y Hultin (1981) esta actividad a altas temperaturas puede ser atribuida al hecho de que la enzima está glicosilada. Estos autores demostraron que la alta termoestabilidad para la catalasa de Aspergillus niger era debida a sus fracciones de azúcares. Wang et al. (1996) también indicaron la importancia del grado de glicosilación sobre la termoestabilidad de las enzimas. Estos resultados indican que la función general de la glicosilación de proteínas es proteger el plegamiento de la cadena polipeptídica y la estabilidad de la conformación de la proteína. Sin embargo, el mecanismo de protección de la fracción glicosilada no está completamente claro.
Jafari–Aghdam et al. (2005) además de confirmar esto, sugieren que la propiedad de estabilización de una glicoproteína no puede ser generalizado y que cada observación debe ser analizada en términos de la propiedad estructural específica a la función exhibida por la molécula proteica.
La enzima purificada mostró también actividad catalasa dentro del rango de pH de 5.5 a 8. A pH 8 mostró 70% de su actividad fenol oxidasa y 69.6% de su actividad catalasa. La catalasa mantiene su actividad en un rango de pH más amplio, con óptimo a pH 6 (10640 Umg–1 de proteína) a diferencia de la actividad fenol oxidasa que lo presenta a pH 7 (22.9 Umg–1 de proteína). La actividad catalasa fue observada a 25 °C, mientras que para la fenol oxidasa la actividad fue evaluada a varias temperaturas mostrando la mayor actividad a 55 °C. Sutay et al. (2008) mencionaron que la actividad catalasa fue superior a temperatura ambiente, mientras que la actividad fenol oxidasa fue mayor a altas temperaturas. De estos resultados se deduce considerar a la enzima parcialmente purificada como bifuncional y llamarla catalasa–fenol oxidasa.
Finalmente, la fenol oxidasa de S. thermophilum parece ser interesante para aplicaciones industriales. Esta enzima es capaz de realizar su acción catalítica a temperaturas y valores de pH altos. Esta propiedad es, sin duda, importante para la estabilidad operacional de procesos a gran escala.
Agradecimientos
Los autores agradecen a los Fondos Mixtos Conacyt–Gobierno del estado de Chiapas, por financiar esta investigación a través del proyecto CHIS–2007–C07–79126. También agradecen a Lilia Moreno y Rosa Román por el apoyo técnico y a Javier Valle por su ayuda en el análisis de datos. El primer autor también agradece al Conacyt por la beca que le permitió obtener el grado de Maestría en Ciencias.
Literatura citada
Aggelis, G., C. Ehaliotis, F. Nerud, I. Stoychev, G. Lyberatos, G.I. Zervakis, 2002. Evaluation of white–rot fungi for detoxification and decolorization of effluents from green olive debittering process. Applied Microbiology and Biotechnology 59(2–3): 353–360. [ Links ]
Ander, P., K. Eriksson, 1976. The importance of phenol oxidase activity in lignin degradation by the white–rot fungus Sporotrichum pulverulentum. Archives ofMicrobiology 109: 1–8. [ Links ]
Beers, R. F. Jr., I. W. Sizer, 1952. A spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase. The Journal of Biological Chemistry 195:133–140. [ Links ]
Bollag, J.M., A. Leonowicz, 1984. Comparative studies of extracellular fungal laccases. Applied and Environmental Microbiology 48: 849–854. [ Links ]
Borja, R., A. Martin, R. Maestro, M. Luque, M.M. Duran, 1993. Enhancement of the anaerobic digestion of wine distillery wastewater by the removal of phenolic inhibitors. Bioresource Technology 45(2): 99–104. [ Links ]
Bradford, M.M., 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding. Analytical Biochemistry 72: 248–254. [ Links ]
Brand, D., A. Pandey, S. Roussos, C.R. Soccol, 2000. Biological detoxification of coffee husk by filamentous fungi using a solid state fermentation system. Enzyme and Microbial Technology 27(1–2): 127–133. [ Links ]
Brown, B.R., 1967. Biochemical aspects ofoxidative coupling of phenols. In: Taylor, W.I., A.R. Battersby (eds.), Oxidative coupling of phenols. Marcel Dekker, New York. pp. 167–201. [ Links ]
Chefetz, B., Y. Chen, Y. Hadar, 1998. Purification and characterization of phenol oxidase from Chaetomium thermophilum and its role in humification. Applied and Environmental Microbiology 64(9): 3175–3179. [ Links ]
Conover, W.J., L.I. Ronald, 1981. Rank Transformations as a bridge between parametric and nonparametric statistics. The American Statistician 35(3): 124–129. [ Links ]
Da Silva, T.M., A. Maller, A.R. De Lima, M. Michelin, R.J. Ward, I.Y. Hirata, J.A. Jorge, H.F. Terenzi, M.L.T.M. De Polizeli, 2009. Properties of a purified thermostable glucoamylase from Aspergyllus niveus. Journal of Industrial Microbiology and Biotechnology 36: 1439–1446. [ Links ]
Field, J.A., G. Lettinga, 1991. Treatment and detoxification of aqueous spruce bark extracts by Aspergillus niger. Water Science and Technology 24(3–4): 127–137. [ Links ]
Freeman, C., N. Ostle, H. Kang, 2001. An enzymatic 'latch' on a global carbon store. Nature 409: 149. [ Links ]
Gersten, D.M., 1996. Gel Electrophoresis proteins: Essential Techniques Series. Wiley, San Francisco, California. p. 113–114. [ Links ]
Gouka, R.J., M. van der Heiden, T. Swarthoff, C.T. Verrips, 2001. Cloning of a phenol oxidase gene from Acremonium murorum and its expression in Aspergillus awamori. Applied and Environmental Microbiology 67 (6): 2610–2616. [ Links ]
Griffith, G.W., 1994. Phenol oxidases. In: Martinelli, S.D., J.R Kinghorn (eds.), Aspergillus nidulans: 50 years. Progress in Industrial Microbiology. Amsterdam. p.p.76–78. [ Links ]
Guimaraes, L.H.S., H.F. Terenzi, J.A. Jorge, M.L.T.M. Polizeli, 2001. Thermostable conidial and mycelial alkaline phosphatases from the thermophilic fungus Scytalidium thermophilum. Journal of Industrial Microbiology and Biotechnology 27: 265 – 270. [ Links ]
Guiraud, J.P., P. Galzy., 1980. L'analyse microbiologique dans les industries alimentaires. Les Editions de L'usine, Paris. p. 230. [ Links ]
Ishigami, T., Y. Hirose, Y. Yamada., 1988. Characterization of polyphenol oxidase from Chaeteomium thermophile, a thermophilic fungus. Journal of General and Applied Microbiology 34: 401–407. [ Links ]
Jafari–Aghdam, J., K. Khajeh, B. Ranjbar, M. Nemat–Gorgani, 2005. Deglycosylation of glucoamylase from Aspergilus niger: effects on the structure, activity and stability. Biochimica et Biophysica Acta 1750: 61–68. [ Links ]
Kang, H., S.H. Lee, S.M. Lee, S. Jung., 2009. Positive relationships between phenol oxidase activity and extractable phenolics in estuarine soils. Journal of Chemical Ecology 25(2): 99–106. [ Links ]
Kemp, G.C.R., 1996. Scale Equivariance and the Box–cox Transformation. Economics Letters 51: 1–6. [ Links ]
Lesage–Meessen, L., D. Navarro, S. Maunier, J.C. Sigoillot, J. Lorquin, M. Delattre, J.L. Simon, M. Asther, M. Labat, 2001. Simple phenolic content in olive oil residues as a function of extraction systems. Food Chemistry 75(4): 501–507. [ Links ]
Lyons, G.A., H. S.S. Sharma, 1998. Differentiation of Scytalidium thermophilum isolates by thermogravimetric analyses of their biomass. Mycological Research 102 (7): 843–849. [ Links ]
Machuca, A., H. Aoyama, N. Durán, 1998. Production and characterization of thermostable phenoloxidase of the ascomycete Thermoascus aurantiacus. Biotechnology and Applied Biochemistry 27: 217–223. [ Links ]
Machuca, A., N. Durán, 1993. Phenol oxidases production and wood degradation by a thermophilic fungus Thermoascus auriantiacus. Applied Biochemistry and Biotechnology 43: 37–44. [ Links ]
Maheshwari, R., G. Bharadwaj, M.K. Bhat, 2000. Thermophilic fungi: their physiology and enzymes. Microbiology and Molecular Biology Reviews 64: 461–488. [ Links ]
Mason, H.S., 1957. Mechanism of oxygen metabolism. Advances in Enzymology 19: 79–233. [ Links ]
Mayer, M.A., R.C. Staples, 2002. Phenol oxidase: new functions for an old enzyme. Phytochemistry 60: 551–565. [ Links ]
Mendonca, E., A. Martins, A.M. Anselmo, 2004. Biodegradation of natural phenolic compounds as single and mixed substrates by Fusarium flocciferum. Electronic Journal of Biotechnology 7(1): 30 – 37. [ Links ]
Miller, G.H., 1959. Use of Dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry 31(3): 426–428. [ Links ]
Minhalma, M., M.N. De Pinho, 2001. Tannic–membrane interactions on ultrafiltration of cork processing wastewaters. Separation and Purification Technology 22–23 (1): 479–488. [ Links ]
Montgomery, D.C., 2006. Diseño y análisis de experimentos. Limusa Wiley. México, D.F. p.p. 1–686. [ Links ]
Montiel, A.M., F.J. Fernández, J. Marcial, J. Soriano, J. Barrios–González y A. Tomasini, 2004. A fungal phenoloxidase (tyrosinase) involved in pentachlorophenol degradation. Biotechnology Letters 26 (17): 1353–1357. [ Links ]
Ögel, Z.B., Y. Yüzügüllü, S. Mete, U. Bakir, Y. Kaptan, D. Sutay, A.S. Demir, 2006. Production, Properties and application to biocatalysis of a novel extracellular alkaline phenol oxidase from the thermophilic fungus Scytalidium thermophilum. Applied Microbiology and Biotechnology 71: 853–862. [ Links ]
Oses, R., J. Rodríguez, K. Tasumi, J. Freer, J. Baeza, 1998. Chlorophenols degradation by catalytic siderophores from white rot fungi Phanerochaete chrysosporium. In: Paice, M., J. Saddler (eds.), P roceedings of the 7th International Conference on Biotechnology in the Pulp and Paper Industry, Vancouver. p.p. 227. [ Links ]
Sánchez, J.E., L. Mejía, D.J. Royse, 2008. Pangola grass colonized with Scytalidium thermophilum for production of Agaricus bisporus. Bioresource Technology 99: 655–662. [ Links ]
Straatsma, G., J.P.G. Gerrits, T.M. Gerrits, H.J.M. Op den Camp, L.J.L.D. Van Griensven, 1991. Growth kinetics of Agaricus bisporus mycelium on solid substrate (mushroom compost). Journal of General Microbiology 58:1471–1477. [ Links ]
Sutay, D., U. Bakir, V.S.E. Phillips, M.J. McPherson, Z.B. Ögel, 2008. Purification, characterization, and identification of a novel bifunctional catalase–phenol oxidase from Sytalidium thermophilum. Applied Microbiology and Biotechnology 79: 407–415. [ Links ]
Tuomela, M., M. Vikman, A. Hatakka, M. Itávaara, 2000. Biodegradation of lignin in a compost environment: a review. Bioresource Technology 72:169–183. [ Links ]
Van Griensven, L.J.L.D., 1988. The cultivation of mushrooms. Darligton Mushroom Laboratories Ltd, UK and Somycel SA, France. [ Links ]
Vasileva–Tonkova, E.S., D.N. Galabova, M.A. Balasheva, A.V. Sotirova, 1993. Purification and partial characterization of acid phosphatase from Candida lipolytica. Journal of General Microbiology 139: 479–483. [ Links ]
Wang, Ch., M. Eufemi, C. Turano, A. Giartosio, 1996. Influence of the carbohydrate moiety on the stability of glycoproteins. Biochemistry 35: 7299–7307. [ Links ]
Wasserman, B.P., H. Hultin, 1981. Effect of the deglycosylation on the stability of Aspergillus niger catalase. Archives of Biochemistry and Biophysics 212: 385–392. [ Links ]
Wiegant, W.M., J. Wery, E.T. Buitenhuis, J.A.M. De Bont, 1992. Growth–promoting effect of thermophilic fungi on the mycelium of the edible mushroom Agaricus bisporus. Applied and Environmental Microbiology 58: 2654–2659. [ Links ]
Williams, S., 1984. Official Methods of Analysis. Association of Official Analytical Chemists. Arlington. p.p.152. [ Links ]














