Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de micología
versão impressa ISSN 0187-3180
Rev. Mex. Mic vol.33 Xalapa Jun. 2011
Contribuciones
Análisis morfológico de biopelículas de Candida albicans producidas en diferentes condiciones de pH y temperatura analizadas por microscopía óptica y de fuerza atómica
Morphological analysis of Candida albicans biofilms produced at different pH and temperature conditions analyzed by optic and atomic force microscopy
Gloria Merino Guzmán1, Lilia Cedillo Ramírez2, Francisco Silva Andrade3, Andrés A. Muñoz García2, Elsa Iracena Castañeda Roldán 2
1 Posgrado en Ciencias Ambientales, Área de Medio Ambiente y Salud, Benemérita Universidad Autónoma de Puebla.
2 Instituto de Ciencias de la Benemérita Universidad Autónoma de Puebla (ICUAP).
3 Departamento de Físico Química de Materiales (ICUAP)
Autor para correspondencia:
Gloria Merino Guzmán
gloria_merino_guzman@yahoo.com.mx
Recibido 11 de mayo 2009;
aceptado 9 de julio 2010.
Abstract
Microbial biofilm formation plays an important role in the cycle of life and subsistence of many microorganisms. Candida albicans colonizes the surface of catheters, prosthetic and epithelium forming biofilms that are extremely resistant to antifungal drugs. In the present study, a strain of C. albicans was grown under different pH and temperature conditions in order to analyze the morphology of biofilms formed by optical microscopy (OM) and quantitatively by atomic force microscopy (AFM). Optical and atomic force micrographs showed the formation of biofilms in all conditions tested. Main morphological parameters of C. albicans biofilms (height, highlight and valleys) were determined by MFA, showing heterogeneity in perimeter, area and volume values reached.
Key words: yeasts, growth in vitro, morphology of biofilms, microscopic techniques.
Resumen
La formación de biopelículas microbianas juega un papel importante en el ciclo de vida y subsistencia de muchos microorganismos. Candida albicans coloniza la superficie de catéteres, prótesis y epitelio formando biopelículas que son extremadamente resistentes a drogas antifúngicas. En el presente estudio, una cepa de C. albicans fue cultivada bajo diferentes condiciones de pH y temperatura con la finalidad de analizar la morfología de biopelículas formadas mediante microscopia óptica (MO) y cuantitativamente por microscopia de fuerza atómica (MFA). Las micrografías ópticas y de fuerza atómica demostraron la formación de biopelículas en todas las condiciones probadas. Los parámetros morfológicos principales (altura, relieve y valles) de las biopeliculas de C. albicans fueron determinados por MFA, mostrando heterogeneidad en los valores de perímetro, área y volumen alcanzados.
Palabras clave: levaduras, crecimiento in vitro, morfología de biopelículas, técnicas microscópicas.
Introducción
Candida albicans (C.P. Robin) Berkhout es el agente causal mas común en infecciones intrahospitalarias ya que el 40% de los pacientes se han contaminado con cepas de Candida a través de catéteres produciendo fungemia con alta mortalidad (Bandenhorts et al., 1991; Anaissie et al., 1993; Arisoy et al., 1993; Hawser y Douglas, 1994). La habilidad de C. albicans para crecer sobre superficies y formar biopelículas está asociada con su virulencia, porque es un comensal de mucosas y de la superficie intestinal que puede servir como fuente para infecciones invasivas (Reagan et al., 1990; Riggle et al., 1999; Donland, 2002; Shin et al., 2002; Donland y Costerton, 2002; Khun et al., 2002; Douglas, 2003). También se ha observado que C. albicans forma biopelículas sobre las superficies inertes de catéteres y prótesis dentales (Arisoy et al., 1993).
El análisis de biopelículas de C. albicans por microscopía de fluorescencia muestra que están formadas por una capa basal de blastosporas, hifas y pseudohifas ordenadas en una estructura de doble capa, dentro de una matriz extracelular constituida fundamentalmente de polisacáridos y proteínas resistentes a un amplio espectro de antifúngicos que incluye anfotericina B y fluconazol (Hawser y Douglas, 1995; Baillie y Douglas, 1998; 2000; Donland, 2000; Khun et al, 2002b; Lupetti et al., 2002; Alem et al., 2006a). En contraste, las biopelículas de Candidaparapsilosis (Ashford) Langeron & Talice tienen un volumen menor que las biopelículas de C. albicans y están formadas exclusivamente por blastosporas. Por otra parte, las cepas invasivas de C. albicans producen biopelículas con un volumen significativamente mayor que las cepas de C. parapsilosis, C. glabrata (H.W. Anderson) S.A. Mey. & Yarrow y C. tropicalis (Castell.) Berkhout, en ensayos determinados por peso seco (Khun et al., 2002a). Esta forma de vida de los microorganismos adheridos a superficies se conoce desde hace mucho tiempo, pero no ha sido hasta hace poco cuando se ha visto su gran impacto médico e industrial.
Por otra parte, se conoce que en C. albicans se producen dos moléculas de comunicación intercelular o quórum sensing: farnesol y tirosol. Estas estructuras aceleran y bloquean la transición morfológica de levadura a hifa y actúan significativamente durante las fases temprana, intermedia y de crecimiento del organismo (Baillie y Douglas, 1999; Hornby et al., 2001; Alem et al., 2006b).
La microscopía de fuerza atómica (MFA) es una herramienta que se ha empleado en esta década para el estudio de la morfología superficial de diversos materiales, como bióxido de silicio (SiO2), cristales fotónicos como el ópalo y materiales que presentan transición de fase metal–semiconductor como el VO2 (Silva Andrade et al., 2004). Con la ayuda de este equipo, se han visualizado las bacterias a alta resolución, investigando las fuerzas de interacción entre objetos a escala de nanómetros, como la superficie de Escherichia coli y otras bacterias como Bacillus coagulans y B. sphaericus, lo que ha permitido obtener mayor información de los lipopolisacáridos característicos de las membranas de bacterias Gram–negativas que son ensamblados en cadenas de 600–3500 moléculas (Kotra et al., 2000).
El objetivo del presente trabajo fue evaluar la capacidad de formación de biopelículas C. albicans bajo diferentes condiciones de crecimiento, específicamente pH y temperatura, y determinar las características morfológicas de las estructuras formadas utilizando microscopía óptica y de fuerza atómica.
Materiales y métodos
Candida albicans (ATCC 10261) fue proporcionada por el Laboratorio de Microbiología Oral de la Facultad de Estomatología de la Benemérita Universidad Autónoma de Puebla. La elección de C. albicans para realizar este estudio se basó en su relevancia clínica como patógeno oportunista de humanos. La cepa de C. albicans se descongeló y posteriormente fue resembrada en placas de medio dextrosa Saboraud (Laboratorios Difco, Detroit, MI, USA), incubándose a 37 °C durante 24 h. De este cultivo se realizó un subcultivo en medio líquido dextrosa Saboraud, que fue incubado a 37 °C durante = 12 h. El crecimiento celular se ajustó a una DO540 nm 0.8 obteniendo una suspensión de 1x106 cel/mL (Baillie y Douglas, 2000).
Las condiciones para estudiar las fases del desarrollo de las biopelículas de C. albicans y sus cambios morfológicos fueron las siguientes: 1) Cinética de crecimiento a las 4, 8, 12 y 24 h, a un pH de 5.6 y una temperatura de incubación de 37 °C, 2) temperaturas de 25, 37 y 44 °C, manteniendo un pH a 5.6 durante 24 h, y 3) pH de 4.4 y 5.4 manteniendo la temperatura a 37 °C durante 24 h.
Para evaluar la cinética de formación de las biopelículas se colocaron 100 µL de medio RPMI 1640 en los 8 pozos de las placas de vidrio Lab–Tek II y 25 |xl de la suspensión de 1x106 cel/mL. Las placas se incubaron a 37 °C/2 h. Posteriormente se realizaron tres lavados con un tampon de fosfatos salinos (PBS) 0.15 M y pH 7.2, con la finalidad de remover las levaduras no adheridas a la superficie de las placas y eliminar las células planctónicas. Se adicionó nuevamente 100 µL de medio RPMI 1640 en cada pozo y las muestras se incubaron a 37°C a los diferentes tiempos considerados (4, 8, 12 y 24 h), realizándose en cada tiempo de incubación tres lavados con la solución tampón de PBS. Cada prueba se evaluó por duplicado y las preparaciones se fijaron con PBS pH 7.2 y formalina al 4%, manteniendo los portaobjetos a temperatura ambiente (Baillie y Douglas, 2000).
Las biopelículas fijadas se analizaron en el microscopio óptico (MO) y de fuerza atómica. El mismo procedimiento descrito anteriormente fue empleado para las diferentes condiciones de temperatura (25, 37 y 44 °C) y pH (4.4 a 5.4) estudiadas. Se utilizó como control negativo a C. albicans a una densidad celular de 1x102 cel/mL y medio RPMI 1640 diluido al 10%.
Para la observación en el MO, las biopelículas fijadas se tiñeron con Giemsa 1:20, aplicando 250 de colorante en cada pozo durante 1 h. Posteriormente se realizaron 3 lavados con agua destilada y entonces las muestras se secaron, desmontando las celdas y colocándolas en un cubreobjetos para su observación en un microscopio óptico Nikon Japan 310454 con focus lock 3–CCD.
Las micrografías de MFA se obtuvieron en un microscopio de fuerza atómica modelo Q–Scopetm 850, con cámara anti vibraciones. Todas las imágenes se visualizaron en el modo de contacto del microscopio, usando un cantilever de nitruro de silicio con un radio de 10 nm, un índice de barrido de 2 Hz y una escala de barrido entre 5 y 10 µm. Los datos acerca de la interacción del cantilever con la superficie fueron transmitidos a la computadora mediante una interfase electrónica para generar imágenes de superficie de las biopelículas en tercera dimensión. Los ejes X y Y de las imágenes se refieren a la escala de barrido y el eje Z corresponde a la altura de las biopelículas. El software del microscopio proporcionó los datos de altura, área, perímetro y volumen de canales y valles. Los canales corresponden a estructuras continuas profundas observadas como zonas obscuras o poros, mientras que los valles se observan como depresiones de la superficie de las biopelículas.
Los valores obtenidos fueron analizados estadísticamente mediante una ANOVA y la prueba t de student, con la finalidad de determinar las diferencias entre las variables experimentadas (horas durante la cinética, temperaturas y pHs), así como para determinar las diferencias entre las áreas, volúmenes y perímetro de las estructuras formadas.
Resultados
El control negativo en 1x102 cel/mL en medio RPMI 1640 al 10% observado por MO mostró la adherencia de algunas células sobre la superficie de las placas a las 4 h, pero sin llegar a formar una biopelícula madura en ninguno de los tiempos estudiados (datos no mostrados), mientras que la cepa de C. albicans en 1x106 cel/mL y en medio RPMI 1640, observado por MO y MFA, presentó la formación de biopeliculas en todas las condiciones estudiadas( Figuras 1, 2, 3).
Las observaciones realizadas en MO mostraron diferentes etapas de formación de las biopelículas de C. albicans, así como su morfología celular. En la fase inicial, 4 y 8 h de crecimiento, las células de C. albicans se pegaron y formaron microcolonias pequeñas o racimos, observándose un crecimiento menor en extensión sobre la superficie de cada pozo de las placas y presencia de hifas (Figuras 1A–1D); mientras que la fase de desarrollo intermedia, 12 h, se caracterizó por la producción de material polimérico extracelular (Figuras 1E–1F). Durante la fase de maduración, ocurrida a las 24 h de incubación, el soporte fue cubierto casi en su totalidad con regiones densas de células levaduriformes, observándose un crecimiento mayor en extensión (Figuras 1G–1H). Las comunidades de C. albicans fueron encerradas por material polimérico extracelular, presentando en todos los casos una característica morfología levaduriforme, con un incremento de la densidad celular dependiente de la fase de desarrollo de la biopelícula, siendo visualmente significativo a las 24 h durante la fase de maduración. La presencia de filamentos fue observada en la cinética a las 4 y 8 h de crecimiento. También se observaron filamentos durante la fase madura de 24 h, bajo las condiciones de crecimiento de 44 °C y pH 5.6 (Figuras 2E–2F) y a 37°C y pH 4.4 (Figuras 3A–3D). El análisis de las micrografías con MO y tinción de Giemsa mostraron la topografía característica de las biopelículas de C. albicans en la cinética de crecimiento, así como en las diferentes condiciones de temperatura y pH estudiadas.
Las imágenes obtenidas por MFA mostraron topografías de superficie tanto en la cinética de formación de las biopelículas como en las etapas de maduración, bajo las diferentes condiciones de temperatura y pH evaluadas. En todos los casos, se observó una morfología de canales y valles, con área, perímetro y volumen de estas estructuras. Estos datos sugieren heterogeneidad en la superficie de las biopelículas de C. albicans (Figuras 1A, 1C, 1E y 1G; 2A, 2C y 2E; 3A, 3C y 3E). La formación de biopelículas maduras a las 24 h de crecimiento se observó en las condiciones de pH 5.6 y temperaturas de 25, 37 y 44 °C (Figuras 2A, 2C y 2E), así como a 37 °C y pHs de 4.4 y 5.4 (Figuras 3A, 3C y 3E).
La prueba t student aplicada a los resultados de formación de biopelículas de C. albicans en las diferentes condiciones estudiadas determinó diferencias significativas (p < 0.001) en la altura entre las 4 y 12 h (2.3±0.57 µm, 0.39±0.085 µm), entre las 8 y 12 h (0.89±0.26 µm, 0.39±0.085 (µm) y entre las 8 y 24 h (0.89±0.26 (µm, 2±0.81(µm). No hubo diferencia significativa entre las 4 y 24 h (2.3±0.57 µm, 2±0.81µm). Cuando se compararon las alturas promedio en el caso de variación de temperatura se encontraron diferencias significativas entre los 25°C y 37°C (0.54±0.23 µm, 2±0.81µm) y entre los 37°C y 44°C (2±0.81 µm, 0.39±0.15 µm). También se observó diferencia significativa entre los pH 4.4 y 5.4 (0.68±0.25 µm, 2±0.81 µm) (p < 0.001), siendo la última condición en dónde se cuantificó la mayor altura.
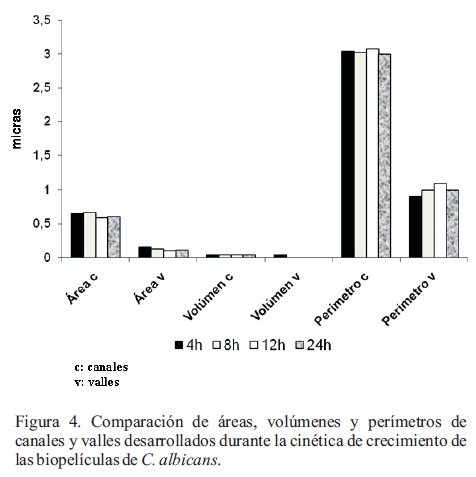
Los datos del área, volumen, perímetro de canales y valles de la cinética de biopelículas a las 4, 8, 12 y 24 h se obtuvieron mediante el software WSMX 4.0 (Figura 4). En los canales, la mayor área se encontró a las 4 y 8 h (0.65, 0.67 µm2), disminuyendo a las 12 y 24 h (0.59, 0.6 µm2), mientras que los perímetros variaron entre 3.05 (4 h), 3.03 (8 h) y 3 µm (24 h), con un ligero incremento a las 12 h (3.08 µm). Los valores del volumen de los canales iniciaron con 0.04 µm3 a las 4 y 8 h, disminuyendo a 0.037 y 0.036 a las 12 y 24 h, respectivamente, lo que puede relacionarse con la maduración de la biopelícula, que alcanzó una morfología amorfa a las 24 h. El análisis de los valles mostró un valor de área mayor a las 4 y 8 h (0.15 y 0.13 µm2), disminuyendo a las 12 y 24 hs (0.10, 0.11µm2); mientras que los perímetros y volúmenes fueron similares en los cuatro tiempos estudiados (1µm y 0 µm3) (Figura 5). Posteriormente con el programa Instat se realizó la prueba de ANOVA comparando los valores del área, volumen y perímetro correspondientes a los canales y valles en los diferentes tiempos de la cinética (4, 8, 12 y 24 h) no encontrándose diferencias significativas en todos casos (p > 0.05).
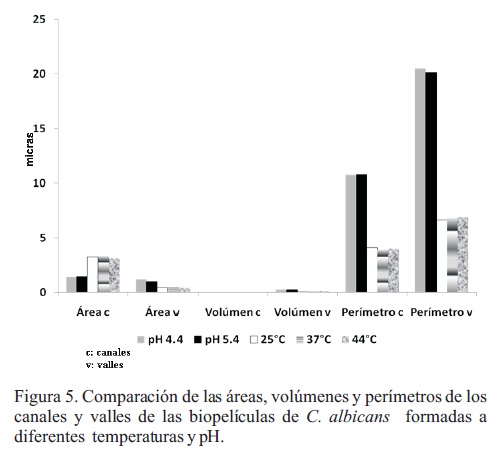
Cuando se realizaron las variaciones de temperatura de 25, 37 y 44 °C a pH 5.6, los valores de los perímetros (4.11, 3.9 y 4 µm) y áreas (3.23, 3.33 y 3.11 µm1) de canales fueron similares, mientras que los volúmenes disminuyeron (0.006, 0.007, 0 µm3). En el caso de los valles, el área fue disminuyendo ligeramente al incrementarse la temperatura (0.43, 0.44 y 0.40 µm2), y viceversa para los perímetros (6.6, 6.8 y 6.9 µm), mientras que los volúmenes fueron similares en las tres condiciones (0.10, 0.12 y 0.13 µm3) (Figura 5).
Las áreas de los canales a pH de 4.4 y 5.4 fueron de 1.43 y 1.47 µm2, con perímetros de 10.75 y 10.8 µm y un volumen de 0.005 µm3, para ambas condiciones. En cuanto a los valles, las áreas correspondieron a 1.2 y 0.99 µm2, manteniendo perímetros similares en ambos pHs (20.5 y 20.1 µm). De igual manera, los volúmenes medidos fueron similares, con 0.23 y 0.25 µm3, respectivamente (Figura 5).
Discusión y conclusiones
Las superficies a las cuales se adhiere C. albicans son principalmente membranas mucosas, piel, o sustratos abióticos usados en implantes médicos, similares a la superficie de placas Lab–Tek II empleadas en este estudio. C. albicans es un hongo dimórfico que tiene la habilidad de adaptarse a diferentes condiciones ambientales, ya que el microorganismo se adhiere y desarrolla polímeros extracelulares que lo proveen de una matriz estructural que facilita su sobrevivencia. Esta capacidad del microorganismo de formar las biopelículas a diferentes pHs y temperaturas, facilita la transferencia y proliferación rápida del hongo en muchos sitios in vivo e in vitro (Murillo et al., 2005) (Biasoli et al., 1999). En este estudio se utilizó medio RPMI 1640 como base para el crecimiento de C. albicans con un pH de 5.6 y a 37°C, estas condiciones permitieron la formación de biopelículas y el desarrollo de filamentos en las 4 y 8 h, así como a pH 4.4 y 37°C, con 24 h de crecimiento. En un estudio realizado por Kabli et al. (2006) se mostró que C. albicans no formó biopelículas en medio RMPI 1640 en pH de 4.4 hasta 7.4 a una temperatura de 34°C, aunque si se favoreció el crecimiento de las formas filamentosas. Dichos autores sugirieron que los pHs cercanos a la neutralidad fueron un factor determinante que no permitió la formación de las biopelículas de C. albicans, sin embargo en nuestro caso los pHs de 4.4, 5.4 y 5.6 permitieron la adherencia y formación de biopelículas maduras a las 24 h de incubación a 37°C. Otros estudios han demostrado que el pH óptimo para el crecimiento de C. albicans se encuentra en el intervalo de 4.5 a 5.6 (Ombrella et al., 2008).
En cuanto a las temperaturas evaluadas, a 44 °C se logró observar la etapa madura en la formación de biopelículas de C albicans. Esta característica podría estar relacionada con la presencia de una molécula de elevado peso molecular llamada farnesol, la cual se induce a 44° C y fue reportada por Hornby et al. (2001). Sin embargo, la búsqueda de esta molécula no se realizó en el presente trabajo.
Referente al análisis de las biopelículas mediante microscopía óptica (MO), el método fue muy limitado porque la amplificación de 1,000X no permitió una observación detallada de las estructuras superficiales, sin embargo este tipo de microscopía ayudó a comprobar que las biopelículas de C. albicans se formaron en las diversas condiciones de pH y temperatura, además de observar estructuras levaduriformes y en algunos casos hifas como las encontradas a las 4 y 8 horas en la cinética de crecimiento (37°C, pH 5.6), así como a 44°C y pHs de 4.4 y 5.6.
El empleo de soportes de vidrio (Lab–Tek II) para el desarrollo de las biopelículas de C. albicans y su posterior observación en el MFA, fue sugerido en un trabajo previo (Murillo et al., 2005). En dicho reporte, al usar MFA en el estudio de la fase temprana de formación de biopelículas de C. albicans, se observó la adherencia de las células al soporte de vidrio, la presencia de hifas y la formación de microcolonias, reportando también la presencia de canales de agua menores a 10 µm de diámetro con un valor promedio aproximado a 1 µm. Parte de los resultados de Murillo et al. (2005) y colaboradores concuerdan con el presente trabajo, sin embargo, en esta investigación se logró visualizar cada etapa de la formación de las biopelículas hasta su estado maduro, lo que proporcionó mayor información en cuanto a dimensiones de área, perímetro y volumen de los canales y valles. Además, las imágenes obtenidas por MFA permitieron observar las estructuras a 40,000X de amplificación y medir los parámetros celulares en las diversas etapas de la biopelícula, puesto que en las micrografías, la superficie de la biopelícula pudo analizarse en una imagen tridimensional.
La superficie celular de las biopelículas formadas en valores de pH de 4.4 a 5.4 no mostró diferencias significativas en las dimensiones de canales y valles. Los canales se observaron en las imágenes como poros o cavidades continuas que comunican a las diferentes partes de la biopelícula y las dimensiones de los valles indicaron la altura mínima o una tonalidad más oscura, incluso la presencia de hifas pudo observarse como una estructura cilíndrica de un color blanco a gris claro y el material polimérico extracelular se observó como una superficie de apariencia difusa. Es indiscutible que el microscopio de fuerza atómica posee ventajas muy importantes como lo es el poder de resolución a escala de nanómetros o subnanómetros; además, las imágenes pueden ser rotadas y analizadas con relativa facilidad, aunque la obtención de cada micrografías es muy laboriosa y requiere tiempo considerable (Silva Andrade et al., 2004). La MFA también ha sido reportada en estudios de pared celular y formación de biopelículas en C. parapsilosis, logrando analizar su adherencia sobre superficies biológicas o inertes (Méndez et al., 2006).
El estudio de la formación de biopelículas se ha realizado en otras especies de Candida mediante ensayos pioneros realizados por Hawser y Douglas en 1994, quienes utilizando colorimetría demostraron que varias especies de Candida pueden formar biopelículas, aunque C. albicans es la que las forma en mayor proporción. Los resultados del presente estudio demostraron la capacidad de C. albicans de desarrollar biopelículas bajo un intervalo amplio de pHs y temperatura. Asimismo, la utilización de la MFA permitió un análisis más detallado de las características superficiales de las biopelículas formadas por C. albicans en las diferentes condiciones ambientales evaluadas, lo que constituyó un estudio innovador en la biología de las biopelículas.
Agradecimientos
Al Laboratorio de Patogenicidad Microbiana del ICUAP, a Antonio Yánez Santos y Cristian Dionisio Román del Laboratorio de Microbiología Oral de la Facultad de Estomatología de la BUAP, así como a Eduardo Condado Picazo del Departamento de Diseño de la VEDC de la BUAP y al Laboratorio de Físico Química de Materiales del ICUAP.
Literatura citada
Alem, M., A. Fattani, L.J. Douglas, 2006a. Biofilm matrix of Candida albicans and tropicalis: chemical composition and role in drug resistance. Journal of Medical Microbiology 55:999–1008. [ Links ]
Alem, M., M.D. Oteef, T.H. Flowers, L.J. Douglas, 2006b. Production of tyrosol by Candida albicans biofilms and its role in quorum sensing and biofilm development. Eukaryotic Cell 5(10):1170–1179. [ Links ]
Anaissie, E.J., G.P. Bodey, H. Pinczowsi, 1993. Invasive candidiasis during granulocitopenia. Recent Results Cancer Research 132:137–145. [ Links ]
Arisoy, E.S., A.Correa, D.K. Seilheimer, S.L. Kaplan, 1993. Candida rugosa central venous catheter infection in a child. Journal of Pediatric Infectious Disease 12(11):961–963. [ Links ]
Baillie, G.S., L.J. Douglas, 1998. Iron– limited biofilms of Candida albicans and their suceptibility to amphotericin B. Journal of Antimicrobial Agents and Chemotherapy 42(8):2146–2149. [ Links ]
Baillie, G.S., L.J. Douglas, 1999. Role of dimorphism in the development of Candida albicans biofilms. Journal of Medical Microbiology 48(7):671–679. [ Links ]
Baillie, G.S., L.J. Douglas, 2000. Matrix polimers of Candida biofilms and their possible role in biofilm resistance to antifungal agents. Journal of Antimicrobial Chemotherapy 46(3):397–403. [ Links ]
Bandenhorts, L., P.L. Botha, J.V. Rensburg, 1991. The incidence of hospital fungal infections–yeast. South African Medical Journal 79:302–303. [ Links ]
Biasoli, M.S., M.E. Tosello, H. Bottai, C. Cuesta, H.M. Magaró, 1999. Efecto de la temperatura y el pH en la adherencia de Candida albicans "in vitro". Revista Iberoamericana de Micología 16:46–49. [ Links ]
Donlan, R.M., 2000. Role of biofilms in antimicrobial resistance. American Society for Artificial Internal Organs Journal 46(6):S47–S52. [ Links ]
Donlan, R.M., 2002. Biofilms: Microbial life on surfaces. Emerging Infectious Diseases 8(9):881–890. [ Links ]
Donlan, R.M., J.W. Costerton, 2002. Biofilms: survival mechanisms of clinically relevant microorganisms. Clinical Microbiology Reviews 15(2):167–193. [ Links ]
Douglas, L.J., 2003. Candida biofilms and their role in infection. Trends in Microbiology 11(1):30–36. [ Links ]
Hawser, S.P., L.J. Douglas, 1994. Biofilm formation by Candida species on the surface of catheter materials in vitro. Infection and Inmunity 62(3):915–921. [ Links ]
Hawser, S.P., L.J. Douglas, 1995. Resistance of Candida albicans biofilms to antifungal agents in vitro. Antimicrobial Agents and Chemotherapy 39(9):2128–2131. [ Links ]
Hornby, J.M., E.C. Jensen, A.D. Lisec, J.J. Tasto, B. Jahnke, R. Shoemaker, P. Dussault, K.W. Nickerson, 2001. Quorum sensing in the dimorphic fungus Candida albicans is mediated by farnesol. Applied and Environmental Microbiology 67(7):2982–2992. [ Links ]
Kabli, S.A., 2006. Morphogenesis of two Candida albicans strains as influenced by growth media, pH value and incubation temperature. American–Eurasian Journal of Agriculture and Environmental Science 1(2): 127–132. [ Links ]
Khun, D.M., J. Chandra, P.K. Mukherjee, M.A. Ghannoum, 2002a. Comparison of biofilms formed by Candida albicans and Candida parapsilosis on bioprosthetic surfaces. Infection and Inmunity 70(2):878–888. [ Links ]
Khun, D.M., T. George, J. Chandra, P.K. Mukherjee, M.A. Ghannoum, 2002b. Antifungal suceptibility of Candida biofilms: Unique efficacy of amphotericin B lipid formulations and echinocadins. Antimicrobial Agents and Chemotherapy 46(6):1773–1780. [ Links ]
Kotra, L.P., N.A. Amro, G.Y. Liu, G.S. Mobashery, 2000. Visualizing bacteria at high resolution. American Society for Microbiology News 66(11):675–681. [ Links ]
Lupetti, A., R. Danesi, M. Campa, M. Del Tacca, S. Kelly, 2002. Molecular basis of resistance to azole antifungals. Trends in Molecular Medicine 8(2):76–71. [ Links ]
Murillo, L.A., G. Newport, C.Y. Lan, S. Habelitz, J. Dungan, N. M. Agabian, 2005. Genome – wide transcription profiling of the early phase of biofilm formation by Candida albicans. Eukaryotic Cell 4(9): 1562–1573. [ Links ]
Reagan, D.R., M.A. Pfaller, R.J. Hollis, R.P. Wenzel, 1990. Characterization of the secuence of colonization and nosocomial candidemia using DNA finger printing and a DNA probe. Journal of Clinical Microbiology 28:2733–2738. [ Links ]
Riggle, P.J., K.A. Andrutis, X. Chen, S.R. Tzipori, C.A. Kumamoto, 1999. Invasive lesions containing filamentous forms produced by a Candida albicans mutant that is defective in filamentous growth in culture. Infection and Inmunity 67:3649–3642. [ Links ]
Shin, J. H., S.J. Kee, M.G. Shin, S.H. Kim, D.H. Shin, S.K. Lee, S.P. Suh, D.W. Riang, 2002. Biofilm production by isolates of Candida species recovered from nonneutropenic patients: comparison of bloodstream isolates with isolates from other sources. Journal of Clinical Microbiology 40:1244–1248. [ Links ]
Silva Andrade F., F. Chávez, T. Prutskii, A. Ilinski, 2002. Microscopía de fuerza atómica, control de la superficie de los semiconductores. Ciencia y Desarrollo 28 (163):68–77. [ Links ]
Ombrella, A. M., L.Racca, L. Ramos, 2008. Actividades proteinasa y fosfolipasa de aislamientos de Candida albicans provenientes de secreciones vaginales. Revista Iberoamericana de Micología 25(1):12–16. [ Links ]














