Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de micología
versión impresa ISSN 0187-3180
Rev. Mex. Mic vol.29 Xalapa jun. 2009
Contribuciones
Características morfológicas de 45 cepas de Microsporum canis
Morphologic characteristics of 45 Microsporum canis strains
Gabriela Moreno–Coutiño1*, María de la Paz Palomares2, Ramón Fernández–Martínez1 y Roberto Arenas1
1 Sección de Micología, Hospital General Dr. Manuel Gea González, SSA.
2 Clínica de Especialidades No. 4 de la Secretaría de Salud de la Ciudad de México.
* Autor para correspondencia:
Gabriela Moreno–Coutiño gmorenocoutino@gmail.com.
Recibido 16 de marzo 2009
Aceptado 1 de junio 2009.
Abstract
Dermatophytes are pathogen fungi of skin and its appendages. One of them, Microsporum spp. has micro and macroscopic characteristics mainly based on the shape and size of macrocon id ia and echinulations that allow the identification of the species. The macro and micromorphological characteristics of 45 M. canis strains were analized with the intention of classifying them into subspecies. All samples had a previous positive direct exam with KOH and were cultured in both Sabouraud dextrose agar with antibiotic and rice media. Thirty five percent grew by the second week. A white velvety colony with a yellowish color on the reversal side was the usual phenotype. Fifteen percent of cultures on rice media were negative. The typical M. canis morphology was seen in 81.1% and macroconidia had an average of 9.08 septa. Sixteen cases had a mixed morphology. Microsporum canis strains are easily identified in most cases, however, in atypical specimens, M. audouinii should be ruled out.
Key words: dermatophytes, Microsporum audouinii.
Resumen
Los dermatofitos son hongos que parasitan la piel y sus anexos. Uno de ellos, Microsporum spp., tiene características macro y microscópicas como forma y tamaño de macroconidios y equinulaciones que permiten su identificación entre las diferentes especies. Se analizaron estas características en 45 cepas de M. canis para intentar su clasificación en subespecies. Todas las muestras provenían de pacientes con un examen directo con KOH positivo y los cultivos se realizaron en agar dextrosa de Sabouraud con antibióticos y en un medio con arroz. El 35% de las cepas crecieron en dos semanas. Predominaron colonias blancas y vellosas con reverso amarillento. El 15% no crecieron en el medio con arroz. El 81.1% presentaron características típicas de M. canis y los macroconidios tuvieron en promedio 9.08 septos. En 16 casos las características morfológicas fueron variadas. Los cultivos de Microsporum canis se identifican fácilmente en la mayoría de los casos, sin embargo, en casos dudosos se debe considerar diagnóstico diferencial con M. audouinii.
Palabras clave: dermatofitos, Microsporum audouinii.
Introducción
Los dermatofitos son un grupo de hongos causantes de micosis superficiales que infectan la queratina de la piel y sus anexos. Se clasifican en tres géneros: Microsporum, Trichophyton y Epidermophyton.
La descripción del género Microsporum inició en 1843 cuando Gruby identificó M. audouinii. Años después, en 1902 Bodin describió M. canis, el cual ha recibido desde entonces varios sinónimos como M. felinum, M. equinum, M. lanosum, M. pseudolanosum y M. obesum, entre otros (Arenas, 2003; Arenas, 2008; Emmons et al., 1977).
Se han descrito varias especies, siendo las más conocidos: M. gallinae, M. fulvum, M. persicolor, M. praecox, M. cookei y M. audouinii.
La especie tipo es M. canis, un hongo zoofílico que se dice ha evolucionado gradualmente a través del tiempo por cambios en su nicho ecológico, ya que en un principio su habitat fue el suelo y después pasó a los animales domésticos y de ahí al hombre causando principalmente tiña de la cabeza. También puede ocasionar tiña de la piel lampiña y rara vez afecta pies y uñas (Viani et al. 2007).
Por su expresión fenotípica el género Microsporum se caracteriza por la presencia de macroconidios con paredes gruesas, además de la presencia de microconidios. La fase teleomorfa pertenece al género Arthroderma (antes Nannizzia) que es miembro de la familia Arthrodermataceae (Gräser et al., 2000).
De M. canis se han descrito tres subespecies. En 1954 Dimenna y Marples describieron la primera como M. canis var. distortum y en 1968 Rivalier y Badillet describieron M. canis var. pulverulentum. Algunos autores mencionan a M. canis var. obesum como otra subespecie, sin embargo no existe bibliografía que apoye su existencia (Badillet, 1975; Hoog et al. 2000).
Los dermatofitos crecen en los medios habituales de agar dextrosa Sabouraud con y sin antibióticos. Sin embargo, se conocen otros medios que son específicos para inducir la esporulación y de esta manera facilitar la identificación de la especie, como el medio de cultivo de arroz (Arenas, 2008; Kaszubiak, 2004; Rippon, 1988).
El objetivo de este estudio es comparar las características micro y macromorfológicas de las cepas de M. canis que se desarrollan en agar de Sabouraud con antibióticos y en medio de arroz.
Materiales y métodos
En la Sección de Micología del Hospital General "Dr. Manuel Gea González", se analizaron cepas de M. canis recolectadas entre marzo de 2002 y marzo de 2003. Las muestras provenían de la propia sección y de la Clínica de Especialidades No 4 de la Secretaría de Salud de la Ciudad de México y del Instituto Dominicano de Dermatología y Cirugía de Piel de la República Dominicana. En total se incluyeron 45 cepas provenientes de escamas de diferentes partes de la piel lampiña y pelos con diagnóstico clínico de tiña microspórica en humanos y algunas mascotas.
En todos los casos se confirmó el diagnóstico de tiña con un examen directo con hidróxido de potasio más dimetilsulfóxido (KOH–DMSO). Otra parte de la muestra fue sembrada en agar dextrosa de Sabouraud adicionado con antibióticos (Mycosel ®) incubados a 26 °C y observados durante 4 semanas. Después de este tiempo se registraron las características macroscópicas de las colonias; se tomó una parte de éstas para el estudio microscópico. De estas muestras, las identificadas como M. canis, fueron sembradas posteriormente en un medio de cultivo de arroz, el cual fue preparado con 20 g de gelosa, 20 g de arroz con cáscara y 1000 ml de agua destilada. (Arenas, 2008). Ambos medios fueron incubados a 26 °C durante 8 semanas. En los cultivos con crecimiento de colonias, se observaron y determinaron nuevamente sus características microscópicas. En ninguna cepa se practicó ureasa o prueba de órganos perforadores, ya que no se consideró necesaria.
Resultados
En los cultivos se observó crecimiento de las colonias desde los primeros 10 hasta los 45 días. El 35% de las cepas crecieron en las primeras dos semanas. De los 45 cultivos obtenidos de Mycosel ®, 7 no crecieron en el medio de arroz (15%). Dentro de las características de las colonias, todas fueron colonias blancas y vellosas con reverso amarillento, algunas con el tiempo tomaron un color beige y solo dos con reverso color durazno o salmón características de M. canis. El aspecto más frecuente de las colonias fue el velloso, aunque se identificaron algunas pulverulentas y otras aterciopeladas. En promedio, los macroconidios presentaron 9.08 septos, 9.02 las de cultivos de Mycosel ® y 9.15 los de cultivo de arroz, con un intervalo de 5 a 16 (Figura 1).

En 16 casos las características morfológicas fueron variadas. Cinco casos que crecieron en medio de arroz tenían características similares a las que presenta M. gallinae: macroconidios angostos con base delgada y punta roma, la mayoría con 5–6 septos con un máximo de 12 (Figura 2). En cuatro cultivos se encontraron datos parecidos a los observados en M. praecox. En un cultivo se observaron macroconidios en forma de cigarro como las observadas en M. persicolor y en otro los microconidios eran fusiformes y con los bordes redondeados como los observados en M. cookei.

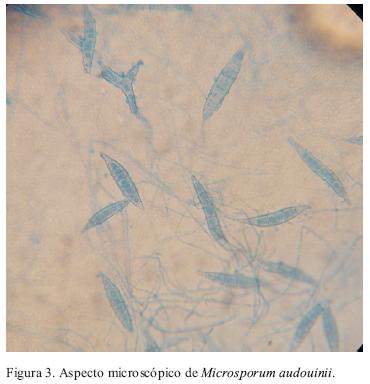
Tres casos tenían características similares a M. fulvum con macroconidios más delgados y entre 6–10 septos y otros tres similares a M. audouinii vs M. canis var. distortum (Figura 3). De éstos, en dos no se observó crecimiento en el medio de cultivo de arroz y los macroconidios fueron escasos o deformados. En éstos se confirmó la identificación de M. audouinii por biología molecular. El caso restante presentó macroconidios en forma de mazo con 16 septos.
De las 17 cepas a las que se les realizaron estudios de biología molecular, solamente hubo crecimiento en 11 de ellas. En nueve el resultado fue M. canis y en dos M. audouinii.
Conclusiones
Las características macro y microscópicas de los cultivos fueron en su mayoría compatibles con las descripciones clásicas de cepas de M. canis.
Esto se corroboró en la mayoría de los casos con la morfología de las colonias tanto macro como microscópicamente (81.1%). El resto de los cultivos tuvo morfología predominantemente de M. canis excepto en dos casos donde el diagnóstico microscópico en forma retrospectiva era compatible y por biología molecular fue confirmado como M. audouinii (2.2%).
El medio de arroz estimula el crecimiento de M. canis y se emplea con la intención de facilitar su identificación, sin embargo, hay una gran variedad micromorfológica que obliga a considerar el diagnóstico diferencial con M. gallinae, M. praecox, M. persicolor, M. cookei o M. fulvum. Sin embargo estos dermatofitos prácticamente no se aislan en México y presentan características epidemiológicas y macromorfológicas que permiten su mejor identificación.
Las colonias de M. canis se caracterizan por crecer rápidamente entre 7 y 14 días. Es un hongo filamentoso blanco; las colonias son planas, vellosas o algodonosas; este aspecto está determinado por la abundancia de micelio. El color varía con la edad del cultivo y va de blanco a café amarillento y el reverso es amarillo–naranja o amarillo–rojizo. Al estudio microscópico presenta abundancia de macroconidios fusiformes de doble pared, de extremos afilados, con o sin equinulaciones. Miden de 7–20 μm de ancho por 30–60 μm de largo y presentan entre 6 y 12 septos, aunque Rippon refiere que pueden ser hasta quince.
Las diferencias entre las especies consisten en el color de las colonias, la forma de los macroconidios, presencia o ausencia de equinulaciones, microconidios y las hifas que en algunos casos como en M. persicolor tienen forma de espiral; además, M. canis se distingue del resto porque crecen en medio de cultivo de arroz que estimula la producción de macroconidios.
Por los datos observados en este estudio podemos concluir que los cultivos de especies de Microsporum comparten similitudes morfológicas, y aunque habitualmente no se plantea la diferenciación con M. audouinii, esta especie constituye el principal diagnostico diferencial.
Las técnicas de biología molecular como la ITS, PCR (Polymerase Chain Reaction) y el análisis de AFLP (Amplified Fragment Length Polymorphism), entre otras, se emplean para la clasificación de las especies y subespecies. Estas técnicas son particularmente útiles cuando las colonias muestran características ambiguas o tienen similitudes con varias especies (Gräser et al., 2000) sin embargo, no están al alcance de todos los laboratorios de micología por lo que con este estudio mostramos que la identificación microscópica de las características morfológicas de los cultivos tienen altos porcentajes de concordancia (90%) con pruebas confirmatorias como lo son las de biología molecular.
Literatura citada
Arenas, R., 2003. Dermatología. Atlas, diagnóstico y tratamiento. 3ª Ed. McGraw Hill, México, D.F. [ Links ]
Arenas, R., 2008. Micología médica ilustrada. 3a Ed. Mc Graw Hill, México, D.F. [ Links ]
Badillet, G., 1975. Les Dermatophytes. Atlas clinique et biologique. Varia, Paris. [ Links ]
Emmons, C.W., CH. Binford, J.P. Utz, K.Chung. 1977. Medical Mycology. 3rd Ed. Lea & Febiger, Philadelphia. [ Links ]
Gräser, Y., A.F. Kuijpers, M. El Fari, W. Presber, G.S. de Hoog, 2000. Molecular and conventional taxonomy of the Microsporum canis complex. Medical Mycology 38:143–153. [ Links ]
Hoog, G.S., J. Guarro, J. Gené, M.J. Figueras, 2000. Atlas of clinical fungi. 2nd Ed. Centraalbureau voor Schimmelcultures/Universitat Rovira i Virgili, Amsterdam. [ Links ]
Kaszubiak, A., S. Klein, G.S. de Hoog, Y. Gräser, 2004. Population structure and evolutionary origins of Microsporum canis, M. ferrugineum y M. audouinii. Infectious Genetic Evolution 4:179–86. [ Links ]
Rippon, J.W., 1988. Medical Mycolgy. The Pathogenic Fungi and the Pathogenic Actinomycetes. 3rd Ed. Saunders. Philadelphia. [ Links ]
Viani, F.C., P.R. Cazares–Viani, I.N. Gutierrez–Rivera, E. Goncalves da Silva, C. Rodrigues Paula, W. Gambale, 2007. Extracellular proteolytic activity and molecular analysis of Microsporum canis strains isolated from symptomatic and asymptomatic cats. Revista Iberoamericana de Micología 24:19–23. [ Links ]














