Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de micología
versión impresa ISSN 0187-3180
Rev. Mex. Mic vol.26 Xalapa jun. 2008
Contribuciones
Crecimiento micelial de cepas silvestres nativas de Lepista nuda, en medios de cultivo con diferentes suplementos orgánicos
Mycelial growth of Lepista nuda native wild strains on culture media with different organic supplements
Rigoberto Gaitán–Hernández1,*, Iván Báez Rodríguez2
1 Unidad de Micología, Instituto de Ecología, A.C., A.P. 63 Xalapa, 91000 Veracruz, México.
2 Instituto Tecnológico del Altiplano de Tlaxcala, Km. 7.5 Carretera Federal San Martín–Tlaxcala, San Diego Xocoyucan, Tlax., México. C.P. 90122
* Autor para correspondencia: rigoberto.gaitan@inecol.edu.mx
Recibido 15 de noviembre 2007
Aceptado 15 de junio 2008
Resumen
Se evaluó el crecimiento micelial de cuatro cepas de Lepista nuda, en medio de cultivo con diferentes suplementos orgánicos (bagazo de coco, bagazo de caña, aserrín de encino), pH (6, 7, 8) y temperaturas (20°C, 25°C). Se registró la tasa de crecimiento (Kt) de los micelios. También se consideró la producción de biomasa y concentración de fenoles en cultivo líquido de encino, bajo dos condiciones de intercambio gaseoso: frascos de cultivo con filtro (CF) y frascos sin filtro (SF). En agar hubo una influencia significativa al suplemento y cepa utilizados. El mayor crecimiento se observó en agar con encino a 20°C y 25°C (0.41 7 y 0.410 mm d–1, respectivamente). En general, no hubo diferencias significativas entre las temperaturas y se observó la más alta Kt a pH 7. Hubo un incremento significante de la biomasa (4.10 mg mL–1), 1.8 veces más que en SF (2.29 mg mL–1) a los 13 días de incubación en cultivo líquido, en el tratamiento CF. Bajo las dos condiciones, los fenoles disminuyeron respecto a su testigo, en CF la concentración (0.79 mMol L–1) decreció menos que en SF (0.620 mMol L–1). No hubo una correlación entre la producción de biomasa y el contenido de fenoles en cultivo líquido.
Palabras clave: pie azul, evaluación in vitro, bagazo de coco, bagazo de caña de azúcar, aserrín de encino.
Abstract
Mycelial growth of four strains of the wood blewit mushroom Lepista nuda on culture media with different organic supplements (coconut bagasse, sugarcane bagasse, oak sawdust), pH (6, 7, 8) and temperature (20°C, 25°C) was evaluated. Linear growth rate (Kt) on agar medium was measured. Biomass production of mycelia and phenolic content on oak liquid culture, under two different gaseous interchange treatments, culture bottles with filter (F) and culture bottles without filter (WF), also were observed. Results showed a significant influence of the supplements and strains on agar. The best growth responses were observed on oak agar medium at 20°C and 25°C (0.417 and 0.410 mm d–1, respectively). For both temperatures, in all treatments no differences significantly were observed. The highest Kt by L. nuda strains was registered at pH 7. On liquid culture, the F treatment significantly increased the biomass production (4.10 mg mL–1) by almost 1.8 times compared to the WF treatment (2.29 mg mL–1) at 13 days of incubation. Phenols concentration decreased in both treatments but in F treatment the phenols concentration (0.79 mMol L–1) decreased less than WF (0.62 mMol L–1). No correlation between the biomass production and phenolic content was observed.
Key words: Blewit, in vitro evaluation, coconut bagasse, sugarcane bagasse, oak powder.
Introducción
Lepista (Fr.) W.G. Sm., es un género con una amplia distribución mundial, se le cita de América, Europa, Asia, África y Australia (Gamundi y Horak, 1993; Stamets, 1993). Lepista nuda (Bull.:Fr.) Cooke, es la especie más estudiada, comúnmente se le conoce como "pie azul" o "blewit" (Guinberteau et al., 1989 ; Stamets, 1993). Contiene más del 40% de proteína (g/1 00g secos) y alto valor energético (Colak et al., 2007), además posee propiedades antitumorales, antibacteriales, antioxidantes, vitamina B1 y varios minerales (Dighe y Agate, 2000; Dulger et al., 2002; Turkekul et al. 2004; Colak et al., 2007). Se le considera un hongo medicinal, ya que en investigaciones previas se ha visto que el extracto acuoso del micelio impide el crecimiento de algunas bacterias, inhibe el sarcoma 180 y el carcinoma de Ehrlich al 90 y 100%, respectivamente (Ying et al., 1987) y actúa como hipoglucémico (Volz, 2000).
L. nuda es una especie de gran aceptación en Europa y actualmente está catalogada como una de las especies más populares. Una encuesta realizada en Francia, reconoce que un 45% de la población ha consumido este hongo (Lannoy, 1982) y aunado a sus numerosas propiedades organolépticas, lo coloca con un potencial económico considerable (Guinberteau et al., 1989; Stott et al., 2005).
En México se le encuentra de manera silvestre en bosques de encino–pino y es objeto de recolección, venta y consumo en mercados populares (Guzmán, 1990; Díaz–Moreno et al., 2005). Esta especie es susceptible de ser cultivada utilizando las técnicas empleadas para el champiñón (Agaricus). Por la relevancia de su producción en otros países (Guinberteau et al., 1989 ; Guinberteau et al. 1991; Chen et al, 2001; Desrumaux et al., 2004), L. nuda representa una alternativa alimenticia viable en México, dada la aceptación en el consumo popular y fuente natural de proteínas.
A pesar que para su producción se utiliza un sistema de cultivo semejante al de Agaricus, son necesarios más estudios de L. nuda enfocados a encontrar los parámetros de crecimiento óptimos para cepas silvestres mexicanas. Varios experimentos se han realizado sobre las características de desarrollo de este hongo (Wright y Hayes, 1978; Colpaert y Van Tichelen, 1996; Stott et al., 1996; Stott, 1998). Sin embargo, no han sido reportados estudios comparativos de parámetros de crecimiento in vitro, sobre las especies que crecen en diferentes regiones de México.
Por lo anterior, con la finalidad de optimizar un medio de cultivo para L. nuda, se evaluó el efecto de medios suplementados con diferentes fuentes de carbono, pH y temperatura, en el crecimiento micelial de cuatro cepas silvestres de este hongo. También, seleccionar un suplemento alternativo de propagación in vitro. El medio de cultivo con compost utilizado para la producción de Agaricus sp. ha sido altamente recomendado para el cultivo de L. nuda (Stott, 1998), sin embargo, la disponibilidad del sustrato en México es una limitante. También se consideró la concentración de fenoles en medio de cultivo y la capacidad de producción de biomasa.
Materiales y métodos
Material biológico
Para todas las pruebas, se trabajó con cuatro cepas de Lepista nuda, depositadas en el Cepario del Instituto de Ecología, A. C. (Xalapa, México) y registradas como IE–607, IE–605, IE–658 e IE–741. Tres de las cepas son silvestres mexicanas y los basidiomas de los aislamientos se encuentran depositados en el Herbario XAL (Instituto de Ecología, A.C., Xalapa, México). La cepa IE–658 es silvestre de origen francés y fue donada por el INRA de Bordeaux, Francia. Todas las cepas se mantuvieron en medio de agar con extracto de malta (AEM) (BIOXON, EUA) a 25°C.
Medios de cultivo
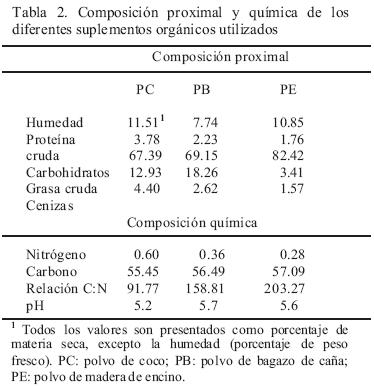
Para la evaluación del crecimiento micelial, se elaboraron tres medios de cultivo suplementados y un testigo. Los primeros se prepararon con 0.5% de extracto de malta, 1.2% de agar bacteriológico, 0.2% de extracto de levadura y 2.5% de suplemento en 1 L de agua destilada. A cada medio se le agrego el suplemento a evaluar: polvo de bagazo de coco (APC), polvo de bagazo de caña (ABC) y polvo de madera de encino (APE). El testigo se preparó con 0.5% de extracto de malta y 1.2% de agar bacteriológico en 1 L de agua destilada (AEM). Cada suplemento se convirtió en polvo (partícula fina), con sustrato seco en un molino eléctrico BRAUN. Los medios se esterilizaron durante 15 min a 121°C. Una vez fríos, se vertieron 25 mL a cajas de Petri (90 mm x 15 mm) y se inocularon con un fragmento de agar con micelio (implante) de 0.8 mm (Ø) de cada una de las cepas crecidas en AEM durante 20 días. Posteriormente las cajas inoculadas se incubaron en oscuridad a 20 y 25°C durante 20 días. En el periodo de incubación se midió el diámetro micelial para estimar la tasa de crecimiento (Kt), la cual se calculó con la función de crecimiento lineal y=kt x + c (donde y es la distancia, x es el tiempo y c el factor constante) y se expresó en milímetros por día (mm d–1) (Zeravakis et al., 2001). El crecimiento se registró en dos ejes cartesianos trazados sobre la tapa de la caja, tomando como intersección el centro del implante.
Los suplementos orgánicos se analizaron para obtener las cenizas, proteína, carbohidratos, grasa, carbono y nitrógeno, de acuerdo a las técnicas descritas en the Official Methods for Analysis, Association of Official Analytical Chemists (1976) y Technical Manual for Feed Analysis, Japan (2000).
Evaluación del pH
Se evaluó el crecimiento de las cuatro cepas de Lepista en APE, ajustado a tres niveles diferentes de pH inicial, con la finalidad de determinar el efecto de esta condición en la Kt.
El pH inicial se ajustó a 6, 7 y 8 antes de esterilizar el medio. Para ello se le añadió una solución de fosfato de sodio dibásico (Na2H2 PO4) (0.066 M) y fosfato de potasio monobásico (KH2PO4) (0.066 M). El medio se esterilizó durante 15 min a 121 °C y posteriormente se colocaron 20 mL en cajas de Petri. El medio se inoculó con un implante de Lepista colocado en el centro de la caja. Las cajas se incubaron en oscuridad a 25°C y se estimó la Kt como previamente fue descrito.
Caracterización morfológica
Las cuatro cepas se hicieron crecer en APE a pH 7, con la finalidad de observar las diferencias morfológicas entre las cepas bajo las mismas condiciones. Para ello se colocó un implante en un extremo de la caja de Petri y se incubó a 25°C durante 20 días en completa oscuridad. Al término del periodo de incubación, se describió el color (Locquin, 1957), la textura y la densidad de los micelios (Stalpers, 1978; Gaitán–Hernández, R., 2000). Se realizaron seis repeticiones por cepa.
Producción de biomasa y concentración de fenoles
Para estimar la producción de la biomasa micelial de Lepista y la concentración de fenoles en el medio de cultivo, se colocaron en frascos de vidrio de 100 mL con tapa de rosca, 10 mL de medio líquido de encino (1% de extracto de malta, 0.5% de extracto de levadura, 1 L de infusión de madera de encino al 2%, pH 7), se esterilizaron durante 20 min a 121°C. Se utilizó el medio líquido para facilitar la cuantificación de ambos parámetros. El medio se inoculó con un implante de cada cepa crecida en AEM durante 20 días. Se realizaron dos tratamientos con diferente intercambio gaseoso. El primero consistió en cerrar el frasco de cultivo con la tapa de rosca, condición sin filtro (SF) y en el segundo tratamiento, al frasco se le colocó, como tapa, un filtro de papel Whatman N° 5 (Tamaño de poro de 2.5 µm), condición con filtro (CF). La incubación fue durante 13 días a 25°C en completa oscuridad.
Para estimar la biomasa micelial producida, el cultivo se filtró con papel Whatman No. 1 (Tamaño de poro de 11 µm), con la finalidad de separar el micelio del medio de cultivo. El papel filtro con el micelio se secó a 50°C durante 24 h, hasta alcanzar peso constante. La biomasa se estimó por diferencia de peso entre las muestras húmedas y secas, expresándose como índice entre los mg de micelio y mL de medio de cultivo (Salmones y Mata, 2005).
Para la cuantificación de fenoles, se siguió el método de Box (1983), adaptado por Mata et al. (1997), con el uso del reactivo Folin Ciocalteu (Sigma). Para ello, se utilizó el medio líquido donde previamente creció L. nuda durante 13 días. Las muestras se leyeron en espectrofotómetro (Spectronic Genesis 5) a 750 nm y los resultados se expresaron en mMol de fenoles hidrosolubles por litro de solución.
Diseño experimental y análisis estadístico
Se aplicó un diseño completamente al azar con un arreglo factorial para los valores de tasa de crecimiento micelial y biomasa micelial producida. Se probaron seis muestras en la tasa de crecimiento micelial (medios de cultivo suplementados y pH) y cuatro en la producción de biomasa, cuantificación de fenoles y análisis químico. Se realizó un análisis de varianza a todos los valores y una comparación de medias, de acuerdo a la prueba de rangos múltiples de Tukey (p<0.05).
Resultados y Discusión
Crecimiento micelial en los medios de cultivo suplementados
Los resultados de la tasa de crecimiento micelial (Kt) logrado por las cepas de Lepista en los diferentes medios de cultivo se presentan en la Tabla 1. Se observa que a 20 y 25°C, la mayor Kt la presentó la cepa nativa mexicana IE–741 en APE, con 0.543 y 0.544 mm d–1, respectivamente, con diferencia estadística (p<0.05) al resto de las cepas en el mismo medio. Sin embargo, en los promedios por cepa, la IE–607 e IE–658 fueron las mejores, en 20 y 25°C, respectivamente. Estas cepas fueron significativamente diferentes (p<0.05) a las otras dos. En el promedio por medio de cultivo a 20°C de incubación, el micelio se desarrolló más rápidamente en APE (0.417 mm d–1), significativamente semejante al crecimiento en ABC (p<0.05), mientras que a 25°C, también el APE fue el mejor (0.410 mm d–1), pero sin diferencia estadística al testigo (AEM) (0.371 mm d–1). En general, no hubo cepas con una Kt similar en los diferentes medios suplementados en una misma temperatura, excepto la IE–605 en AEM y APE a 20°C, sin embargo, se presentaron cepas con una Kt significante (p<0.05) en el medio de cultivo, evaluadas bajo diferente temperatura. Lo anterior se observó con la cepa silvestre de origen francés IE–658, cuya Kt fue similar en las dos temperaturas, en cada uno de los medios de cultivo evaluados. Lo mismo sucedió con la cepa IE–741 en ABC y APE (Tabla 1). El análisis estadístico de los datos demostró que no hay diferencia significativa (p>0.05) entre las temperaturas, lo que coincide con Wrigth y Hayes (1978), quienes señalaron un buen desarrollo de Lepista a temperaturas de incubación de 22 a 25 °C. Así mismo, Stott (1998) citó una temperatura de 25°C como la óptima para el crecimiento de L. nuda en diferentes medios de cultivo.
Con base en la Kt , el polvo de encino en el medio de cultivo favoreció (p<0.05) el desarrollo de L. nuda y el polvo de coco lo disminuyó (Tabla 1). Anteriormente, Stott et al. (1996), afirmaron que cepas australianas de Lepista se desarrollan bien en medio con extracto de malta agar y levadura al 2%. Esto es apoyado con lo reportado por Wrigth y Hayes (1978), quienes observaron un buen desarrollo de micelio de Lepista en un medio enriquecido con caseína hidrolizada o con peptona. Ellos también demostraron una estimulación en el crecimiento, debido a la presencia de algunas vitaminas y macerados de hojas de coníferas, lo que prueba el efecto positivo en el crecimiento de este hongo en medios suplementados. Las cepas probadas, mostraron un mayor crecimiento en el medio con polvo de encino, este suplemento si tuvo un efecto positivo en el desarrollo de cada cepa, posiblemente favorecido por la alta relación C:N y carbohidratos presentes. Hubo una cantidad menor de estos elementos en polvo de coco, lo que pudo influir en un menor crecimiento micelial (Tabla 1, 2). El medio de cultivo con compost utilizado para la producción de Agaricus sp. ha sido recomendado para el cultivo de L. nuda (Stott, 1998), sin embargo, en ensayos preliminares realizados durante este estudio (datos no mostrados), las cepas nativas mexicanas no tuvieron buen desarrollo, además hubo un alto grado de contaminación. Por otra parte, la disponibilidad de este sustrato en México es una limitante.
Efecto del pH en el crecimiento micelial
El efecto del pH en la Kt de las cepas de Lepista en APE incubadas a 25°C, se presentan en la Figura 1. Hubo crecimiento micelial de las cepas en los tres niveles de pH evaluados (6,7, 8). Sin embargo, la mayor Kt lo registraron las cepas IE–605 (4.235 mm d–1), IE–658 (5.477 mm d–1) e IE–741 (4.210 mm d–1) a pH 7 y la IE–658 (4.828 mm d–1) a pH 6. Las cepa IE–741 fue significativamente similar (p>0.05) a pH 6 y 7, lo que indicó una tolerancia de la misma a un intervalo mayor de pH. El promedio por cepa mostró a la IE–658 como la de mejor desarrollo, independiente del pH presente en el medio de cultivo. La Kt promedio lograda por esta cepa (4.343 mm d–1) fue superior (p<0.05), a las otras tres. El valor promedio reveló que el pH 7 fue el óptimo para el crecimiento de L. nuda, con una Kt de 3.804 mm d–1, significativamente diferente al pH 6 y 8. Este último pH fue el que menos favoreció el desarrollo micelial de las cepas evaluadas. Wrigth y Hayes (1978) señalaron un pH de 6 a 7 como óptimo para esta especie. Sin embargo, el análisis estadístico de los valores promedio aquí obtenidos, demostraron una diferencia significativa (p<0.05) entre los pH probados. Por otra parte, Colpaert y Van Tichelen (1996) encontraron un pH de 6 como óptimo para L. nuda durante la descomposición de hojarasca de Haya en condiciones experimentales. Dighe y Agate (2000), mencionaron que la mayor actividad de las sustancias antibacteriales presentes en L. nuda se registra a un pH de 5.2, por lo que las cepas evaluadas, probablemente soporten valores de pH menores a los aquí probados. Así también, Stott et al. (1996) y Stott (1998), han citado un pH favorable de 5 a 7 para el desarrollo de cepas comerciales de Lepista. Sin embargo, en este trabajo se observó un menor crecimiento de las cepas nativas silvestres a pH 6 que a pH 7, por lo que no se evaluaron valores de pH menores. Con base en la Kt, el pH 7 favoreció (p<0.05) el desarrollo de L. nuda y el pH 8 lo perjudicó (Figura 1).
Características morfológicas de los micelios de L. nuda en medio de cultivo
La morfología de los micelios de las cuatro cepas de L. nuda en APE, fue similar. En general, el micelio fue de color azul cielo (B–05) a azul brillante (B–10), de aspecto rastrero y en relieves y con una densidad de regular a alta, de acuerdo a Gaitán–Hernández (2000). Estas características concuerdan con lo citado por Stamets (1993) y Stamets y Chilton (1983), para esta especie. La evaluación de la morfología micelial se llevó a cabo utilizando el APE, ya que fue el medio con mejor desarrollo micelial (Tabla 1).
Producción de biomasa de Lepista y concentración de fenoles en el medio, en respuesta al intercambio gaseoso
Los resultados de la producción de biomasa y concentración de fenoles se observan en la Tabla 3. Las cepas de L. nuda cultivadas en medio líquido de encino bajo dos condiciones, con filtro (CF) y sin filtro (SF), produjeron un promedio de 2.29 mg mL–1 en la condición SF y 4.10 mg mL–1 en la condición CF, lo que representó 1.8 veces más que en SF. Las cepas silvestres mexicanas IE–607 e IE–605, fueron la de mayor biomasa en la condición SF (3.62 mg mL–1) y CF (4.71 mg mL–1), respectivamente. Por otra parte, la IE–741 presentó la menor cantidad de biomasa en ambas condiciones, con 2.3 3 mg mL–1 en SF y 3.56 mg mL–1en CF. En SF no hubo diferencias estadísticas (p>0.05) entre la cepa con mayor biomasa (IE–607) y la silvestre mexicana (IE–605) y la extranjera (IE–658), mientras que en CF, la cepa con mayor biomasa (IE–605) fue significativamente semejante (p>0.05) a la IE–607. En general, hubo una producción de biomasa similar entre las cepas desarrollas en el medio de cultivo, dentro de cada condición, pero entre ellas se observó una significante diferencia estadística en los valores obtenidos. La mayor disponibilidad de oxígeno en la condición CF, favoreció la producción de biomasa.
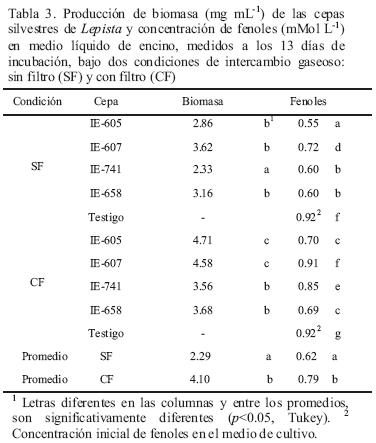
Por otra parte, el contenido fenólico del medio disminuyó en todas la cepas, respecto al testigo, en ambos tratamientos (p<0.05) (Tabla 3). En el experimento se consideró la medición de fenoles sólo al cultivo testigo y después de 13 días de incubación, motivado por el lento crecimiento del hongo; además con la finalidad de registrar una marcada diferencia de la concentración entre ambas mediciones. En general, los fenoles decrecieron de 0.92 mMol L–1 (testigo) a 0.62 mMol L–1 (3 2.6%) en la condición SF y a 0.79 mMol L–1 (13.8%) en la condición CF, con diferencia estadística (p<0.05) entre ambas. En SF, la cepa IE–605 tuvo el mayor efecto sobre los fenoles, con una disminución respecto al testigo del 39.71%; mientras que en CF fue la IE–658, con una disminución del 24.44%, estadísticamente similar a la IE–605 (Tabla 3). Este comportamiento de Lepista en disminuir la concentración de fenoles en el medio de cultivo durante su crecimiento, fue similar al citado por Salmones y Mata (2005) y Gaitán–Hernández et al. (2006), en especies de Pleurotus y Lentinula.
En la condición SF, se observó una menor concentración de fenoles en el medio, así también una baja producción de biomasa fúngica. Por una parte, el hongo fue capaz de neutralizar los efectos tóxicos causados por los monómeros fenólicos presentes, pero fue deficiente en la formación de células fúngicas. Lo anterior coincide con lo encontrado por Salmones y Mata (2002, 2005) y Mata y Pérez–Merlo (1999), en estudios realizados con especies de Lentinula y Pleurotus, en donde, la colonización del hongo en pulpa de café, durante los primeros días, estuvo más relacionada con la destoxificación del sustrato que con el incremento de la biomasa micelial. Por su parte, el análisis estadístico estableció que no existe correlación entre la concentración de fenoles en el medio y la producción de biomasa, bajo las condiciones evaluadas.
En conclusión, no se observaron diferencias significativas entre las temperaturas de incubación, reflejo de la tolerancia de las cepas silvestres de L. nuda al intervalo probado aquí. Además, bajo las condiciones de cultivo evaluadas, las cepas presentaron su mejor desarrollo entre el pH 6 y pH 7. En general, las cepas de Lepista, tuvieron la capacidad de aprovechar las fuentes energéticas para el crecimiento micelial y producción de biomasa, especialmente cuando al medio de cultivo se le aplicó polvo de madera de encino. En el presente estudio, se demostró la capacidad adaptativa de las cepas a todos los medios de cultivo probados, pero significativamente al suplementado con encino. Estos resultados dan a conocer los parámetros favorables de desarrollo micelial in vitro de cepas silvestres nativas de L. nuda y aportan la información para realizar los procesos de manipulación de germoplasma de esta importante especie en México.
Agradecimientos
Los autores expresan su agradecimiento a la M. en C. Dulce Murrieta y M. en C. Rosalía Pérez Merlo, del Instituto de Ecología, por su asistencia técnica durante el desarrollo de la presente investigación. Al Dr. Jean–Michel Savoie, del INRA de Bordeaux, Francia, se le agradece por la donación de la cepa. Asimismo, expresan su gratitud a la M. en C. Aracelly Vega, de la Facultad de Química de la Universidad Autónoma de Chiriquí, en Panamá, por su valiosa ayuda en el análisis químico. Finalmente, al Instituto de Ecología, A.C. y al Consejo Nacional de Ciencia y Tecnología (CONACyT) por proporcionar el apoyo financiero.
Literatura citada
AOAC., Official Methods of Analysis of the Association of Official Analytical Chemists, 12th ed; AOAC: Washington, DC, 1976. [ Links ]
Box, J. D., 1983. Investigation of the Folin Ciocalteu's reagent for determination of polyphenolic substances in natural waters. Water Research 17:501–525. [ Links ]
Chen, M.H., J. T. Peng, J.T. Chen, 2001. Study on the culture improvement of Lepista nuda (Bull.:Fr.) Cooke. Journal of Agriculture and Research of China 50:12–21. [ Links ]
Colak, A., Y. Kolcuoglu, E. Sesli, O. Dalman, 2007. Bichemical composition of some Turkish fungi. Asian Journal of Chemistry 19: 2193–2199. [ Links ]
Colpaert, J.V., K.K. Van Tichelen, 1996. Decomposition, nitrogen and phosphorus mineralization from beech leaf litter colonized by ectomycorrhizal or litter–decomposing basidiomycetes. New Phytologist 134:123–132. [ Links ]
Desrumaux, B., P. Sedeyn, M. Demeulemeester, A. Calus, 2004. Growing Lepista nuda: a summary of three years of research and experience. In: Romaine, C.P., C.B. Keil, D.L. Rinker, D.J. Royse (eds.), Science and Cultivation of Edible Medicinal Fungi. The Pennsylvania State University, Penn State. pp. 273–280. [ Links ]
Díaz–Moreno, R., J.G. Marmolejo, R. Valenzuela, 2005. Flora micológica de los bosques de pino–encino en Durango, México. Ciencia UANL 8: 362–369. [ Links ]
Dighe S., A. D. Agate, 2000. Antibacterial activity of some Indian mushrroms. International Journal of Medicinal Mushrooms 2: 141–150. [ Links ]
Dulger, B., C.C. Ergul, F. Gucin, 2002. Antimicrobial activity of the macrofungus Lepista nuda. Fitoterapia 73: 695–697. [ Links ]
Gaitán–Hernández, R., 2000. Obtención de de cepas de Neolentinus suffrutescens por entrecruzamiento, su caracterización in vitro y producción de cuerpos fructíferos a nivel planta piloto. Revista Iberoamericana de Micología 17:20–24. [ Links ]
Gaitán–Hernández, R., M. Esqueda, A. Gutiérrez, A. Sánchez, M. Beltrán–García, G. Mata, 2006. Bioconversion of agrowastes by Lentinulaedodes: the high potencial of viticulture residues. Applied of Microbiology and Biotechnology 71:432–439. [ Links ]
Gamundi, I.J., E. Horak, 1993. Fungi of the Andean–Patagonian Forests. Vázquez Manzzini Editores, Buenos Aires. [ Links ]
Guinberteau, J., J. M. Olivier, M.R. Bordaberry, 1989. Données récentes sur la culture des "pieds bleus" (Lepista sp.). Revue Horticole 298: 17–22. [ Links ]
Guinberteau, J., J.M. Olivier, M.T. Tanne, 1991. Improvement of Lepista species cultivation, technical factors and selection of strains. In: Maher, M.J., A.A. Balkema (eds.), Mushroom Science XIII, Rotterdam. pp. 615–621. [ Links ]
Guzmán, G., 1990. Identificación de los hongos. Ed. Limusa, México, D.F. [ Links ]
Japan Livestock Technology Association, Technical Manual for Feed Analysis Japan, 2000. [ Links ]
Lannoy, G., 1982. Enquête sur la consommation des champignons. Bulletin de la Société My cologique de France 3: 7–15. [ Links ]
Locquin, M. 1957. Chromotaxia code mycologique et pédologique des couleurs. Terreauy Freres 53. Paris. [ Links ]
Mata, G., R. Pérez–Merlo, 1999. Selección de cepas del shiitake Lentinulaedodes, para su cultivo en pulpa de café. In: San Blas, G., T. Iturriaga (Comps.), Proc. 3rd Latin American Mycological Congress, Caracas, p. 78. [ Links ]
Mata, G., J.M. Savoie, P. Delpech, 1997. Variability in laccase production by micelia of Lentinula boryana and Lentinula edodes in the presence of soluble lignin derivatives in solid media. Material und Organismen 31: 109–122. [ Links ]
Salmones, D., G. Mata, 2002. Detection of extracellular enzymes produced by Pleurotus spp. grown on coffee pulp. In: Sánchez J.E., G. Huerta, E. Montiel (eds.), Mushroom Biology and Mushroom Products. Universidad Autónoma de Morelos, Cuernavaca. pp. 213–219. [ Links ]
Salmones, D., G. Mata, 2005. Efecto de la presencia de compuestos solubles de lignina y fenoles sobre la producción de lacasa y biomasa en cultivos de Pleurotus spp. Revista Mexicana de Micología 21: 63–69. [ Links ]
Stalpers, J. A., 1978. Identification of wood–inhabiting Aphyllophorales in pure culture. Stud. Mycol. 16:1–248. [ Links ]
Stamets, P., 1993. Growing Gourmet and Medicinal Mushrooms. Ted Speed Press, Berkeley. [ Links ]
Stamets, P., J.S. Chilton, 1983. The Mushroom Cultivator a Practical Guide to Growing Mushrooms at Home. Agarikon Press, Olympia. [ Links ]
Stott, K., 1998. Characteristics of Australian edible fungi in the genus Lepista and investigation into factors affecting cultivation. Tesis de Doctorado, University of Western Sydney Hawkesbury, Sydney. [ Links ]
Stott, K., A. Broderick, T. Nair, 1996. Investigation into cultivation parameters for Australian species of Lepista. In: Royse, D.J. (ed.), Mushroom Biology and Mushroom Products. Penn State University. pp. 285–291. [ Links ]
Stott, K., C. Desmerger, P. Holford, 2005. Relationship among Lepista species determined by CAPS and RAPD. Mycological Research 109: 205–211. [ Links ]
Turkekul, I., E. Mahfuz, M. Tuzen, 2004. Determination of iron, copper, manganese, zinc, lead, and cadmiun in mushroom samples from Totat, Turkey. Food Chemistry 84:389–392. [ Links ]
Volz, P. A., 2000. Spawn media and exudate formation in search of medicinal mushrooms. International Journal of Medicinal Mushrooms 2: 81–86. [ Links ]
Wright, S.H., W.A. Hayes, 1978. Nutrition and fruitbody formation of Lepista nuda (Bull. Ex. Fr.) Cook. In: Delmas, J. (ed.), Mushroom Science X (part 1). Burdeos.pp. 873–884. [ Links ]
Ying, J., X. Mao, Q. Ma, Y. Zong, W. Huaan, 1987. Icons of Medicinal fungi from China. Science Press, Beijing. [ Links ]
Zervakis, G., A. Philippoussis, S, Ioannidou, P. Diamantopoulou, 2001. Mycelium growth kinetics and optimal temperature conditions for the cultivation of edible mushroom species on lignocellulosic substrates. Folia Microbiologica 46:231–234. [ Links ]














