Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de micología
versión impresa ISSN 0187-3180
Rev. Mex. Mic vol.26 Xalapa jun. 2008
Contribuciones
Caracterización e identificación morfológica de hongos formadores de micorriza arbuscular, en cinco suelos salinos del estado de San Luis Potosí, México
Identification and morphological characterization of arbuscular mycorrhizal fungi from five saline soils in the state of San Luis Potosi, Mexico
Jesús Tapia–Goné1*, Ronald Ferrera–Cerrato2, Lucia Varela–Fregoso3, Juan Carlos Rodríguez Ortiz1, J. Lara Mireles1, José Carmen Soria Colunga1, Humberto Cuellar Torres1, Miguel Angel Tiscareño Iracheta1, Rodolfo Cisneros Almazán4
1 Facultad de Agronomía, Universidad Autónoma de San Luís Potosí.
2 Instituto de Recursos Naturales Colegio de Postgraduados, Montecillo, 56230, Montecillo, Edo. de México.
3 Laboratorio de Ecología Microbiana, Escuela Nacional de Ciencias Biológicas del IPN.
4 Facultad de Ingeniería de la Universidad Autónoma de San Luis Potosí
* Autor para correspondencia: jtapia@uaslp.mx
Recibido 21 de febrero 2007
Aceptado 4 de octubre 2007
Resumen
Se caracterizaron, identificaron y propagaron cepas nativas de hongos formadores de micorriza arbuscular, en cinco suelos altamente salinos en el estado de San Luis Potosí, México. Se registran tres géneros de hongos formadores de la micorriza arbuscular: Acaulospora, Gigaspora y Glomus. Así mismo se describieron, identificaron y propagaron las siguientes morfoespecies: Glomus mosseae, G. aff. etunicatum, G. intraradices y Paraglomus sp, mismas que se registran por primera vez para el estado de San Luis Potosí.
Palabras clave: Hongos micorrizicos arbusculares, simbiosis, Glomales.
Abstract
Native strains of mycorrhizal arbuscular forming fungi, in five highly saline soils in the state of San Luis Potosí, were characterized, identified and propagated. Propagation of five native species of México was done in pots. Three genera of mycorriza arbuscular forming fungi were recorded Acaulospora, Gigaspora and Glomus. Additionally, four morphospecies: Glomus mosseae, G. aff. etunicatum, G. intraradices and Paraglomus sp., were propagated, described and identified.
Key words: Arbuscular mycorrhizal fungi, symbiosis, Glomales.
Introducción
La diversidad de los hongos micorrízicos arbusculares (HMA) en México, ha sido poco estudiada, y es probable que sea una de las más grandes del mundo, principalmente por la gran variedad de biomas que se presentan en nuestro territorio (Varela y Trejo, 2001). Existe una clara evidencia de que la germinación de esporas y el desarrollo de las hifas de algunos hongos micorrízicos arbusculares, están reducidas por la presencia de las sales en los suelos (Becker y Gerdemann, 1977). Además se ha mencionado que la asociación entre los HMA y las diferentes especies vegetales se presenta bajo condiciones de estrés al ambiente como la sequía, baja fertilidad, salinidad y altas temperaturas (Sylvia y Williams, 1992). Los HMA presentes en todos los ecosistemas agrícolas, pueden representar el segundo componente en biomasa, favoreciendo el desarrollo de las especies vegetativas (Varela y Estrada–Torres, 1997), asi mismo se ha mencionado la importancia de realizar la identificación de las diferentes especies de los HMA aislados de los suelos salinos en los diferentes estados de la República Mexicana (Varela y Trejo, 2001).
Actualmente la riqueza de especies y diversidad de los HMA no ha sido completamente estudiada en los diferentes tipos de suelos que comprende el territorio mexicano, registrándose solo 44 especies potenciales, lo que corresponde al 29 % de las conocidas mundialmente (Varela y Estrada–Torres, 1997). Por lo anterior, la presente investigación tiene como objetivos caracterizar morfológicamente e identificar las especies de hongos formadores de micorriza arbuscular nativa, en cinco suelos altamente salinos del estado de San Luis Potosí, México y su propagación mediante cultivo en macetas.
Materiales y métodos
Se seleccionaron cinco sitios con suelos altamente salinos de uso agrícola del estado de San Luis Potosí, México y se tomó en cuenta las características climatológicas de la Entidad la cual esta dividida en tres zonas: Altiplano, Media y Huasteca. Por otra parte, para ubicar los suelos salinos, se revisaron los estudios realizados por la Subdirección de Agrología de la Secretaría de Recursos Hidráulicos, entre los años 1988 y 1994, ubicándose los mayores problemas de salinización de los suelos en los municipios de Moctezuma, Villa de Arista, Mexquitic de Carmona, Matehuala y Rioverde, localizados dentro de la zona altiplano y media. En la Tabla 1, se muestran las características climatológicas de los sitios seleccionados, así como la vegetación que corresponde a cada sitio según Rzedowsky (1978).
Muestreo de suelos
Se realizaron 3 muestreos de suelos en los sitios previamente clasificados como suelos altamente salinos (Tabla 2), a una profundidad de 0–3 0 cm, obteniéndose un total de 15 muestras de suelos compuestas, a las que posteriormente se les realizó un análisis físico y químico del suelo, en el laboratorio de suelos y aguas de la Facultad de Ingeniería de la Universidad Autónoma de San Luis Potosí (Tabla 3).
Cuantificación de esporas
La extracción de esporas de los suelos salinos obtenida directamente de las bolsas del muestreo rizosférico de los cultivos agrícolas en campo, fue realizada por el método de tamizado húmedo y decantación, establecido por Gerdemann y Nicolson (1963), posteriormente se realizó el conteo de esporas en 100 gramos de suelos.
Colonización en cultivos agrícolas
Para el porcentaje de colonización micorrízica, se utilizaron las raíces de los cultivos establecidos en las parcelas agrícolas de los cinco sitios seleccionados, utilizando las raicillas más finas se realizó el clareo y tinción de raíces, por el método de Phillips y Hayman (1970) y el porcentaje de colonización micorrízica por la técnica de Mc. Gonigle y Fitter (1990).
Identificación y propagación en maceta de los HMA en los suelos salinos estudiados
Las esporas fueron separadas en grupos de acuerdo al color, forma y tamaño, preparándose laminillas con las esporas extraídas, utilizando alcohol polivinílico–glicerol (PVLG) y PVLG Melzer, de acuerdo al método de Schenck y Pérez (1990), aplicándose una ligera presión sobre cada uno de los cubreobjetos para romper levemente las esporas y posteriormente observar la estructura de la pared, para identificarlas inicialmente a nivel de género. Las esporas se separaron del suelo bajo un estéreomicroscopio, colocándose en una caja de Petri con papel filtro, depositando el mayor número de esporas posible (aproximadamente de 100 a 150), este procedimiento se realizó para cada muestra de suelo. Las esporas retenidas en el papel filtro se propagaron durante cuatro meses en macetas y/o contenedor de un litro, con arena de río esterilizada. Se utilizó sorgo (Sorgum vulgare) como planta trampa. Después de este periodo se procedió a la identificación de las especies correspondientes a la micorriza arbuscular, propagadas en macetas de los suelos salinos. La estructura de la pared fue el principal criterio que se utilizó para la identificación de las especies, empleando las claves taxonómicas de Schenck y Pérez (1990).
Resultados
Las figuras 1 y 2 muestran la relación entre el número de esporas y la colonización micorrízica con la conductividad eléctrica. Por otra parte, se cuantificaron más de 100 esporas en 100 g de suelo seco y la colonización micorrízica en las raíces de los cultivos agrícolas en campo, varió de 10.5 a 27.1 % (Tabla 4). Las esporas identificadas corresponden a tres diferentes géneros: Acaulospora la cual se forma a partir de un sáculo esporífero (espora madura) sin hifa de sostén; Gigaspora, presenta una hifa sustentora bulbosa y la pared de la espora al romperse no se separa en varias capas. Por su parte el género Glomus, presenta esporas solitarias o en grupos y está formada sobre una hifa de sostén recta, curva ó en forma de embudo (Figura 3). Los géneros Acaulospora y Gigaspora, observados inicialmente en los sitios representativos de los suelos salinos, no se propagaron en el cultivo trampa, ya que no necesariamente las especies presentes en las muestras de campo se logran propagar debido a la variabilidad de sus características.


Descripción de especies
Glomus mosseae (T.H. Nicholson & Gerd.) Gerd. y Trappe. Esporas solitarias o formando esporocarpios, globosas a subglobosas, de color paja (0–0–20–0) a café amarillento (0–10–60–0), de 160–240 µm. La pared de la espora está formada por tres capas, la primera es hialina, evanescente, se tiñe de púrpura (0–60–20–0) con reactivo de Melzer, la segunda es hialina, unitaria, difícil de distinguir y la tercera es laminada y de color café amarillento (0–40–100–0). Se encontró rodeada por un peridio de color café amarillento (0–10–60–0), la hifa de sostén se observó en forma de embudo con un septo curvo que se forma 20 µm, por abajo del punto de unión de la espora (Figura 4).

La morfología de las esporas observadas, concuerdan con el manual de Schenck y Pérez (1990), sobre todo en el color amarillo marrón, la forma globosa e irregular y distribución del tamaño (Figura 3).
Se propaga y se registra por primera vez de suelos salinos con actividad agrícola (maíz, girasol y chile ancho) del estado de San Luis Potosí, anteriormente se conocía de los Estados de México, Tlaxcala y Veracruz. La especie fue descrita de Inglaterra, asociada a cultivo de trigo, además forma micorriza con los cultivos de fresa y maíz (Gerdemann y Nicolson, 1963). Los sitios donde se localizaron fueron: 3,4 y 5.
Glomus aff etunicatum
Esporas solitarias, globosas de color amarillento (0–60–70–10) a café anaranjado (0–60–100–0), de 100–140 µm diám. Pared esporal de dos capas, la externa es hialina, evanescente que se degrada y se desprende, cuando la capa externa es laminada de 4.8 a 6.9 µm, de color café amarillento (0–60–70–10) a color café anaranjado (0–60–100–10).
Hifas de sostén cilíndricas, de 4.8 µm de grosor, la pared hifal semejante a la de la espora (Figura 4).
Las esporas observadas, se cotejaron con las descritas por Schenck y Pérez (1990). Se encontraron semejanzas con el color naranja a rojizo, y el número de capas laminadas. Sin embargo, no se pudo precisar la especie, debido a la falta de esporas en buen estado, porque se encontraban parasitadas y otras en mal estado (Figura 5). Se propaga y se registra por primera vez de suelos salinos con actividad agrícola (chile ancho, maíz y girasol) del estado de San Luis Potosí, se conocía de los Estados de Morelos y Tlaxcala. Los sitios agrícolas altamente salinos donde se localizaron: 3 y 4. Esta especie se describió por primera de los Estados Unidos de América, asociada con pastos, maíz y caña de azúcar, forma micorriza con cebolla, ajo chile y trébol (Becker y Gerdemann, 1977).
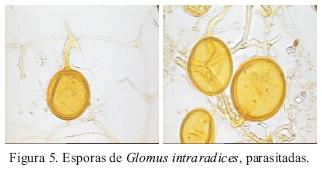
Glomus intraradices (Schenck y Smith, 1982)
Esporas solitarias, globosas a subglobosas, de color amarillo paja (0–0–20–0) a café amarillento (0–0–40–0), de 70–130 µm de diám. Pared de tres capas, de 7.2–10.8 µm de ancho. La primera capa es hialina evanescente, se tiñe de color rosa (0–40–20–0) con reactivo Melzer, tiene un grosor de 2.4 µm, la segunda capa es unitaria hialina, se tiñe del mismo color que la primera capa, con el reactivo Melzer y la tercera capa tiene un grosor de 3.9–8.1 µm de grosor formada por varias laminas, de color amarillo paja (0–0–40–0). La hifa de sostén es de forma cilíndrica, tiene un grosor de 18.0 µm en el punto de unión con la espora, la pared está formada de igual manera que la pared de la espora (Figura 5).
La morfología de las esporas coincide con las descritas por Schenck y Pérez (1990), sobre todo en color, forma y distribución de las mismas. Se propaga y se registra por primera vez de suelos salinos con actividad agrícola (jitomate) del estado de San Luis Potosí, solo se conocía de Jalisco y Tlaxcala. La especie se describió de Estados Unidos de América, asociada con papaya, ajo, jitomate, cítricos, cacahuate, maíz, fríjol y zanahoria, forma micorriza con pastos (Schenck y Smith, 1982). El sitio agrícola donde se localizó fue el 2.
Paraglomus
Esta especie tiene una semejanza con los morfotipos de las esporas del género Glomus. El desarrollo de las esporas procede exactamente como se ha encontrado en la familia Glomaceae, por la extensión de un extremo de la hifa. Se propaga y se registra por primera vez de suelos salinos con actividad agrícola (maíz) del estado de San Luis Potosí. El sitio agrícola donde se localizó fue el 2. Solamente dos especies se han descubierto en este género, ambos están clasificados primero como especie de Glomus basadas en la morfología de la espora (Morton y Redecker, 2001). Las semejanzas para clasificarlas como Paraglomus, fueron las siguientes: la capa externa de la pared a menudo se observa sucia, la capa de la espora frecuentemente cambia con la maduración de la espora. El desarrollo de esta capa, es el primer componente de la pared para formar esporas juveniles. Generalmente tiene material orgánico acumulado en la superficie; no tiene ninguna reacción al reactivo de Melzer. La hifa sustentora se distingue y está formada por las mismas capas encontradas en la pared de la espora. En algunas especies la hifa sustentora es tan delgada que es difícil observarla o se desprende de la espora (Figura 6).

Conclusiones
Se encontró una baja riqueza de hongos formadores de la micorriza arbuscular en los cinco suelos altamente salinos. Se ha establecido que en suelos perturbados debido a la labranza, disminuyen la abundancia y diversidad de los HMA. Otro factor que disminuye esta diversidad es la aplicación de insumos y el manejo tecnificado (Jonson y Pfleger, 1992) además el incremento de la salinidad en la solución del suelo, es factor que establece baja diversidad de especies de los HMA (Sylvia y Williams, 1992) lo cual coincidió con los resultados de este estudio. La especie Glomus mosseae fue la dominante en los suelos objeto de estudio.
Agradecimientos
Los autores agradecen el apoyo al CONACyT, México COI–236–2003 Fondos Sectoriales y a la Fundación PRODUCE 2002–2003 de San Luis Potosí A.C., por los recursos aportados para la realización de este proyecto de investigación.
Literatura citada
Becker, W.N., J.W. Geredemann, 1977. Glomus etunicatus sp. nov. Mycol:16: 29–32. [ Links ]
Gerdemann, J.W., T.H. Nicolson, 1963. Spores of mycorrhizal Endogone species extracted from soil by wet sieving and decanting. Transactions of the British Mycolical Society 46:235–244. [ Links ]
Jonson, N.C., F.L. Pfleger, 1992. Vesicular–arbuscular mycorrhizal and cultural stresses. In: G.J. Bethlenfalvay, R.G. Linderman (eds.). Mycorrhizal in sustaintable agriculture. ASA Special Publisher No. 54 Madison, Wisconsin USA. P71–97. [ Links ]
Junniper, S., L. K. Abbott, 1993. Vesicular–arbuscular mycorrhizal and soil salinity. Mycorrhiza 8:305–314. [ Links ]
Mc. Gonigle, T.P., A.H. Fitter, 1990. Ecological specifity of vesicular Arbuscular mycorrhizal associations. Mycological Research 94: 12–122. [ Links ]
Morton, J.P., D. Redecker, 2001. Two new families of Glomales, Archaeosporaceae and Paraglomaceae, with two new genera Archaeospora and Paraglomus, based on concordant molecular and morphological characters. Mycologia 93:181–195. [ Links ]
Phillips J.M., Hayman D.S., 1970. Inproved growth of formato in salinizad soil by vesicular mycorrhizal fungi collected from saline soil. Mycologia 76:74–84. [ Links ]
Rzedowsky J. R., 1978. Mapa de tipos de vegetación de la República Mexicana. Dirección de Agrología, S.R.H. México. [ Links ]
Schenck, N.C., Y. Pérez, 1990. Manual for the identification of VA mycorrhizal fungi. 3th Edition. Synergistic Publications. Gainsville. [ Links ]
Schenck, N.C., G.S. Smith, 1982. Aditional new and unreported species of mycorrhizal fungi (Endogonaceae) from Florida. Mycologia 74: 77–92. [ Links ]
Sylvia, D. M., S.E. Williams, 1992. Vesicular–arbuscular mycorrhizae and environmental stresses. In: Bethlenfalvay, G.J., R. J. Linderman (eds.), Mycorrhizae in Sustainable Agriculture. ASA No. 54. Madison, pp. 101–124. [ Links ]
Varela, L., D. Trejo, 2001. Los Hongos micorrizógenos arbusculares como componentes de la biodiversidad del suelo en México. Acta Zoologica Mexicana 1: 39–51. [ Links ]
Varela, L., A. Estrada–Torres, 1997. El papel de los microorganismos de la rizosfera y de la micorriza en la absorción de nutrimentos minerales y agua. In. Orellana, R., Escamilla, J.A., Larque–Saavedra, A. (Eds). Ecofisiología vegetal y conservación de recursos genéticos. Centro de Investigación Científica de Yucatán, AC. (CICY). México. pp 137–150. [ Links ]














