ANTECEDENTES
El embarazo es un estado que impone un verdadero desafío para el sistema cardiovascular materno, como lo es el incremento de la frecuencia cardiaca y gasto cardiaco, disminución de la presión arterial media y resistencias vasculares sistémicas; con remodelamiento cardiaco que conlleva a la disminución de la función cardiaca, lo que sumado a los cambios en el periodo periparto, ocasionan insuficiencia cardiaca aguda.1
En el puerperio se espera que la mujer cardiópata tenga complicaciones en 25-30% y que los recién nacidos padezcan complicaciones (prematurez, asfixia, restricción en el crecimiento, muerte) hasta en 54%.2
Bauersachs y su grupo (2016)3 en un consenso definen que la miocardiopatía periparto (MCPP) es el trastorno en el que la función sistólica del ventrículo izquierdo y los síntomas de insuficiencia cardiaca ocurren en el último mes del embarazo y los cinco meses posteriores al parto en pacientes sin afección cardiaca conocida.
La enfermedad es relativamente poco común, pero su incidencia está aumentando. Hace poco se refirió que muchos casos de cardiomiopatía periparto tienen bases genéticas.4
Kao, Hsich y Lindenfeld (2013)5 mencionaron que los factores de riesgos importantes son: ascendencia africana (OR: 1.79, IC95%: 1.37-2.31), hipertensión (OR: 6.41, IC95%: 4.81-8.44), obesidad (OR: 1.42, IC95%: 0.84-2.24), anemia (OR: 4.89, IC95%: 3.95-6.03), diabetes (OR: 1.42, IC95%: 0.73-2.49), tabaquismo (OR: 1.43, IC95%: 0.89-2.22), enfermedades autoinmunitarias (OR: 3.61, IC95%: 1.42-7.43) 0.002, eclampsia (OR: 5.93, IC95%: 2.88-10.9) y desnutrición. La existencia de un solo factor aporta poco riesgo y al agregarse otros se va incrementando el riesgo de forma exponencial.
Polanía y Navarrete 6 describieron en 2006 algunas teorías, entre las que destacan la teoría inflamatoria, en la que se involucra el sistema inmunológico de la paciente y la formación de anticuerpos contra las proteínas de actina y miosina. La teoría viral, en la que hay una respuesta inmunitaria humoral atenuada y la adquisición de infecciones que dan origen a miocarditis virales. La teoría de la apoptosis que afirma que hay desequilibrio entre los mecanismos homeostáticos entre la proliferación celular no controlada y la muerte celular excesiva. Mientras que la teoría hormonal involucra la cascada del estrés oxidativo.
Hilfiker-Kleiner y Sliwa7 presentaron en 2014 una teoría que está dada por la prolactina liberada de la pituitaria y que, en condiciones del estrés oxidativo en el miocardio, se adhiere por proteólisis a un fragmento de 16 kDa por proteasas, como la catepsina D. El aumento del estrés oxidativo se debe a la regulación a la baja de los factores de transcripción STAT3 (transductor de señal y activador de transcripción 3) y PGC-1α (coactivador γ del receptor activado por el proliferador de peroxisoma 1α), suprimiendo la expresión cardiaca de SOD2 (superóxido dismutasa mitocondrial 2). La prolactina de 16 kDa aumenta la expresión de microARN-146a en el endotelio donde ejerce efectos angiostáticos y perjudica la actividad metabólica de los cardiomiocitos; esta misma mejora la expresión de CCL2 (quimiocina 2 del motivo C-C) en células endoteliales a través de la señalización NF-κB (factor nuclear kappa-beta), con incremento del IFN-γ (interferón gamma), generando inflamación local en el corazón. El STAT3 y PGC-1α protegen la vasculatura cardiaca de factores antiangiogénicos en la fase periparto, como sFlt-1 (factor soluble similar a tirosina cinasa 1); mientras que el VEGF (factor de crecimiento endotelial vascular) neutraliza los efectos adversos de sFlt-1 (Figura 1).

Figura 1 En el periodo periparto hay secreción de prolactina (PRL) y en la placenta factor soluble similar a tirosina cinasa 1 (sFlt1). La prolactina se convierte en 16 kDa por la catepsina D (CatD) secretada a partir de los cardiomiocitos. Estas inhibiciones de los vasos sanguíneos generan apoptosis y secreción de miRNA146a, que es encapsulado en exosomas y son internalizados por las células cardiacas, donde miRNA146 activa otra vía causando disfunción y apoptosis celular. Al mismo tiempo, sFlt1 se une e inhibe la señalización del factor de crecimiento del endotelio vascular (VEGF) y, por tanto, mayor insuficiencia cardiaca.
En la actualidad el consenso del diagnóstico se basa en que la insuficiencia cardiaca aparezca en el último mes de embarazo o en los primeros cinco meses del puerperio, FEVI < 55%, por ecocardiografía o fracción de acortamiento > 30% y dilatación del ventrículo izquierdo mayor a 6 cm.8
Fett9 en 2016 revisó los biomarcadores séricos observados durante el embarazo que pueden ayudar a establecer el diagnóstico temprano, como son: péptico natriurético cerebral (BNP por sus siglas en inglés) y pro-BNP-NT, ambos predicen eventos maternos adversos, tienen alta sensibilidad para incluir y alta especificidad para excluir insuficiencia cardiaca. Las concentraciones menores de 100 pg/dL de BNP tienen alto valor predictivo negativo. Las concentraciones de pro-BNP-NT mayores de 300 pg/mL antes del embarazo se vinculan con complicaciones durante el periodo periparto en mujeres con cardiomiopatía dilatada.
Otros biomarcadores son: el factor-1 soluble endotelial vascular tipo tirosina cinasa (sFlt1), biomarcador de preeclampsia que disminuye posterior al embarazo y que aumenta en caso de MCPP. La relaxina sérica, cuyas concentraciones altas predicen mayor recuperación a dos meses porque se identifica como factor protector. La relaxina-2 tiene propiedades antinflamatorias, angiogénicas y antifibróticas, además de expresar efectos, como incremento del gasto cardiaco, del volumen plasmático, de la frecuencia cardiaca, del flujo renal y bajas resistencias vasculares. Algunos anticuerpos cardiacos desempeñan un papel importante en la patogénesis y pueden ser inhibidos por beta-bloqueadores, como el autoanticuerpo beta-1, adrenoreceptor capaz de colocarse en los receptores efectuando sobre- marcha de las células cardiacas. El micro-ARN 146 aa, éste se eleva en MCPP más que en mujeres sanas en el periodo posparto y en pacientes con miocardiopatía dilatada. La más importante es la prolactina de 16 kDa, ésta se escinde de la prolactina normal por acción de la catepsina D. Por ello, la bromocriptina es parte del tratamiento.9,10
El tratamiento de la cardiomiopatía periparto es similar al tratamiento convencional de la insuficiencia cardiaca aguda según las condiciones clínicas de la paciente. Debe dentificarse y evaluarse la condición cardiopulmonar mediante signos vitales y el diagnóstico se confirma mediante pruebas de laboratorio y gabinete, el siguiente paso es determinar si hay insuficiencia cardiaca aguda o no, de ahí el tratamiento farmacológico inicial, considerando en caso de fallo de éste, soporte mecánico circulatorio que puede ser puente para un trasplante cardiaco. En caso de tratar la insuficiencia cardiaca, deberá mantenerse el tratamiento durante 12 meses (Figura 2).3,11

Adaptada de la referencia 3.
Figura 2 Evaluación y tratamiento de la miocardiopatía periparto. PAS: presión arterial sistólica; FC: frecuencia cardiaca; FR: frecuencia respiratoria; VMNI: ventilación mecánica no invasiva; ICC: insuficiencia cardiaca congestiva; BB: beta-bloqueadores; IECA: inhibidores de enzima convertidora de angiotensina; ARA: antagonista de receptores de angiotensina; FEVI: fracción de eyección del ventrículo iquierdo.
CASO CLÍNICO
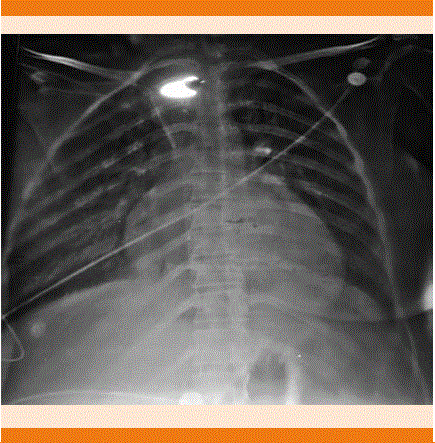
Paciente femenina de 26 años de edad con los siguientes antecedentes: carga genética para diabetes mellitus, cardiopatía e insuficiencia renal crónica. Antecedentes patológicos personales: catarata congénita con resección y colocación de lente intraocular hacía siete años. Antecedentes ginecoobstétricos: menarquia a los 13 años, ritmo 45 x 3 días, parejas sexuales: 2, método de planificación familiar: preservativo. FUM: 29/03/2017, FPP: 16/01/2018. Embarazo con control prenatal, infección urinaria a las 16 semanas e infección vaginal a las 24 semanas. Inmunizaciones completas, prueba rápida de VIH negativa. Ganancia ponderal de 4 kg. Padecimiento actual: ingresó al hospital por dolor obstétrico el 06/01/18 con los siguientes signos vitales: presión arterial: 105/70 mmHg, frecuencia cardiaca: 81 por minuto, frecuencia respiratoria: 20 por minuto, temperatura: 36.5ºC. Exploración física ginecológica: feto en situación longitudinal, FCF: 145 lpm, tacto vaginal con 1-2 cm de dilatación, 80% de borramiento, la paciente ingresó con trabajo de parto en fase latente para vigilancia y conducción del parto. Se decidió programar cesárea por antecedente de cirugía oftálmica. Estudios de laboratorio iniciales: hemoglobina 14 g, hematócrito 44.7%, plaquetas 233 mil, TP 13.7 seg, TPT 26.9 seg. En la valoración preanestésica se encontró taquicardia sinusal de 140 por minuto con presión arterial de 115/80 mmHg, saturación de oxígeno 89% y frecuencia respiratoria de 20 por minuto, se aplicó bloqueo peridural en ese momento. Durante el transoperatorio se reportó presión arterial de 113/83 mmHg, saturación de O2 89%, frecuencia cardiaca 142 lpm, electrocardiograma ritmo sinusal, con balance de líquidos +250 mL, uresis 150 mL, sangrado 450 mL con hallazgos de recién nacida de 3220 g, talla 50 cm, Apgar 7/9. Sangrado 500 mL. La paciente salió de procedimiento con taquicardia sinusal remitida, ingresó a piso seis horas después con evolución a la mejoría y egresó al tercer día. El mismo día reingresó a hospitalización por padecer de forma súbita disnea, calosfríos y somnolencia. A la exploración física se encontró angustiada, con palidez de tegumentos, taquicardia, abdomen blando, sin datos de irritación peritoneal, útero involucionado, con edema vulvar y loquios escasos, no fétidos. Se decidió su ingreso por datos clínicos de síndrome anémico. Durante su estancia la paciente tuvo deterioro clínico, se decidió la activación del código de Equipo de Respuesta Inmediata-Obstétrica (ERI-O) debido a probable choque hipovolémico; se encontró a la paciente con diaforesis, disnea, estertores crepitantes bilaterales, taquicardia, con soplo mitral sistólico grado II/IV, extremidades frías, cianosis distal y llenado capilar de más de 3 segundos, signos vitales: presión arterial 90/50 mmHg, frecuencia cardiaca 128 por minuto, frecuencia respiratoria 24 por minuto, saturación de O2 87%. Se inició reanimación tratando de canalizar una vía periférica sin tener éxito, por lo que se colocó catéter venoso central, se colocó oxígeno suplementario y se realizó ventana ultrasonográfica pulmonar y cardiaca por médico intensivista, con hallazgos de patrón B en ambos campos pulmonares, ventana cardiaca con discinesia del ventrículo izquierdo y el ventrículo izquierdo dilatado. Fracción de eyección del ventrículo izquierdo (FEVI) menor a 30% (Figura 3). Se estableció el diagnóstico de choque de origen cardiogénico y edema agudo pulmonar secundario a probable miocardiopatía dilatada, se inició la administración de vasopresores inotrópicos y diurético. La paciente ingresó a la unidad de cuidados intensivos, 12 horas después tuvo leve disminución de la congestión pulmonar. La radiografía de tórax evidenció cardiomegalia G III (Figura 4). En los estudios de laboratorio destacaron: creatinina 1 mg/dL, urea 85.8 mg/ dL, glucosa 154 mg/dL, ácido úrico 9 mg/dL, TGO 610 UI/L, TGP 322 UI/L, DHL 2146 UI/L, CPK 6456 UI/L MB 302.7 UI/L, datos de lesión renal aguda. Se decidió su envío a un hospital de tercer nivel de atención donde se logró el retiro de vasopresores e inotrópicos, con remisión de la lesión renal y mejoría de su clase funcional, egresada a piso de cardiología con tratamiento a base de digitálico y bromocriptina. El eco- cardiograma Doppler color reportó: ventrículo izquierdo con hipocinesia severa generalizada marcada en los segmentos distales, diámetros diastólicos de 54 mm, diámetro sistólico de 59 mm, grosor diastólico septal de 7 mm, pared posterior de 7 mm, FEVI por método de Simpson de 17%, válvula mitral con insuficiencia severa, vena contracta de 7 mm, válvula aórtica con insuficiencia moderada, válvula tricúspide con insuficiencia severa, válvula pulmonar con hipertensión arterial pulmonar leve a moderada, tronco de la arteria pulmonar de 21 mm, rama derecha de 12 mm, rama izquierda de 10 mm, aurícula derecha de 53 x 43 mm, aurícula izquierda de 63 x 40 mm. Con lo anterior se concluyó probable miopericarditis, ventrículo izquierdo dilatado con disfunción sistólica se- vera, disfunción diastólica con tendencia a la restricción del llenado ventricular, insuficiencia mitral severa, insuficiencia aórtica moderada sin gradiente significativo, insuficiencia tricuspídea severa, con hipertensión arterial pulmonar leve a moderada. La resonancia magnética mostró miocardiopatía dilatada con fibrosis intramural y ventricular con disfunción sistólica severa, FEVI 13%, hipocinesia severa generalizada con datos de insuficiencia tricuspídea y mitral, derrame pericárdico, se completó el protocolo de estudio con realización de cateterismo diagnóstico derecho e izquierdo con resultados de miopericardiopatía dilatada periparto. Durante la evolución de la paciente en piso de cardiología se continuó tratamiento para insuficiencia cardiaca aguda, se mantuvo estable hemodinámicamente, se iniciaron beta-bloqueadores y requirió digitálicos; sin embargo, 20 días después la paciente tuvo choque cardiogénico, por lo que ingresó a la unidad de cuidados intensivos coronarios (UCIC) con evolución desfavorable por falla de bomba y fue tratada nuevamente con dobutamina y norepinefrina a dosis altas, sin lograr presiones arteriales perfusorias, nuevamente tuvo lesión renal aguda con elevación importante de azoados, a pesar del tratamiento tuvo poca respuesta, requiriendo bicarbonato por acidosis metabólica severa, se mantuvo para protocolo de trasplante cardiaco y potencialmente apta a oxigenación por membrana extracorpórea, valorada por electrofisiología para colocación de desfibrilador automático implantable; sin embargo, no fue apta por insuficiencia renal agudizada, con insuficiencia hepática aguda secundaria a hepatitis isquémica. Nueve días después de su ingreso a la unidad de cuidados intensivos coronarios la paciente tuvo actividad eléctrica sin pulso, salió al primer ciclo de reanimación y requirió apoyo mecánico ventilatorio, con sedación y analgesia, persistió con lesión renal aguda AKIN III con acidosis metabólica y oliguria, estudios de laboratorio con pro-BNP: 1020 UI/L glucosa: 88 mg/dL, creatinina: 2.29 mg/dL, Na: 124 mmol/L, K: 5.1 mmol/L, Cl: 89 mmol/L, ALT: 1223 UI/L, AST: 1168 UI/L, DHL: 1409 UI/L, CPK: 2121 UI/L, CK-MB: 137 UI/L, hemoglobina: 10.3 g/dL, hematócrito: 32.3, leucocitos: 10,800, neutrófilos %: 88.7, linfocitos %: 2.6, plaquetas: 134,000. La gasometría venosa reportó pH: 7.11, pCO2: 58, pO2: 2.6, HCO : 18.4, be: -11.1, SO2 vc: 27%, con disminución de oxemia hasta 70% sin respuesta a pesar de parámetros altos ventilatorios, tuvo bradicardia, posterior asistolia; se dio reanimación cardiopulmonar avanzada durante 20 minutos, sin retorno de circulación espontánea; se dio egreso por defunción.
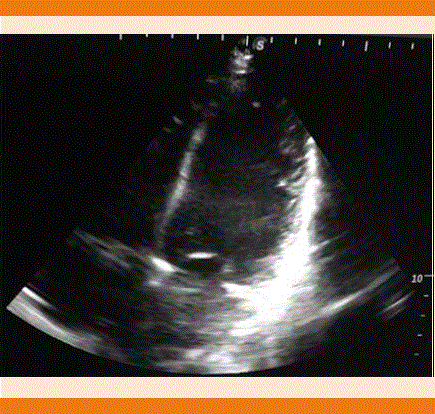
. Figura 3 Ventana ultrasonográfica cardiaca monofocal que evidencia importante dilatación del ventrículo izquierdo.
DISCUSIÓN
La miocardiopatía periparto es una enfermedad poco frecuente, que afecta a mujeres en edad reproductiva y su incidencia se relaciona con el ciclo embarazo-puerperio. Las hipótesis consideradas de sus causas relacionan la interacción fisiológica del embarazo y el puerperio con factores metabólicos, inflamatorios, infecciosos, genéticos y hormonales.1,6 La detección de la miocardiopatía periparto está muy relacionada con los antecedentes, factores predisponentes, experiencia del especialista y sospecha clínica, junto con la evaluación ultrasonográfica pulmonar y cardiaca, lo que se llevó a cabo con nuestra paciente y se estableció el diagnóstico temprano y, por tanto, se dio el tratamiento de manera oportuna.
Los factores de riesgo más relacionados incluyen la edad mayor de 30 años, multiparidad, embarazos múltiples, mujeres afroamericanas, tratamiento a largo plazo con β-agonistas adrenérgicos, enfermedad hipertensiva, adicción materna a la cocaína y deficiencias nutricionales; los factores de riesgo que tuvo la paciente fueron desnutrición y alteraciones congénitas.
La sospecha clínica es muy importante, porque en este caso la paciente tuvo episodios de taquicardia y desaturación, que fueron compensadas en el puerperio; sin embargo, se debe sospechar algún problema cardiopulmonar ante estos signos vitales. La miocardiopatía periparto se asocia con disfunción ventricular y crecimiento de las cavidades izquierdas, como en el caso de nuestra paciente, además de fracción de eyección de 17%. Estos resultados son comparables con los obtenidos por Lim y Sim,12 quienes también detectaron insuficiencia mitral severa, que también acompaña a la miocardiopatía periparto. El diagnóstico se establece mediante métodos de imagen, como el ecocardiograma, en el que la paciente mostró todos los criterios para miocardiopatía periparto: FEVI < 55%, por ecocardiografía o FA < 30%, y dilatación del ventrículo izquierdo mayor a 6 cm.6 Para el tratamiento se describen los vasopresores e inotrópicos, se sugiere la administración de levosimendán, al no disponer de éste, la segunda opción es dobutamina, aunque en menor medida por los efectos secundarios,3,9 lo que se prescribió a la paciente. Asimismo, el metoprolol, un beta-bloqueador, puede ser el agente elegido durante el embarazo porque es seguro. La digoxina puede prescribirse, misma que se administró durante la estancia en cardiología de la paciente. Parte del tratamiento fue la bromocriptina, en los estudios de Blauwet y Cooper L (2011)11 se comenta que la prolactina se vincula con el origen de la miocardiopatía periparto y, por tanto, la inhibición de la secreción hipofisaria de prolactina, mediante cese de la lactancia o con bromocriptina, un alcaloide agonista del receptor dopaminérgico D2, puede ser benéfica. En el caso la paciente se revirtió el estado de choque y en su internamiento en piso se trató con beta-bloqueadores y digitálicos. A pesar de ello, tuvo deterioro hemodinámico, por lo que requirió apoyo multisistémico, por la resistencia de la enfermedad se contempló oxigenación por membrana extracorpórea y trasplante cardiaco; sin embargo, la severidad de la insuficiencia cardiaca condicionó insuficiencia de otros órganos, como el hígado, los riñones, el cerebro, lo que condicionó deterioro y un desenlace mortal.
La muerte súbita cardiaca frecuentemente se informa como causa de mortalidad; sin embargo, existe información limitada de la prevalencia de arritmias ventriculares en pacientes con miocardiopatía periparto; el balón intraaórtico, los dispositivos de asistencia del VI y biventriculares y la oxigenación por membrana extracorpórea deben considerarse en pacientes con miocardiopatía periparto porque han demostrado ser benéficos.
CONCLUSIONES
La miocardiopatía periparto es una enfermedad rara, aunque actualmente se han registrado varios casos en nuestro medio, a consecuencia de la sospecha y reconocimiento por medio de evaluaciones ultrasonográficas pulmonares y cardiacas. En presencia de miocardiopatía periparto deben implantarse tratamientos agresivos. El reconocimiento y tratamiento oportunos de los signos y síntomas de la enfermedad permitirán que disminuyan las tasas de mortalidad en nuestras pacientes afectadas.











 nueva página del texto (beta)
nueva página del texto (beta)