ANTECEDENTES
La tuberculosis es una enfermedad infecto-contagiosa causada por Mycobacterium tuberculosis o bacilo de Koch, a pesar de los importantes avances médicos desde su descubrimiento, la tuberculosis sigue siendo un desafío diagnóstico,1,2 es una de las 10 principales causas de muerte en todo el mundo.3 Aunque típicamente se considera una enfermedad crónica con manifestación clásica de varios meses de síntomas constitucionales (fiebre, pérdida de peso y sudoración nocturna) y localizados (tos y hemoptisis), la tuberculosis también puede manifestarse de forma aguda (duración de los síntomas-signos ≤ 30 días) en casi cualquier sistema orgánico e imitar otros procesos infecciosos o no infecciosos. Aunque su patogenia aún no se comprende por completo, puede estar relacionada con factores epidemiológicos y genéticos del huésped; la enfermedad se reporta casi exclusivamente en huéspedes inmunodeprimidos, especialmente pacientes infectados con el virus de la inmunodeficiencia humana (VIH).2
Una vez que M. tuberculosis se inhala en los pulmones, ocurre una serie de eventos inmunológicos que conduce a tres resultados posibles: erradicación, infección primaria o infección latente. La tuberculosis aguda puede surgir como una enfermedad primaria o de reactivación de infección latente,2 de estas formas agudas las más frecuentes son meníngea, miliar, abdominal y pulmonar. La tuberculosis aguda puede progresar en severidad y entre 1 y 3% de los casos requiere tratamiento en unidades de cuidados intensivos. La manifestación como sepsis o choque es infrecuente,1 generalmente se manifiesta como insuficiencia respiratoria y, a pesar de la disponibilidad de terapias efectivas, las tasas de mortalidad se mantienen entre 15.5 y 65.9%. El espectro de la enfermedad dificulta el diagnóstico de tuberculosis aguda, a menos que la sospecha clínica de la enfermedad sea alta, pero la alta mortalidad exige su consideración, además, el inicio temprano del tratamiento es decisivo para optimizar el resultado clínico.2
CASO CLÍNICO
Paciente femenina de 28 años de edad, originaria y residente del estado de Guerrero; proveniente de medio rural, nivel socioeconómico bajo, no refirió convivencia con paciente tosedor crónico o con antecedente de tuberculosis. La paciente cursó con hospitalización previa por aborto incompleto hacía siete meses, de ocho semanas de gestación, en esa intervención se realizó aspiración manual intrauterina, sin reporte de hallazgos histopatológicos.
En agosto de 2016, seis días previos a su ingreso, consultó en el servicio de urgencias de su hospital regional por sangrado uterino anormal en cantidad moderada, con prueba inmunológica de embarazo negativa. El cuadro clínico se acompañó de taquipnea, taquicardia e hipotensión; por lo que se realizó legrado uterino instrumentado hemostático, sin hallazgos histopatológicos durante la intervención; además, la paciente tuvo complicaciones por daño hemodinámico y choque séptico y fue referida a nuestra unidad. La paciente no tenía tos, expectoración ni hemoptisis, pero se comprobó insuficiencia respiratoria aguda tipo 1.
A su ingreso al departamento de urgencias sus signos vitales fueron: presión arterial: 70/50 mmHg, frecuencia cardiaca: 154 latidos por minuto, frecuencia respiratoria: 25 por minuto, temperatura: 40ºC, saturación a 89%, sopor superficial, ictericia generalizada ++, disminución del esfuerzo ventilatorio y murmullo vesicular disminuido, hepatomegalia, distensión abdominal con signo de la ola y matidez cambiante presente, facies álgica a la palpación, extremidades con edema ++, dermatosis diseminada, acentuada en el hombro izquierdo y el miembro torácico ipsilateral, con placas de aspecto verrugoso, bordes bien definidos, úlceras centrales. Al examen oftalmológico se observaron tubérculos coroideos, a la exploración genital edema vulvar y pérdida transvaginal hemática fétida escasa. Se calcularon escalas de APACHE II (27 puntos) y SAP II (64 puntos) que predice mortalidad estimada de 60.5 y 75.3%, respectivamente.
La paciente evolucionó con progresión de la insuficiencia respiratoria, por lo que requirió ventilación mecánica invasiva, apoyo hemodinámico con cristaloides y coloides para mantener presión arterial media y presión venosa central estables, más norepinefrina a 2.2 µg/kg/min. Se decidió su ingreso a la unidad de cuidados intensivos, donde mantuvo volúmenes urinarios bajos de 0.21 cc/kg/h (TFG 36.9 mL/min/1.73 m2) y saturación a 75% a pesar del manejo. Se trató con doble esquema antibiótico y requirió transfusión de hemoderivados (2 U de concentrados eritrocitarios, 5 U de plasma fresco congelado y un concentrado plaquetario).
La radiografía de tórax mostró múltiples nódulos finos, de aproximadamente 3 mm, de distribución azarosa, bilateral, con patrón miliar. La tomografía pulmonar mostró imágenes micronodulares de aspecto miliar, mal definidas, de distribución difusa y opacidades periféricas con morfología de árbol en gemación más adenopatías mediastínicas y neumotórax derecho menor de 10%. La tomografía abdominal mostró líquido libre en la cavidad. Se realizó estudio de líquido de ascitis con resultado de gradiente de albúmina sérica ascitis menor a 1.1 g/dL.
Con base en los hallazgos de los estudios de imagen y la baciloscopia de aspiración bronquial positiva, se inició tratamiento antituberculoso a dosis plena (4 tabletas) el día 27 de agosto de 2016 para asegurar resultados clínicos satisfactorios, sin medidas de hepatoprotección. A pesar del tratamiento, el mismo día se acentuó la inestabilidad hemodinámica, se manejó con apoyo aminérgico dual con norepinefrina (0.9 µg/kg/min) y dopamina (10 µg/kg/min), se acentuó la insuficiencia renal con datos francos de hipoperfusión tisular.
Los parámetros de laboratorio (Cuadro 1) y hemodinámicos eran compatibles con choque séptico, con resistencia a las medidas señaladas; la paciente tuvo insuficiencia orgánica múltiple, por lo que falleció el 31 agosto de 2016 a cinco días de estancia en la unidad. Los cultivos bacterianos de secreciones bronquiales, orina y sanguíneos fueron negativos. Los estudios histopatológicos de líquido de ascitis y endometrial fueron negativos para malignidad.
Cuadro 1 Datos bioquímicos de acuerdo con los días de estancia hospitalaria
| Día 1 | Día 2 | Día 3 | Día 4 | Día 5 | |
|---|---|---|---|---|---|
| Hemoglobina (g/dL) | 11.7 | 8.8 | 9.8 | 12.8 | 8.1 |
| Hematócrito (%) | 37.8 | 26.6 | 29.8 | 41 | 25.2 |
| MVC (fL) | 73.68 | 70 | 71 | 79 | 79 |
| MCH (pg) | 23.27 | 23.4 | 23.2 | 24.2 | 29 |
| Leucocitos (K/L) | 17,099 | 11,600 | 11,200 | 16,300 | 21,200 |
| Plaquetas (K/L) | 200,000 | 69,000 | 63,000 | 53,000 | 43,000 |
| Bandas (%) | 12 | 8 | 5 | 9 | 6 |
| Urea (mg/dL) | 73 | 66 | 68 | 70.62 | 74.9 |
| Creatinina (mg/dL) | 2.5 | 1.6 | 1.2 | 0.91 | 0.79 |
| Ácido úrico (mg/dL) | 5.7 | 9.6 | 9.3 | 5.8 | 4.3 |
| Bilirrubina total (mg/dL) | 4.39 | 4 | 5.3 | 8.8 | 8.5 |
| Bilirrubina directa (mg/dL) | 3.87 | 2.6 | 3.6 | 5.8 | 5.7 |
| Bilirrubina indirecta (mg/dL) | 0.52 | 1.4 | 1.7 | 3.0 | 2.8 |
| TGO (U/L) | 161 | 89 | 124 | 140 | 207 |
| TGP (U/L) | 94 | 37 | 48 | 48 | 62 |
| TP | 27.6 | No coagula | 16.8 | No coagula | Mayor a 1 minuto |
| TPT | 104 | No coagula | 80.5 | No coagula | No coagula |
| INR | 2.7 | - | 1.48 | - | - |
| Fosfatasa alcalina (U/L) | 983 | 179 | 192 | 465 | 336 |
| VIH | Negativo | ||||
| VDRL | Negativo | ||||
| Dímero D (mg/dL) | 0.2 | ||||
| Procalcitonina (ng/dL) | 2.1 | 4.37 | |||
| Antígeno carcinoembrionario (ng/mL) | <1 | ||||
| Alfafetoproteína (ng/mL) | 54.37 |
La autopsia clínica reveló diagnósticos anatómicos finales de tuberculosis miliar, con afección pulmonar bilateral, pleural, ganglionar, cerebral, tiroidea, diafragmática, esplénica, peritoneal, pancreática y cutánea. Ascitis y derrame pleural bilateral. Sin datos anatómicos ni histológicos de embarazo (Figuras 1 a 3).
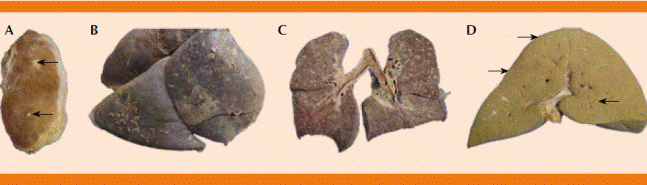
Figura 1 A. Superficie de corte de la glándula tiroides con lesiones tuberculosas (flechas). B y C. La superficie pleural visceral muestra paquipleuritis y numerosas lesiones “en grano de mijo”, menores de 2 mm. Los ganglios linfáticos muestran antracosis. D. En la superficie del hígado también se ven lesiones tuberculosas (flechas).

Figura 2 Corte histológico teñido con Ziehl-Neelsen donde se observa el bacilo tuberculoso (flecha) en una célula gigante multinucleada. Objetivo de inmersión
DISCUSIÓN
La diseminación hematógena de Mycobacterium tuberculosis puede ocurrir con o sin enfermedad miliar, conocida esta última como septicemia Landouzy o sepsis tuberculosa acutissima. Cuando la tuberculosis se manifiesta en forma diseminada puede cursar como sepsis tuberculosa gravissima, cuadro caracterizado por choque séptico e insuficiencia orgánica múltiple.1 La sepsis relacionada con tuberculosis es más común en pacientes con infección por VIH o estados de inmunodepresión, que pueden avanzar rápidamente a insuficiencia multisistémica antes de que sea evidente cualquier signo de tuberculosis, pero algunas formas agudas, especialmente la forma gravissima, pueden provocar la muerte en pacientes inmunocompetentes.1,4.
La variante séptica de la tuberculosis es poco frecuente en pacientes inmunocompetentes y comúnmente se vincula con tuberculosis miliar, pero se han descrito casos de sepsis tuberculosa severa sin tuberculosis miliar, en los que el choque séptico asociado con la infección micobacteriana estaría relacionado con la producción de factor de necrosis tumoral alfa, factor que juega un papel mayor en estos pacientes, que es estimulado por un componente de la pared celular de M. tuberculosis denominado lipoarabinomanano, un glicolípido que puede enlazar leucocitos y modular la respuesta inmunitaria. M. tuberculosis también produce lipopolisacáridos que pueden provocar sepsis a través de un mecanismo semejante a las bacterias gramnegativas, aunque el mecanismo exacto aún no está determinado.1,5 Además, Mycobacterium tuberculosis puede invadir, inflamar y destruir la médula ósea y potencialmente cualquier otro órgano. El choque hipovolémico puede deberse a adrenalitis por tuberculosis con insuficiencia subsiguiente o hemoptisis masiva, que puede asociarse con la rotura del aneurisma de Rasmussen. El choque cardiogénico puede ser consecuencia de miocarditis, endocarditis, pericarditis o taponamiento pericárdico.2
Hay pocos casos de sepsis tuberculosa gravissima descritos en la bibliografía. En una serie de tres casos publicada en 2002, todos los pacientes fallecieron por insuficiencia multiorgánica, evolución que también tuvo nuestra paciente.6 Mycobacterium tuberculosis se aísla sólo en 14% de los hemocultivos e incluso 25% de los casos se diagnostican premortem.2,4 Por tal motivo, el inicio temprano del tratamiento antituberculoso es esencial y parece asociarse con mejor su-pervivencia, particularmente en pacientes con enfermedad muy severa. Esto no solo requiere alto índice de sospecha clínica, también significa que, en muchos casos, los medicamentos antituberculosos deben iniciarse empíricamente con base en factores individuales del paciente y la manifestación clínica, incluso en ausencia de un resultado positivo del frotis de esputo.3,7-11
CONCLUSIÓN
Este caso fue una paciente con diagnóstico de infección generalizada por M. tuberculosis y requirió tratamiento en la unidad de cuidados intensivos, que tuvo evolución séptica e insuficiencia orgánica múltiple concomitante con su enfermedad tuberculosa, sin otros focos que expliquen su evolución, configurando el cuadro de sepsis tuberculosa gravissima, lo que finalmente ocasionó la muerte.1,4 Por tanto, nos parece razonable recomendar y considerar la tuberculosis en el diagnóstico diferencial de una variedad de síndromes clínicos, especialmente en los pacientes con síntomas prolongados antes del ingreso, cultivos negativos y sin respuesta a tratamientos estándar. Un alto nivel de sospecha de tuberculosis aguda, respaldado por área de procedencia geográfica, hallazgos clínicos, radiológicos, patológicos y de laboratorio, debe impulsar el inicio temprano de la terapia antituberculosa como maniobra diagnóstica y terapéutica. En la práctica, esta estrategia beneficiará los resultados de pacientes y sistemas de formas agudas de tuberculosis, al mismo tiempo que rompen la cadena de transmisión y la consiguiente carga de la enfermedad.1,6











 nueva página del texto (beta)
nueva página del texto (beta)



