ANTECEDENTES
La incidencia de carcinoma renal de células claras corresponde a cerca de 2% de todas las neoplasias malignas, se trata de un tumor con amplias variaciones clínicas. La tríada clásica de hematuria, dolor abdominal y masa palpable se estima en 10% de los casos y los síntomas sistémicos y paraneoplásicos se manifiestan en 20% durante el curso de la neoplasia. En 1961 Stauffer describió un síndrome paraneoplásico con disfunción hepática sin ictericia en ausencia de metástasis u obstrucción hepática. Este síndrome es una manifestación rara del carcinoma renal de células claras caracterizado por la elevación de la fosfatasa alcalina y enzimas hepáticas, que puede ser la primera manifestación de carcinoma renal.1
CASO CLÍNICO
Paciente masculino de 52 años de edad que acudió al servicio de urgencias por padecer dolor punzante en el hombro izquierdo, con irradiación a la escápula, que se exacerbaba al momento de realizar actividad física y disminuía con el reposo y medicamentos (analgésicos y antiinflamatorios), con evolución de cinco meses, calificando el dolor como 7/10 en la escala EVA. El cuadro se acompañaba de astenia, adinamia, disnea de mínimos esfuerzos, insomnio y polifagia cuatro días previos a la consulta, pérdida de peso de 15 kg en 6 meses. Antecedentes de importancia: pinzamiento subacromial izquierdo, sin toxicomanías. Al interrogatorio el paciente negó hematoquecia, melena, hematemesis, acolia o dolor abdominal, comentó haber tenido orina oscura durante dos días hacía un mes. En el examen físico se encontró palidez generalizada, sin alteraciones pulmonares, cardiacas ni abdominales. Signos vitales al ingreso: frecuencia cardiaca: 80 lpm, frecuencia respiratoria: 12 rpm, presión arterial: 138/85 mmHg, temperatura: 36ºC. Los resultados relevantes de laboratorio fueron: anemia severa normocítica normocrómica, hemoglobina 6.5 g/dL, hematócrito 23%, en hemograma, pruebas de función hepática elevadas (Cuadro 1), química sanguínea y bilirrubinas dentro de parámetros normales. El examen general de orina reveló: hematuria microscópica, proteinuria, leucocitosis. sangre oculta en heces positiva, antígeno S del virus de la hepatitis B y anticuerpos contra el virus de hepatitis C negativos.
Cuadro 1 Pruebas de función hepática
| Examen | Resultados (U/L) | Valores de referencia (U/L) |
|---|---|---|
| AST | 483 | 0-37 |
| ALT | 414 | 0-41 |
| GGT | 92 | 8-61 |
| ALP | 222 | 35-129 |
| LDH | 1005 | 240-480 |
El paciente ingresó al hospital con el diagnóstico de síndrome anémico y probable hepatopatía en estudio. Se trasfundieron dos concentrados eritrocitarios y 24 horas después se reportó hemoglobina de 8.6 g/dL. El ultrasonido hepático no reveló datos ecográficos que sugirieran enfermedad del hígado o vías biliares por el momento. Al tener en cuenta el antecedente de la micción y la pérdida de peso, se solicitó tomografía computada abdominal que detectó gran tumoración renal izquierda heterogénea en el polo superior con infiltración al polo inferior y seno renal, con medidas de 90 x 80 mm, que se extendía al seno renal condicionando infiltración de la vena renal, la vena cava inferior y la fascia de Gerota. El páncreas, el bazo y el hígado tenían forma y tamaño normales, bordes regulares, sin lesión, vía biliar sin dilatación, vena porta y colédoco de calibre normal (Figura 1).

Figura 1 Diferentes cortes con gran tumoración renal izquierda en el polo superior e hidronefrosis izquierda.
La tomografía computada de tórax evidenció lesión tumoral de tejidos blandos que infiltraba y destruía la escápula en relación con metástasis.
Las pleuras íntegras sin derrame, el parénquima pulmonar de la base mostraba MÚLTIPLES nódulos pulmonares relacionados con metástasis con medidas de 5 a 20 mm, T4NOM1, Robson IV (Figura 2).
En la evaluación multidisciplinaria se decidió la realización de una angiotomografía en la que se describía gran tumoración hipodensa, heterogénea (90 x 69 mm) en el tercio medio y superior del riñón izquierdo, con trombo tumoral a la vena renal izquierda, gran trombo tumoral en la vena cava inferior, Robson IVB (Figura 3).
De acuerdo con los hallazgos obtenidos en la angiotomografía, se optó por la toma de biopsia tumoral guiada por ultrasonido, se realizó punción a nivel subcostal, línea axilar posterior con aguja tipo trucut, y se obtuvieron tres muestras de calibre adecuado de diversas porciones tumorales.
Resultados
El reporte histopatológico reveló hallazgos consistentes con carcinoma renal de células claras, Fuhrman 3, que ocupaba la totalidad de dos de los fragmentos en una superficie de 30% (Figura 4).
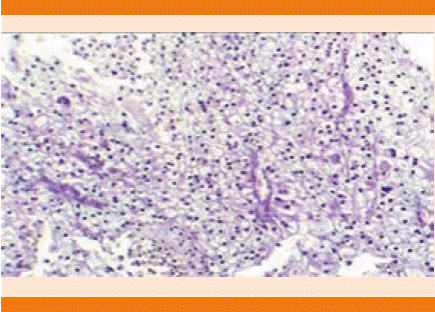
Figura 4 Muestra histopatológica teñida con hematoxilina y eosina. Lesión neoplásica maligna de estirpe epitelial.
Se obtuvo participación multidisciplinaria para este caso, se solicitó el apoyo de medicina interna y urología y, con base en el resultado del estudio integral del paciente, no se consideró apto para resección quirúrgica, se optó por tratamiento paliativo por parte de oncología médica.
Consideraciones éticas
El caso comunicado corresponde a un paciente masculino de 52 años de edad, cuya enfermedad fue atendida en la Clínica Hospital ISSSTE de Ensenada, Baja California, al que se le practicó biopsia tumoral por solicitud del equipo médico encargado, con autorización del paciente, según lo exige el convenio de Oviedo, artículo 5. Este trabajo cuenta con la autorización de la jefatura de enseñanza e investigación y dirección médica de ese hospital para la revisión de protocolo, preparaciones histológicas y fotografías y tiene en cuenta las normas vigentes sobre investigación en seres humanos, contempladas en la Declaración de Helsinki de la Asociación Médica Mundial.
DISCUSIÓN
De acuerdo con la bibliografía médica, nuestro paciente no tenía factores de riesgo, no padeció un cuadro clínico compatible con la enfermedad estudiada, como la tríada de cáncer renal, solo síntomas aislados (pérdida de peso y diagnóstico previo de pinzamiento subacromial) a partir de los hallazgos en las pruebas de citología hemática y función hepática alterada (FAL y transaminasas elevadas), descartando hepatomegalia, metástasis, infección u obstrucción; la causa de la alteración en nuestro paciente se inclina a la posible secreción de hepatotoxinas, secundaria a tumoración renal, de acuerdo con teorías establecidas en diversos artículos médicos.
Frente a esto, el procedimiento más eficaz es la realización de ultrasonido hepático, que permite diagnosticar enfermedad obstructiva y afección parenquimatosa; aunque en este caso las enzimas eran específicas de lesión hepática, la demostración de una masa renal en la tomografía computada descartó el daño hepático y se obtuvo un hallazgo maligno, lo que cambió el panorama. Al tratar al paciente de manera integral, se tomó en cuenta cada detalle, teniendo presente este tipo de manifestación, ya que puede ser la primera o la única en un carcinoma renal y puede hacer la diferencia entre que éste pase inadvertido o establecer el diagnóstico de manera oportuna.
En el cáncer renal, la tríada clásica de hematuria, dolor abdominal y masa abdominal palpable solo es apreciable en menos de 10% de los casos.1-3
La afectación de las enzimas hepáticas puede estar en relación con la infiltración metastásica del hígado o deberse a disfunción no metastásica, como lo describió Maurice Stauffer en 1961 como síndrome de disfunción hepatonefrogénica no metastásica, mejor conocido como síndrome de Stauffer; este padecimiento puede encontrarse en 3 a 20% de los casos de cáncer de riñón, se manifiesta con elevación de las transaminasas y la fosfatasa alcalina y puede retornar a la normalidad tras la cirugía. También puede encontrarse en leucemia linfocítica crónica, linfomas, leiomiosarcomas, cáncer de vejiga, cáncer de próstata y schwannoma maligno. Se ha reportado acompañando a afecciones como el quiste renal simple hemorrágico. Alrededor de 40% del cáncer de riñón se diagnostica incidentalmente al efectuar un ultrasonido abdominal.2,4-6
La fisiopatología del síndrome de Stauffer se desconoce, aunque se piensa que el tumor secreta hepatotoxinas o enzimas lisosomales que estimulan a catepsinas o a fosfatasas, que conducen al daño hepatocelular. Otras hipótesis plantean que el deterioro hepático, causado por las enzimas mencionadas, activa las células T del sistema inmunitario y la producción de anticuerpos contra los antígenos hepáticos. Por último, se especula que en estos pacientes existe producción de citocinas (IL- 6), con relación directa entre sus concentraciones y las de la fosfatasa alcalina y la gamma-glutamil transpeptidasa, además de que con el tratamiento de anticuerpos monoclonales anti-IL-6 se ha logrado revertir a la normalidad la mayor parte de los parámetros de la función hepática alterados en el síndrome de Stauffer.5,7
La poca supervivencia de los pacientes con carcinoma renal es muy conocida, los que no son tratados llegan al año de vida y solo 10% alcanza supervivencia de cinco años. Con base en esto, el síndrome de Stauffer como manifestación para- neoplásica puede ser la forma de manifestación inicial de cáncer renal, su reconocimiento puede significar el diagnostico temprano. La interleucina 2 y el interferón 2 alfa recombinante han sido los tratamientos fundamentales prescritos a los pacientes con carcinoma renal metastásico. Estos fármacos son citocinas no específicas que se piensa tienen acción antitumoral, por medio de la estimulación de la respuesta inmunitaria antitumoral, que no es adecuada en estos pacientes. Sin embargo, el interferón 2 alfa recombinante no se prescribe como monoterapia por mucho tiempo. Se ha administrado la combinación de éste con el anticuerpo monoclonal Avastin® (bevacizumab), aunque de modo particularizado según el caso, porque esta mezcla suele producir efectos tóxicos, como fatiga, anorexia, hipertensión arterial y proteinuria.7
CONCLUSIÓN
En un paciente con enzimas hepáticas elevadas en quien se hayan descartado alteraciones anatómicas y funcionales, debe sospecharse el síndrome de Stauffer; se sugiere individualizar a cada paciente, realizando un diagnóstico integral y no centrarse en un solo órgano. Debe tomarse en cuenta la importancia del reconocimiento de un síndrome paraneoplásico como manifestación de lesiones tumorales comunes. Difícilmente los síntomas se manifiestan al comienzo, lo que demora el diagnóstico definitivo.
Recomendaciones
Indagar a profundidad ante síntomas inespecíficos y hallazgos de laboratorio, una vez descartadas las posibilidades, rastrear los órganos adyacentes para identificar de manera oportuna enfermedades y evitar errores en los medios de abordaje, así como estudios innecesarios, que retrasan el diagnóstico y la recuperación.











 nueva página del texto (beta)
nueva página del texto (beta)




